Las estrategias terapéuticas actuales poseen una limitada eficacia para erradicar biopelículas de Candida formadas en la superficie de los dispositivos biomédicos. Pocos estudios han evaluado la eficacia de los antifúngicos sobre biopelículas de Candida tropicalis.
ObjetivosEvaluar la actividad de la anfotericina B (AMB) y la anidulafungina (AND), solas y combinadas, sobre biopelículas de C. tropicalis desarrolladas en superficies de politetrafluoroetileno (teflón - PTFE) y titanio mediante ensayos de letalidad-tiempo.
MétodosLos ensayos se realizaron en un CDC Biofilm Reactor sobre biopelículas de 24h de maduración formadas en discos de PTFE y titanio. Las concentraciones ensayadas fueron 40mg/l para AMB y 8mg/l para AND, tanto para su uso por separado como combinadas. Tras 24, 48 y 72h de exposición a los antifúngicos se determinaron las ufc/cm2 mediante agitación vorticial y cultivo cuantificado previa sonicación.
ResultadosAMB redujo las células viables adheridas a PTFE y titanio en más de un 99%, y AND lo hizo en un 89,3% en PTFE y 96,8% en titanio. La combinación AMB+AND fue menos activa que la AMB sola tanto en PTFE (descenso en ufc/cm2 de 3,09 Log10vs. 1,08 en la combinación) como en titanio (4,51 vs. 1,53 en la combinación), siendo la interacción indiferente en ambas superficies.
ConclusionesAMB es más activa que AND sobre biopelículas de C. tropicalis. La eficacia sobre las biopelículas es mayor en el titanio. La combinación AMB+AND es menos eficaz que AMB sola en ambas superficies.
Current therapeutic strategies have a limited efficacy against Candida biofilms that form on the surfaces of biomedical devices. Few studies have evaluated the activity of antifungal agents against Candida tropicalis biofilms.
ObjectivesTo evaluate the activity of amphotericin B (AMB) and anidulafungin (AND), alone and in combination, against C. tropicalis biofilms developed on polytetrafluoroethylene (teflon -PTFE) and titanium surfaces using time-kill assays.
MethodsAssays were performed using the CDC Biofilm Reactor equipped with PTFE and titanium disks with C. tropicalis biofilms after 24h of maturation. The concentrations assayed were 40mg/l for AMB and 8mg/l for AND, both alone and combined. After 24, 48 and 72h of exposure to the antifungals, the cfu/cm2 was determined by a vortexing-sonication procedure.
ResultsAMB reduced biofilm viable cells attached to PTFE and titanium by ≥99% and AND by 89.3% on PTFE and 96.8% on titanium. The AMB+AND combination was less active than AMB alone, both on PTFE (decrease of cfu/cm2 3.09 Log10vs. 1.08 when combined) and titanium (4.51 vs. 1.53 when combined), being the interaction irrelevant on both surfaces.
ConclusionsAMB is more active than AND against C. tropicalis biofilms. Yeast killing rates are higher on titanium than on PTFE surfaces. The combination of AMB plus AND is less effective than AMB alone on both surfaces.
Las infecciones relacionadas con biopelículas del género Candida se han convertido en un importante problema sanitario en los últimos años20, no solo porque las células en el interior de la biopelícula muestran una mayor resistencia a los antimicrobianos sino porque además están protegidas del sistema inmunitario3. Las estrategias terapéuticas actuales poseen una limitada eficacia para erradicar las biopelículas formadas en la superficie de los dispositivos biomédicos colonizados, lo cual obliga en muchas ocasiones a intervenciones quirúrgicas para su retirada y así controlar la infección. Las especies del género Candida son capaces de formar biopelículas sobre una gran variedad de biomateriales, desde polímeros plásticos utilizados en catéteres vasculares como el politetrafluoroetileno (conocido como teflón - PTFE) hasta materiales metálicos como el titanio, utilizados habitualmente para la fabricación de prótesis osteoarticulares16.
Aunque Candida albicans es la especie más comúnmente relacionada con estas infecciones, Candida tropicalis ha emergido como un importante patógeno asociado a pacientes inmunodeprimidos, pacientes ingresados en unidades de críticos y pacientes neutropénicos7,10. En la actualidad, la anfotericina B (AMB) y las equinocandinas han demostrado ser eficaces frente a biopelículas de C. albicans11,18,26, y se ha propuesto su utilización para el sellado de catéteres venosos centrales25. Sin embargo, al contrario de lo que ocurre con C. albicans, hay pocos estudios que evalúen la eficacia de estos antifúngicos sobre las biopelículas de C. tropicalis18,26.
La mayor parte de los trabajos relacionados con biopelículas de Candida se han realizado con el análisis de la actividad metabólica de las células en la biopelícula mediante el ensayo de reducción del XTT en placas de poliestireno de 96 pocillos19,21. En la actualidad se dispone de varios modelos in vitro para el estudio de las biopelículas microbianas, como los dispositivos de Calgary, el de Robbins o el CDC Biofilm Reactor (CBR). El CBR ha sido estandarizado por la American Society for Testing Materials (método E2562 - 12)8 y destaca por ser una herramienta eficaz para estudiar la interacción entre el microorganismo y distintos biomateriales con la ventaja de que el fluido está en movimiento. Además, permite evaluar la influencia del biomaterial tanto en la adherencia como en la sensibilidad a los antimicrobianos6,17.
El presente estudio posee un doble propósito: 1) estudiar la cinética de formación de las biopelículas de C. tropicalis en dos biomateriales con propiedades fisicoquímicas muy distintas, como el PTFE (hidrófobo) y el titanio (hidrófilo), y 2) evaluar la actividad de AMB y la anidulafungina (AND), solas y combinadas, sobre la biopelícula formada en estos materiales.
Materiales y métodosCDC Biofilm Reactor y biomaterialesEl CBR (modelo CBR 90-1) y los biomateriales fueron suministrados por BioSurface Technologies Corporation (Bozeman, MT, EE. UU.). El CBR está equipado con ocho portadiscos, incluidos en un recipiente de 1 litro de capacidad. Cada portadisco aloja tres discos de 1,27cm de diámetro y 0,4cm de grosor, lo que permite un total de 24 pruebas. Los biomateriales utilizados fueron PTFE (modelo RD 128-PTFE) y titanio comercialmente puro (modelo RD128-Ti).
AntifúngicosLa anfotericina B soluble (ref. A9528) fue suministrada por Sigma-Aldrich (Madrid, España) y disuelta en agua estéril; AND fue suministrada por Pfizer (Madrid, España) en forma de polvo valorado y se disolvió en dimetil sulfóxido. Las concentraciones ensayadas fueron 40mg/l de AMB y 8mg/l de AND, las cuales podrían ser potencialmente útiles en una terapia de sellado antifúngico de catéter venoso central.
Caracterización fenotípica del aislamientoEl aislamiento de C. tropicalis utilizado fue recuperado de un paciente durante un episodio de candidemia asociada a catéter. La capacidad para formar biopelícula se determinó por el método de tinción con cristal violeta y el ensayo de reducción del XTT19,24,26. La sensibilidad de las células planctónicas a AMB y AND se determinó según el método de microdilución en caldo del CLSI (documento M27-A3)5. La CMI frente a AMB se definió como la concentración más baja capaz de inhibir el 100% del crecimiento; la CMI frente a AND se definió como la concentración más baja que produce una inhibición del crecimiento igual o superior al 50%. La sensibilidad de la biopelícula a AMB y AND se determinó en placas de 96 pocillos mediante el ensayo de reducción del XTT previamente descrito26. La CMI de las células en biopelícula (CMIB) se definió como la concentración más baja de antifúngico capaz de reducir la actividad metabólica de la biopelícula ≥50% (CMIB50) o ≥90% (CMIB90).
Curvas de letalidadEl inóculo se preparó a partir de un cultivo de 24h en agar glucosado de Sabouraud mediante la suspensión de 1-3 colonias en solución salina estéril y posterior ajuste de la densidad óptica a 2 de la escala de McFarland (107ufc/ml). El CBR, equipado con los discos de PTFE, titanio y con 400ml de base nitrogenada de levadura (Difco Laboratories, Detroit, MI, EE. UU.) suplementada con glucosa 100 mM (YNBG), se inoculó con 1ml de la suspensión. Posteriormente se colocó el CBR en un agitador magnético ajustado a 250rpm. La temperatura se mantuvo durante todo el experimento a 30°C±1°C. Después de 24h de incubación se retiraron asépticamente tres discos de PTFE y tres discos de titanio para cuantificar el número de células viables en sus superficies previa agitación vorticial y cultivo tras sonicación. Posteriormente se añadió a cada unidad CBR 40mg/l de AMB y 8mg/l de AND, solas y combinadas. A las 24, 48 y 72h de haber añadido el antifúngico se retiraron los discos de PTFE y titanio para determinar el número de células viables en la biopelícula. Como control se utilizó un CBR en las mismas condiciones de ensayo pero sin antifúngico.
Recuento de células viables adheridas a los discos de PTFE y titanioUna vez extraído el disco del CBR se lavó con 14ml de PBS estéril con el fin de eliminar las células no adheridas, se depositó en un tubo con 1ml de YNBG y se sometió a agitación vorticial durante 1min a 2.500rpm, sonicación (modelo Ultrasons-H; JP Selecta, Barcelona, España) durante 5min a 50 KHz y nueva agitación vorticial durante 1min a 2.500rpm. Posteriormente 0,1ml del caldo obtenido tras la sonicación se diluyó (1:10, 1:100, 1:1000 y 1:10.000) en solución salina estéril y 0,1ml de cada dilución se sembraron en agar infusión cerebro-corazón (Becton Dickinson, EE. UU.). Las placas se incubaron durante 24h a 37°C. Los resultados del cultivo (ufc/ml) se transformaron en Log10 ufc/cm2 según la ecuación descrita por Goeres et al.8 y considerando que la superficie de cada disco es 1,267 cm2. Con el fin de minimizar el sesgo los dos biomateriales se ensayaron en el mismo CBR. Todos los experimentos se realizaron por triplicado.
Análisis de los datosSiguiendo los criterios establecidos para las curvas de letalidad, la interacción entre AMB y AND se clasifica como sinérgica si la disminución en células viables (ufc/cm2) a las 72h es ≥2 Log10 en comparación con el antifúngico más activo, como indiferente si la diferencia en células viables es <2 Log10 y ≥1 Log10, y antagónica cuando hay un incremento en las células viables ≥2 Log10 en comparación con el antifúngico menos activo12. Se realizó un modelo de regresión lineal con triple interacción (tiempo, biomaterial y antifúngico) para detectar diferencias significativas (p<0,05) en los recuentos de células viables y en las cinéticas de letalidad. Los análisis se realizaron con el programa estadístico R (versión 3.3.2).
ResultadosC. tropicalis fue capaz de formar biopelícula en placas de poliestireno y se clasificó como muy adherente; se utilizaron tanto el procedimiento de tinción con cristal violeta como el ensayo de reducción del XTT. Los valores CMI del aislamiento para AMB y AND fueron de 0,25mg/l y 0,03mg/l respectivamente. Las CMIB50 y CMIB90 frente a AMB fueron 4mg/l y >8mg/l, respectivamente, y las correspondientes a AND fueron en ambos casos >16mg/l.
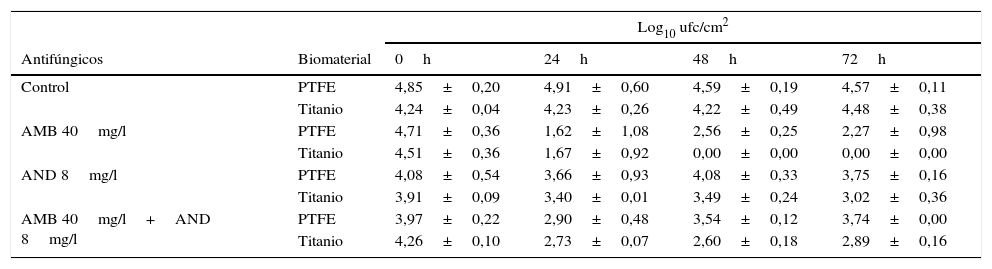
En la tabla 1 se muestra el número de células viables (Log10 ufc/cm2) presentes en la biopelícula de C. tropicalis formada en las superficies de PTFE y de titanio en presencia y ausencia de los antifúngicos. En el control a las 24h no se observó un aumento significativo (p>0,05) de células viables adheridas a la superficie de ambos biomateriales, aunque el número de células adheridas fue ligeramente mayor en PTFE. A las 24h de la adición de AMB se observó una reducción en el número de ufc/cm2 en la biopelícula de 3,09 Log10 (99,6% de mortalidad) en PTFE y de 2,84 Log10 (99,5% de mortalidad) en titanio. La letalidad en PTFE no aumentó significativamente después de 48 y 72h de exposición al antifúngico (p>0,05). Por el contrario, en titanio, la mortalidad fue del 100% a las 48h y se mantuvo hasta el final del experimento.
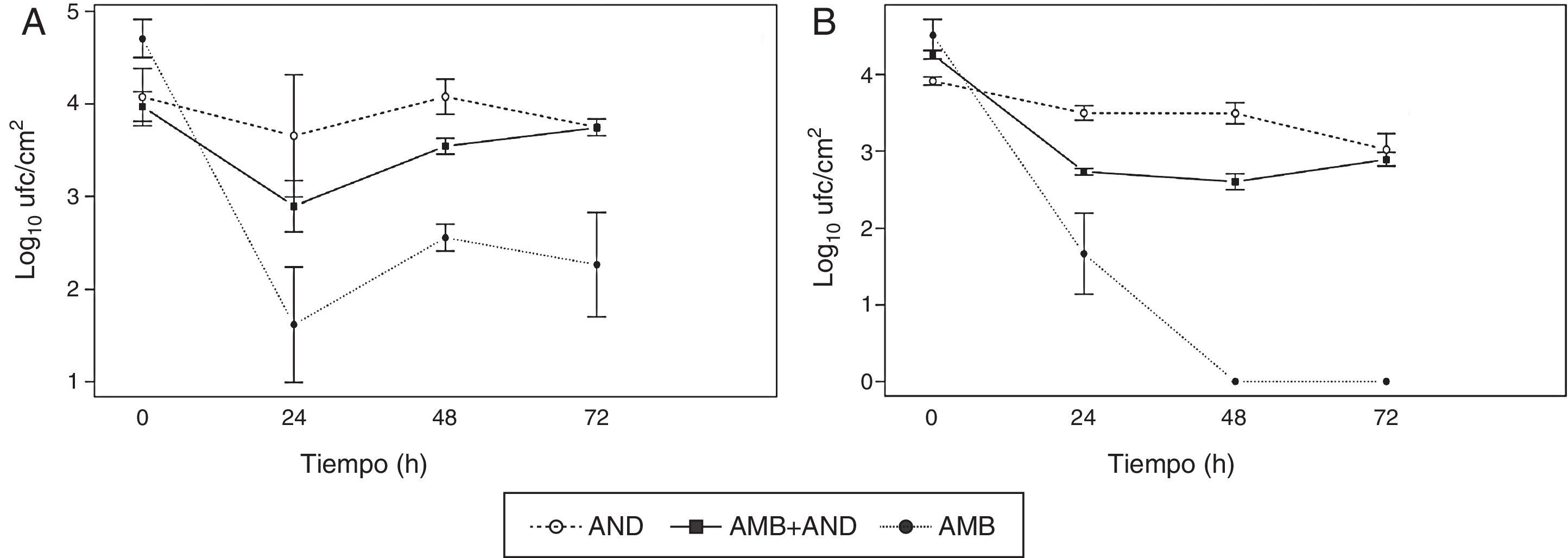
Cuantificación de células viables en la biopelícula de C. tropicalis desarrollada en PTFE y titanio, después de la exposición a anfotericina B (AMB), anidulafungina (AND) y a una combinación de ambas
| Log10 ufc/cm2 | |||||
|---|---|---|---|---|---|
| Antifúngicos | Biomaterial | 0h | 24h | 48h | 72h |
| Control | PTFE | 4,85±0,20 | 4,91±0,60 | 4,59±0,19 | 4,57±0,11 |
| Titanio | 4,24±0,04 | 4,23±0,26 | 4,22±0,49 | 4,48±0,38 | |
| AMB 40mg/l | PTFE | 4,71±0,36 | 1,62±1,08 | 2,56±0,25 | 2,27±0,98 |
| Titanio | 4,51±0,36 | 1,67±0,92 | 0,00±0,00 | 0,00±0,00 | |
| AND 8mg/l | PTFE | 4,08±0,54 | 3,66±0,93 | 4,08±0,33 | 3,75±0,16 |
| Titanio | 3,91±0,09 | 3,40±0,01 | 3,49±0,24 | 3,02±0,36 | |
| AMB 40mg/l+AND 8mg/l | PTFE | 3,97±0,22 | 2,90±0,48 | 3,54±0,12 | 3,74±0,00 |
| Titanio | 4,26±0,10 | 2,73±0,07 | 2,60±0,18 | 2,89±0,16 | |
Los datos representan la media±desviación estándar de tres discos.
La exposición a AND sola durante 24h produjo una disminución de células viables de 0,42 Log10 ufc/cm2 (36,4% de mortalidad) en PTFE y de 0,51 (55,4% de mortalidad) en titanio; la mortalidad no aumentó significativamente con el tiempo de incubación (fig. 1). La actividad de AMB fue significativamente mayor (p<0,05) sobre las biopelículas formadas en titanio. AMB fue más activa que AND sobre las biopelículas formada en ambas superficies (p<0,05).
Cinética de letalidad de la anidulafungina (8mg/l, AND), la anfotericina B (40mg/l, AMB), y una combinación de ambos antifúngicos a las mismas concentraciones mencionadas frente a la biopelícula de C. tropicalis formada sobre PTFE A) y titanio B). Cada punto representa la media±desviación estándar de tres discos.
La combinación de AMB y AND alcanzó una reducción de células viables a las 24h de 1,08 Log10 ufc/cm2 (89,3% de mortalidad) en PTFE y 1,53 (96,8% de mortalidad) en titanio. En las superficies de titanio se mantuvo constante el número de células viables, mientras que en PTFE se observó un aumento de las mismas a las 24 y 72h (tabla 1 y fig. 1). La actividad de AMB se redujo significativamente en presencia de AND (p<0,05) tanto en PTFE (3,09 Log10 ufc/cm2 vs. 1,08 combinadas) como en titanio (4,51 vs. 1,53 combinadas). No se obtuvieron diferencias significativas entre la actividad de la combinación y la AND sola en ninguno de los dos biomateriales ensayados (p>0,05).
DiscusiónNuestros resultados muestran que AMB es significativamente más eficaz que AND sobre las biopelículas de C. tropicalis formadas en la superficie de titanio y PTFE (p<0,05). En la actualidad no parece haber otros estudios que hayan analizado la actividad de estos antifúngicos sobre las biopelículas de C. tropicalis formadas en distintos biomateriales, ni usando el CBR como modelo in vitro ni realizando curvas de letalidad. Nuestro estudio muestra la escasa actividad de AND sobre las biopelículas desarrolladas en ambos biomateriales, los cuales permanecen colonizados después de 72h de exposición al fármaco; la resistencia de las biopelículas de C. tropicalis a AND ya había sido descrita mediante otras metodologías1,18,26. Por el contrario, AMB es capaz de eliminar más del 99% de las células adheridas a los dos biomateriales, e incluso esterilizar la superficie del titanio después de 48h de exposición, aunque no consigue erradicar todas las células adheridas al PTFE. Sin embargo, la actividad de la combinación AMB+AND es inferior que la de AMB sola. Al final del experimento (72h) la interacción, siguiendo los criterios establecidos para las curvas de letalidad, se clasificó como indiferente en ambos biomateriales. En cambio, al analizar gráficamente las curvas obtenidas con respecto al antifúngico más activo (AMB) es posible visualizar una cierta tendencia al antagonismo puesto que la adición de AND conlleva una disminución de la actividad de AMB de 2,01 Log10 en PTFE y de 2,98 Log10 en titanio.
La mayoría de los estudios de sensibilidad de las biopelículas a los antifúngicos se han realizado principalmente con la especie C. albicans mediante el ensayo de reducción del XTT, y se dispone de pocos datos sobre la actividad de estos en otras especies de Candida18,23,26. Aunque AND ha demostrado ser eficaz frente a las biopelículas de C. albicans9,18 no ocurre lo mismo con las biopelículas de C. tropicalis, ya sea mediante la medida de la actividad metabólica (XTT) o por la determinación de las ufc adheridas al biomaterial (CBR). Estas diferencias entre las dos especies podrían estar relacionadas con la composición de la matriz extracelular, glucosa en C. albicans y hexosaminas en C. tropicalis, lo cual podría influir en la tasa de difusión del antifúngico al interior de la biopelícula2. Por otra parte, las diferencias en la eficacia de los antifúngicos entre ambos biomateriales podrían ser explicadas por las distintas características de la superficie de los biomateriales ensayados. Liu et al.14 observaron que la adherencia de Candida a superficies inertes está mediada por proteínas con dominios hidrofóbicos que podrían facilitar la adhesión a las superficies hidrófobas (PTFE) y así explicar las diferencias encontradas entre ambos biomateriales.
Varios autores han estudiado la influencia de la hidrofobicidad del biomaterial en la tasa de crecimiento de la biopelícula15,22 y nuestro estudio sugiere que esta propiedad superficial también influye sobre la tasa de mortalidad. Las diferencias en las características superficiales del PTFE (hidrofóbico) y del titanio (hidrofílico) podrían explicar las diferencias de mortalidad de la cepa estudiada encontradas entre los dos biomateriales. Estos resultados refuerzan la hipótesis de que las características fisicoquímicas de las superficies son un factor importante en la evolución de las infecciones relacionadas con las biopelículas de Candida y deben tenerse en cuenta en la elección del biomaterial de los dispositivos biomédicos.
Una de las limitaciones de este estudio es la utilización de un solo aislamiento de C. tropicalis, si bien se trata de una cepa que ha sido seleccionada previamente por su gran capacidad para formar biopelícula a las 24h en el CBR. Otra limitación son las concentraciones ensayadas: aunque cercanas a las concentraciones séricas máximas tras la administración de una dosis estándar4,13, no son fisiológicas ya que se mantienen durante un corto periodo de tiempo; no obstante, al ser tan elevadas (>100 veces la CMI), nos dan información para su posible utilización en una terapia de sellado antifúngico de catéter venoso central.
En resumen, nuestros resultados ponen de manifiesto la influencia de los biomateriales en el desarrollo de la biopelícula. AMB es más activa que AND en ambos biomateriales y la mortalidad sobre la cepa utilizada es mayor sobre superficies de titanio para ambos antifúngicos. La pérdida de actividad de AMB cuando se combina con AND sugiere que esta última podría no ser apropiada para el tratamiento de las infecciones por C. tropicalis asociadas a biopelículas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosEste trabajo ha sido financiado por el Instituto de Salud Carlos III (FIS PI12/02786).