Introducción
La leflunomida es un fármaco inmunomodulador, no citotóxico, derivado sintético del isoxazol. Es una sustancia profármaco ya que en el tracto gastrointestinal se abre el anillo isoxazol transformándose en su forma activa conocida como A771726.
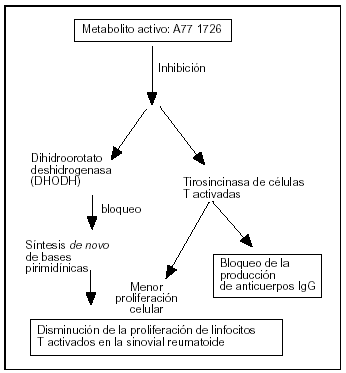
La leflunomida es un inhibidor selectivo y reversible de la dihidroorotato deshidrogenasa (DHODH), enzima clave para la formación del uridinmonofosfato, que es un elemento esencial para la síntesis de novo de las pirimidinas (fig. 1)1-5. Éstas son un componente básico para completar el ciclo celular de los linfocitos T activados, por lo que la leflunomida bloquea la expansión clonal de estos linfocitos. De aquí el concepto de fármaco inmunomodulador no citotóxico6.
Figura 1. Principales mecanismos de acción de la leflunomida que explicarían sus acciones farmacológicas.
Los efectos antiinflamatorios, analgésicos, inmunorreguladores y antiproliferativos de la leflunomida no quedan explicados suficientemente por este mecanismo de acción, por lo que otras acciones descritas que completan el espectro de su eficacia farmacológica han sido: a) la inhibición de la tirosincinasa en los linfocitos T activados (relacionada con el bloqueo de la producción de anticuerpos en linfocitos B y menor proliferación celular); b) la inhibición de la glucosilación de membranas; c) inhibición de la 5-lipooxigenasa y ciclooxigenasa 2; d) inhibición de la adhesión leucocitaria al endotelio vascular y de la producción de citocinas (factor de necrosis tumoral α [TNF-α], interleucina 1 [IL-1], factor nuclear kappa) y metaloproteasas, y e) disminución de la expresión de moléculas de adhesión (ICAM-1 y VCAM-1)6-12.
En el proceso de desarrollo de un nuevo fármaco en el arsenal terapéutico y su disponibilidad cotidiana son necesarios diversos estudios previos. Entre ellos está el efecto en los diferentes modelos experimentales reconocidos de inflamación y autoinmunidad. Así, la leflunomida fue un fármaco ampliamente investigado en la década de los ochenta en modelos experimentales, con resultados prometedores1. En aquellos años los investigadores de la empresa Hoechst en Alemania y de diversas universidades alemanas, yugoslavas y americanas se planteaban la duda razonable de si aquellos resultados iniciales podrían ser trasladados a la patología humana.
¿Hasta qué punto sería efectiva? ¿Hasta qué punto sería segura? ¿Sería trasladable su uso a las diferentes enfermedades autoinmunes que constituían un reto terapéutico para los reumatólogos? Estas inquietudes se basaban en los esperanzadores resultados de la leflunomida obtenidos en los diferentes modelos experimentales de inflamación y de autoinmunidad que, de hecho, explican su posterior uso aceptado en la artritis reumatoide. Así los modelos experimentales en los que leflunomida demostró sus efectos terapéuticos fueron:
1. Modelos de inflamación:
Edema inducido por carragenina. Este modelo se usa para la evaluación de antiinflamatorios no esteroides (AINE) y corticoides. La leflunomida demostró un efecto similar a fenilbutazona1.
Eritema de piel inducido por luz ultravioleta. La irritación ultravioleta en la piel se emplea para valorar la eficacia de determinados fármacos, sus propiedades antirreumáticas y su capacidad para disminuir la hiperemia y el aumento de la permeabilidad vascular que ocurre en este modelo13. La leflunomida demostró un efecto protector1.
2. Modelos experimentales de autoinmunidad:
Poliartritis progresiva inducida por proteoglicanos. Éste es un modelo que presenta numerosas similitudes con la artritis reumatoide y la espondilitis anquilosante14. Después de una sinovitis poliarticular en articulaciones periféricas y espondilitis, aparece lesión erosiva en el cartílago y hueso. Este cuadro es dependiente de la inmunidad celular y humoral. La leflunomida suprime las manifestaciones inflamatorias y bloquea la evolución de la sinovitis crónica y la aparición de nuevos episodios inflamatorios. Los investigadores comprobaron una clara disminución en la respuesta primaria y secundaria de producción de anticuerpos, y conjeturando que el efecto beneficioso del fármaco estaba en relación con la supresión de anticuerpos autorreactivos15.
Lupus murino. Los ratones MRL/lpr desarrollan espontáneamente una enfermedad grave similar al lupus eritematoso sistémico (LES) de los humanos. Presentan proliferación de linfocitos T, hipergammaglobulinemia, glomerulonefritis por inmunocomplejos, producción de anti-ADN nativo y lesiones articulares similares a las observadas en la artritis reumatoide (poliartritis erosiva) además de la presencia de factor reumatoide positivo16.
En este modelo de autoinmunidad, la leflunomida suprime la presencia de inmunocomplejos circulantes, disminuye la formación de autoanticuerpos, limita la presencia de células T en nódulos linfáticos y bazo, detiene la progresión de la enfermedad y previene el desarrollo de glomerulonefritis17,18.
Estos efectos terapéuticos son de larga duración y la vida media de los ratones se prolonga, a diferencia de los resultados obtenidos con ciclosporina A, que produce reactivación inmediata de la enfermedad tras la suspensión del fármaco1.
Artritis por adyuvante. Un modelo clásico de inflamación reumatológica es la artritis por adyuvante en ratas Lewis, en la cual se valora el efecto antiinflamatorio e inmunodepresor de las sustancias a testar19. La leflunomida demostró un efecto antiinflamatorio e inmunodepresor, pero para sorpresa de los investigadores demostró no presentar efecto citotóxico12,20.
Encefalomielitis alérgica experimental. Es un modelo de enfermedad neurológica autoinmune mediado por células T en cuya patogenia los factores humorales desempeñan un papel importante21. Su equivalente en humanos sería la esclerosis múltiple. La utilidad de la leflunomida se comprobó por la prevención de la parálisis en ratas Lewis de este modelo1.
Enfermedades autoinmunes organoespecíficas. Dos ejemplos de este modelo son la nefritis tubulointersticial en ratas y la glomerulonefritis inducida por anticuerpos antimembrana basal. Aquí la leflunomida reduce la formación de autoanticuerpos y previene el desarrollo de la enfermedad22,23.
Enfermedades del injerto contra el huésped. La leflunomida prevenía la aparición del rechazo al órgano trasplantado, limitaba la intensidad del rechazo y restauraba la respuesta a mitógenos de las células T24.
De la información obtenida en estos modelos experimentales y de los estudios realizados sobre el mecanismo de acción de la leflunomida se deduce que es un fármaco inmunomodulador con efectos antiinflamatorios y que ha demostrado estos beneficiosos efectos terapéuticos contra diversas enfermedades autoinmunes. Para explicar esta diversidad de efectos terapéuticos beneficiosos se han aducido, entre otras, las siguientes razones1-9:
La inhibición de la proliferación de linfocitos T activados a través de la supresión del ciclo celular por inhibición de la síntesis de novo de las pirimidinas por bloqueo reversible de la enzima (DHODH).
La leflunomida es antagonista de la acción de numerosas citocinas y factores de crecimiento (IL-2, IL-4, IL-3, IL-6, TNF, GM-CSF, G-CSF) y producción de autoanticuerpos a través de la inhibición de la enzima tirosincinasa.
Inhibición de la liberación de histamina de células cebadas y basófilos.
Es decir, la acción de la leflunomida se realiza en diversos ámbitos inhibiendo la proliferación de linfocitos T activados y la producción de autoanticuerpos dependientes de las células T.
El linfocito T es un elemento clave en la etiopatogenia de numerosas enfermedades autoinmunes. Parece obvio, por tanto, que la leflunomida debe de tener efectos terapéuticos beneficiosos sobre ellas. Este hecho ya se ha demostrado según los estudios previos realizados en modelos experimentales. En patología humana este fármaco ha demostrado ampliamente y de forma contundente sus efectos beneficiosos y su utilidad como tratamiento de primera línea en la artritis reumatoide25-32.
Su uso se esta extendiendo, con resultados en principio prometedores, a otras enfermedades en las que los linfocitos T, la presencia de inmunocomplejos circulantes y la formación de autoanticuerpos desempeñan diversos papeles preponderantes. A continuación se comentan algunos de los procesos patológicos más destacados (tabla 1).
Lupus eritematoso sistémico
En un estudio recientemente comunicado33, 18 pacientes reciben tratamiento con leflunomida a dosis de carga de 100 mg/24 h durante 3 días, seguida de 20 mg/día. Se comparan diversos parámetros antes y después del tratamiento (tres meses). Diez de 14 pacientes tratados presentan mejoría objetiva y se constata que los valores del SLEDAI (índice de actividad del lupus)34 disminuyen. No se observaron alteraciones significativas en los datos de laboratorio y los efectos secundarios aparecidos en los pacientes tratados fueron diarrea en 7 de los 18 pacientes y eritema cutáneo en uno. Los autores concluyen que la leflunomida es un fármaco efectivo y bien tolerado en pacientes con LES.
En otro trabajo realizado en Austria y Alemania35, 11 pacientes con LES fueron con dosis de carga de 100 mg/24 h durante 3 días, posteriormente con 20 mg/día, aumentando las dosis a 30 o 40 mg/día según la respuesta clínica. Se valoraron los habituales parámetros de seguridad, y las variables de eficacia fueron el ECLAM (European Consensus Lupus Activity Measurement)36, anti-ADN, C3, C4 y proteinuria de 24 h. Los resultados fueron esperanzadores en cuanto que 8 de los 11 pacientes presentaron mejoría en ECLAM, aunque no se observaban cambios significativos en los parámetros analíticos anteriormente comentados. Cuatro pacientes completaron el estudio, 7 lo abandonaron por ineficacia, efectos secundarios o voluntariamente. Los autores concluyen que la leflunomida presenta el perfil de seguridad habitual y que la actividad de la enfermedad tendía a disminuir tras el tratamiento.
En el tercer estudio, Petri37 sigue a 20 pacientes portadores de LES durante 3 meses. Utiliza las dosis de carga habitual, seguidas de 40 mg/24 h. Realiza visitas de seguimiento mensuales monitorizando la seguridad, SLEDAI, número de articulaciones inflamadas y dolorosas y la opinión del médico. Todos los pacientes cumplen las tres visitas. Cuatro de ellos abandonan el tratamiento por toxicidad, otro por crisis del sistema nervioso central y en un caso se disminuyó la dosis a 20 mg por diarrea. El 30% de los pacientes (6 de 20) presentó una respuesta completa que se observaba al mes de tratamiento y que se mantenía después de los tres meses al reducir la dosis a 20 mg. El autor concluye que la leflunomida es útil en los pacientes con LES con artritis grave en los que fracasan otros tratamientos.
Artritis psoriásica
En un estudio realizado en Argentina38 en un grupo de 72 pacientes, se compara la leflunomida a dosis habituales en 36 pacientes con otro grupo (36 pacientes) que reciben metotrexato a dosis de 7,5 mg/semana con suplemento de ácido fólico. Los autores concluyen que la leflunomida es un fármaco con seguridad y efectos beneficiosos similares al metotrexato. Se basaron en los resultados obtenidos con el ACR20 y ACR50, la opinión global del médico y el paciente, así como en los datos obtenidos en la reducción del número de articulaciones inflamadas y dolorosas.
Otro grupo de trabajo39 realiza un seguimiento de 13 pacientes durante 31 meses (8-31). Son tratados con leflunomida a dosis de 10-30 mg/24 h. Los autores estiman que la leflunomida puede ser un fármaco efectivo en la artritis psoriásica recalcitrante y en la psoriasis.
En un estudio realizado en Italia40 6 pacientes son tratados con leflunomida con dosis de carga habitual y 20 mg/24 h como mantenimiento. Todas las variables analizadas (número de articulaciones dolorosas e inflamadas, dolor, proteína C reactiva [PCR]) mejoraron, excepto la velocidad de sedimentación globular (VSG) y la extensión de la psoriasis. Los investigadores opinan que la leflunomida es un tratamiento activo y seguro en pacientes portadores de artritis psoriásica.
Actualmente está en marcha un estudio (en el que participan varios hospitales españoles) multicéntrico, multinacional, doble ciego, paralelo, aleatorio y controlado con placebo de la leflunomida en el tratamiento de la artritis psoriásica (HWA 486/3L01)
Granulomatosis de Wegener
Es una enfermedad de origen desconocido, probablemente autoinmune, etiquetada como una vasculitis sistémica con afectación de vasos pequeños, en la que destaca la presencia de granulomas, vasculitis necrotisante y variable grado de afectación renal (glomerulonefritis). Se ha relacionado con la presencia positiva de anticuerpos anticitoplasma de neutrófilo (ANCA) contra una proteinasa-3 (PR-3). Se ha realizado un estudio41,42 en 20 pacientes portadores de esta enfermedad a los que previamente se les indujo remisión completa o parcial con ciclofosfamida o metotrexato. Los pacientes recibieron leflunomida a dosis de carga, seguida de 20 mg/24 h con aumento a 30 y 40 mg/24 h a la semana 12 y 24, respectivamente, si no se observaba remisión completa. El tratamiento tuvo una duración de 52 semanas. Se utilizaron parámetros de medida de eficacia primaria (índice de extensión de enfermedad [DEI], medida de Birmingham de actividad de vasculitis [BVAS]43 y presencia de ANCA) y secundaria (SF-36, [VSG] y valores de PCR). Al final del estudio los autores no encontraron cambios clínicos relevantes en los parámetros de eficacia, pero a dosis de 30-40 mg/24 h era efectiva en el mantenimiento de las remisiones clínicas, por lo que concluyen que es un fármaco seguro y bien tolerado en la terapia de esta enfermedad en remisión parcial o completa.
Arteritis de Takayasu
Es una vasculitis que afecta a la aorta y sus ramas principales y a la arteria pulmonar. Su mecanismo etiopatogénico es desconocido. La terapia clásica combina el uso de corticoides e inmunodepresores (metotrexato, ciclofosfamida o azatioprina). En el Congreso de EULAR 200144 se comunica un caso de arteritis de Takayasu refractario a tratamiento con glucocorticoides y metotrexato en una mujer de 28 años con notable actividad de la enfermedad. Los autores utilizan leflunomida a dosis de 30 mg/día tras retirar el metotrexato y posteriormente reducen las dosis de corticoides hasta una suspensión total. A los 6 meses del inicio del tratamiento, los parámetros inflamatorios (VSG, PCR y IL-6) y clínicos (síncopes, cefaleas, etc.) disminuyeron notablemente.
Síndrome de Felty
Es una rara complicación de la artritis reumatoide caracterizada por la presencia de artritis, leucopenia y esplenomegalia. En un caso comunicado recientemente45, se presenta un paciente con síndrome de Felty tratado con metotrexato y prednisona. Al desarrollar leucopenia y neutropenia importantes se suspende este tratamiento. Los autores intentan remontar las cifras de leucocitos usando leucovorin, posteriormente factor recombinante estimulante colónico de granulocitos humanos y finalmente etanercept. Al no tener éxito inician tratamiento con leflunomida a las dosis habituales y observan recuperación paulatina y progresiva en los meses siguientes de los valores de leucocitos.
Este caso puede poner de manifiesto uno de los efectos importantes de la leflunomida, es decir, su acción inmunorreguladora sin el efecto citotóxico (neutropenia y leucopenia) que presentan los fármacos inmunodepresores clásicos. Los autores indican que puede ser un tratamiento alternativo en pacientes con síndrome de Felty grave.
Artritis crónica juvenil poliarticular
Es un subgrupo de la artritis crónica juvenil o artritis reumatoide juvenil. En un estudio multicéntrico, Silverman et al46 evalúan la eficacia y seguridad de la leflunomida durante 6 meses en un grupo de 27 pacientes portadores de artritis crónica juvenil poliarticular refractaria al tratamiento con metotrexato. Completaron las 26 semanas del estudio 18 y se retiraron 9 pacientes (4 por falta de eficacia, 4 voluntariamente y uno por efecto adverso). Al final del estudio 14 pacientes fueron considerados respondedores. Los efectos secundarios más notables que se hallaron fueron cefaleas, dolor abdominal e infecciones del tracto respiratorio superior. Los autores concluyen que la leflunomida es bien tolerada y beneficiosa en pacientes con artritis crónica juvenil poliarticular refractaria a la terapia con metotrexato.
Conclusión
Actualmente la leflunomida es un fármaco de elección en el tratamiento temprano de la artritis reumatoide. Su uso se está generalizando tanto en monoterapia como en combinación con otros fármacos (metotrexato), incluso en la práctica de muchos reumatólogos se usa junto con los fármacos anti-TNF. Es de esperar que los efectos beneficiosos que se consiguen en la artritis reumatoide (alterando su evolución natural y dando una mayor calidad de vida al paciente) sean aplicables a otras enfermedades reumatológicas. En éstas es importante el papel que desempeñan los linfocitos T, la producción de autoanticuerpos y la presencia de inmunocomplejos circulantes. Por tanto, parece lógico plantearse su uso por las diferentes acciones farmacológicas y mecanismos de acción que posee la leflunomida, que afectan al linfocito T y a la producción de autoanticuerpos. No obstante, la realización de estudios amplios aclarará las dudas planteadas y la terapia futura en estas enfermedades.