Introducción
Los pacientes sometidos a un trasplante hepático desarrollan una serie de enfermedades, relacionadas en muchos casos con el tratamiento inmunosupresor, que condicionan una importante morbilidad. Entre las complicaciones descritas, las enfermedades reumáticas adquieren cada vez mayor relevancia. Así, estos pacientes pueden presentar osteonecrosis, episodios de gota e infecciones osteoarticulares. Sin embargo, entre ellas destaca el desarrollo de enfermedad metabólica ósea, especialmente cuando se evidencia por fracturas que producen un gran deterioro en la calidad de vida, y que retrasan y limitan la capacidad de estos enfermos para realizar una actividad normal1-4.
Entre los trasplantes de órganos sólidos, el trasplante hepático es uno de los que con más frecuencia se ha asociado al desarrollo de osteoporosis. En estos pacientes se ha descrito una incidencia de fracturas que oscila entre un 17 y un 65%5-10. Las diferencias en las frecuencias descritas en las distintas series se deben a la ausencia de criterios estandarizados en la definición de fractura vertebral, al hecho de que en muchas ocasiones sólo se contabilizan las fracturas sintomáticas y a las heterogeneidad de las poblaciones analizadas (algunas series incluyen únicamente a pacientes trasplantados por hepatopatías crónicas, mientras otras abarcan hepatopatías subagudas, agudas y pacientes retrasplantados). No existe un factor de riesgo concreto o una prueba complementaria que permita identificar con exactitud a los pacientes que van a desarrollar fracturas. No obstante, existen características intrínsecas al individuo y otros factores relacionados con la enfermedad previa al trasplante, que pueden favorecer el desarrollo de osteopatías. Así, hasta un 50% de los pacientes con una cirrosis hepática grave pueden presentar una osteoporosis y alrededor de un 60% tiene concentraciones bajas de 25 hidroxivitamina D sérica y/o un hipogonadismo11. Sin embargo, el tratamiento inmunosupresor es probablemente el factor desencadenante más importante tras el trasplante.
Inmunosupresión
Resulta difícil analizar el efecto real de los diferentes inmunosupresores sobre el metabolismo óseo, la introducción de la ciclosporina A permitió reducir las dosis de glucocorticoides que recibían los pacientes y, en ese sentido, ha tenido un efecto beneficioso sobre la evolución de la afección ósea. Sin embargo, no podemos afirmar que la ciclosporina A sea totalmente inocua para el hueso. In vitro, disminuye la resorción ósea, pero in vivo en estudios experimentales en rata aumenta el remodelado óseo y causa osteopenia12-14. Aun así, en estudios realizados en pacientes con trasplante renal que recibían tratamiento con ciclosporina A y no recibían glucocorticoides, se observó un aumento de la masa ósea15. Los estudios experimentales realizados con FK 506 han proporcionado resultados contradictorios16,17, pero en los escasos ensayos clínicos realizados no se observan diferencias importantes entre la ciclosporina A y el FK 506, y la dosis de glucocorticoides parece ser el factor determinante18.
Actualmente, carecemos de datos sobre el efecto de la rapamicina o el micofenolato en la incidencia de fracturas o la evolución de la masa ósea en los pacientes con trasplante hepático. Estudios experimentales en rata muestran que la rapamicina produce un aumento del remodelado óseo y, aunque a corto plazo, no produce una reducción del volumen trabecular y afecta al crecimiento del hueso, lo que contraindica su uso en niños19. La azatioprina y el micofenolato mofetil no parecen tener un efecto pernicioso sobre el tejido óseo a corto plazo20.
Estudios in vitro dirigidos a evaluar el efecto de los inmunosupresores en los mecanismos de regulación del metabolismo óseo, sugieren que, de forma similar a los glucocorticoides, la ciclosporina A, la rapamicina y el FK 506 disminuyen la secreción de osteoprotegerina y estimulan la producción de RANK-L en células estromales. Por el contrario, en células osteoblásticas fetales la rapamicina aumenta la producción de osteoprotegerina21.
En general, los resultados sugieren que los inmunosupresores tienen un efecto directo sobre el metabolismo óseo, aunque las nuevas pautas de tratamiento podrían llegar a reducir sus efectos indeseables.
Después del trasplante
Durante los primeros 6 meses postrasplante, se observa un aumento del remodelado óseo, con una elevación de los marcadores bioquímicos de resorción y un desacoplamiento inicial de los marcadores de formación ósea que posteriormente se recuperan22. En las biopsias óseas realizadas después del trasplante se observa un aumento del remodelado óseo, que se refleja fundamentalmente en el aumento de los parámetros de formación. Los resultados sugieren también un aumento de la resorción ósea, aunque los parámetros histomorfométricos no alcanzan significación estadística, probablemente a causa del número insuficiente de pacientes9,10,23.
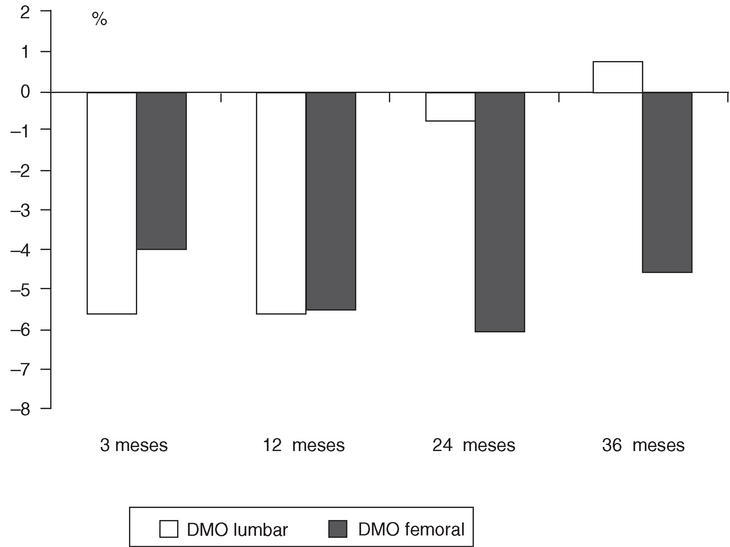
El aumento del remodelado que se observa después del trasplante hepático, se acompaña de una importante pérdida de densidad mineral ósea (DMO), que alcanza del 3 al 24% en columna lumbar y del 4 al 5% en cuello femoral (fig. 1). En la mayoría de los casos, la masa ósea lumbar aumenta progresivamente a partir del primer año del trasplante7,8,10,24, no obstante, el cuello femoral parece reflejar una respuesta más tardía del hueso cortical y, aunque aumenta a partir del segundo año del trasplante, no llega a alcanzar los valores basales (fig. 1)10. Uno de los factores más importantes en el desarrollo de fracturas esqueléticas es la DMO previa al trasplante, de forma que los pacientes que presentan una osteoporosis por criterios densitométricos tienen un mayor riesgo de desarrollar fracturas, con una odds ratio (OR) de 5,6 (intervalo de confianza [IC] del 95%, 1,31-24,53)10. Sin embargo, pacientes con DMO normal pueden desarrollar fracturas después de un trasplante hepático.
Figura 1. Variación porcentual de la densidad mineral ósea respecto a los valores previos al trasplante hepático15.
A nivel hormonal, el déficit de vitamina D y el hipogonadismo se recuperan en la mayoría de los pacientes durante el primer año del trasplante. Estudios realizados en nuestro propio centro sugieren que las concentraciones de 25-hidroxivitamina D aumentan a partir del tercer mes del trasplante y posteriormente se mantienen estables. Al tercer año del trasplante sólo el 10% de los pacientes presentaba concentraciones de 25-hidroxivitamina D inferiores a las normales. En los varones se observa un aumento de las concentraciones de testosterona libre a partir del primer mes del trasplante, y continúan aumentando posteriormente10.
Durante los primeros meses después del trasplante aumentan los valores séricos de paratirina, que continúan elevándose progresivamente durante todo el primer año10,25. Hasta un 40% de los pacientes pueden presentar valores séricos de paratirina por encima del rango de la normalidad a partir del primer año del trasplante hepático. Los valores de paratirina se correlacionan con los valores de creatinina sérica, sin embargo, aún no existen datos suficientes para explicar los mecanismos que favorecen el desarrollo del hiperparatiroidismo secundario en estos pacientes, y tampoco se conoce su participación real en la evolución de la masa ósea o su efecto sobre el metabolismo óseo a largo plazo.
Factores de riesgo asociados al desarrollo de osteoporosis
Aunque no existen factores predictivos que permitan seleccionar qué pacientes van a desarrollar una osteoporosis después del trasplante, conocemos algunas de las circunstancias que favorecen la pérdida de masa ósea o aumentan el riesgo de presentar fracturas.
Se ha observado que la pérdida de masa ósea después del trasplante puede estar influida por la edad, la DMO previa al trasplante, los valores séricos de paratirina, la dosis diaria y acumulada de glucocorticoides, las concentraciones séricas de ciclosporina A y los días de estancia hospitalaria8-10,26. Además, el estudio de Crosbie et al22 sugería que los valores séricos de 25-hidroxivitamina D a los 3 meses del trasplante podrían predecir los cambios en la masa ósea lumbar, y femoral a los 6 meses. Recientemente, Guardiola et al27, observaron que la evolución de la masa ósea lumbar estaba influida por los polimorfismos del gen del receptor de la vitamina D y que el genotipo bb podría ejercer un papel protector sobre la masa ósea.
Los resultados de los estudios clínicos indican que las fracturas son más frecuentes entre los pacientes de más edad, de sexo femenino, los portadores de hepatopatías colestásicas y los retrasplantados. La presencia de una fractura o una DMO baja espe cialmente, los pacientes que tienen una osteoporosis diagnosticada por criterios densitométricos antes del trasplante y la pérdida de masa ósea en los 3 primeros meses influyen de forma importante en el desarrollo de nuevas fracturas esqueléticas7-10,28.
Recomendaciones para la evaluación de los pacientes en lista de trasplante
A pesar de la dificultad para seleccionar qué pacientes van a presentar fracturas después de un trasplante, una evaluación adecuada permite identificar a los que presentan un mayor riesgo (tabla 1). Al igual que en cualquier otra enfermedad, el estudio debe iniciarse con una anamnesis completa con especial atención a los factores de riesgo clínicos. Como se ha comentado anteriormente, los pacientes con fracturas o con una osteoporosis por criterios densitométricos previos al trasplante hepático, al igual que los que presentan una importante pérdida de masa ósea en los primeros meses, tienen un mayor riesgo de desarrollar fracturas; por ello, la evaluación debería incluir la radiología de columna vertebral y la medición de la DMO.
Otros mecanismos implicados en el desarrollo de osteopatías pueden ser detectados mediante pruebas de laboratorio y es recomendable determinar los valores séricos de calcio, fósforo, fosfatasa alcalina, paratirina y 25-hidroxivitamina D. En el varón, el hipogonadismo puede descartarse al evaluar los valores de testosterona libre. Los marcadores bioquímicos del remodelado óseo pueden ser útiles en algunas circunstancias; sin embargo, actualmente en estos pacientes su uso más aceptado es la investigación.
Tratamiento
Uno de los principales problemas, cuando se realizan recomendaciones sobre el tratamiento de la osteoporosis en los pacientes sometidos a trasplante hepático, es que la mayoría de los estudios realizados tienen importantes problemas metodológicos; hay muy pocos ensayos aleatorizados, la mayoría se han realizado con un número escaso de pacientes y en casi todos el objetivo es evaluar la eficacia del tratamiento sobre la DMO y no hay datos suficientes para valorar la eficacia de estos fármacos sobre la reducción de fracturas vertebrales o periféricas. Además, aunque es importante considerar los factores de riesgo que confluyen en cada caso y se debe realizar una evaluación meticulosa de los pacientes (tabla 1) para descartar la presencia de una osteopenia o una osteoporosis, no podemos olvidar que los pacientes con DMO normal también pueden desarrollar fracturas después de un trasplante.
Existen ciertas medidas generales que deben ser consideradas en todos los pacientes. Es necesario que reciban un aporte adecuado de calcio (entre 1.000 y 1.500 mg de calcio elemento) y de vitamina D (400-800 UI), se debe recomendar que se utilicen las pautas de inmunosupresión menos nocivas para el esqueleto al reducir, en lo posible, las dosis de glucocorticoides y evitar la inmovilización prolongada.
La perdida de masa ósea y las fracturas se desarrollan especialmente en los primeros meses; por tanto, hay que iniciar el tratamiento lo más tempranamente posible tras el trasplante. Sin embargo, es difícil elegir el más adecuado. Un estudio realizado por Valero et al29, que analizaba la eficacia de la elcatonina y el etidronato cíclico asociados a calcio, sugería que ambos fármacos eran útiles en el tratamiento de los pacientes sometidos a trasplante hepático. El estudio de Neuhaus et al30 mostraba que el tratamiento con calcitriol y calcio podría reducir la incidencia de fracturas y la pérdida de masa ósea, aunque este estudio tenía importantes limitaciones metodológicas. Contradiciendo estos resultados, Riemens et al31 no observaron una reducción en la pérdida de masa ósea o en la incidencia de fracturas al utilizar etidronato cíclico, alfacalcidiol y calcio y en un ensayo abierto pero aleatorizado, el tratamiento con calcitonina (100 UI subcutanea) fue ineficaz32.
No disponemos de estudios que analicen la eficacia y la seguridad a largo plazo del tratamiento hormonal sustitutivo (THS), en esta población. En un estudio con 2 años de seguimiento, el tratamiento con 17 beta-estradiol administrado a 33 mujeres menopáusicas receptoras de un trasplante hepático se asociaba a un aumento del 5% de la DMO en columna lumbar y un 3% en cuello femoral, y a una reducción del 47% del propéptido aminoterminal del procolágeno33. Sin embargo, la inclusión se realizó como mínimo 6 meses después del trasplante, algunas pacientes recibieron simultáneamente calcio y calcitonina, y sólo 3 pacientes del grupo control completaron los 2 años de seguimiento.
Por último, 2 ensayos clínicos en los que se administraba pamidronato disódico34,35 después del trasplante hepático, indicaban que este fármaco reducía la incidencia de fracturas y aumentaba la DMO cuando los resultados se comparaban con los datos obtenidos de grupos controles retrospectivos. No obstante, un estudio aleatorizado realizado en 99 pacientes con trasplante hepático no observó diferencias en la evolución de la masa ósea lumbar y femoral o la incidencia de fracturas esqueléticas36, por lo que su eficacia aún no ha sido demostrada.
En resumen, al considerar los resultados de los estudios publicados, se puede concluir que los tratamientos con calcio, metabolitos activos de la vitamina D y bisfosfonatos pueden ser útiles en los pacientes con trasplante hepático. Sin embargo, debemos recordar que no existen resultados concluyentes y son necesarios nuevos ensayos diseñados adecuadamente para confirmar estas afirmaciones.