La resección quirúrgica se considera el tratamiento curativo por excelencia para los pacientes con tumores hepáticos primarios o metastásicos. Sin embargo, menos de 40% de ellos son candidatos a cirugía, ya sea por factores no modificables (comorbilidades, edad, disfunción hepática…), como por la invasión o proximidad del tumor a los principales pedículos vasculares, la falta de un futuro remanente hepático (FRH) adecuado para mantener una función hepática postoperatoria, o criterios de tamaño y numero tumoral. En estos últimos factores, la radioembolización hepática ha mostrado tener un papel como herramienta prequirúrgica, ya sea mediante la hipertrofia del FRH o mediante la reducción del tamaño tumoral que consigue disminuir la estadificación tumoral (término conocido como «downstaging»). A estos se suma un tercer factor, que es su capacidad de aplicar el test del tiempo, que permite identificar aquellos pacientes que presenten en un plazo corto de tiempo progresión de la enfermedad (tanto a nivel local como a distancia), evitándoles una cirugía innecesaria. En este trabajo se pretende hacer una revisión de la radioembolización como herramienta facilitadora de la cirugía hepática, tanto a través de la experiencia de nuestro centro como de la evidencia científica disponible.
Surgical resection is considered the curative treatment par excellence for patients with primary or metastatic liver tumors. However, less than 40% of them are candidates for surgery, either due to non-modifiable factors (comorbidities, age, liver dysfunction...), or to the invasion or proximity of the tumor to the main vascular requirements, the lack of a future liver remnant (FLR) adequate to maintain postoperative liver function, or criteria of tumor size and number. In these last factors, hepatic radioembolization has been shown to play a role as a presurgical tool, either by hypertrophy of the FLR or by reducing tumor size that manages to reduce tumor staging (term known as “downstaging”). To these is added a third factor, which is its ability to apply the test of time, which makes it possible to identify those patients who present progression of the disease in a short period of time (both locally and at distance), avoiding a unnecessary surgery. This paper aims to review RE as a tool to facilitate liver surgery, both through the experience of our center and the available scientific evidence.
Las terapias locorregionales desempeñan un papel destacado en el tratamiento de los tumores hepáticos, especialmente del carcinoma hepatocelular (CHC) tanto en estadios precoces como avanzados. La quimioembolización transarterial (TACE) sigue siendo el tratamiento estándar y más globalmente utilizado para el CHC en el estadio intermedio1. Sin embargo, existe cada vez más evidencia que demuestra la eficacia de otras terapias locorregionales, como la radioembolización (RE) con Itrio-90 (90Y) o con Holmio-166 (166Ho), en el tratamiento de tumores hepáticos primarios y metastásicos.
El término RE se refiere a la aplicación de altas dosis de irradiación ß de corto alcance utilizando microesferas cargadas con 90Y o con 166Ho. Actualmente se disponen de dos tipos de microesferas marcadas con 90Y, de resina (Sir-Spheres®, Sirtex Medical Ltd., Sydney, Australia), que es en la que se basa la experiencia de nuestro centro, y de vidrio (Therasphere®, Boston Scientific, Boston, MA, EE. UU.), mientras que marcadas con 166Ho, solo se dispone de microesferas de ácido poli-L-láctico (PLLA) (QuiremSpheres®, Quirem Medical B.V., Deventer, Países Bajos).
La administración de las microesferas por vía intraarterial permite alcanzar selectivamente los tumores hepáticos (aprovechándose de su principal vascularización arterial), minimizando la radiación del hígado no tumoral. Tanto el 90Y como el 166Ho presentan un rango medio de penetración bajo (2,5 mm y 2,2 mm, respectivamente), por lo que se consigue administrar dosis muy altas en el tumor con una radiación mínima en los tejidos situados a más de 1 cm de este2. Esto permite maximizar la dosis absorbida por el tejido tumoral y minimizar la dosis recibida por tejido adyacente. De esta manera se mejora la respuesta observada mientras se reducen las complicaciones derivadas de la radiación del tejido hepático normal. Pero como se verá a lo largo de este trabajo, los beneficios de la RE van mucho más allá de su capacidad tumoricida, lo que la convierten en una terapia locoregional con un gran potencial terapéutico.
Es importante destacar que dependiendo del tipo de microesferas empleadas, existen diferencias en los valores de dosis absorbidas que se prescriben en el estudio de planificación (tomografía por emisión de fotón único/tomografía computarizada [SPECT/TC] con 99mTc-macroagregados de albúmina [MAA] o con 166Ho-PLLA). Parece que estas diferencias se deben en gran medida a la diferencia en el número de partículas inyectadas, que condicionan diferencias en el efecto biológico, tanto en términos de eficacia como de toxicidad. Así, potencialmente, para la misma actividad prescrita, el mayor número de microesferas de resina puede proporcionar una distribución de dosis más uniforme, con un mayor efecto biológico3, por lo que generalmente las dosis absorbidas necesarias para producir un efecto tumoricida con este tipo de esferas son inferiores que con las de vidrio e incluso las de 166Ho.
Desde los primeros estudios realizados a principios de los años 60 del siglo pasado, el desarrollo e investigación en las aplicaciones clínicas de la RE han logrado que hoy en día ya esté integrada dentro del arsenal terapéutico de los principales tumores hepáticos primarios y metastásicos. Dependiendo de la intención con la que se quiera aplicar, la RE con 90Y ha demostrado ser efectiva tanto como un tratamiento puramente ablativo (y potencialmente curativo en estadios iniciales), como paliativo en estadios avanzados de la enfermedad4.
Sin embargo, debemos destacar el papel de la RE como herramienta prequirúrgica. Frente a otros tratamientos intraarteriales (como la TACE), la RE destaca por su capacidad de hipertrofiar el futuro remanente hepático (FRH) cuando se aplica al tejido sano contralateral. Igualmente, su eficacia en la reducción del tamaño tumoral permite disminuir la estadificación tumoral (término conocido como «downstaging»). Ambos efectos son los pilares que permiten acceder a la cirugía5,6, único tratamiento potencialmente curativo en estos pacientes. Pero cabe destacar un tercer factor: el test del tiempo. Para lograr conseguir estos efectos (disminución de tamaño/hipertrofia contralateral) es preciso que transcurran al menos tres a cuatro meses. La ausencia de progresión a distancia durante este tiempo ayuda a confirmar la indicación quirúrgica en un contexto generalmente de tumores avanzados o biológicamente agresivos. Aplicada, por tanto, con intención prequirúrgica, la RE ofrece la posibilidad de un tratamiento potencialmente curativo a pacientes con tumores hepáticos primarios y metastásicos cuyo pronóstico sin cirugía sería modesto. Es importante destacar que, para conseguir unos resultados adecuados, es necesario su manejo e indicación en el contexto de un equipo multidisciplinar. El equipo quirúrgico debe definir las necesidades para lograr convertir la enfermedad en resecable, oncólogos y hepatólogos deben centrar este tratamiento en el contexto de la enfermedad oncológica o hepática respectivamente, y el trabajo conjunto del radiólogo intervencionista y del médico nuclear debe permitir diseñar el tratamiento más eficaz para lograr dichos objetivos.
La cirugía hepática como tratamiento curativo de tumores hepáticos primariosLa resección quirúrgica se considera el tratamiento curativo por excelencia para los pacientes con tumores hepáticos primarios7,8. La resección hepática (RH) debe asegurar la extirpación completa del tumor con márgenes libres (resección R0) y la preservación de un remanente hepático suficiente. Bajo estas condiciones, en pacientes correctamente seleccionados con CHC o colangiocarcinoma intrahepático (CCi), la tasa de supervivencia a cinco años de la RH se encuentra respectivamente en torno a 70-80% y 25-40%. Por otro lado, el trasplante hepático (TH) se considera una alternativa a la RH con potencial curativo. En pacientes con CHC dentro de los criterios de Milán (un nódulo tumoral menor de 5 cm o dos a tres nódulos menores de 3 cm), las tasas de supervivencia postrasplante a cinco años llegan a alcanzar 75-80%, con la ventaja frente a la resección de un bajo riesgo de recurrencia y la eliminación de la cirrosis hepática subyacente9,10. El papel del TH en pacientes con CCi es más limitado, aunque ha emergido en los últimos años como una prometedora estrategia terapéutica. Actualmente, el TH de inicio se reserva para aquellos pacientes con CCi muy precoz que no son susceptibles de RH, normalmente debido a una disfunción hepática subyacente significativa11.
Sin embargo, la mayoría de los pacientes con tumores hepáticos primarios son diagnosticados en un estadio avanzado y no son candidatos a cirugía (RH o TH). De hecho, solo 10-40% de todos los pacientes con tumores hepáticos primarios son candidatos a RH en el momento del diagnóstico7. Las comorbilidades, la edad, la disfunción hepática o complicaciones derivadas de la cirrosis son, entre otros, factores no modificables que contraindican la RH o el TH en estos pacientes. Por otro lado, factores como la invasión o proximidad del tumor a los principales pedículos vasculares, la falta de un FRH adecuado para mantener una función hepática postoperatoria suficiente o criterios de tamaño y numero tumoral impiden también el acceso a la RH y al TH a una gran proporción de pacientes. Son este último subgrupo de pacientes no candidatos a cirugía en los que es posible aplicar la RE con el objetivo final de alcanzar unos criterios que permitan realizar una cirugía segura, oncológicamente adecuada y con potencial curativo.
Resección hepática y radioembolizaciónLa RE se puede aplicar previamente a la cirugía con una combinación de los siguientes objetivos, según cada caso concreto:
- 1.
Disminución del estadio tumoral (downstaging).
- 2.
Hipertrofia del FRH.
- 3.
Control local de la enfermedad.
- 4.
Test del tiempo.
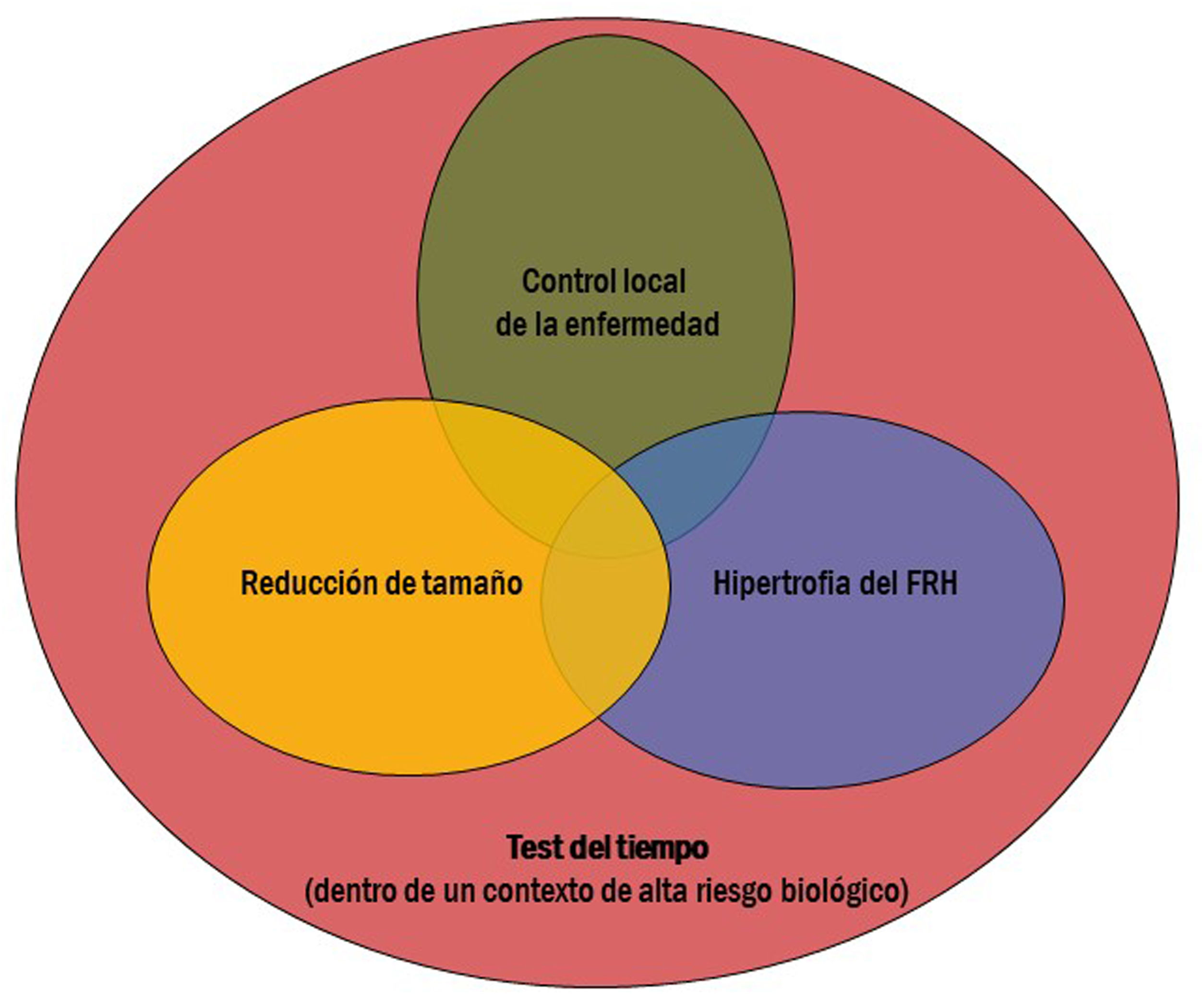
El tratamiento de RE se realiza generalmente con la intención de conseguir dos o más de estos objetivos al mismo tiempo (fig. 1). Dado que los objetivos que se buscan a nivel hepático se aplican generalmente dentro de un contexto de alto riesgo biológico tumoral, el último factor (test del tiempo) suele ser estar presente en la mayoría de los casos. La finalidad de este tiempo es identificar aquellos pacientes que presenten en un plazo corto de tiempo progresión de la enfermedad (tanto a nivel local como a distancia), y así evitarles una cirugía innecesaria.
Dependiendo del objetivo principal con el que se aplique la RE y la anatomía arterial de cada paciente, se debe diseñar el tratamiento de forma personalizada. Esto incluye en qué lugar(es) del árbol arterial administrar las microesferas, así como la planificación de dosis administrada en cada lugar y estimación de dosis absorbidas por el tumor y el parénquima hepático sano.
A continuación se describen los principales objetivos de la RE:
Dowstaging del tumorEl concepto de downstaging del tumor se refiere a la reducción de la carga tumoral viable con el objetivo de cumplir los criterios de acceso al tratamiento quirúrgico (TH o RH). En esencia, el downstaging actúa como herramienta para seleccionar un subconjunto de pacientes con una biología tumoral favorable –que responden a los tratamientos de reducción de estadio– y cuyos resultados oncológicos se han demostrado favorables tras el TH o la RH. Al igual que en otros centros, en el nuestro se prioriza la RE como principal herramienta de downstaging por encima de otros tratamientos locoregionales como puede ser la TACE12.
El downstaging del tumor con intención de alcanzar criterios de TH se ofrece en nuestro centro a pacientes seleccionados con CHC multinodular, función hepática preservada, sin enfermedad extrahepática y que se encuentren fuera de los criterios de Up-to-7 (la suma del número de nódulos tumorales y del diámetro en centímetros del nódulo tumoral de mayor tamaño es menor o igual que siete). Bajo esta modalidad de tratamiento, la RE ofrece tasas de downstaging a TH de alrededor de entre 50 y 60%. Los resultados oncológicos posteriores son excelentes, observándose en los pacientes a los que se les redujo hasta criterios de Milán una supervivencia post-TH a cinco años de 78%, una tasa similar a la de los pacientes que inicialmente cumplen estos criterios y no necesitan una reducción de estadio13.
La RE tiene grandes aplicaciones cuando se quiere utilizar para downstaging con intención de lograr una RH posterior. La capacidad tumoricida de la RE permite, en pacientes con tumores hepáticos primarios y secundarios, reducir el tamaño tumoral de lesiones que se encuentran próximos a estructuras vasculares o biliares (fig. 2). Cuando estos tumores afectan a estas estructuras de manera bilobar o cercanas a la bifurcación del hilio hepático, se consideran en su mayoría irresecables. En estos pacientes, la RE ha demostrado lograr altas tasas de respuesta tumoral significativa (alcanzando entre 60 y 90% de respuestas completas radiológicas) y control de la enfermedad permitiendo realizar una resección R0 posterior4,14.
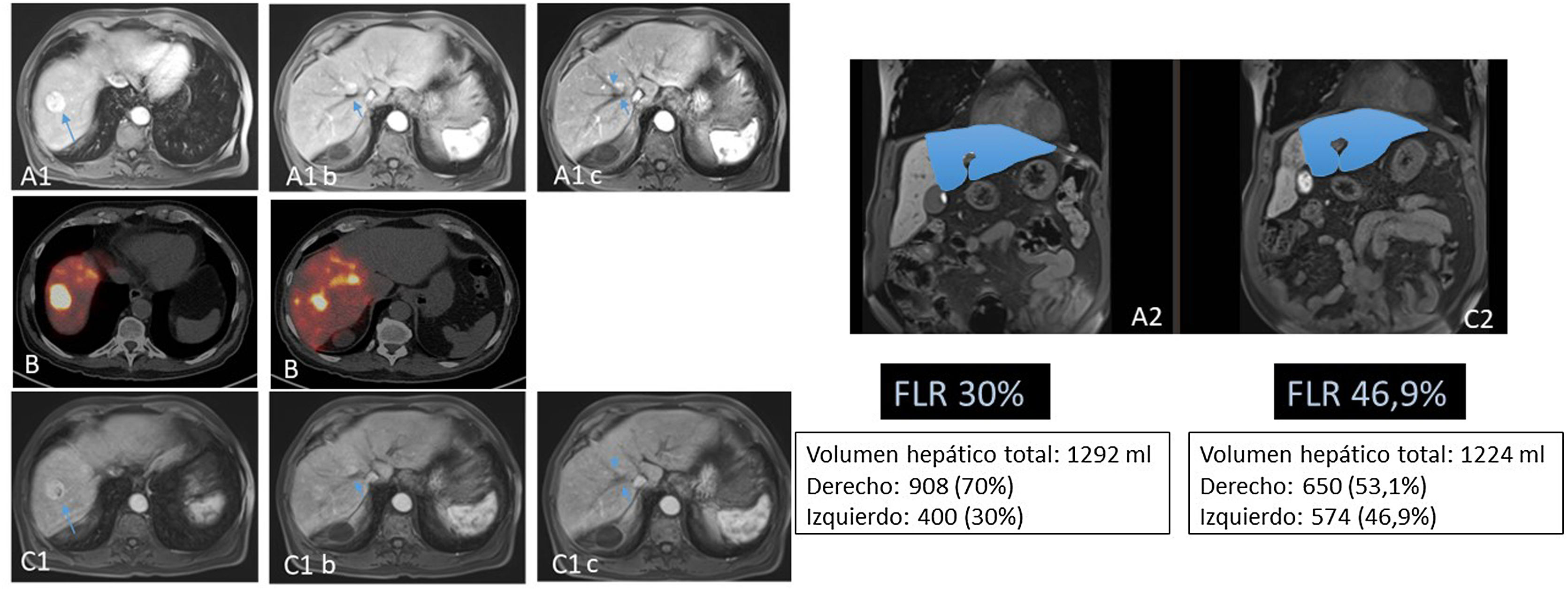
Paciente de 69 años con hepatocarcinoma binodular. No enfermedad a distancia. Función hepática conservada. Se aprecian dos lesiones en la resonancia magnética en segmentos VII y VIII (A). En imágenes A1b y A1c se aprecia que la lesión del segmento VIII está en contacto con la vena suprahepática derecha. Esto, unido al hecho de que el remanente hepático tras una hepatectomía derecha sería de 30% (A2), hicieron que se plantease la realización de una RE con la doble finalidad de downstaging e hipertrofia del remanente hepático. En el estudio PET-90Y (B) tras la administración por la arteria hepática derecha de 1,5 GBq de 90Y-microesferas de resina, se comprobó la adecuada llegada del tratamiento a las lesiones tumorales (dosis absorbida media de 185 Gy) y al tejido no tumoral hepático derecho (dosis absorbida media de 76 Gy; V30 56%). A los cinco meses de la radioembolización se comprobó (C1) la separación de la lesión del VIII de la vena adyacente (C1b y C1c), junto a una adecuada hipertrofia del remanente (C2). El paciente fue tratado mediante hepatectomía derecha laparoscópica (no requirió transfusión; tres días de ingreso). En la fecha de la última revisión (72 meses tras la cirugía), el paciente seguía vivo y libre de enfermedad.
En pacientes con tumores resecables con alto riesgo biológico tumoral que precisan una RH mayor o extendida, la RE segmentaria se puede aplicar con intención de reducir el tamaño tumoral. Esta modalidad permite valorar la respuesta local y la evolución de la enfermedad a la vez que facilita la realización de hepatectomías menos extensas, un factor especialmente útil en pacientes con metástasis de cáncer colorrectal (mCCR) (fig. 3). Esto conlleva una disminución del riesgo de complicaciones asociadas a la extensión de la hepatectomía, así como un ahorro de parénquima hepático. En estos casos, la planificación de la RE debe ser lo más selectiva posible, con la finalidad de generar respuesta tumoral a la vez que se preserva la máxima cantidad de parénquima hepático no tumoral posible, permitiendo que la potencial resección sea más segura.
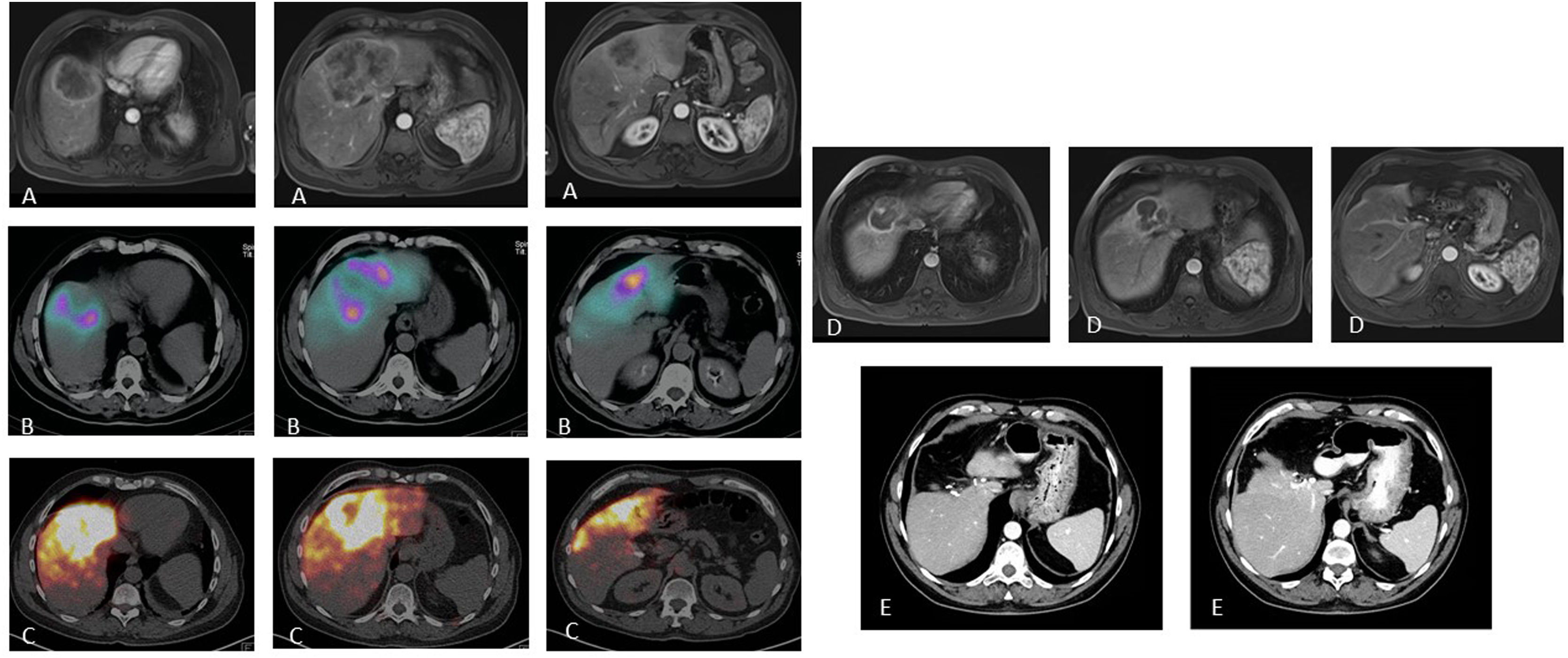
Paciente con carcinoma de recto estadio IV por metástasis única que afecta los segmentos centrales IVa, IVb y VIII tratada con quimioterapia neoadyuvante (FOLFOXIRI) con respuesta minor (A). Con la intención de reducir el tamaño tumoral (que requería cirugía hepática extrema) y como test del tiempo (primario no resecado y comportamiento tumoral incierto), se valora al paciente como candidato a RE. La SPECT/TC tras la inyección de MAA a través de las arterias segmentaria del VIII y accesoria de la hepática izquierda (B) muestra el adecuado acceso al tejido tumoral, con llegada a parte del tejido no tumoral pero con preservación de todos los segmentos hepáticos posteriores. Se administran 2,3 GBq de 90Y-microesferas de resina. El estudio dosimétrico en el PET de 90Y (C) calcula una dosis absorbida media en el tumor de 120 Gy y en el tejido no tumoral de 74,7 Gy. El estudio de resonancia magnética ocho meses después de la RE (D) muestra una reducción significativa del tamaño tumoral, lo que permite realizar una hepatectomía central laparoscópica (E) con mínima pérdida de sangre e ingreso de tres días. El paciente sigue vivo 72 meses después de la RE y ha permanecido libre de enfermedad tumoral hepática 54 meses tras la cirugía (presentó lesión metastásica en el segmento V/VIII que fue nuevamente resecada).
Cuando el principal objetivo de la RE es una reducción del tamaño tumoral, idealmente la infusión de las microesferas debe hacerse de forma selectiva en la/s arteria/s segmentaria/s o subsegmentaria/s de la que depende el tumor. De esta manera, la radiación administrada al tumor es máxima consiguiendo una mayor necrosis y una consecuente disminución de la masa tumoral. Cuando el estudio angiográfico y la SPECT/TC-MAA confirman la posibilidad de administrar el tratamiento casi de manera exclusiva al tumor o como mucho a dos segmentos hepáticos en los que se sitúa este, la finalidad del tratamiento será administrar una dosis tumoricida o ablativa de los segmentos (segmentectomía rádica). Sin embargo, cuando por la localización del/os tumor/es, no sea posible una administración selectiva de la RE, se ha de tener en cuenta en gran medida la dosis que recibirá el tejido no tumoral, lo que en ocasiones condicionará la dosis absorbida por el tumor e incluso la idoneidad del paciente como candidato a RE.
Como se ha comentado previamente, dependiendo del tipo de esferas empleadas, las dosis absorbidas que se deben emplear pueden ser significativamente diferentes. En el caso de las esferas de vidrio, el estudio LEGACY demostró en un subconjunto de pacientes en los que se relacionó la dosis con la respuesta patológica de la pieza resecada o trasplantada, que cuando la dosis absorbida en el volumen hepático que incluía al tumor era superior a 400 Gy, se encontraba necrosis patológica completa4. Este valor está respaldado por un estudio fase 2, en el que los investigadores encontraron una diferencia significativa en la dosis absorbida de los respondedores frente a los no respondedores (490 Gy vs. 275 Gy)15. Estos valores se refieren al cálculo unicompartimental, en el que únicamente se tiene en cuenta el volumen de tejido hepático que va a recibir la dosis, sin distinguir entre la dosis absorbida por el tumor y por el tejido no tumoral. Sin embargo, actualmente se recomienda el empleo de la dosimetría multicompartimental (que hace distinción entre las dosis recibida por cada uno de estos compartimentos tisulares) personalizada, ya que permite la optimización del tratamiento. Por ello, se ha de tener en cuenta que la dosis absorbida por el tejido tumoral óptima establecida para este tipo de esferas es de > 200 Gy16.
En el caso de las esferas de resina, la dosis recomendada hasta el momento para conseguir respuesta tumoral es > 100-120 Gy, mientras que para producir una ablación de los segmentos en los que se localiza el tumor, de > 150 Gy. No obstante, es importante precisar que este último valor se definió a partir de la experiencia de los distintos autores implicados en las recomendaciones internacionales para este tipo de esferas, ya que en ese momento no se disponía de suficiente evidencia científica17. Sin embargo, recientemente se ha publicado un estudio que al comparar la eficacia, seguridad y dosimetría de ambas esferas de 90Y para producir una segmentectomía rádica, determinaba que el umbral medio de dosis absorbida por tumor capaz de predecir la respuesta objetiva y completa del tumor fue, respectivamente, de 176 Gy y 247 Gy para resina y de 290 Gy y 481 Gy para vidrio18.
En el caso de las esferas de 166Ho, la recomendación actual es prescribir una dosis absorbida por tumor > 150 Gy en el caso del HCC y > 90 Gy para las metástasis de tumor colorrectal (mCCR)3. Sin embargo, hasta el momento no se dispone de resultados que permitan establecer límites dosimétricos para estas esferas en la segmentectomía rádica.
Si por el contrario, debido a la localización de las lesiones tumorales no es posible realizar una RE selectiva y previsiblemente el volumen a tratar será alrededor de los dos tercios del volumen hepático total, se ha de tener en cuenta la dosis absorbida que recibirá el tejido hepático no tumoral para evitar toxicidad hepática secundaria al tratamiento. Esta situación, menos habitual que la anterior, se podría encontrar en el contexto del uso de la RE como downstaging de la enfermedad con intención de alcanzar criterios de TH, o como se verá en el apartado 3, cuando el objetivo principal es el control de la enfermedad pero no es posible acceder de una manera selectiva al tumor. Para las esferas de vidrio, la recomendación es que la dosis absorbida media que reciba el tejido no tumoral total (tratado y no tratado) sea < 75 Gy (rango de 50-90 Gy) o < 120 Gy en el tejido sano tratado en aquellos pacientes con características similares a los incluidos en el estudio DOSISPHERE (Child-Pugh A, lesiones grandes y con al menos 30% de la reserva hepática preservada)3. En aquellos pacientes en los que para no sobrepasar estos límites en el tejido sano, no sea posible que el tejido tumoral reciba al menos 200 Gy (205 Gy en el caso de invasión macrovascular) deben considerarse otras alternativas terapéuticas16. Dado que estos umbrales se han establecido en su mayoría en pacientes cirróticos con CHC, pueden considerarse seguros también para pacientes con tumores distintos al CHC. Sin embargo, se requiere especial precaución en pacientes con CCi con cirrosis subyacente y después de la quimioterapia3. Respecto a las esferas de resina, las recomendación aceptada es que el tejido no tumoral reciba < 40 Gy, reduciéndose a < 30 Gy en pacientes que hayan recibido previamente quimioterapia o que presenten función hepática comprometida. Al igual que para las esferas de vidrio, si estas limitaciones no permiten administrar una actividad suficiente para que el tejido tumoral reciba > 100 Gy, deberían considerarse terapias alternativas a la RE17. En el caso de las esferas de 166Ho, los valores aceptados en el tejido sano unilobar se sitúan < 60 Gy, considerándose al paciente como candidato a RE solo si es posible conseguir que el tejido tumoral reciba > 150 Gy (para HCC y CCI) o > 90 Gy (para mCRC)3.
En ocasiones, la contraindicación de la cirugía se debe a la infiltración de estas estructuras sumado a la ausencia de un FRH adecuado. En estos casos, la planificación juega un papel crucial, debiéndose combinar la aplicación de la RE de forma selectiva al tumor junto con la aplicación lobar. De este modo, se logra así en el mismo paciente una respuesta tumoral efectiva favoreciendo al mismo tiempo la atrofia del lóbulo tratado y la hipertrofia contralateral. Esta técnica mixta de administración, conocida como lobectomía rádica modificada, combina una administración selectiva dirigida al tumor y otra lobar dirigida al tejido sano. De esta manera, es posible alcanzar la dosis tumoricida establecida para cada tipo de microesferas, sin sobrepasar los límites recomendados como seguros para el tejido sano19.
Por último, la RE también parece ser útil como tratamiento de downstaging a cirugía laparoscópica. Este concepto novedoso, nunca publicado en la literatura, se basa en los beneficios que la cirugía hepática laparoscópica ha mostrado sobre la abierta. El abordaje laparoscópico ha demostrado una superioridad frente al abierto en resultado intraoperatorios y de morbimortalidad así como una asociación con mejores resultados oncológicos a largo plazo20–22. De esta manera, en pacientes en los que se plantea una hepatectomía mayor extendida abierta –por la necesidad de resección vascular o biliar y posterior anastomosis vascular o hepaticoyeyunostomía–, la RE permite en ocasiones reducir el tamaño tumoral, liberar estas estructuras pudiendo así realizar una cirugía menos extensa por vía laparoscópica asegurando un adecuado control local de la enfermedad y facilitando un tiempo para confirmar ausencia de progresión de la enfermedad. En nuestro centro hemos utilizado esta indicación de RE en cuatro pacientes hasta el momento. Los resultados en los cuatro han sido satisfactorios y las cirugías se realizaron por vía laparoscópica con excelentes resultados.
Hipertrofia del futuro remanente hepáticoPara evitar la insuficiencia hepática tras la RH, se debe asegurar que el FRH alcance un mínimo de hasta 40% del volumen hepático total en pacientes con cirrosis hepática o tratamiento quimioterápico previo y de entre 20-30% en aquellos pacientes con un hígado sano. En nuestro centro, en aquellos pacientes con tumores hepáticos candidatos a RH en los que el FRH sería insuficiente según estos criterios, optamos mayoritariamente por la RE lobar por encima de otros tratamientos (como la embolización portal o la asociación de bipartición hepática con ligadura portal para hepatectomía en 2 tiempos [ALPPS]) cuando existe un alto riesgo biológico o en el contexto de un hígado cirrótico. Cuando la intención es producir una hipertrofia compensatoria del FRH, la RE a través de una de las ramas arteriales hepáticas principales ha demostrado la capacidad de alcanzar una atrofia significativa del lóbulo hepático tratado, así como tasas de aumento de volumen contralateral de entre 20 y más de 100% con respecto al volumen inicial5. Esta respuesta se alcanza tanto en hígados sanos como cirróticos, y además no es solo volumétrica, ya que con la RE lobar también se consiguen cambios en la función metabólica hepática del FRH, algo que no se ha demostrado con otras técnicas de hipertrofia en cirugía hepática23,24. Una característica diferencial de los cambios volumétricos producidos por la RE es que se producen de manera más lenta que utilizando otras técnicas de inducción de hipertrofia. A diferencia de las técnicas basadas en la embolización o ligadura de la vena porta, la hipertrofia compensatoria máxima tras la RE tarda en alcanzarse entre seis y nueve meses25. Desde nuestra experiencia, esto es una ventaja ya que permite valorar la respuesta tumoral, la progresión de la hipertrofia y, sobre todo, aporta un valioso periodo para observar la evolución de la enfermedad (test del tiempo). Así pues, se puede valorar la agresividad del tumor identificando la progresión local en el hígado no tratado o la progresión extrahepática. De esta manera, se evita en algunos pacientes una RH que no aportaría beneficio en la supervivencia permitiendo reevaluar la enfermedad y buscar otros tratamientos más adecuados para mejorar el pronóstico.
En el caso de generación de hipertrofia compensatoria contralateral mediante RE, también llamada lobectomía rádica, los valores dosimétricos están especialmente enfocados al tejido hepático no tumoral. Para las esferas de vidrio, se recomienda que la dosis absorbida en el tejido no tumoral tratado sea ≥ 88 Gy (< 75 Gy en el tejido hepático no tumoral tratado y no tratado). En el caso de las esferas de resina, la dosis absorbida prescrita en el tejido no tumoral tratado se recomienda que sea > 70 Gy17. No obstante, el estudio retrospectivo de Grisanti et al. encontró que, para las esferas de resina, no solo era importante esta dosis absorbida media, sino cómo de uniforme es la distribución de la radiación en el parénquima sano. Así, cuando la mitad del volumen sano tratado recibía al menos 30 Gy (V30), el FRH aumentaba a ≥ 40%, con mayor precisión entre los pacientes con FRH de inicio < 30%26. Con el fin de establecer la dosis máxima tolerada absorbida por el hígado sano de microesferas de 166Ho en pacientes con HCC que reciben lobectomía rádica como puente a la cirugía, se está llevando a cabo un estudio prospectivo cuyo reclutamiento finalizará en 202427.
Control de la enfermedadHay determinadas circunstancias en las que el objetivo de tratamiento local no es tanto lograr una reducción del tamaño tumoral, sino exclusivamente un control local sin otras exigencias. La RE ha demostrado una tasa de detención de la progresión tumoral de más del 90% y una estabilización de la enfermedad a nivel hepático de entre 75-100%4. Esta capacidad de control de la enfermedad y detención de la progresión es especialmente relevante en dos situaciones previas a la cirugía hepática. En pacientes candidatos a RH que presentan tumores hepáticos primarios gigantes, con valores altos de biomarcadores o aquellos tumores primarios que experimentan una recidiva precoz tras tratamientos previos, la RE ofrece una estabilización de la enfermedad mientras se valora la respuesta o la progresión local. Estas características también son aplicables a tumores secundarios con alto riesgo de progresión extrahepática o peritoneal, especialmente en los pacientes con metástasis de cáncer colorrectal refractarios a quimioterapia estándar o en los que el debut de la enfermedad fue en forma de perforación o cuya afectación ganglionar locorregional del tumor primario fuera extensa. En estos pacientes, la RE aporta un control local de la enfermedad, ofreciendo de forma segura un valioso tiempo para valorar la evolución de la enfermedad extrahepática antes de proceder a la cirugía hepática.
Por otro lado, en pacientes candidatos a trasplante cuyo tiempo en lista se prevea prolongado o cuyo riesgo de progresión sea elevado, esta capacidad de control de la enfermedad la utilizamos como una terapia puente hasta recibir el TH13. En pacientes candidatos a TH la progresión del CHC es una de las principales causas de salida de la lista de espera («dropout»). La RE es especialmente útil en estos pacientes, ya que ha demostrado en ensayos clínicos unas tasas de aproximadamente 90% de éxito como terapia puente al trasplante28. La RE ha demostrado que prolonga el tiempo hasta la progresión con una mediana mayor a 26 meses y que reduce el abandono de la lista de espera en comparación con la TACE28.
En este escenario de control de la enfermedad, la planificación dosimétrica vendrá definida (al igual que en el apartado de downstaging), de la posibilidad de administrar un tratamiento selectivo (y por tanto con finalidad tumoricida o ablativa) o no (en el que el volumen de tejido no tumoral tratado determinará el límite de actividad a administrar)
Experiencia quirúrgica de nuestro centroNuestro centro comenzó a implementar la RE en el año 2003, convirtiéndonos en uno de los primeros en hacerlo a nivel mundial. En aquel entonces, la RE se consideraba principalmente un tratamiento paliativo. Sin embargo, con el tiempo, pudimos observar la efectividad de la RE al rescatar a los primeros pacientes, brindándoles la posibilidad de una cirugía potencialmente curativa. A partir de 2005 nos aventuramos en el terreno inexplorado de las resecciones hepáticas después de la RE. Aunque estas resecciones resultaron más difíciles debido a las adherencias post-RE, al gran tamaño tumoral y a la fibrosis del tejido hepático, especialmente en los casos con fibrosis cerca de los pedículos, los resultados postoperatorios fueron satisfactorios29,30
Posteriormente, en marzo de 2011, llevamos a cabo el primer caso de RH laparoscópica, una segmentectomía del segmento VI en un paciente con cirrosis. El resultado fue exitoso y el paciente fue dado de alta sin complicaciones tres días después de la cirugía. A medida que nuestro equipo ganó experiencia, pudimos abordar cirugías laparoscópicas más complejas. En consecuencia, entre 2011 y 2014, realizamos ocho resecciones hepáticas después de la RE en nuestro centro, de las cuales seis fueron cirugías abiertas y dos fueron laparoscópicas, siendo solo una de ellas una resección mayor. Tras la realización de esta primera resección mayor (que fue la primera publicada en la literatura médica después de la RE31), la laparoscopia se convirtió en nuestro abordaje de elección. De 2015 a 2020 se llevaron a cabo 13 resecciones hepáticas después de la RE, de las cuales 10 fueron laparoscópicas (77%) y solo tres fueron abiertas (23%). Las hepatectomías abiertas se realizaron exclusivamente en casos que requerían reconstrucciones vasculares complejas por lo que ese fue el único criterio de exclusión para la cirugía laparoscópica.
Recientemente, hemos compartido nuestra experiencia en cirugía post-RE mediante la publicación de nuestros resultados, enfocándonos en las resecciones mayores laparoscópicas. Los resultados obtenidos demuestran que, cuando son realizadas por un equipo experto, estas cirugías son seguras y logran resultados postoperatorios óptimos, sin ser inferiores a los obtenidos tras resecciones hepáticas realizadas sin una RE previa. Además, de encontrarse dentro de los estándares actuales de la cirugía hepática laparoscópica32.
En otro artículo reciente hemos resaltado cómo tanto la RH como el TH después de la RE se han convertido en estrategias de tratamiento con potencial curativo para pacientes con CHC y CCi. La utilización de la RE previa a la resección en pacientes con CHC o CCi irresecables ha demostrado tasas de supervivencia global (SG) a 10 años de 57% para el CHC y de 60% para el CCi. Estos resultados son alentadores y demuestran el impacto positivo de la RE en la supervivencia a largo plazo de estos pacientes. En cuanto a los resultados en pacientes que fueron rescatados mediante TH o en aquellos en los que se aplicó la RE con la intención de ser una terapia puente, los resultados de la SG a 10 años fueron óptimos, con tasas de 51,3%. En este grupo, solo dos pacientes fallecieron debido a la recurrencia de la enfermedad lo que resalta el buen control oncológico y la idoneidad de la estrategia combinada de RE y TH33.
Estos hallazgos respaldan la eficacia tanto de la RH como del TH en pacientes con RE previa, y demuestran que esta estrategia ofrece resultados prometedores en términos de supervivencia a largo plazo. Para lograr resultados óptimos, es importante llevar a cabo la RE dentro de un enfoque multidisciplinar en el cual se seleccione correctamente al paciente y planifique cuidadosamente la intención de la administración de la RE. Esto implica definir la mejor estrategia para lograr la resecabilidad del tumor o acceder al TH y, en función de eso, planificar el lugar de aplicación de las microesferas y la dosis de radiación que se administrarán tanto al tumor como al tejido hepático sano. Bajo estas condiciones, la RE permite realizar una cirugía de rescate de manera segura en pacientes con tumores hepáticos primarios y metastásicos que previamente no eran considerados candidatos para cirugía, ofreciendo una estrategia potencialmente curativa con resultados excelentes en términos de seguridad, complicaciones y supervivencia a largo plazo.
Conflicto de interesesNinguno.