La situación actual y las perspectivas futuras de los nuevos radionúclidos en Medicina Nuclear continúan evolucionando, impulsados por el desarrollo de isótopos con aplicaciones innovadoras en teragnosis.
En esta segunda entrega de la serie de formación continuada, se analizan en profundidad las aplicaciones clínicas y terapéuticas del terbio, actinio y bismuto. Se describe el uso de los 4isótopos del terbio (terbio-149, terbio-152, terbio-155 y terbio-161), que ofrecen un sistema versátil para diagnóstico y tratamiento gracias a su similitud química con el lutecio-177, junto con los retos en su producción y disponibilidad. Asimismo, se revisa el actinio-225, un potente emisor alfa con un papel creciente en la terapia alfa dirigida, especialmente en cáncer de próstata y tumores neuroendocrinos. Por último, se analiza el bismuto-213, derivado del actinio-225, cuya vida media corta lo convierte en una opción viable para terapias localizadas y selectivas.
A pesar de los desafíos técnicos y de producción, estos radionúclidos están impulsando la evolución de la medicina de precisión y ampliando las posibilidades terapéuticas y diagnósticas en Medicina Nuclear.
The state of the art and future perspectives of new radionuclides in Nuclear Medicine continue to evolve, driven by the development of isotopes with innovative applications in theragnostics.
In this second part of the continuing education series, the clinical and therapeutic applications of terbium, actinium, and bismuth are analyzed in depth. The use of the 4terbium isotopes (terbium-149, terbium-152, terbium-155, and terbium-161) is described, offering a versatile system for both diagnosis and treatment due to their chemical similarity to lutetium-177, along with the challenges related to their production and availability. Additionally, actinium-225, a powerful alpha-emitting radionuclide, is reviewed for its growing role in targeted alpha therapy, particularly in prostate cancer and neuroendocrine tumors. Finally, bismuth-213, derived from actinium-225, is analyzed for its short half-life, making it a viable option for localized and selective therapies.
Despite technical and production challenges, these radionuclides are driving the evolution of precision medicine, expanding therapeutic and diagnostic possibilities in Nuclear Medicine.
El desarrollo de nuevos radionúclidos para aplicaciones teragnósticas continúa expandiendo las posibilidades de la Medicina Nuclear y mejorando tanto el diagnóstico como el tratamiento de diversas enfermedades.
Tras revisar en la primera parte de esta serie de artículos los pares teragnósticos cobre-64/cobre-67, plomo-212/plomo-203 y escandio-44/escandio-47, en esta segunda entrega se analizan otros radionúclidos emergentes con un alto potencial clínico: terbio, actinio y bismuto.
Estos elementos presentan características físicas y químicas que los hacen especialmente prometedores en terapias dirigidas y en imagen molecular. Se abordarán sus principales isótopos, los métodos de producción, las ventajas y desafíos asociados a su uso y su creciente integración en ensayos clínicos y estudios preclínicos.
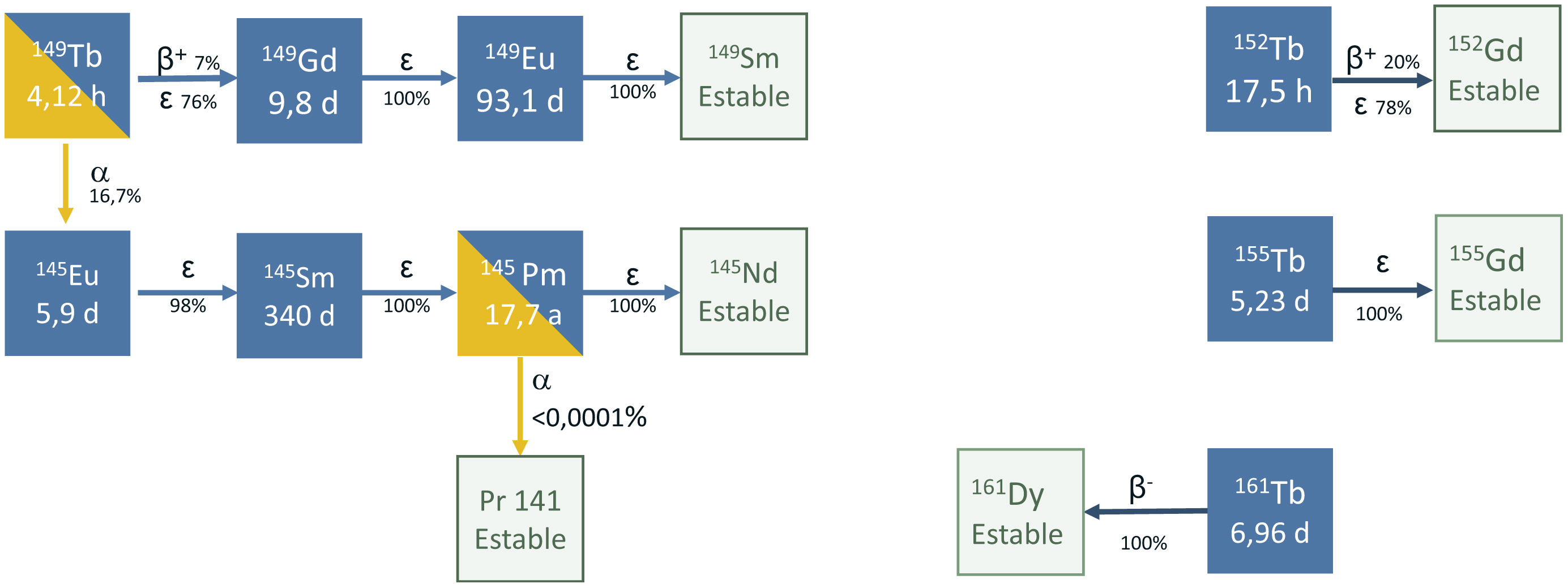
TerbioEl terbio presenta 4radioisótopos de interés para fines médicos: terbio-152 y terbio-155 para diagnóstico, y terbio-149 y terbio-161 para terapia. Estos 4radioisótopos se denominan de forma coloquial en la bibliografía como terbium sisters1 y permiten la preparación de radiofármacos con diferentes tipos de emisión, pero con una farmacocinética idéntica (fig. 1).
El terbio es un metal del grupo de los lantánidos que presenta una química similar a la del lutecio-177. Esto supone que pueden emplearse los mismos quelantes que se emplean en los radiofármacos con lutecio-177 (DOTA, DOTATATE, etc.) y que, por tanto, están disponibles y ampliamente estudiados2-4.
Disponibilidad de los isótopos de terbioLa producción de estos radioisótopos no es sencilla. El método más usado es la espalación, que es una reacción nuclear en la cual un núcleo pesado es bombardeado por una partícula de muy alta energía (del orden de los gigaelectronvoltios, GeV) de forma que el núcleo desprende o «espala» un gran número de neutrones libres en respuesta al impacto. Este proceso es que el que se emplea para producir terbio-149, terbio-152 y terbio-155, mediante reacciones de espalación sobre una lámina de tantalio en aceleradores de protones de alta densidad (aceleradores HIPA: high intensity proton accelerator). Tras el proceso de espalación, los radioisótopos producidos se separan según su relación masa-carga. Cabe destacar que solo unos pocos centros en todo el mundo producen estos radionúclidos (las instalaciones ISOLDE y MEDICIS del Centro Europeo para la Investigación Nuclear [CERN] y el laboratorio nacional de Canadá para la física nuclear y de partículas), que actualmente producen cantidades suficientes para investigación. Es importante señalar que este limitado número de instalaciones operativas a día de hoy no podrá satisfacer la creciente demanda mundial de terbio para la práctica asistencial1. Para hacer frente a este reto, se está estudiando la posibilidad de construir nuevas instalaciones que amplíen la producción o de usar nuevas rutas posibles en ciclotrones comerciales.
El único isótopo de esta familia que se puede producir en reactor es el terbio-161, irradiando con neutrones un blanco de gadolinio altamente enriquecido en gadolinio-160. La reacción nuclear empleada es 160Gd(n,c)161Gd y el gadolinio-161 decae a terbio-161 con un periodo corto de t1/2=3,7min. A continuación, el terbio-161 se aísla para su uso médico. El principal problema de este método es la presencia de impurezas de terbio-159 que, aunque no supondría un problema para el paciente, implica que todos los radiofármacos que se produzcan con este precursor radionucleídico serán con carrier añadido y, por tanto, la actividad específica del radiofármaco se verá afectada.
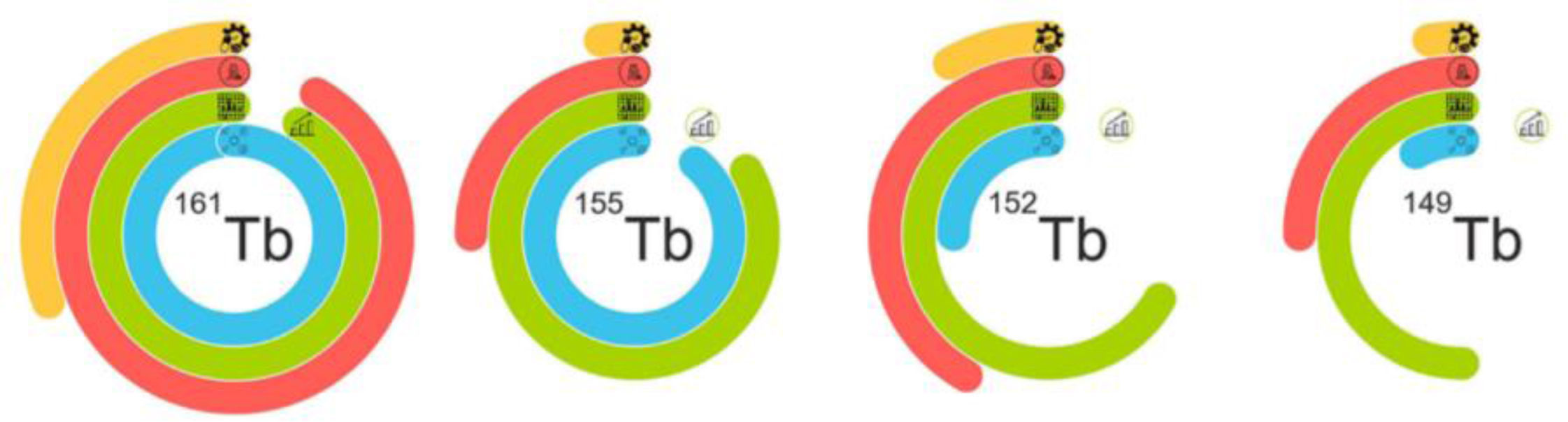
En la figura 2 se muestra el estado actual de la producción de los isótopos de esta familia.
Representación de la situación actual de la producción de los radioisótopos de terbio. Cuatro anillos simbolizan las 4fases principales de la implementación de radiofármacos: la línea azul muestra la situación de producción del ciclotrón/reactor, la línea verde representa la preparación del proceso de separación e incluye problemas con el proceso de ampliación en su última curva, la línea roja muestra los estudios preclínicos y la línea amarilla representa el desarrollo de las buenas prácticas de manufactura y la implementación clínica. Imagen publicada originalmente en Frontiers in Nuclear Medicine1.
El terbio-149 tiene un esquema de desintegración bastante complejo (fig. 1) que combina la emisión de partículas α (alcance en tejido de 25-28μm), fotones γ de energías bien adaptadas para hacer imagen SPECT (Eγ=165 keV, Iγ=26,4%) y, además, partículas β+ para imagen PET.
Este complejo esquema de desintegración es una limitación. Debido a que tiene productos de la desintegración que son radioisótopos de larga vida: gadolinio-149 (t1/2=9,28 d), europio-145 (t1/2=5,93 d), samario-145 (t1/2=340 d) y europio-149 (t1/2=93,1 d), entre otros, es necesario estudiar detenidamente el efecto que generan en el organismo. Beyer et al.5 dentro de su estudio sobre la eficacia del [149Tb][Tb(SCN-CHX-A-DTPA-rituximab)] para matar específicamente células cancerosas individuales circulantes o grupos de células pequeñas in vivo, hicieron una extrapolación de esta posible terapia a dosis clínicas: estimando una retención de actividad residual tras inyección de 1 GBq del radiofármaco y que los radionucleidos hijos tuvieran una retención del 100% (el peor escenario posible), concluyeron que la actividad retenida después de un año era de 100 kBq para el europio-149, de 41 kBq para el samario-145 y de 2,2 kBq para el prometio-145. Todas estas actividades, a pesar de quedar retenidas en la dosis en médula ósea roja, estaban debajo de los valores críticos.
Desde un punto de vista de desarrollo farmacéutico, los radiofármacos marcados con terbio-149 se encuentran en los primeros estudios preclínicos. Debido a su similitud química con el lutecio, una de las primeras líneas de investigación preclínica se está centrando en comparar la eficacia terapéutica y seguridad de los péptidos dirigidos contra el receptor de somatostatina (SSTR) marcados con terbio-149 con el radiofármaco de referencia. Mapanao et al.6 acaban de publicar un estudio cuyos resultados muestran la ausencia de hematoxicidad de los compuestos marcados en un modelo tumoral de roedor tras administrar dosis de 40 MBq (actividad muy superior a la dosis que se emplea en la rutina clínica con radiofármacos con radioisótopo de emisión α).
También se están explorando varios enfoques para el radiomarcaje de moléculas de FAPI, ya que la farmacocinética comúnmente rápida de las moléculas de FAPI coincidiría a la perfección con la vida media de este radioisótopo. Los datos preliminares sobre estos compuestos son muy prometedores y se han iniciado los estudios preclínicos de eficacia en un modelo in vitro de células de sarcoma7.
Terbio-152El terbio-152, con un periodo de semidesintegración de 17,5h, decae a gadolinio-152 mediante un proceso competitivo de desintegracionesβ+ (probabilidad del 17%) y capturas electrónicas (83%) y, además, tiene una rama de desintegración α, pero de probabilidad tan baja que se considera despreciable (7·10-7%). Las desintegracionesβ+ más relevantes tienen energías máximas de 2.620 keV (5,9%) y 2.970 keV (8%). En la mayoría de las transiciones, el terbio-152 decae a estados excitados de gadolinio-152 (más de 200 niveles posibles) y se produce emisión γ a continuación. De estas emisiones, solo unas pocas tienen probabilidad relevante y energía de interés para aplicaciones médicas (fotones de 271 keV con una fracción de 8,6% y de 344 keV con un 65%).
Este radionúclido es una herramienta diagnóstica adecuada para la dosimetría y la monitorización de tratamientos con ligandos marcados con terbio-149 y terbio-161. Debido a las múltiples emisiones de rayos γ, puede usarse en SPECT y la emisión de positrones permite usar PET, aunque para PET, las emisiones de rayos γ también suponen una fuente de ruido y de aumento de la dosis de radiación.
Los primeros estudios preclínicos datan de 2019, todos ellos realizados como prueba de concepto para determinar la biodistribución y dosimetría de moléculas de referencia como el DOTANOC8, el PMSA-6179 o la fracción de anticuerpo scFv78-Fc (marcador endotelial tumoral-1, TEM1)10. Estos estudios fueron tan prometedores que el terbio-152 fue el primero de las 4hermanas para una aplicación clínica en un paciente. Se han realizado 2estudios en humanos con 2moléculas diferentes:
- 1.
[152Tb][Tb(DOTATOC)], que se administró a un paciente de 67 años con neoplasia neuroendocrina funcional metastásica bien diferenciada del íleon, presentado para reestadificación 8 años después del 6.° ciclo de radionúclido receptor de péptidos terapia (PRRT)11. Las imágenes PET mostraron incluso las metástasis más pequeñas, con un mayor contraste entre el tumor y el fondo con el tiempo. La vida media relativamente larga del terbio-152 hizo factible escanear al paciente durante un periodo prolongado, una característica que sería útil para fines dosimétricos antes de la terapia con radionúclidos basados en radiolantánidos.
- 2.
[152Tb][Tb(PMSA-617)], que se administró a un paciente de 59 años con un adenocarcinoma de próstata refractario, poco diferenciado, con tumor primario residual que infiltraba ambas vesículas seminales, múltiples ganglios linfáticos y metástasis óseas. En el diagnóstico inicial tenía enfermedad metastásica (estadio IV) y una puntuación de Gleason de 8 (4+4). Se presentó para reestadificación de todo el cuerpo bajo terapia de privación de andrógenos para evaluar la posibilidad de terapia con [177Lu][Lu(PSMA-617)]. Las exploraciones PET resultantes fueron de calidad diagnóstica, de las que fueron particularmente relevantes aquellas obtenidas en momentos tardíos (18,5 y 25h tras la administración), que permitieron la visualización de las mismas lesiones metastásicas y del tumor recurrente local ya detectado por [68Ga][Ga(PSMA-11)]9.
La producción de este radionúclido es un desafío y, por lo tanto, la posibilidad de que esté disponible en un futuro próximo para cubrir las necesidades clínicas son bastante escasas. Sin embargo, la aplicación clínica del terbio-152 realizada hasta ahora ha allanado el camino para su traslado a la aplicación clínica.
Terbio-155El terbio-155 (t1/2=5,3 d) se desintegra por captura electrónica a niveles excitados de gadolinio-155, de forma que, a continuación, se produce una emisión de fotones γ principalmente de energía 87 keV (32%) y 105 keV (25%), lo que hace que sea considerado para su uso en SPECT12. Esta aplicación permite que sea empleado para el cálculo de la dosimetría previa al tratamiento con su par terapéutico, terbio-16113.
Las imágenes SPECT de fantomas del tipo jaszczak de sectores con terbio-155 y terbio-161 revelaron una excelente resolución espacial14. Los resultados iniciales indican que las múltiples emisiones de fotones de ambos isótopos brindan adaptabilidad en los protocolos de adquisición y reconstrucción de imágenes para optimizar su calidad. Aunque las métricas sobre los límites de resolución, la precisión cuantitativa y métodos óptimos de reconstrucción de imágenes aún requieren más investigación. El hecho de que sea un emisor γ y presente esta adaptabilidad para optimizar la calidad de la imagen lo postula como sucesor del indio-111 en la evaluación de los pacientes para recibir terapia con radioisótopos como ytrio-90, lutecio-177, holmio-166, etc., pues químicamente es igual de versátil.
Se han realizado estudios preclínicos con este radioisótopo mediante radiomarcaje de péptidos pequeños como DOTA-folato, un análogo de minigastrina, o DOTATOC, y con un anticuerpo dirigido a L1-CAM en modelo tumoral de ratón. Los resultados mostraron que, a pesar de la baja actividad administrada (8,5 MBq), la calidad de imagen era adecuada por la ausencia de emisiones adicionales β+/β− y la larga vida media del terbio-15515-17. Esta es una gran ventaja porque su uso sería favorable con bajas dosis, lo que limitaría la dosimetría del paciente. Otra ventaja que presenta es el hecho de que se está optimizando su producción en ciclotrón comercial, por lo que podría ser factible su producción a gran escala y la investigación sería más sencilla18.
Terbio-161Este radionúclido (t1/2=6,9 d) se desintegra vía β−. Decae por 9ramas distintas al estado basal o a algún nivel excitado de disprosio-161, con energías de excitación entre 43 y 593 keV. Estos niveles excitados decaen y emiten una gran variedad de electrones de conversión, Auger y fotones γ. Este esquema le proporciona ventaja frente a otros radioisótopos emisores β−, ya que genera 2,24 electrones (conversión y Auger) por cada partícula β. Esto supone una elevada transferencia lineal de energía y una mayor concentración de dosis de radiación de corto recorrido en comparación con los electrones provenientes de la desintegración β y, por tanto, una mayor eficacia terapéutica, especialmente cuando la diana es de pequeño tamaño (micrometástasis). Además, al emitir fotones (48,9 keV con probabilidad 17% y 74,6 keV con probabilidad 10,2%) permite la obtención de imágenes para monitorizar la distribución del tratamiento.
Los primeros estudios preclínicos datan de 2013. Desde entonces la mayoría comparan la capacidad terapéutica19, la radiotoxicidad a tumor20, la dosimetría21-23, etc., del terbio-161 respecto al lutecio-177 (radiometal terapéutico de referencia). En este sentido, Müller et al.13 realizaron un estudio preclínico en un modelo de cáncer de próstata en roedor comparando [161Tb][Tb(PSMA-617)] respecto al estándar [177Lu][Lu(PSMA-617)]. Los resultados indicaron que el radiofármaco marcado con terbio-161 tuvo una deposición de energía 1,4 veces mayor en tumores establecidos que el lutecio-177. Esta proporción aumentó hasta aproximadamente 4 veces para grupos de células pequeñas y células individuales. Sin embargo, puede generar dudas como: ¿esta ventaja puede suponer una elevada dosimetría en órganos radiosensibles, como los riñones, por la eliminación renal de los péptidos que se radiomarcan? En este sentido, el mismo grupo realizó un estudio en un modelo para comparar la dosimetría renal entre [177Lu][Lu(folato)] y [161Tb][Tb(folato)]. El análisis funcional e histopatológico de los riñones después de la aplicación del radiofármaco con terbio-161 reveló un daño dependiente de la dosis comparable al daño causado por radiofármaco marcado con lutecio-177 aplicado con la misma actividad. Estas observaciones están en línea con la hipótesis de que los electrones Auger y los electrones de baja conversión de energía no producen daño renal adicional, como se observó anteriormente durante la aplicación terapéutica de [111In][In(octreótida)] en pacientes.
En 2021 se desarrolló el primer estudio en humanos con este radioisótopo con 2pacientes. El primer paciente (varón de 35 años con un paraganglioma maligno metastásico, bien diferenciado y no funcional) recibió una dosis de 596 MBq de [161Tb][Tb(DOTATOC)]. El segundo paciente (varón de 70 años con una neoplasia neuroendocrina funcional de la cola pancreática) recibió una dosis de 1.300 MBq del mismo radiofármaco. Ambos pacientes recibieron diferentes líneas de terapia, entre ellas [177Lu][Lu(DOTATOC)] y fueron seleccionados tras mostrar progresión en la PET de seguimiento. Se adquirieron imágenes de gammagrafía planar de cuerpo entero a diferentes tiempos para los cálculos dosimétricos. Este primer estudio concluyó que este radiofármaco se puede utilizar para imágenes planares de todo el cuerpo, así como para imágenes SPECT/CT incluso de actividades bajas24.
Actualmente hay 3ensayos clínicos con este radioisótopo:
- •
Beta-Plus (NCT05359146): ensayo en fase 0 cuyo objetivo es medir el índice terapéutico (proporciones de dosis entre el tumor y el órgano limitante de la dosis) de [161Tb][Tb(DOTA-LM3)] en comparación con el estándar actual [177Lu][Lu(DOTATOC)] en el mismo tumor neuroendocrino GEP-NET en un diseño cruzado y aleatorizado, en todos los pacientes.
- •
Violet (NCT05521412): ensayo en fase 1-2 cuyo objetivo será evaluar la seguridad y eficacia de [161Tb][Tb(PSMA-I&T)] en hombres con cáncer de próstata metastásico resistente a la castración (mCRPC)25.
- •
Prognostics (NCT06343038): ensayo en fase 1 cuyo objetivo es evaluar la seguridad y la eficacia del anticuerpo SibuDAB, cuya diana es el receptor de PSMA.
PUNTO CLAVE: El terbio presenta 4isótopos de interés clínico (149, 152, 155 y 161), lo que permite un arsenal teragnóstico versátil con aplicaciones tanto en diagnóstico (SPECT/PET) como en terapia dirigida.
PUNTO CLAVE: El principal reto en la implementación clínica de los radioisótopos de terbio es su producción, ya que la espalación requiere instalaciones especializadas y el terbio-161, el único que se produce en reactor, presenta limitaciones en su pureza.
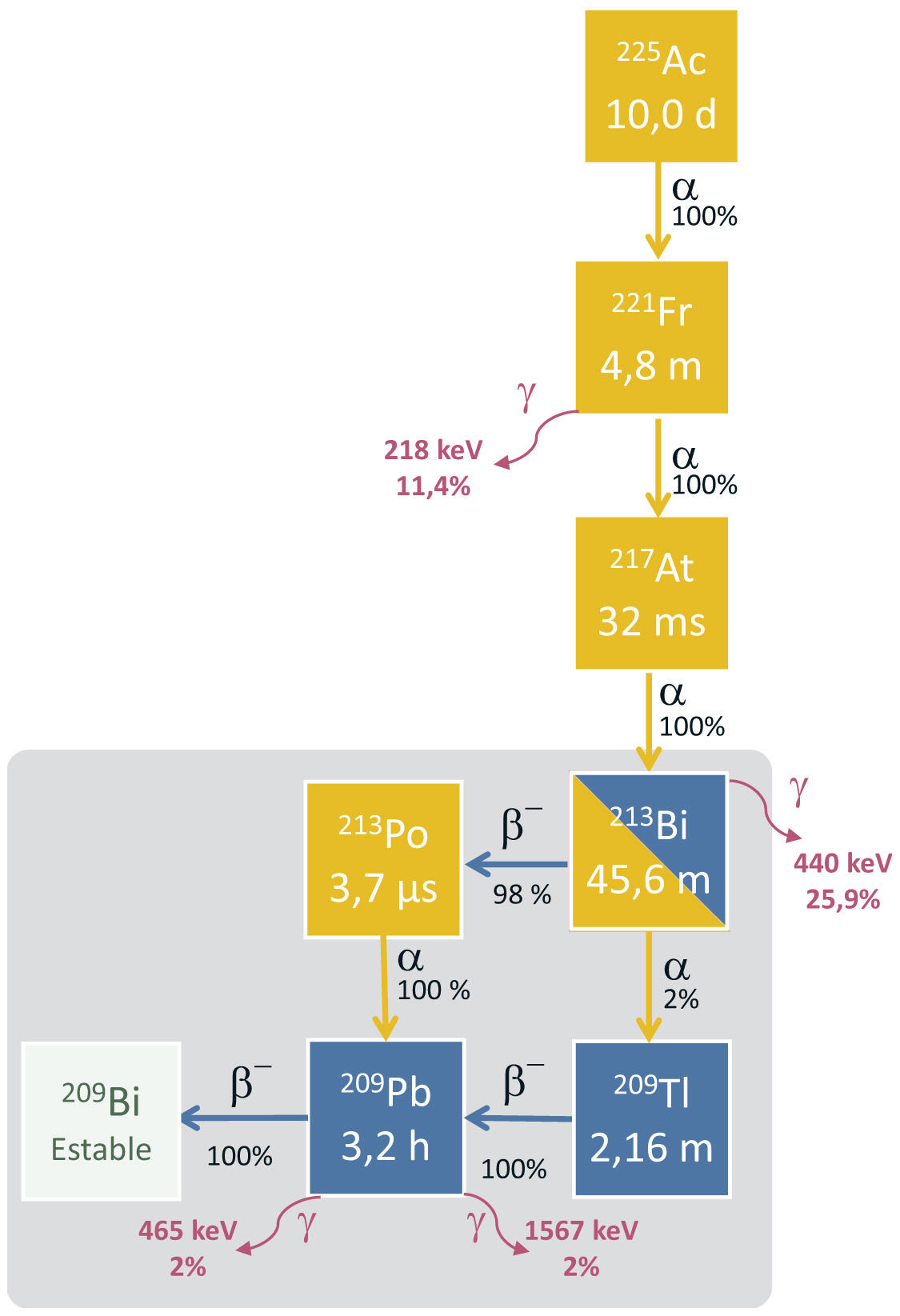
El actinio-225 tiene un periodo de semidesintegración de 9,92 días y se desintegra vía cascada de 6radionúclidos de vida media corta hasta llegar al bismuto-209, que se considera estable (periodo de semidesintegración de 2,01×1019 años). A través de esta cascada, se emiten 5partículas α cuyas energías van desde 5 MeV hasta 8,4 MeV, con alcances en tejido desde 47 hasta 85μm. Las primeras 3desintegraciones son casi en su totalidad vía desintegración α (francio-221, astato-217 y bismuto-213) con periodos de desintegración de 4,8min, 32,6min y 45,6min. A partir del bismuto-213 y hasta llegar al bismuto-209, se combinan desintegraciones α y β−. La descripción completa de dicho esquema se encuentra en la figura 3. Se emiten los siguientes fotones 218 keV (11,4%) 440 keV (25,9%), 465 keV (1,9%) y 1.567 keV (1,98%). Estos fotones son útiles para imágenes y control de calidad26.
La principal fuente de actinio-225 proviene de la desintegración del torio-229 (T1/2=7.340 años). Sin embargo, su disponibilidad es limitada, ya que no se ha logrado aún un método de obtención de este isótopo, sino que se extrae de los restos de las pruebas nucleares obtenidos entre los años 1954 y 1970 en Rusia, Alemania y Estados Unidos. Este proceso de extracción y purificación solo permite obtener anualmente alrededor de 1,7Ci. Además, la cantidad total de uranio-233 es limitada y no se espera que haya más producción debido los acuerdos de no proliferación. Esta cantidad está por debajo de las necesidades actuales para ensayos clínicos e investigación preclínica27. Por ello, en la última década ha habido una búsqueda intensiva de otros medios de producción.
Una opción alternativa para producir actinio-225 es a partir de la reacción de espalación con protones de alta energía sobre torio-232 natural. Teóricamente, una irradiación única de 10 días puede producir cantidades comparables a las que se obtienen por la desintegración del torio-229 al año. La principal limitación de esta vía de producción es que se necesitan protones de energías superiores a 100 MeV y esto solo está disponible en pocas instalaciones a nivel global. Existen otras 2estrategias de producción para aumentar la disponibilidad de actinio-225, que se basan en la irradiación de radio-226 con protones de media energía (15-20 MeV) y fotones. Desde el punto de vista teórico, la irradiación con protones de energía intermedia produce cantidades comparables a la producción a través de reacciones de espalación del torio-232 y produce menos impurezas28,29. Sin embargo, la principal ventaja sobre la reacción de espalación y otros métodos de producción es la gran disponibilidad de ciclotrones de energía media. Cuando se emplean fotones en la producción, la cantidad generada es menor y se puede compensar aumentando la masa del blanco, que produce acumulación de radio-225, el cual se emplea como generador de actinio-22530. Hasta la fecha, solo hay experimentos iniciales que demuestran la viabilidad del empleo de estas 2rutas. Los principales desafíos de estas 2formas de producción es asegurar suficiente radio-226 y desarrollar la tecnología para una irradiación segura de blancos altamente radiactivos.
La imagen clínica utilizando actinio-225 también presenta desafíos. Aunque se ha propuesto el uso de 2picos energéticos a 218 keV y 440 keV para la imagen clínica y recientemente se ha identificado un tercer pico a 78 keV en el espectro de rayos γ del actinio-225, con una mayor recuento31,32, la baja probabilidad de emisión γ y la superposición de bremsstrahlung debido a emisores β en la cadena de desintegración de actinio-225 dificultan la obtención de una imagen de suficiente calidad para dosimetría en un entorno clínico33. Por lo tanto, la investigación clínica actual en la terapia alfa dirigida se basa en gran medida en aproximaciones indirectas extrapolando radiofármacos marcados con lutecio-17733.
Radiofármacos de actinio-225 y aplicacionesLa terapia con radionúclidos de receptores peptídicos (PRRT) con isótopos emisores de radiación α, β y electrones Auger, dirigida a dianas específicas en forma de moléculas radiomarcadas, ha revolucionado el tratamiento del cáncer34. Entre los emisores α, el actinio-225 destaca como uno de los radionúclidos más prometedores para la PRRT. Los avances en tecnologías de quelación han facilitado su administración e internalización estable en el organismo, lo que ha mejorado su eficacia en aplicaciones clínicas.
La mayoría de los radiofármacos basados en actinio-225 están compuestos por DOTA, una estructura macrocíclica hidrofílica que, por sus características, es el quelante más estable para el desarrollo de radiofármacos marcados con tecnecio-99m, galio-68 y actinio-22535-37.
Los radiofármacos con más ensayos clínicos en marcha con radiofármacos que contienen actinio-225 son los los dirigidos al antígeno prostático específico de membrana y a los receptores de somatostatina (SSRT) para los tumores neuroendocrinos.
Radiofármacos para terapia en el cáncer de próstataEntre las moléculas PSMA más estudiadas para la terapia del cáncer de próstata con actinio-225 por su alta especificidad y farmacocinética rápida están el PSMA-617 y el PSMA I&T.
En 2021, Feuerecker et al.38 investigaron la seguridad y actividad del [225Ac][Ac(PSMA-617)] en 21 pacientes con cáncer de próstata metastásico resistente a la castración tras el fracaso de [177Lu][Lu(PSMA-617)]. Aunque la actividad antitumoral de [225Ac][Ac(PSMA-617)] fue significativa, la irradiación de las glándulas salivales, por la unión no específica del radiofármaco a ellas, produjo xerostomía de grado 1/2 como efecto adverso en todos los pacientes, lo cual llevó a suspender el tratamiento en el 23% de ellos. Se ha descrito que la prevalencia de la xerostomía en pacientes tratados con este radiofármaco aumenta con el número de ciclos administrados. Kratochwil et al.33 reportaron que su actividad óptima para inducir un efecto antitumoral con efectos adversos tolerables era de 100 kBq/kg (fig. 4). A esta actividad, la prevalencia de xerostomía de grado 1 fue del 100%. En contraste, el 50% de los pacientes tratados con dosis superiores a 150 kBq/kg presentó xerostomía de grado 2.
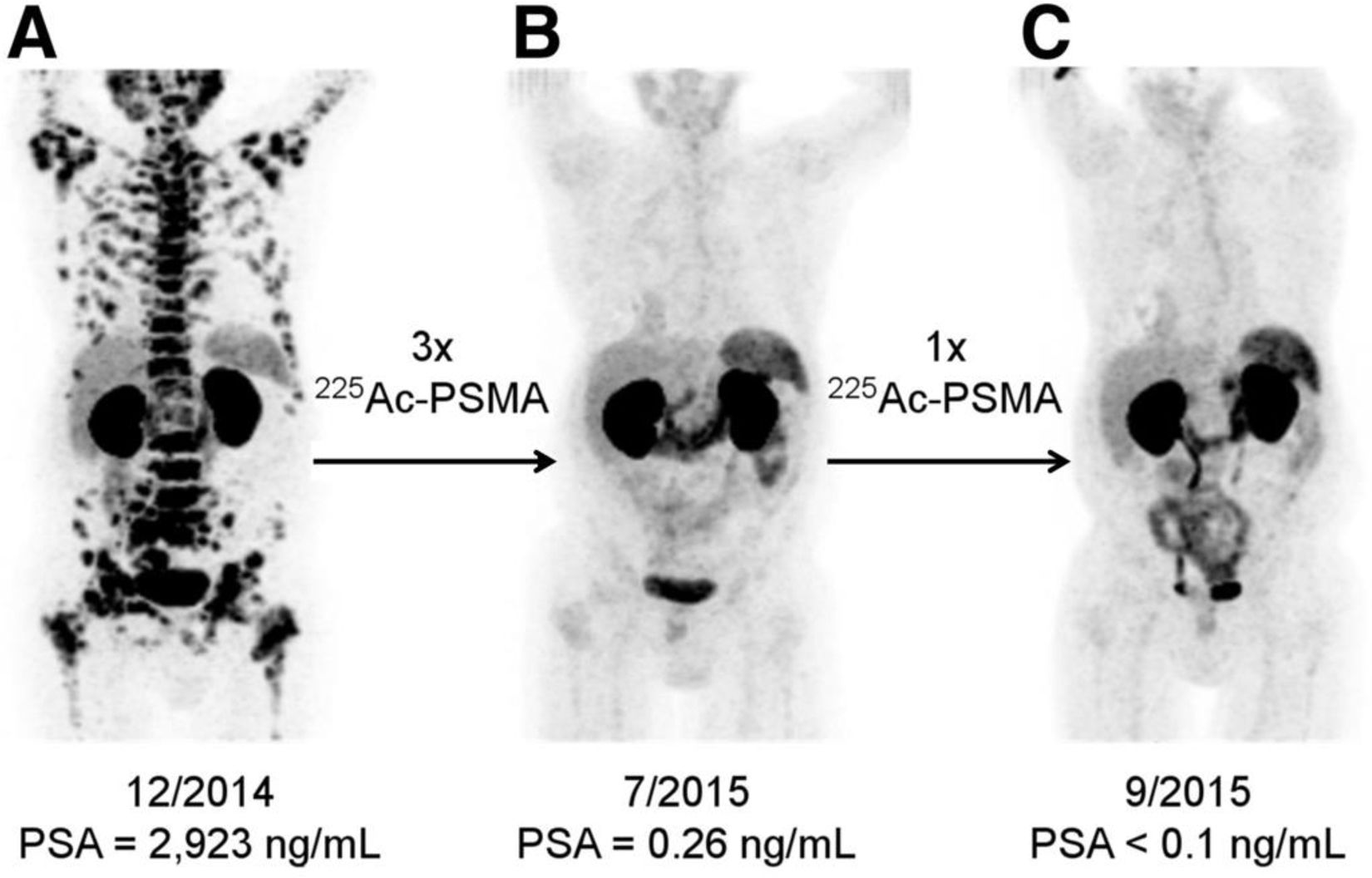
[68Ga]Ga-PSMA-11 PET/TC de un paciente tratado con 4 ciclos de [225Ac][Ac(PSMA-617)]. A) Estudio preterapéutico. B) Reestadificación a los 2meses del 3.er ciclo de [225Ac][Ac(PSMA-617)]. C) Reestadificación tras 2meses del 4.° ciclo. Imagen publicada originalmente en The Journal of Nuclear Medicine41.
Un estudio multicéntrico retrospectivo reciente con un elevado número de pacientes (n=488) tratados con 8 MBq de [225Ac][Ac(PSMA-617)] con una media de 2 ciclos (RIC: 2-4) reportó la presencia de xerostomía en el 68% de ellos tras el primer ciclo y en el 100% en los que recibieron más de 7 ciclos. Uno de los posibles factores que contribuyeron al desarrollo de esta es que aproximadamente 1/3 de los pacientes habían recibido terapia con [177Lu][Lu(PSMA-617)]. Otro de los efectos adversos conocidos de la terapia con [225Ac][Ac(PSMA-617)], y que reporta el mismo estudio, es la posible toxicidad de médula ósea. Los datos obtenidos reportan anemia en el 81% de los pacientes, trombocitopenia en 54% y leucocitopenia en 44%, atribuible en parte a la baja reserva de médula ósea basal debida a los tratamientos previos. La supervivencia global reportada fue de 15,5 meses y la supervivencia libre de progresión de 7,9 meses39.
Un ensayo clínico en fase 1 (ClinicalTrials.gov NCT04597411) de escalada de dosis pretende investigar la dosis óptima para el tratamiento con [225Ac][Ac(PSMA-617)] en el cáncer de próstata metastásico resistente a la castración con o sin exposición previa a [177Lu][Lu(PSMA-617)].
Respecto al uso de otras moléculas PSMA radiomarcadas con actinio-225, como el PSMA I&T, la evidencia es más limitada, dado el poco número de pacientes tratados. Zacherl et al.40 reportaron los primeros datos clínicos con [225Ac][Ac(PSMA-I&T)] en 14 pacientes con cáncer de próstata metastásico resistente a la castración, con resultados bastante comparables a los observados con [225Ac][Ac(PSMA-617)]. Actualmente hay 2ensayos clínicos fase 2 y 2/3 en etapa de reclutamiento para evaluar el efecto del [225Ac][Ac(PSMA-I&T)] en pacientes con cáncer de próstata metastásico (ClinicalTrial.gov NCT06402331, NCT05219500).
Radiofármacos para terapia los tumores neuroendocrinosUna característica definitoria de los tumores neuroendocrinos es la sobreexpresión de SSRT. Los análogos de SSRT utilizados con más frecuencia, como agentes terapéuticos, son el DOTATOC y el DOTATATE radiomarcados con lutecio-177 o actinio-225.
El primer estudio clínico de terapia con [225Ac][Ac(DOTATOC)] en el tratamiento de tumores neuroendocrinos comenzó en 2011 con el grupo de Kratochwil et al.42. En 34 pacientes, se determinó una dosis máxima tolerable de 40 MBq. Además, se encontró que el tratamiento era seguro con dosis de 18,5 MBq cada 2 meses o 25 MBq cada 4 meses. A pesar de la respuesta observada en varios pacientes, los autores recalcaban la necesidad de más ensayos de cara a la mejor selección de los pacientes y de la dosis óptima.
En 2020 se publicó la primera experiencia clínica de seguridad y eficacia del [225Ac][Ac(DOTATATE)] en 32 pacientes con tumores neuroendocrinos con enfermedad estable o en progresión tras completar tratamiento con [177Lu][Lu(DOTATATE)]. El esquema de tratamiento usado fue: 2 ciclos de 100 MBq/kg separados 8 semanas entre sí, con la posibilidad de administrar más ciclos en ausencia de progresión de la enfermedad en imagen PET/TC con [68Ga][Ga(DOTATOC)]. La respuesta morfológica se evaluó en 24/32 pacientes, de los cuales, 15 alcanzaron una remisión parcial y 9 permanecieron estables. Los niveles de cromogranina disminuyeron significativamente tras el tratamiento y no se observó progresión de la enfermedad o fallecimientos tras una mediana de seguimiento de 8 meses. En este estudio, la mayoría de los pacientes (41%) experimentaron pérdida de apetito (grado II), seguida de náuseas y gastritis, particularmente entre 24 y 72 h después de la terapia con [225Ac][Ac(DOTATATE)], con una duración promedio de hasta una semana en algunos pacientes43.
Un ensayo clínico en fase 1 (NCT06732505) está en marcha para evaluar la seguridad y eficacia del [225Ac][Ac(DOTATATE)] en pacientes con tumores neuroendocrinos bien diferenciados (G1/G2/G3) inoperables, localmente avanzados, metastásicos o en progresión con sin historia previa de PRRT.
PUNTO CLAVE: El actinio-225 ha revolucionado la PRRT, pero la toxicidad y los desafíos técnicos limitan su expansión clínica y exigen avances en producción y dosimetría para satisfacer la creciente demanda.
PUNTO CLAVE: La toxicidad medular y la xerostomía de la terapia con [225 Ac][Ac(PSMA-617)] se incrementa con el número de ciclos administrados.
El bismuto-213 es un isótopo radiactivo hijo del actinio-225, por lo que su esquema se puede revisar en la figura 3. Decae a través de la desintegración β− (98%) a polonio-213 y de la desintegración α (2%) a talio-209 con un periodo de semidesintegración de 45,6 min44. Estos 2radioisótopos decaen vía α (el polonio-213) y vía β− (el talio-209) al plomo-209. Este se desintegra finalmente a través de un proceso de desintegración β al isótopo bismuto-209. En este complejo esquema de desintegración se emiten tanto partículas α como electrones de diferentes energías y algún fotón γ que permite visualizar la distribución en imagen. De la desintegración vía β− del bismuto-213 al polonio-213, cabe destacar la emisión de electrones de energía máxima 982 keV (30%) y 1.422 keV (66,8%) y la emisión de un fotón de 440 keV (25,9%). El polonio-213 decae a plomo-209 a través de una desintegración α, emitiendo un núcleo de helio con una energía de 8.376 keV (100%) y con un periodo de semidesintegración de 3,72 ⌠s. Por tanto, un 98% de las desintegraciones del bismuto acaban emitiendo una partícula α de 8.376 keV. Esta partícula posee un recorrido libre medio en tejido de unos 85 ⌠m y puede ser considerada como la partícula más citotóxica proveniente de la desintegración del bismuto-213. Del otro brazo de la desintegración del bismuto-213 al talio-209, indicamos la emisión de la partícula α de 5.785 keV (2%). El talio-209 al plomo-209 decae 100% vía desintegración β− con un periodo de desintegración de 2,2 min y una energía máxima de partícula β− de 1.827 keV (97%). En esta desintegración también se emiten 2fotones γ de altas energías 465 keV (95%) y 1.567 keV (99%). Por último, el plomo-209 se desintegra vía β− al bismuto-209 con un periodo de semidesintegración de 3,2h y una energía máxima de partícula β− de 644 keV (100%).
La obtención del bismuto-213 se puede hacer a partir de generadores de 225Ac/213Bi para preparar los radiofármacos en el lugar de producción. La forma más establecida de estos generadores es la del actinio-225 en solución ácida y fuertemente retenido por el solvente (por ejemplo, AG MP-50, resina de intercambio catiónico). El bismuto-213 se eluye a partir de una mezcla de 0,1M HCl / 0,1M NaI y se obtiene [213Bi]BiI4 y [213Bi]BiI5, que se puede emplear con fines radioquímicos45. Gracias a la vida media del padre de varios días, estos generadores se pueden usar clínicamente y trasportarlos a largas distancias. Entre el radioisótopo padre y el hijo se produce un equilibrio transitorio que permite la elución cada 3 h46.
Radiofármacos con bismuto-213 y aplicacionesCaracterísticas químicasEl estado de oxidación del bismuto en solución es Bi(III. En este estado forma estructuras complejas en toda la escala de pH. Este ion metálico presenta elevada afinidad por ligandos que contienen átomos donadores de oxígeno y nitrógeno.
Los radiofármacos que contienen bismuto-213 muestran mejores resultados al combinarse con moléculas vector de vida media biológica corta, es decir, moléculas pequeñas como péptidos o fragmentos de anticuerpos (incluidos nanobodies), ya que su vida media es similar a la del radioisótopo, lo que permite al bismuto-213 depositar su energía antes de desintegrarse44.
Entre los quelantes más empleados para unir el radiometal a la molécula vehicular destaca el DTPA (ácido dietilenetriaminopentaacético), que se ha utilizado mucho debido a su rapidez de radiomarcaje, pero presenta una estabilidad in vivo limitada. Por su parte, el CHX-A”-DTPA, una modificación estructural del DTPA, presenta mayor rigidez y estabilidad. La estabilidad de los complejos es crítica, ya que su disociación podría resultar en toxicidad renal por la acumulación de bismuto-213 libre. El DOTA es considerado el quelante estándar debido a su alta estabilidad termodinámica, pero su empleo en el radiomarcaje es más largo y requiere condiciones de calentamiento que pueden dañar la molécula vehicular. Los quelantes emergentes, como NETA y DEPA, combinan la rápida cinética de formación de complejos de sistemas acíclicos con la estabilidad de los macrocíclicos, con un gran potencial para el bismuto-213. Además, el Me-DO2PA ha demostrado ser estable in vivo cuando se conjuga con bismuto-21344.
Estudios preclínicos con radiofármacos con bismuto-213Los estudios preclínicos han explorado una amplia gama de radiofármacos basados en bismuto-213, utilizando anticuerpos, fragmentos de anticuerpos, péptidos y moléculas pequeñas para diferentes tipos de cáncer.
- •
El [213Bi][Bi(DOTA-9E7.4mAb)], un anticuerpo monoclonal anti-CD138, se ha usado en ratones con mieloma múltiple. El tratamiento basado en partículas α incrementó la mediana de supervivencia de los ratones y mostró tasas de cura en el 45% de los casos. Se obtuvieron mejores resultados que con el radiofármaco marcado con lutecio-177 (partículas β−)47.
- •
El [213Bi][Bi(DTPA-2Rs15dsdAb)], un nanobody antiHER2 se ha estudiado en un modelo tumoral HER2pos que manifiesta metástasis peritoneales. El radiofármaco mostró rápida acumulación en tumores HER2+y prolongó la mediana de supervivencia en modelo animal, especialmente en combinación con trastuzumab48.
- •
El [213Bi][Bi(DOTATATE)], un péptido con afinidad a los receptores de la somatostatina, principalmente el tipo 2, se ha utilizado en tumores neuroendocrinos. Se determinó una alta eficacia en comparación con emisores β como lutecio-177 y la necesidad de menores dosis para la destrucción de células tumorales49.
También se han llevado a cabo estudios preclínicos con el uso de radiofármacos marcados con bismuto-213 en otras enfermedades como el cáncer pancreático ([213Bi]Bi-69-11 Ab, [213Bi][Bi(DTPA-C595-mAb)] y [213Bi][Bi(DTPA-PAI2-mAb)], cáncer de colon ([213Bi][Bi(IMP288-mAb)] y [213Bi][Bi(DTPA- A”-CHX-Bn-SCNuCC49ΔCH2)], cáncer de mama ([213Bi][Bi(DTPA-PAN-622-mAb)], [213Bi][Bi(DTPA-Cetuximab)] y [213Bi][Bi(DTPA-A”-CHX-Bn-7.16.4-mAb)], linfoma no Hodgkin ([213Bi][Bi(DTPA-anti-CD20-mAb)] y [213Bi][Bi(DOTA-biotina)]44.
Estudios clínicos con radiofármacos con bismuto-213En estudios clínicos se han utilizado radiofármacos tanto en administración sistémica como locorregional.
- -
[213Bi][Bi(CHX-A-DTPA-Lintuzumab)] (anti-CD33) se ha utilizado en pacientes con leucemia mieloide aguda refractaria o en recaída. Este radiofármaco, administrado sistémicamente, ha mostrado seguridad y actividad antitumoral en estudios de fase I y II, en especial, en combinación con citarabina. Se observaron 6 respuestas clínicas en pacientes con características de bajo riesgo que recibieron dosis de ≥ 37 MBq/kg50.
- -
[213Bi][Bi(DOTATOC)] ha sido estudiado en pacientes con tumores neuroendocrinos avanzados y resistentes a emisores β como ytrio-90 y lutecio-177. El tratamiento fue administrado vía intraarterial en 7 pacientes y vía sistémica en uno. Se obtuvieron respuestas antitumorales duraderas, incluida una remisión completa51.
- -
[213Bi][Bi(PSMA-617)] se ha investigado en un paciente con cáncer de próstata metastásico resistente a la castración refractario a tratamientos convencionales. Fueron administrados 2ciclos, con una dosis acumulada de 592 MBq, con una notable reducción de niveles PSA y una excelente respuesta molecular en la PET/TC con [68Ga][Ga(PSMA-11)]52.
- -
[213Bi][Bi(anti-EGFR)] se ha utilizado en pacientes con carcinoma in situ de vejiga refractario al tratamiento con bacilo de Calmette-Guérin. Se diseñó un estudio piloto para evaluar la viabilidad, tolerabilidad y eficacia del radiofármaco administrado mediante instilaciones intravesicales (1 o 2 dosis de 366-821 MBq). Se observaron remisiones completas a las 8 semanas en un tercio de los pacientes tratados, algunos de los cuales permanecieron libres de enfermedad durante más de 3años53.
- -
[213Bi][Bi(DOTA-Substance P)] ha sido evaluado en pacientes con gliomas de grado II a IV. La administración fue intratumoral o en cavidades quirúrgicas a través de catéteres implantados con hasta 14,1 GBq en un máximo de 8 ciclos con intervalos de 2 meses. La mediana de supervivencia desde el inicio del tratamiento fue de 7,5 meses. Sin embargo, varios pacientes alcanzaron remisiones completas con ausencia de recurrencias de hasta 23,8 meses tras finalizar el tratamiento54,55.
- -
[213Bi][Bi(DTPA-9.2.27mAb)] (AIC) se ha diseñado para el tratamiento del melanoma con expresión de antígeno MCSP. La administración, inicialmente, fue por inyección intralesional con dosis variable en función del tamaño. Se objetivó una necrosis tumoral extensa, con preservación de los tejidos circundantes y sin efectos adversos hematológicos significativos56 Después, se empleó este radiofármaco por vía sistémica en melanomas metastásicos y se obtuvo un 50% de enfermedad estable, 14% de respuesta parcial y 6% de respuesta casi completa. No se describieron toxicidades significativas57.
PUNTO CLAVE: Los radiofármacos con bismuto-213 muestran mejores resultados al combinarse con moléculas vectoras de vida media biológica corta, sobre todo con péptidos y fragmentos de anticuerpos.
PUNTO CLAVE: El 98% de las desintegraciones del bismuto-213 terminan con la emisión de partículas α de alta energía (8.376 keV), con un alcance de solo 85μm en tejido, lo que maximiza la destrucción tumoral con daño mínimo a tejidos sanos.
El desarrollo y aplicación de nuevos radionúclidos en Medicina Nuclear continúa avanzando con rapidez, ofreciendo soluciones innovadoras en el ámbito del diagnóstico y la terapia personalizada. En esta revisión, hemos analizado en profundidad el potencial clínico del terbio, actinio y bismuto, destacando sus propiedades fisicoquímicas, sus principales aplicaciones terapéuticas y los desafíos asociados a su producción y disponibilidad.
El terbio, con sus 4isótopos de interés, representa una opción versátil en teragnosis, aunque su producción mediante espalación sigue siendo una barrera para su implementación clínica a gran escala. El actinio-225 se ha consolidado como un potente emisor alfa para la terapia alfa dirigida, con resultados prometedores en cáncer de próstata y tumores neuroendocrinos, aunque su limitada producción aún restringe su acceso. Por su parte, el bismuto-213, gracias a su vida media corta y su capacidad para tratamientos altamente localizados, ofrece una herramienta valiosa en aplicaciones específicas, si bien su dependencia de generadores de actinio-225 plantea retos logísticos.
A medida que se optimizan las estrategias de producción y se amplía la evidencia clínica, estos radionúclidos tienen el potencial de transformar el panorama de la Medicina Nuclear. En futuras entregas, abordaremos otros radionúclidos emergentes y su impacto en el desarrollo de nuevas estrategias terapéuticas y de imagen, con el objetivo de seguir explorando el futuro de la medicina de precisión.
Conflictos de interésNinguno.








![[68Ga]Ga-PSMA-11 PET/TC de un paciente tratado con 4 ciclos de [225Ac][Ac(PSMA-617)]. A) Estudio preterapéutico. B) Reestadificación a los 2meses del 3.er ciclo de [225Ac][Ac(PSMA-617)]. C) Reestadificación tras 2meses del 4.° ciclo. Imagen publicada originalmente en The Journal of Nuclear Medicine41. [68Ga]Ga-PSMA-11 PET/TC de un paciente tratado con 4 ciclos de [225Ac][Ac(PSMA-617)]. A) Estudio preterapéutico. B) Reestadificación a los 2meses del 3.er ciclo de [225Ac][Ac(PSMA-617)]. C) Reestadificación tras 2meses del 4.° ciclo. Imagen publicada originalmente en The Journal of Nuclear Medicine41.](https://static.elsevier.es/multimedia/2253654X/0000004400000003/v1_202504280650/S2253654X25000265/v1_202504280650/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

