Durante los últimos meses gran parte de los esfuerzos científicos se han centrado en la investigación sobre el SARS-CoV-2 y las consecuencias de su infección en humanos. Aun así, muchos aspectos siguen siendo desconocidos. Se sabe que la afectación por SARS-CoV-2 es multifactorial y que su extensión va más allá del daño pulmonar y del momento agudo, con aparición de numerosas complicaciones y secuelas. El conocimiento de la utilidad de la 18F-FDG-PET/TC en el momento agudo se ha limitado, hasta la fecha, a la detección incidental de afectación pulmonar por SARS-CoV-2. En los últimos meses han ido apareciendo trabajos que recogen los hallazgos de la 18F-FDG-PET/TC en el estado post-COVID, así como las alteraciones provocadas en la imagen metabólica tras la vacunación masiva de la población. Este trabajo pretende revisar la literatura existente sobre estas tres cuestiones y exponer de manera breve la experiencia preliminar propia.
In recent months, much of the scientific efforts have focused on research on SARSCoV-2 infection and its consequences in humans. Still, many aspects remain unknown. It is known that the damage caused by SARS-CoV-2 is multifactorial and that its extension goes beyond lung inflammation and the acute phase, with the appearance of numerous complications and sequelae. To date, knowledge about the usefulness of 18F-FDG-PET/CT in the acute phase has been limited to the incidental detection of SARS-CoV-2 unsuspected pneumonia. Recent studies have been appearing collecting the findings of 18F-FDG- PET/CT in long COVID-19 or persistent COVID-19 state as well as the alterations caused after mass vaccination of the population in the metabolic studies. This work aims to review the existing literature focusing on these three issues and to briefly present our own preliminary experience.
El 31 de diciembre del 2019, la Comisión Municipal de Salud de Wuhan (Hubei, China) notificó un brote de 27 casos de neumonía. El 11 de febrero del 2020, la Organización Mundial de la Salud (OMS), con ya cerca de 32.000 casos confirmados, establece el término Coronavirus Disease 2019 (COVID-19) para referirse a esta nueva enfermedad causada por el Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2), un nuevo virus que recibe su nombre por la similitud con el SARS del año 2003, pero al que se reconoce como entidad diferente. En el momento de la redacción de este trabajo, el número de casos confirmados en todo el mundo asciende a 169.597.415 (España 3.663.176), con un total de 3.530.582 fallecidos (España 79.888) y una mortalidad global del 2,1%, que puede llegar al 37% entre pacientes hospitalizados1,2.
La información sobre la COVID-19 ha crecido exponencialmente, como el número de casos, con casi 100.000 artículos publicados en un año, el equivalente a lo recogido sobre el virus de la inmunodeficiencia humana (VIH) a lo largo de 14 años3. A pesar de ello, aún se desconocen muchos aspectos sobre esta esta nueva enfermedad.
PatogeniaLa fisiopatología de la infección por SARS-CoV-2 aún no está totalmente descifrada.
Es un virus ARN monocatenario encapsulado perteneciente al género β de la familia Coronaviridae, junto con el MERS y SARS4.El principal medio de transmisión es a través de partículas líquidas procedentes de la vía aérea de personas infectadas. Una vez en contacto con el huésped, el SARS-CoV-2 penetra en la célula mediante la unión de su glicoproteína de superficie «S» o spike con su receptor principal, la enzima convertidora de angiotensina-2 (ECA-2). La endocitosis está facilitada por la proteína transmembrana TMPRSS25. Los receptores ECA-2 están muy expresados en las células epiteliales ciliadas del tracto respiratorio, en los neumocitos tipo II y en los macrófagos alveolares, pero también están presentes en otros tejidos como el cerebro, riñón, intestino, corazón, útero, suprarrenales, sistema gastrointestinal, córneas y paredes vasculares. La internalización del virus activa el sistema inmune, provocando la liberación de citoquinas proinflamatorias que a su vez activarán la inmunidad natural (monocitos, linfocitos T y macrófagos) produciendo una retroalimentación de la respuesta inflamatoria. Una respuesta inmune inadecuada producirá un acúmulo excesivo de células inflamatorias con sobreproducción de citoquinas y el consecuente daño tisular y extensión del proceso a distintos territorios del organismo. A esta extensión viral también contribuyen los linfocitos B productores de anticuerpos no neutralizantes6. Además de esta respuesta inmune e inflamatoria exagerada, la infección por SARS-CoV-2 también se ha asociado con coagulopatía, que tiene un probable origen multifactorial en el que intervienen la endotelitis, la disfunción endotelial, la alteración del flujo sanguíneo y la activación plaquetaria y de factores de la coagulación7. Por último, la unión del SARS-CoV-2 al receptor ECA-2 ocasiona un aumento de angiotensina-2 circulante y una disminución de angiotensinas 1-7, lo que favorece un estado proinflamatorio, profibrótico y vasoconstrictor8.
Manifestaciones clínicasDado que la vía aérea es la principal puerta de entrada del SARS-CoV-2, la COVID-19 cursa sobre todo con síntomas de infección del tracto respiratorio, superior en casos leves y neumonía en casos graves, pero se trata de un proceso multisistémico en el que pueden aparecer otras complicaciones agudas como las cardiacas, tromboembólicas, gastrointestinales y neurológicas entre otras9–11.
El porcentaje de individuos infectados asintomáticos oscila entre un 15-45%, porcentaje que puede ser superior en niños5. Entre los pacientes sintomáticos, el periodo de incubación medio es de 5 días, siendo poco frecuente la aparición de síntomas más allá de los 11,5 días desde la exposición al virus. La mayoría de los pacientes tendrán síntomas leves (81%) con cefalea, tos, fiebre y/o ligera disnea, pero hay un 14% de pacientes que desarrollarán clínica severa con mayor disnea e hipoxemia y un 5% que entrarán en estado crítico, con insuficiencia o distrés respiratorio, shock y/o fallo multiorgánico5,12. Los factores de riesgo asociados a mayor mortalidad son la edad superior a 65 años, el consumo activo de tabaco, la hipertensión arterial, la diabetes y la enfermedad cardiovascular o pulmonar crónica. En cuanto a parámetros analíticos, la elevación de proteína C reactiva, LDH, ferritina, procalcitonina, D-dímero y enzimas cardiacas también ha demostrado relación con peor pronóstico3.
DiagnósticoLa reacción en cadena de la polimerasa con transcripción inversa en tiempo real (RT-PCR) de muestras respiratorias, se considera el estándar de referencia de diagnóstico, con especificidad de casi 100%, pero su sensibilidad oscila entre 60-97% por fallos en la obtención de muestras, por su realización en diferentes estadios de la enfermedad o por baja carga viral3.
La radiografía simple y la TC de tórax tienen un papel fundamental para el diagnóstico de la neumonía por SARS-CoV-2 y sus complicaciones. La radiografía puede ser normal en las fases iniciales o formas leves de la enfermedad4,13. La TC es más sensible y puede demostrar alteraciones hasta en un 50-70% de los individuos asintomáticos13. Los hallazgos más habituales son las opacidades pulmonares en vidrio deslustrado (50-98%) o un patrón radiológico reticular (hasta en el 77% de los casos), con una distribución bilateral de predominio periférico y posterior. También pueden aparecer consolidaciones, solas o superpuestas a las opacidades en vidrio deslustrado (24,2-64%). Otros hallazgos como el patrón en empedrado, el derrame pleural o las adenopatías mediastínicas se han observado en una minoría de casos14. La frecuencia de los hallazgos depende del momento en el que se realice la exploración en el curso de la enfermedad. Las opacidades en vidrio deslustrado generalmente se desarrollan entre los días 0-4 desde del inicio de los síntomas y alcanzan su punto máximo a los 6-13 días. Según avanza la enfermedad, la frecuencia de las consolidaciones aumenta15. Un meta-análisis reciente ha demostrado que determinados hallazgos se relacionan con mayor severidad del proceso, como adenopatías hiliomediastínicas, bronquiectasias de tracción, engrosamiento septal interlobar, consolidaciones, patrón en empedrado, reticulación o derrame pleural16.
A pesar de la elevada sensibilidad de las pruebas radiológicas, la Sociedad Fleischner realizó en abril del 2020 una declaración de consenso de carácter internacional que consideraba la limitación de recursos, estableciendo que no hay indicación para pruebas de imagen en pacientes asintomáticos o con síntomas leves, a no ser que exista riesgo de empeoramiento. Tampoco se recomiendan estudios seriados en pacientes intubados estables. Sí considera indicada la realización de estudios de imagen en pacientes con clínica moderada o severa, independientemente del resultado de la PCR, o en pacientes con diagnóstico de COVID-19 y empeoramiento respiratorio. La radiografía de tórax será preferible a la TC, a no ser que exista empeoramiento respiratorio o deterioro funcional y/o hipoxemia tras la COVID-1917.
TratamientoDada la complejidad de la fisiopatología de la COVID-19 y su versatilidad clínica, no existe un tratamiento estándar y la respuesta a las terapias es variable.
Frente al SARS-CoV-2 se han empleado fármacos antivirales y anticuerpos de plasma de pacientes convalecientes o inmunoglobulinas hiperinmunes. Frente a la respuesta del huésped se han empleado tratamientos antiinflamatorios, inmunomoduladores, anticoagulantes y antifibróticos12.
Como medida de soporte, más del 75% de los pacientes hospitalizados requieren oxígeno suplementario, que puede variar desde oxigenoterapia en gafas nasales a la ventilación invasiva en los casos graves. La dexametasona se ha asociado a una reducción del riesgo de mortalidad en pacientes con COVID-19 grave, recomendando su uso en pacientes con necesidad de oxígeno (evidencia IA), sin ningún beneficio demostrado entre los pacientes sin indicación de oxigenoterapia. El tocilizumab en combinación con la dexametasona reduce el riesgo de progresión a ventilación mecánica invasiva y la mortalidad18.
En el entorno hospitalario es frecuente asociar antibioterapia de amplio espectro para cubrir las posibles infecciones fúngicas o bacterianas.
Síntomas persistentes o estado post-COVID-19La evidencia clínica y científica sobre los efectos subagudos y a largo plazo de la COVID-19 es cada vez mayor. Aunque no existe aún una definición universalmente aceptada, ni se han catalogado estos síntomas como enfermedad o síndrome claro. Se ha propuesto diferenciar al menos tres momentos de la enfermedad19:
- -
-COVID-19 agudo: síntomas y signos causados por SARS-CoV-2 que pueden extenderse hasta las cuatro semanas desde el inicio de la clínica.
- -
-Secuelas de COVID-19: secuelas producidas tras afectación aguda por SARS-CoV-2 que frecuentemente ocurren en pacientes que han requerido ingreso hospitalario, a veces en cuidados intensivos (UCI). Son consecuencia del daño estructural de distintos órganos por la infección en sí y/o las complicaciones asociadas. Se incluyen las secuelas propias del estado crítico y la posibilidad de infecciones secundarias.
- -
-COVID-19 persistente o «long COVID-19»: sintomatología que permanece pasadas las 4-12 semanas tras la infección aguda en pacientes con diagnóstico de COVID-19, sin que sea imprescindible la confirmación por pruebas de laboratorio. Otros autores han propuesto denominar a este proceso COVID-19 subagudo para diferenciarlo del COVID-19 crónico o síndrome post-COVID-19, que sería aquel en el que los síntomas persisten o aparecen más allá de la semana 1220.
Aún se desconoce la patogenia del estado post-COVID-19, pero parece que la persistencia de un estado de inflamación juega un papel fundamental, habiéndose demostrado en estos pacientes proteína C-reactiva e IL-6 y 4 elevadas en sangre. Probablemente también contribuyen otros factores como la persistencia del virus en tejidos, originando infección latente o crónica, la posibilidad de la reinfección, la regulación a la baja de receptores ECA-2 y la disfunción vascular. El desacondicionamiento físico por inactividad prolongada, factores neuropsicológicos debidos al estrés postraumático y la desregularización del sistema nervioso simpático son otros de los factores propuestos19–21.
La COVID-19 persistente ha sido descrita hasta en el 87% de los pacientes que requirieron hospitalización en el momento agudo de la enfermedad, con presencia de al menos tres síntomas en un 55% de los casos20. El espectro clínico es muy amplio y no se conoce con exactitud por qué algunas personas tardan más en recuperarse. Puede ocurrir tanto en pacientes que han presentado una infección aguda con curso grave, como aquellos que lo han padecido de forma más leve y, aunque puede afectar a personas de cualquier edad y sexo, predomina en mujeres con edades comprendidas entre los 36-50 años sin comorbilidades previas22. En general, los síntomas son fluctuantes y cíclicos, alternando días en los que prácticamente han desaparecido con otros en los que reaparecen. El síntoma más frecuente es la fatiga, presente en el 17-72% de los pacientes que han sufrido ingreso hospitalario, seguido de la disnea, el dolor articular, muscular y torácico. Pero pueden aparecer otros muchos síntomas y afectar a prácticamente cualquier órgano, con otras secuelas o complicaciones pulmonares (tos y disminución de la capacidad de difusión [DLCO]), cardiovasculares (palpitaciones, arritmias, taquicardia, disautonomía y fibrosis miocárdica), hematológicas (fenómenos tromboembólicos), neuropsiquiátricas (cefalea, disautonomía, parestesias, niebla mental, ansiedad, depresión, trastorno del sueño, anosmia y disgeusia), renales (disminución del filtrado glomerular), endocrinológicas (mal control de la diabetes, tiroiditis subaguda, hipotiroidismo, desmineralización ósea), digestivas (diarrea y dolor abdominal, alteración de la microbiota intestinal), dermatológicas, el síndrome inflamatorio multisistémico pediátrico y la fiebre o febrícula20,21,23–25. Esta sintomatología se ha descrito en otros coronavirus (SARS, MERS) y en la infección por virus de Epstein-Barr y chikungunya, entre otros, resolviéndose transcurridos unas semanas o meses.
Estudios capaces de poner de manifiesto este estado son fundamentales para planificar los tratamientos y cuidados de estos pacientes y dirigir el enfoque de futuras líneas de investigación. Aún no hay evidencia sobre la eficacia de medidas farmacológicas o no farmacológicas frente a esta sintomatología persistente, pero sí se recomienda un manejo multidisciplinar22,26.
PET/TC con 18F-FDG en la infección por SARS-CoV-2Sistema respiratorioComo se ha referido anteriormente, la neumonía viral activa las células inflamatorias (neutrófilos, monocitos y linfocitos T-helper) y la liberación local de citoquinas27. Considerando la avidez de las células inflamatorias por la glucosa, es esperable que la enfermedad pueda ser evaluada con 18F-FDG-PET/TC, técnica que ya ha demostrado utilidad en el estudio de las enfermedades infecciosas e inflamatorias, en general, y del aparato respiratorio, en particular28. Estudios previos han mostrado cómo pacientes infectados por MERS mostraban marcada captación pulmonar de 18F-FDG cuando progresaban a neumonía29. Asimismo, se ha documentado captación patológica de 18F-FDG en adenopatías mediastínicas y axilares de primates no humanos a los cinco días de ser infectados por MERS, coincidiendo con monocitosis en sangre periférica, sin cambios en la imagen TC ni en la temperatura corporal30. Estudios realizados en camellos y conejos infectados con MERS han demostrado la presencia de virus en ausencia de signos clínicos, especulando que la infección subclínica podría ocurrir también en humanos inmunocompetentes sanos, dado que la mayoría de los pacientes que exhibían una infección grave de vías respiratorias inferiores tenían comorbilidades subyacentes31. También se ha revelado mediante 18F-FDG-PET/TC una activación del tejido linfoide de ganglios axilares, cervicales y mediastínicos de macacos infectados con el virus de la inmunodeficiencia aguda simio-humana, que precede a la replicación fulminante del virus32.
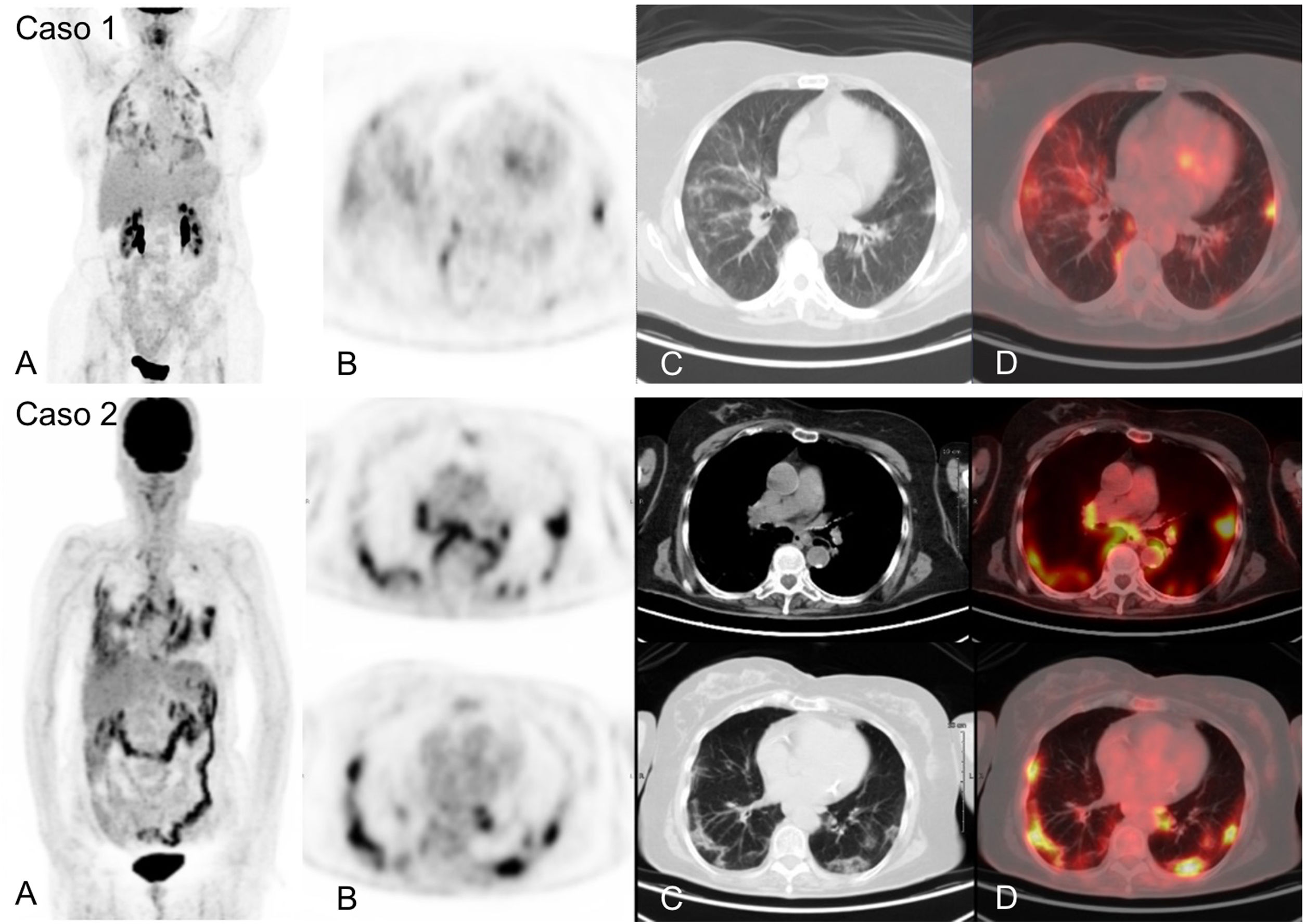
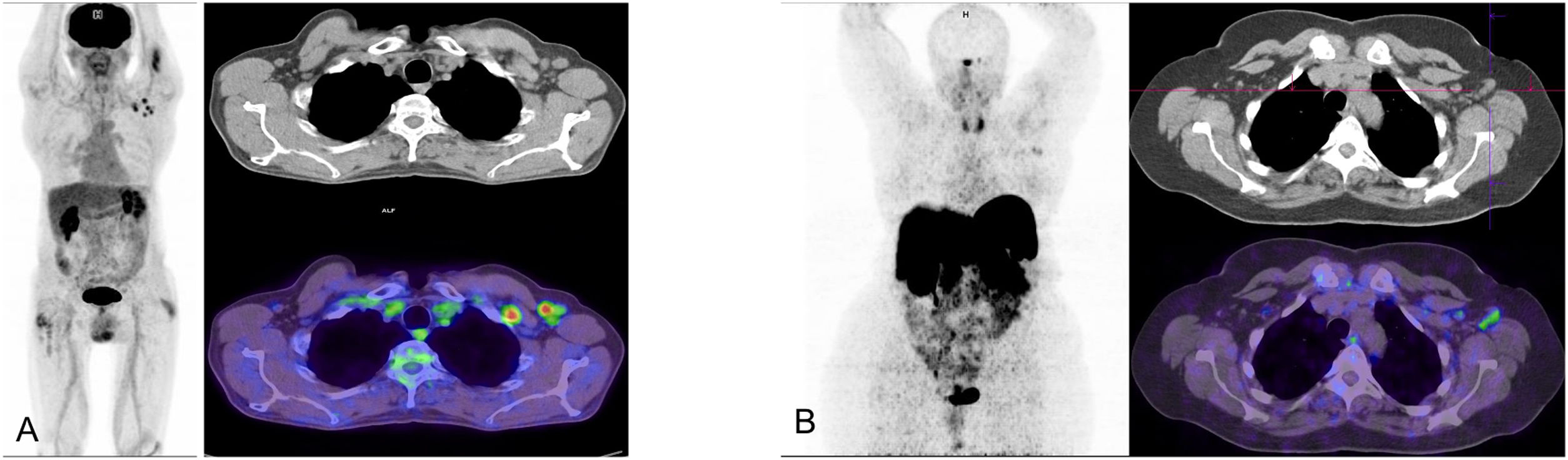
La 18F-FDG-PET/TC puede demostrar alteraciones radiológicas características y tempranas de la neumonía por COVID-19, a pesar de emplear una TC de baja dosis que, no obstante, también es diagnóstico33. Numerosos trabajos han recogido la detección fortuita de alteraciones metabólicas en el parénquima pulmonar de pacientes, a menudo asintomáticos, que se realizan una 18F-FDG-PET/TC por cualquiera de las indicaciones clínicas establecidas, confirmándose posteriormente la infección por SARS-CoV-2, con una frecuencia que oscila entre el 4,1-9,2%34–37. (fig. 1. Caso 1). La aparición de estas alteraciones en pacientes asintomáticos podría reflejar la respuesta inmune precoz a la infección, de manera similar a la descrita en los modelos animales referidos.
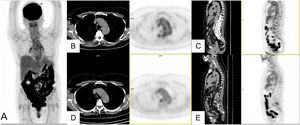
Infección aguda por SARS-CoV-2 detectada durante la realización de 18F-FDG-PET/TC en dos pacientes asintomáticos desde el punto de vista respiratorio e infeccioso, confirmada mediante realización posterior de PCR. Caso 1. MIP (A) de paciente con linfoma B difuso de células grandes en respuesta completa metabólica que muestra múltiples captaciones pulmonares visibles también el corte axial de PET (B) y correspondientes con opacidades en vidrio deslustrado en cortes axiales de TC (C) y PET/TC (D). Caso 2. MIP (A) de paciente en seguimiento por melanoma que muestra intensas captaciones pulmonares e hiliomediastínicas correspondientes con opacidades en vidrio deslustrado bilaterales de predominio periférico y adenopatías mediastínicas e hiliares visibles en los cortes tomográficos de PET (B), TC (C) y PET/TC (D).
Una reciente revisión sistemática documenta los hallazgos observados en 52 pacientes con neumonía por COVID-19 detectada incidentalmente tras la realización de estudio PET/TC con 18F-FDG en 48 casos, con 18F-colina en tres y con 68Ga-PSMA en uno. Los hallazgos más frecuentes fueron opacidades en vidrio deslustrado bilaterales hipermetabólicas (75%), consolidaciones (34,6%), engrosamiento septal interlobular (7,6%). El rango de SUVmáx observado en estudios con 18F-FDG fue de 2,2-18 (media SUVmáx 4,9 ± 2,3), en los casos con 18F-colina, el SUVmáx osciló entre 3- 4 y, en el único caso realizado con 68Ga-PSMA, el SUVmáx fue de 3,238. Se ha observado que las lesiones pulmonares con mayor captación de 18F-FDG podrían correlacionarse con una mayor velocidad de sedimentación globular y con un mayor tiempo hasta la curación, aunque son necesarios estudios de cohorte con un mayor número de pacientes para extraer conclusiones al respecto39,40.
El hallazgo quizá más distintivo de los estudios 18F-FDG-PET/TC realizados en pacientes con neumonía por COVID-19 es la presencia de adenopatías mediastínicas (27%) e hiliares (19,2%) con captación patológica, hecho que es infrecuente en los estudios radiológicos publicados hasta la fecha16,38. (fig. 1. Caso 2).
A pesar de la capacidad de la técnica para poner de manifiesto la enfermedad pulmonar, en general, se recomienda no emplear la 18F-FDG-PET/TC como procedimiento diagnóstico de la neumonía por COVID-19, dado que parece aportar poco sobre la radiografía y la TC de tórax14. Además, aunque la 18F-FDG-PET/TC refleja el proceso inflamatorio pulmonar en el supuesto pico de la fase aguda de la COVID-19, no se ha podido demostrar correlación entre el estatus inflamatorio y la evolución de los hallazgos radiológicos o la evolución clínica a corto plazo41. También hay que considerar que es una exploración que aumenta el tiempo de exposición del personal profesionalmente expuesto y de otros pacientes al virus, con respecto a la TC o la radiografía que son mucho más rápidas.
No se conoce con exactitud el periodo «normal» de resolución de las alteraciones pulmonares en pacientes que han sufrido neumonía. La cohorte más extensa de seguimiento tras el alta hospitalaria incluye 1.733 pacientes, de los cuales, 353 fueron investigados con TC, encontrándose alteraciones radiológicas persistentes en aproximadamente el 50% de los casos, consistentes, sobre todo, en opacidades en vidrio deslustrado.
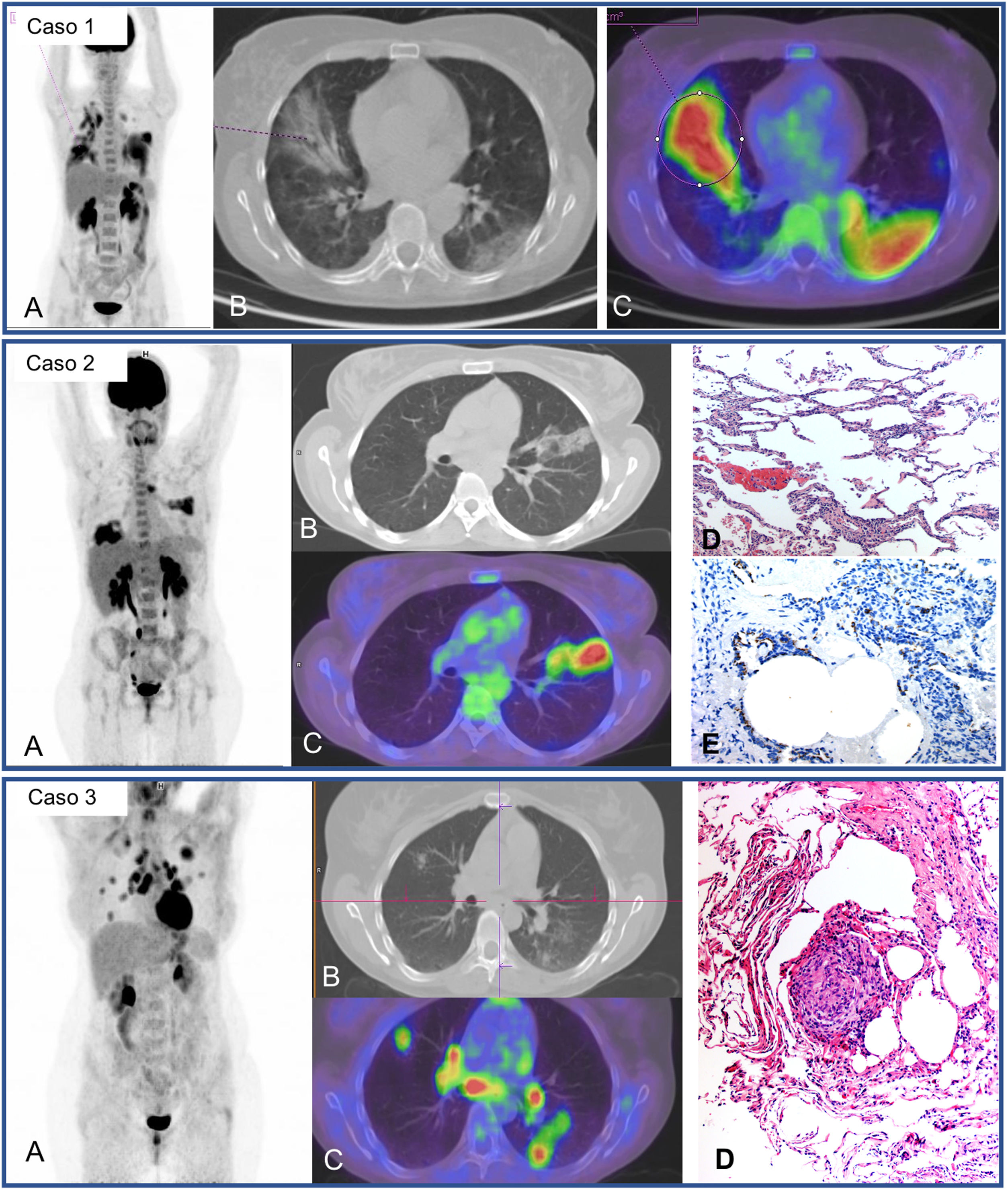
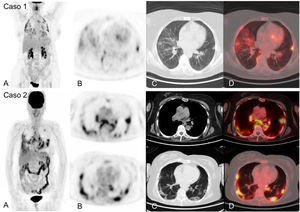
La captación descrita en las lesiones pulmonares residuales de pacientes convalecientes de neumonía por COVID-19 entre la segunda y la cuarta semanas desde el establecimiento de los síntomas es de carácter leve-moderado (SUVmáx 3,4 ± 2,3) y es aún menor a partir del primer mes (SUVmáx 0,85-1,79)42,43. Desde el inicio de la pandemia hemos realizado estudios PET/TC con 18F-FDG en 24 pacientes por persistencia o empeoramiento de síntomas por COVID-19 sistémicos, con un tiempo transcurrido desde la aparición de síntomas o desde el ingreso hospitalario de al menos un mes. Hemos detectado captación pulmonar de elevada-moderada intensidad en ocho de ellos, coincidente con áreas de alteración parenquimatosa en TC que consistían en infiltrados en vidrio deslustrado con distinto grado de consolidación. Seis pacientes compartían la característica común de haber recibido tratamiento inmunosupresor por patologías previas y manifestaban fiebre o febrícula persistentemente elevada. El lavado bronquialveolar realizado tras la PET/TC mostró un elevado porcentaje de macrófagos (45-81%) y variable de linfocitos (4-51%). En una paciente se demostró presencia del SARS-CoV-2 mediante PCR del broncoaspirado, a pesar de muestras nasofaríngeas reiteradamente negativas (fig. 2. Caso 1). En otros tres pacientes se realizaron técnicas de inmunohistoquímica en tejido pulmonar y dos de ellos demostraron positividad frente a la subunidad S2 de la proteína spike de superficie del SARS-CoV-2 (fig. 2. Caso 2). En el resto de los casos no se llegó a realizar inmunohistoquímica, dado que ocurrieron antes de disponibilidad de la técnica. Estos resultados alertan sobre la posibilidad de permanencia del virus, más allá del momento agudo en pacientes inmunosuprimidos.
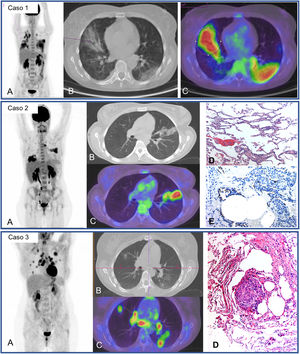
Caso 1. MIP (A) de paciente con fiebre de origen desconocido y síndrome de Sjögren en tratamiento con rituximab. Cuadro clínico compatible con COVID-19 (fiebre y TC con afectación parenquimatosa pulmonar bilateral) desde el 25 de marzo de 2020 con 3 PCR de exudado nasofaríngeo negativas. PET/TC un mes después que muestra intensa captación pulmonar bilateral coincidente alteraciones radiológicas visibles en los cortes axiales de TC (B) y PET/TC (C) y probable reactivación medular. Se realizó un posterior broncoaspirado que confirma, mediante PCR, la infección persistente por SARS-CoV-2. Caso 2. MIP (A) de paciente con esclerosis múltiple en tratamiento con rituximab y fiebre post-COVID de dos meses evolución. Captación patológica de elevada intensidad en ambos parénquimas pulmonares coincidiendo con áreas de opacificación en el TC y PET/TC (B, C). Se realizó posterior biopsia transbronquial con el resultado de neumonitis linfocitaria T (D) y mediante tinción inmunohistoquímica en tejido pulmonar, se evidenció la persistencia del SARS-CoV-2 (E). Caso 3. MIP (A) de paciente joven sin antecedentes de interés con disnea post-COVID de ocho meses de evolución. Muestra múltiples captaciones nodulares en ambos pulmones y captación hiliomediastínica bilateral, coincidentes con áreas de opacificacion del parénquima y adenopatías no aumentadas de tamaño (B, C). El estudio histológico ganglionar obtenido por ecobroncoscopia (D) mostró inflamación granulomatosa no necrotizante de tipo sarcoide. La biopsia transbronquial posterior, demostró el mismo tipo de inflamación granulomatosa sin presencia de virus en la inmunotinción.
Los otros dos pacientes con moderada-elevada captación pulmonar no contaban con antecedentes de inmunosupresión. Uno de los casos, solicitado por fiebre alta persistente correspondió a sobreinfección bacteriana, mostrando el estudio PET/TC una captación claramente dominante en pulmón izquierdo. El segundo caso se realizó por febrícula persistente y disnea significativa discordante con la afectación radiológica. El estudio mostró intensa captación pulmonar coincidente con opacidades nodulares de tamaño variable, así como en múltiples ganglios hiliomediastínicos no aumentados de tamaño. Se realizó una punción-aspiración con aguja fina de adenopatía subcarinal que demostró una reacción sarcoide, por lo que se inició tratamiento con corticoides a altas dosis (fig. 2 Caso 3).
Según nuestra experiencia, en el marco de la investigación del estado post-COVID-19, una captación pulmonar elevada más allá del primer mes desde el proceso agudo, y sin una causa evidente que la justifique, constituye un signo de alarma y justificaría la realización de estudios dirigidos.
Una de las secuelas pulmonares más preocupantes es la fibrosis pulmonar. Según un reciente metaanálisis, aproximadamente el 30% de los pacientes hospitalizados con neumonía por SARS-CoV-2 muestran cambios fibróticos que persisten los primeros 12 meses desde el alta44. Dado el tiempo transcurrido desde que se inició la pandemia, se desconoce si esta fibrosis será estable o si, como la fibrosis pulmonar idiopática (FPI), con la que comparte vías patogénicas comunes, tendrá un carácter progresivo45. En la FPI, estudios con 18F-FDG PET/TC han demostrado una asociación inversa significativa entre el nivel de captación pulmonar y la supervivencia, con independencia de la edad, sexo y variables fisiológicas, mantenida incluso en pacientes con buena función pulmonar. Por tanto, si se demostrara el carácter irreversible y progresivo de la fibrosis post-COVID-19, la PET/TC podría ser útil como biomarcador pronóstico y contribuir al diseño de tratamientos46.
Sistema cardiovascularLa comorbilidad cardiovascular se ha asociado con mayor gravedad de la COVID-19, con evidencia de lesión cardiaca en un 7-28% de los pacientes hospitalizados, que exhiben una tasa de mortalidad sustancialmente más alta47,48. Además existe una evidencia cada vez mayor de que la enfermedad respiratoria aguda se asocia significativamente con el daño miocárdico agudo, que aparece hasta un 20-30% de los pacientes49, cuyo mecanismo aún no ha sido aclarado. Las series de autopsias de pacientes con COVID-19 han encontrado partículas virales en el miocardio en el 47% de los casos y más del 7,5% de las células miocárdicas expresan ECA-250,51. Probablemente también intervienen en el daño miocárdico la hiperinflamación vascular y miocárdica mediada por citoquinas, la disfunción endotelial, la hipercoagulabilidad y los efectos que tenga sobre el corazón la presencia de una infección sistémica51.
En pacientes con elevación significativa de biomarcadores de daño miocárdico, las pruebas de imagen pueden ser útiles para esclarecer el origen, si bien debe considerarse cuidadosamente la indicación en el momento agudo de la infección, dado el riesgo de exposición al virus para el personal y pacientes. En pacientes hemodinámicamente estables con enfermedad coronaria conocida y dolor torácico de origen incierto, en los que se sospeche síndrome coronario agudo sin elevación de ST son útiles los estudios SPECT o PET/TC de perfusión con estrés farmacológico, pero si existe bajo riesgo, la exploración puede diferirse hasta la resolución de la fase aguda52.
Los pacientes hospitalizados por COVID-19 tienen mayor riesgo de asociar infecciones fúngicas o bacterianas, entre ellas endocarditis, donde la 18F-FDG-PET/TC ha demostrado un impacto del 40% en el manejo del paciente53. Esta indicación debe, por tanto, ser tenida en cuenta incluso en pacientes con infección activa.
La prevalencia de miocarditis asociada a la COVID-19 se desconoce. Una revisión sistemática de los estudios de autopsias publicados la establece en un 1,5% de los casos50, aunque otros estudios refieren hasta un 7% de miocarditis fulminantes en la fase aguda de la enfermedad. Los estudios de seguimiento de pacientes hospitalizados por COVID-19 señalan la presencia de alteraciones en RM en el 75% de los casos, con diagnóstico de pericarditis en un 3% de los pacientes, miopericarditis en un 11% y miocarditis en un 26%, en muchas ocasiones de carácter asintomático54. La detección de la inflamación persistente es importante, ya que puede conducir al desarrollo de miocardiopatía dilatada y arritmias potencialmente fatales. El realce tardío de gadolinio en RM, signo de inflamación activa en las fases agudas, pierde especificidad en fase avanzada por mayor dificultad para diferenciar inflamación activa de cicatriz o fibrosis. La realización de un 18F-FDG-PET/TC aporta información adicional al diagnóstico diferencial, con una especificidad del 97%49,55, al demostrar captación en las lesiones correspondientes a inflamación. No hay aún estudios dirigidos a analizar la utilidad de la 18F-FDG-PET/TC en miocarditis por SARS-CoV-2, pero ya ha demostrado utilidad en la valoración de disfunciones ventriculares cuando se sospechan otras miocardiopatías inflamatorias56. Se ha documentado la detección de inflamación miocárdica y su respuesta al tratamiento corticoideo mediante 18F-FDG-PET/TC en un paciente pediátrico con síndrome inflamatorio multisistémico tras infección por SARS-CoV-257.
Es de esperar que el estudio COSMIC-19 (CardiOvaScular Mechanisms In Covid-19), recientemente iniciado, esclarezca la presencia y características de la lesión cardiaca asociada a la infección por SARS-CoV-2 y la utilidad de la 18F-FDG-PET/TC para su caracterización58. De momento, y hasta tener mayor información, considerando que se describen palpitaciones y dolor torácico a los seis meses del alta en un 9 y 5% de los pacientes hospitalizados por COVID-19, respectivamente24, y la citada presencia de alteraciones en RM, aun en pacientes asintomáticos, puede ser de interés aplicar un protocolo de preparación de supresión miocárdica59 en los estudios 18F-FDG-PET/TC realizados en el contexto de estado post-COVID-19.
Se han descrito fenómenos embólicos hasta en un 5% de los pacientes tras la infección aguda. La duración del estado protrombótico es desconocida. Estudios preliminares indican menos de un 5% de fenómenos tromboembólicos tras la COVID-19 aguda. Se han identificado factores de riesgo predisponentes como la elevación del dímero D, dos veces por encima de su valor normal, una neoplasia intercurrente, índice de masa corporal mayor de 30, edad superior a 60 años, ingreso reciente en la UCI o episodio tromboembólico previo20. Algunas de estas características están presentes en los pacientes remitidos a estudio PET/TC, por lo que debemos ser especialmente minuciosos en la revisión de la vascularización pulmonar, especialmente en centros que empleen un protocolo de adquisición TC con contraste intravenoso.
Sistema nerviosoSe sospecha que el SARS-CoV-2 tiene potencial neuroinvasivo y se han demostrado partículas virales en células endoteliales del córtex frontal en estudios histológicos60. Además, existe expresión de receptores ECA-2 en el endotelio vascular y en células nerviosas, tanto en neuronas como en células gliales, particularmente en el territorio ventrolateral de la médula, sustancia negra mesencefálica, giro temporal medio, córtex cingulado posterior y bulbo olfatorio61,62. Se barajan varios mecanismos de entrada del virus al sistema nervioso central, como la diseminación retrógrada transináptica desde el bulbo olfatorio, la invasión vascular directa por adhesión a las células endoteliales atravesando la barrera hematoencefálica o como caballo de Troya en el interior de macrófagos y linfocitos infectados63. Además del daño directo causado por el virus, existen mecanismos de daño indirecto mediado por la hipoxia cerebral, la activación de la microglía secundaria a la elevación de citoquinas, por el bloqueo de receptores o canales iónicos por anticuerpos, por activación del eje hipotálamo-hipofisario y por fenómenos vasculares y trombóticos64 (fig. 3A). Las series post mortem que han analizado el tejido cerebral encuentran presencia del virus en el 53% de los casos, sin relación con la severidad de los cambios neuropatológicos. Los hallazgos dominantes fueron la presencia de astrogliosis, microglía activada y linfocitos T citotóxicos en el córtex frontal, tronco, cerebelo y ganglios basales, así como la presencia de múltiples áreas de infarto65.
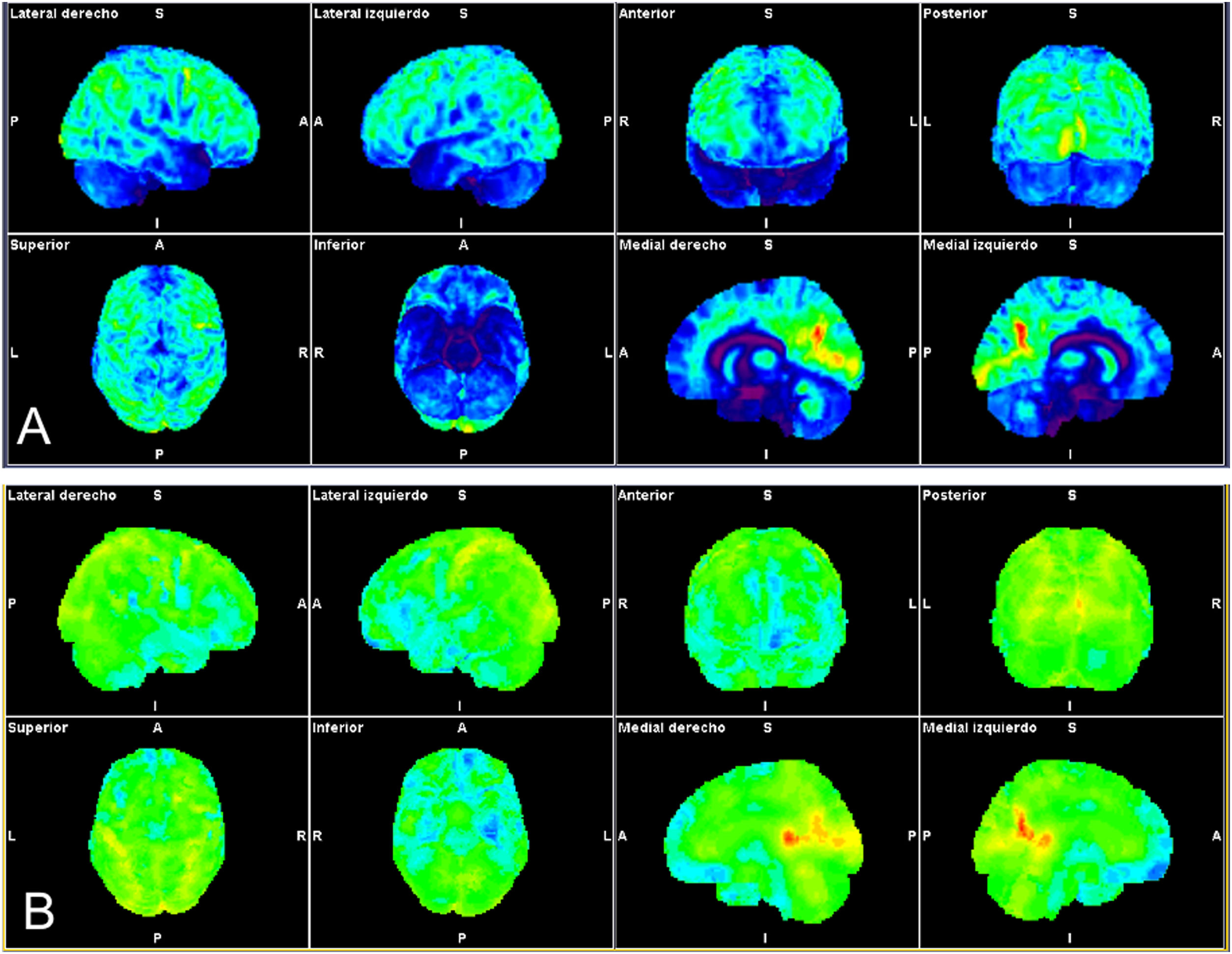
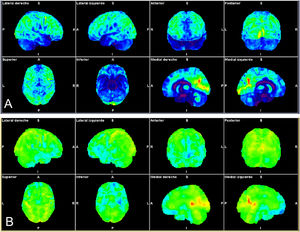
Paciente con perfil de autoinmunidad (antecedentes de sacroileitis, uveítis, sensibilidad al gluten). Infección por SARS-CoV-2 leve con pérdida progresiva de memoria a corto plazo, déficit atencional y astenia importante. Se muestran los mapas estadísticos de superficie cerebral obtenidos mediante análisis automatizado (Syngo.via Neurology; Siemens). Imágenes con normalización a cerebro entero (A) y análisis comparativo con la base de datos ajustada a la edad de la paciente (B) que muestran hipometabolismo frontal (frontorbitario, circunvolución recta y circunvolución inferior) temporal bilateral (amígdalas e hipocampos), en ambos tálamos, tronco y relativo de ambos hemisferios cerebelosos.
En la fase aguda de la enfermedad, la mayoría de las series clínicas describen la aparición de síntomas neurológicos, la mayoría de ellos en pacientes ingresados por la gravedad del cuadro respiratorio62,66. Hasta un 57,4% de los pacientes, según las series más extensas66, presenta síntomas neurológicos inespecíficos como cefalea, disminución del nivel de consciencia, agitación, alteraciones del olfato y/o gusto, mialgias y cuadros más específicos como infartos cerebrales, encefalitis y lesiones de sustancia blanca en pruebas de imagen67.
Aunque actualmente se carece de biomarcadores específicos del deterioro cognitivo producido por el SARS-CoV-2, hay pruebas que apoyan que el fenómeno inflamatorio relacionado con la infección podría dirigirse preferente a los lóbulos frontales y/o redes neuronales frontales, como el hecho de que predominen síntomas conductuales y disejecutivos, la hipoperfusión frontotemporal en la RM, la desaceleración del electroencefalograma en las regiones frontales y el hipometabolismo frontal en los estudios 18F-FDG-PET/TC, tanto en pacientes con síndrome frontal como en aquellos sin delirio pero con anosmia o ageusia68.
La encefalopatía aguda por COVID-19, encefalitis por SARS-CoV-2 o sensible a esteroides, se ha documentado con frecuencia en pacientes hospitalizados que cursan con delirio agudo y otros síntomas neuropsiquiátricos. Los estudios 18F-FDG-PET/TC realizados precozmente en estos pacientes muestran hipometabolismo prefrontal u orbitofrontal, de la ínsula y cíngulo anterior, y en hemisferios cerebelosos y caudados con menor frecuencia. En esta fase aguda puede además aparecer hipermetabolismo en vermis y estriados que se atribuye a fenómenos compensatorios, electroconvulsivos o inflamatorios69,70. Los estudios PET/TC secuenciales realizados uno y seis meses después de la imagen basal muestran desaparición de las áreas hipermetabólicas y un menor hipometabolismo, en consonancia con la mejoría clínica. Esto indicaría que las alteraciones metabólicas pueden ser el sustrato neuronal de la clínica de los pacientes, que cursan, sobre todo, con síndrome frontal, alteraciones emocionales y alteración en la percepción del fallo respiratorio70.
También se ha estudiado mediante 18F-FDG-PET/TC a dos pacientes con COVID-19 aguda y disociación cognitiva-motora o conciencia encubierta, condición que ocurre en pacientes ingresados por lesiones cerebrales graves y que parecen no responder a órdenes, pero conservan su capacidad cognitiva, a diferencia de los trastornos reales de la conciencia. Se ha observado un hipometabolismo frontal difuso con respeto del córtex motor y premotor, pero afectando a áreas asociativas responsables de la integración de la iniciación motora y de la coordinación. Estos resultados demostrarían la utilidad de la 18F-FDG-PET/TC en los casos de pacientes con COVID-19 grave, RM normal, déficit motor aislado en la electromiografía y ausencia de respuesta, confirmando la integridad de las estructuras responsables del movimiento voluntario71.
Se ha publicado un caso de anosmia aguda con hipometabolismo leve en córtex orbitofrontal izquierdo, que podría sugerir deterioro neuronal por acción directa del SARS-CoV-272. Sin embargo, un estudio más reciente sugiere que la anosmia parece más relacionada con procesos de desaferentación y reorganización funcional por carencia del estímulo olfativo, que ocasionan cambios metabólicos sutiles en áreas corticales olfativas y asociativas, visible en 18F-FDG -PET/RM73.
Existe una evidencia creciente de la persistencia de síntomas neurológicos tras la COVID-19 aguda, proceso que se ha denominado recientemente como neurological manifestations of post-acute sequelae of SARS-CoV-2 infection (Neuro-PACS)74. Su incidencia es superior entre pacientes que requirieron hospitalización, especialmente si fue en UCI o desarrollaron encefalopatía. Esta sintomatología es muy variada. Según un registro electrónico del seguimiento de 236.379 pacientes durante los seis primeros meses desde el diagnóstico de COVID-19, las secuelas neuropsiquiátricas aparecen en un 34% de los casos, sin incluir la cefalea. Entre las más habituales se encuentran los trastornos de ánimo y ansiedad y la psicosis (24%), neuropatías (2,1%), infartos isquémicos (2,8%) y demencia (0,67%)75. La posibilidad de desarrollar parkinsonismo tras la COVID-19 también está generando preocupación, considerando las secuelas de pandemias previas como la gripe de 1918. La afectación del sistema nigroestriatal tras la infección por SARS-CoV-2 se ha documentado mediante estudios de neuroimagen76. Sin embargo, no está claro que el riesgo de parkinsonismo sea superior que tras otras infecciones del tracto respiratorio75.
Los síntomas más frecuentes en nuestro medio son la cefalea y la queja cognitiva, descritos hasta en el 68 y 81%, respectivamente, de los pacientes con algún síntoma neurológico más allá de la semana 12 desde la infección aguda77. La queja cognitiva que habitualmente se refiere es una falta de concentración, de atención o dificultad para planificar tareas, lo que se ha englobado bajo el término de niebla mental (brain fog), aunque el perfil neurocognitivo no está correctamente descrito aún.
Los estudios PET/TC con 18F-FDG realizados en pacientes hospitalizados con al menos dos síntomas neurológicos en la fase subaguda de la enfermedad encuentran una disminución del metabolismo con un predominio frontoparietal que se correlaciona con la alteración del MoCA con perfil de disfunción neocortical78.
Se hipotetiza que las quejas funcionales persistentes (fatiga, disnea, alteración del gusto y/u olfato, deterioro mnésico o cognitivo, trastorno del sueño y dolor, entre otras) tras la infección aguda por SARS-CoV-2 pueden estar relacionadas con una afectación central, que puede ponerse de manifiesto mediante PET/TC con 18F-FDG, empleando esta técnica como un biomarcador diagnóstico y de seguimiento. En este sentido, el análisis retrospectivo del metabolismo cerebral de 35 pacientes con esta sintomatología ha puesto de manifiesto, en comparación con el grupo control, un hipometabolismo que afecta fundamentalmente a giro recto/orbitario, del lóbulo temporal derecho con extensión al tálamo ipsilateral, de la protuberancia y del cerebelo. Además, estas áreas hipometabólicas se han relacionado con síntomas determinados. Pacientes con mayor número de quejas mostraron más afectación del tronco del encéfalo y del cerebelo. El mayor hipometabolismo frontal fue detectado en pacientes con dolor. Las quejas cognitivas se relacionaron con mayor afectación de los hemisferios cerebelosos79.
Otro estudio en pacientes con sintomatología persistente más allá del mes desde la primoinfección ha encontrado relación entre la hiposmia/anosmia y un hipometabolismo característicamente del giro parahipocampal y córtex orbitofrontal bilateral, y entre la fatiga y el giro parahipocampal derecho, el tronco del encéfalo y el tálamo bilateral80.
Según nuestra experiencia preliminar, pendiente de validación, basada en 10 pacientes con niebla mental de nueva aparición tras la COVID-19, en los que prima un déficit atencional y disejecutivo y remitidos desde la consulta específica de neuro-COVID-19, la afectación metabólica en 18F-FDG-PET/TC muestra un predominio frontal inferior, sobre todo izquierdo, del territorio temporal también con predominio izquierdo, y de ambos hemisferios cerebelosos. Coincidiendo con el estudio de Guedj et al.79, los pacientes con más afectación funcional sistémica han mostrado mayor alteración del estudio PET/TC cerebral (fig. 3).
Los astrocitos contribuyen significativamente a la captación cerebral de 18F-FDG y se sabe que tienen una función principal en la defensa frente a las agresiones inflamatorias. Aunque el sustrato celular del hipometabolismo cerebral persistente con 18F-FDG-PET/TC aún no está definido, la persistencia de una alteración astrocitaria identificada en los estudios postmortem podría ser una causa principal81.
PET en el estado post-COVID-19Aún no se han establecido las herramientas del diagnóstico del estado post-COVID-19 y posiblemente dependan de los síntomas dominantes. Considerando su fisiopatología, una técnica como la 18F-FDG-PET/TC, capaz de poner de manifiesto las áreas de inflamación y/o hipofunción, así como los focos de infección activa, evaluando de manera global el organismo, puede ofrecer ventajas en estos pacientes. Además, la sensibilidad de la técnica puede verse aumentada, ya que la afinidad de los receptores GLUT hacia la 18F-FDG aumenta en presencia de citoquinas y factores de crecimiento80. No obstante, debemos ser cautos, ya que en la práctica diaria resultaría imposible asumir la totalidad de la demanda generada por los pacientes en estado post-COVID-19. Por ello es necesario profundizar en el conocimiento del síndrome, manteniendo una comunicación fluida con los servicios implicados para establecer un marco clínico de mayor utilidad o rendimiento diagnóstico.
A lo largo del artículo, se ha ido revisando la utilidad o aportación de la 18F-FDG-PET/TC en las complicaciones o secuelas específicas, pero hasta la fecha, solo un estudio recoge los hallazgos sistémicos de la imagen 18F-FDG-PET/TC en pacientes con síntomas inespecíficos, más allá del primer mes, tales como disnea (69%), fatiga (62%), ageusia/anosmia (31%), dolor articular (23%) y taquicardia (15%), entre otros. Los resultados indican que en estos pacientes existe, en comparación con el grupo control, mayor captación multiorgánica, especialmente en médula ósea, vascular y en grandes articulaciones, que sugiere un estado de inflamación sistémica persistente, sin que se haya podido definir un patrón metabólico concreto.
En nuestro medio, la derivación a estudio 18F-FDG-PET/TC se está produciendo fundamentalmente por febrícula/fiebre persistente o síndrome constitucional significativo, con o sin el resto de los síntomas descritos. El objetivo del estudio 18F-FDG-PET/TC ha sido, sobre todo, descartar la existencia procesos patológicos concomitantes.
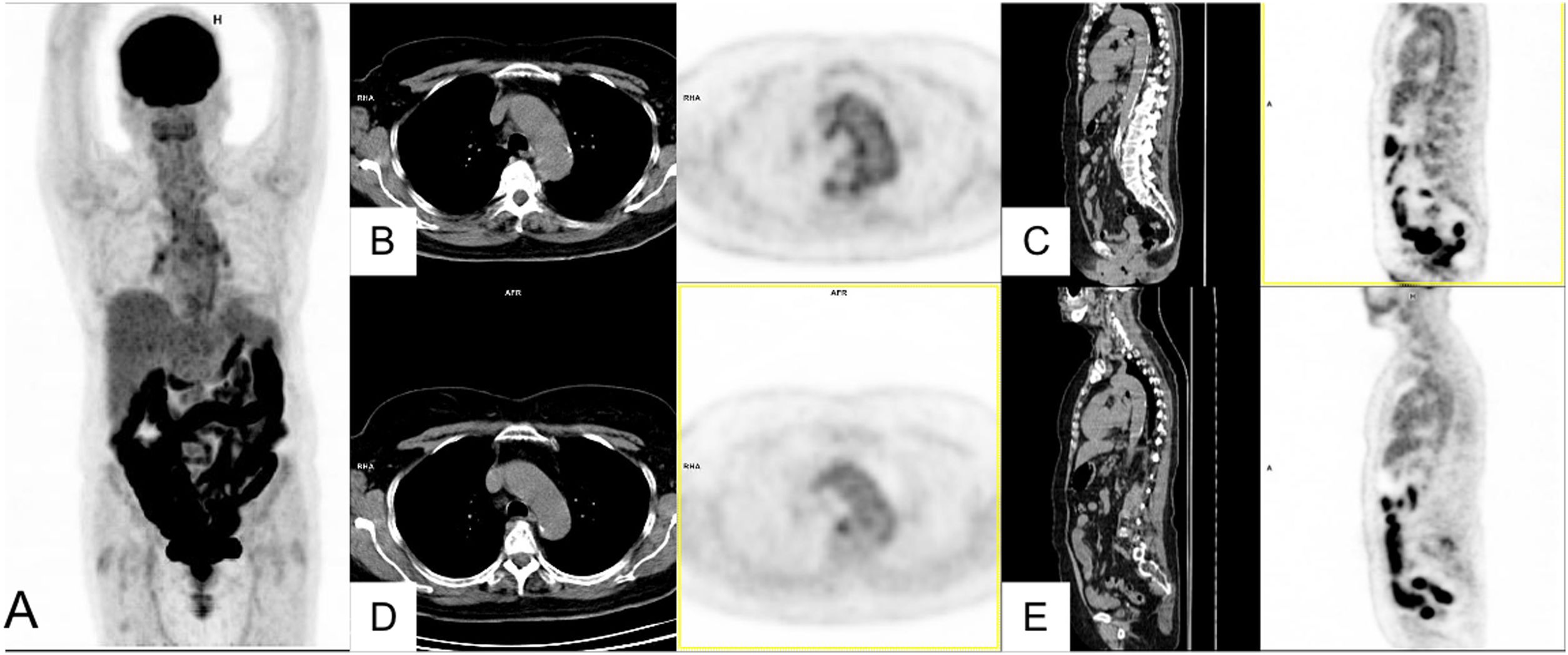
De los 24 estudios realizados, ocho ya descritos mostraban captación pulmonar significativa (33%). En el resto no encontramos un patrón reproducible, salvo una captación difusa en glándulas salivares mayores en seis casos (25%), junto con captación muscular inespecífica en uno y tímica en otro. Cinco (21%) mostraron distribución fisiológica del radiotrazador, sin hallazgos patológicos reseñables. Probablemente el hecho de no haber detectado el incremento multiorgánico descrito por Sollini et al.80se debe a un mayor tiempo transcurrido entre la infección aguda y la imagen. En dos casos se detectaron adenopatías hiliomediastínicas hipermetabólicas confirmadas histológicamente como reacción sarcoide en un caso (fig. 2. Caso 3) y no investigadas en otro. Se identificó incidentalmente un carcinoma papilar de tiroides y un caso de incremento difuso de la captación que correspondió a un hipotiroidismo. Se ha publicado una prevalencia de hipotiroidismo en pacientes con COVID-19 del 5,2-5,6%, pero se desconoce aún si existe en estos casos un hipotiroidismo previo o si puede ser un fenómeno secundario a la activación del proceso autoinmune por la infección82. Por último, un paciente mostró captación patológica difusa en la pared de la aorta torácica. En este caso, la vasculitis se sospechaba clínicamente con un estudio inicial con 18F-FDG-PET/TC sin hallazgos de interés. Tras la COVID-19 empeora la clínica, en consonancia con la demostración de captación patológica vascular (fig. 4). Se plantea la posibilidad de que la infección haya actuado como un fenómeno de activación de proceso autoinmune previo.
Paciente con malestar general y pérdida de peso y elevación de PCR tras COVID-19 leve. En seguimiento por cuadro polimiálgico como presentación de entesopatía HLAB27+. MIP (A) que muestra incremento difuso de la captación intestinal que se atribuye al tratamiento con antidiabéticos orales y leve captación hiliar bilateral y de la aorta torácica. Cortes axiales (B) y sagitales (C) de TC y PET que muestran incremento de la captación en pared de aorta, no visible en estudio previo realizado por el cuadro reumatológico (D, E).
La principal contribución de la 18F-FDG-PET/TC en nuestros pacientes post-COVID-19 con evolución desfavorable ha sido confirmar o descartar otro proceso patológico significativo que pueda justificar la clínica.
Cambios en la imagen PET/TC inducidos por la vacunación frente al SARS-CoV-2La vacunación de la población general se inició en diciembre del 2020 y el 28 de enero del 2021 ya se publicaba el primer caso de captación deltoidea en estudio 18F-FDG-PET/TC, en relación con el punto de administración, y adenopatías axilares ipsilaterales reactivas, alertando del potencial artefacto que la inmunización masiva podría tener en la interpretación de los estudios de imagen83. Posteriormente, un análisis realizado sobre 728 pacientes reveló la presencia de adenopatías hipermetabólicas en un 36,4% de los pacientes que habían recibido una sola dosis de la vacuna Pfizer-BioNTech (BNT162b2) y en un 53,9% de los que habían completado la pauta. En la mayoría de los casos, los ganglios no mostraban tamaño patológico (86%) y se localizaban en el nivel I axilar ipsilateral al punto de inyección (99%), aunque también se detectaron ganglios en niveles axilares II y III e interpectorales y, con menor frecuencia, supraclaviculares. A pesar de la experiencia en la lectura de estudios PET/TC, hasta en un 14,8% de los casos la interpretación de estos ganglios puede no ser concluyente84.
Hasta la fecha se ha publicado solo un caso de respuesta inflamatoria sistémica tras la vacuna Moderna mRNA-1273, visualizada con 18F-FDG-PET/TC, en el que se demuestra, además de la captación deltoidea y ganglionar axilar ipsilateral, un aumento difuso del metabolismo glicídico esplénico85.
Se ha encontrado una relación inversamente proporcional entre la edad y la existencia de inmunocompromiso o patología hematológica y la presencia de estos ganglios. Así, entre pacientes inmunocomprometidos, el porcentaje de captación ganglionar se reduce a un 33%86. Estos son factores sobre los que no se puede actuar, pero también se ha demostrado una relación inversa entre la intensidad de la captación ganglionar y el tiempo transcurrido desde la vacunación. Por ello, para minimizar la posibilidad de artefactos en la interpretación ganglionar, se han propuesto ventanas temporales a considerar para la planificación los estudios de imagen. Se sugiere un periodo de cinco días desde la primera dosis de la vacuna, en el que la probabilidad de captación ganglionar sería baja y, posteriormente, a partir de las dos a tres semanas desde la primera o segunda dosis, siendo preferible dejar pasar cuatro a seis semanas84,87. Aun así, se ha descrito persistencia de captación ganglionar hasta en un 29% de los casos entre las siete y 10 semanas posvacunación88. Además del factor tiempo, en aquellos pacientes oncológicos cuyos tumores muestren lateralidad (cáncer de mama, melanoma, sarcoma, tumores de cabeza y cuello y pulmón, entre otros) resulta obviamente beneficioso vacunar en el brazo contralateral al teórico territorio de drenaje del tumor. Y, por supuesto, el acceso a la información sobre la fecha y lugar de la vacuna contribuye a una mejor interpretación de los hallazgos. En caso de que persista incertidumbre, la realización de una ecografía axilar transcurridas cuatro semanas desde el estudio PET/TC puede contribuir a la caracterización ganglionar89.
Por último, no solo los estudios PET/TC con 18F-FDG muestran ganglios axilares hipermetabólicos. Hasta el 50% de los estudios con 68Ga-DOTATATE resultan positivos a nivel axilar y, con mucha menor frecuencia, con 11C-colina, 18F o 68Ga-PSMA y 18F-DOPA86,90 (fig. 5).
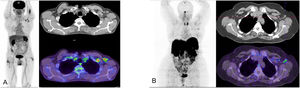
(A) Estudio PET/TC con 18F-FDG en paciente receptor de la primera dosis de vaxzevria cinco días antes. La imagen MIP muestra captación focal en el área de inyección en brazo izquierdo y adenopatías axilares ipsilaterales que se localizan en niveles I y II en los cortes axiales de TC y PET/TC. (B) Estudio PET/TC con 68Ga-edotreotide (Somakit-TOC) en paciente receptora de segunda dosis de vaxzevria 15 días antes. La imagen MIP muestra captación en axila izquierda que se corresponde con adenopatías de nivel I axilar izquierdo, visibles en los cortes axiales de TC y PET/TC.
La infección por SARS-CoV-2 es un proceso sistémico que va más allá de la afectación del tracto respiratorio. Las complicaciones y secuelas de la COVID-19 son muy variadas y cada vez más numerosas, y se requiere un abordaje multidisciplinar de los pacientes tanto en el momento agudo como en el estado post-COVID-19.
El papel de la 18F-FDG-PET/TC en el momento agudo se ve limitado por el riesgo de exposición al virus que supone realizar estudios prolongados en pacientes con carga viral. No obstante, en esta fase puede aportar información fundamental en el estudio de complicaciones asociadas, como la endocarditis infecciosa.
En el estado post-COVID-19 es pronto para extraer conclusiones, pero el estudio con 18F-FDG-PET/TC puede ser una herramienta útil para detectar o descartar procesos concomitantes graves. Las alteraciones del metabolismo cerebral objetivadas mediante esta técnica pueden ser un marcador del proceso sistémico.
Por último, en los próximos meses vamos a convivir con la respuesta inmunológica local provocada por la vacuna, por lo que será fundamental conocer los antecedentes de cada paciente en cuanto a fecha y lugar de inyección para programar e interpretar adecuadamente los estudios 18F-FDG-PET/TC.
FinanciaciónNo hay fuente de financación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.