El envejecimiento del sistema inmune o «inmunosenescencia» afecta a la respuesta inmune viral en el adulto mayor, sobre todo si existe fragilidad. Algunos hallazgos destacan un desbalance en los mecanismos pro- y antiinflamatorios, una menor producción y diversificación de linfocitos T, alteración de la inmunovigilancia y en la síntesis de anticuerpos ante la inmunización. En este contexto, la nutrición cobra gran importancia al combatir la sarcopenia y la fragilidad. Algunos componentes alimentarios que contribuyen en la inmunocompetencia son las proteínas, la vitamina D, los ácidos grasos n-3, las vitaminas antioxidantes (vitaminas C y E), el cinc, el selenio y el hierro. En tiempos de pandemia, las recomendaciones nutricionales que apunten a la inmunocompetencia en el adulto mayor deben basarse en estudios clínicos. En este artículo se abordan la inmunosenescencia y su relación con la nutrición, incluyendo intervenciones estudiadas en el contexto de la pandemia por COVID-19.
Aging of the immune system, or immunosenescence, alters the viral immune response in the elderly, especially when frailty exists. Research findings have demonstrated an imbalance in pro- and anti-inflammatory mechanisms, reduced production and diversification of T lymphocytes, and an alteration in immunovigilance and antibody synthesis. In this context, nutrition has a role in combating sarcopenia and frailty. Some food components that contribute to immune-competence are protein, vitamin D, n-3 fatty acids, antioxidant vitamins (vitamins C and E), zinc, selenium and iron. In times of a pandemic, nutritional recommendations for immune-competence in the elderly should be based on clinical studies. In this article, immunosenescence and its relationship to nutrition are addressed, including interventions studied in the context of the COVID-19 pandemic.
Los virus causan patologías frecuentes en los adultos mayores (AM). En la pandemia por coronavirus se han producido más muertes en los AM con comorbilidades asociadas al envejecimiento, que afecta la inmunidad1–3. Un sistema inmune envejecido se vincula a menor capacidad de respuesta, pero la «inmunosenescencia» se relacionaría más bien con la alteración de la regulación de la inmunidad, al existir también una respuesta inflamatoria exacerbada. Entre las alteraciones inmunes del AM destacan la involución del timo, el remodelamiento y menor recuento linfocitario, la alteración en la activación de linfocitos B y T, la menor síntesis de anticuerpos por los linfocitos B y los cambios en el patrón de secreción de citoquinas, junto a la mayor producción de agentes proinflamatorios que, en conjunto, generan mayor susceptibilidad a enfermedades virales4–6.
En la presente revisión se describen las principales alteraciones inmunológicas asociadas al envejecimiento, con énfasis en la respuesta inmune viral, destacando la participación de la nutrición en la capacidad inmune.
Inmunidad celular y humoralLos AM son más susceptibles a las infecciones. Aunque no se conocen todos los mecanismos subyacentes, estudios en modelos animales responsabilizan a una respuesta inmune exagerada5 mediada por agentes proinflamatorios6-9, generando un fenotipo de inmunosenescencia, por la pérdida del balance entre los mecanismos pro- y antiinflamatorios, que cursa con inflamación sistémica de bajo grado, crónica y asintomática10. La inflamación es una característica del envejecimiento y se vincula con enfermedades crónicas, lo que es favorecido por la estimulación antigénica y por procesos de estrés oxidativo mantenidos que alteran los mecanismos de reparación. Concomitantemente, hay menor expresión de agentes antiinflamatorios (tales como interleucina-4 (IL-4) e IL-10) y factor neurotrófico derivado del cerebro, asociados a trastornos linfoproliferativos, entre otros7–9. El balance pro-/ antiinflamatorio puede determinar la velocidad de envejecimiento y dar cuenta de la longevidad11.
El estado inflamatorio, en el que contribuye la elevación de citoquinas proinflamatorias, tales como la IL-6, y el factor de necrosis tumoral-α, es potenciado por las células natural killer (NK) mediante la secreción de IL-17, que promueve la migración de células efectoras innatas hacia los sitos de inflamación12,13. Esta situación, sumada a una menor respuesta de interferón-α por las células dendríticas plasmocitoides, genera una eliminación viral deficiente. Estas células secretan menos interferón-i (estimulador de la capacidad citotóxica de células CD8 y NK, y de la regulación de la secreción de interferón-γ por CD4 y CD8) e interferón-iii (defensa contra infecciones virales en mucosas respiratorias), como resultado de una fosforilación alterada del factor de transcripción IRF-7 (interferon regulatory factor-7) asociada al envejecimiento14, con menor capacidad de inducir perforinas y granzimas en CD8.
El envejecimiento altera especialmente la respuesta inmune adaptativa. Los linfocitos T son los más afectados, en su capacidad de autorrenovarse, diversificarse y controlar su quiescencia15. Los AM presentan más CD8 maduros, lo que podría asociarse al mantenimiento de la inmunovigilancia sobre infecciones virales persistentes15. Al exponer ratones jóvenes y viejos a un péptido viral, se observó menor proliferación de CD8 en ratones viejos, con una expresión retardada de marcadores de activación (CD69, CD25 y CD44)16,17. En el envejecimiento aumentan las células T de memoria con fenotipo naïve, subtipo de CD8, que secretan citoquinas efectoras en respuesta a los antígenos virales persistentes18. La investigación en esta línea celular es reciente, y podría dar origen a inmunoterapias antivirales.
La respuesta inmune humoral tras la vacunación es inferior en los AM, con diferencias según el componente inmunitario. En ratones viejos inmunizados con nucleoproteína del virus influenza, los CD4 tendieron a diferenciarse en linfocitos T helper foliculares y no helper 1, afectando la respuesta, ya que participan en la eliminación viral7. Jóvenes y AM que recibieron 2 dosis consecutivas de vacunación antiinfluenza, no mostraron diferencias en los promedios de células B, probablemente por la proliferación secundaria a vacunaciones repetidas, pero la capacidad de síntesis de anticuerpos y diferenciación en células plasmáticas estaba disminuida en AM19. Al analizar el impacto del envejecimiento del receptor de células B en la inmunización por vacuna antiinfluenza, los AM mostraron menos linfocitos naïve y diversificación intralinaje, con menor respuesta inmune20. Recientemente, Márquez et al.21 evidenciaron una diferenciación según sexo, observando que después de 65 años los hombres presentan mayor actividad proinflamatoria y de inmunidad innata y menor actividad adaptativa, lo que explicaría el peor pronóstico de COVID-19 en edad avanzada, sexo masculino y fragilidad.
Los AM frágiles son sedentarios, dependientes, tienen poca fuerza, tienden a sufrir fracturas, se hospitalizan y mueren más22, a lo que contribuye la pérdida de masa y fuerza muscular. El síndrome de fragilidad genera mayor vulnerabilidad y menor capacidad de recuperar la homeostasis, manteniendo el bienestar y la capacidad física, especialmente frente a un estresor como una patología aguda23. Es afectada por la interacción de las funciones cerebral, inmune, endocrina y muscular, generando en conjunto una menor respuesta inmune23 que cursa con un estado inflamatorio, con sobreproducción de citoquinas proinflamatorias, lo que se asocia a mayor morbimortalidad24. Las citoquinas proinflamatorias y de fase aguda en AM frágiles hacen considerar la inflamación sistémica en su fisiopatología, generando reducción de la funcionalidad, parte esencial de la fragilidad25. Existe una asociación entre fragilidad y niveles elevados de IL-6 y adiponectina, y una correlación inversa con la función y capacidad física26, y otros agentes proinflamatorios, como proteína C-reactiva, también se asocian a mayor mortalidad de AM frágiles27.
Los pacientes con COVID-19 presentan niveles muy altos de citoquinas proinflamatorias, factor de crecimiento básico de fibroblastos-2, factor estimulante de colonias de granulocitos, factor estimulante de colonias de granulocitos y macrófagos, interferón-γ, proteína 10 inducida por interferón-γ, proteína quimioatrayente de monocitos 1, proteína inflamatoria de macrófagos 1-α, proteína inflamatoria de macrófagos 1-β, subunidad B del factor de crecimiento derivado de plaquetas, factor de necrosis tumoral-α y factor de crecimiento endotelial vascular, los cuales elevan la severidad28. Las estadísticas de defunciones de pacientes con COVID-19 muestran que los AM fallecidos presentaban menos CD4 y CD8 y un alto nivel de marcadores de inflamación, con más trastornos de coagulación, daño cardíaco e infecciones bacterianas. Los pacientes críticos presentaron niveles mayores de proteína C-reactiva, IL-6, troponina i sensible, β2-macroglobulina y dímero D (que favorece la coagulación). Al progresar la enfermedad, se reducen los niveles de CD3, CD4 y CD8, con una correlación positiva entre procalcitonina y algunos de estos parámetros (proteína C-reactiva e IL-6)29. Se ha observado que los niveles de procalcitonina son extremadamente altos el día de la muerte de pacientes con COVID-19, lo que indica una alta incidencia de coinfección bacteriana en pacientes graves29.
Fragilidad, respuesta inmune y sistema neuroendocrinoLos sistemas nervioso, endocrino e inmune se encuentran intercomunicados. El envejecimiento y el estrés afectan sinérgicamente el eje neuroendocrino-inmunológico, causando inmunosupresión30. El estrés psíquico crónico es un factor de vulnerabilidad31, y uno de los parámetros asociados a la respuesta inmune es el elevado nivel de cortisol, que también puede afectar la menor respuesta del AM a la vacunación. En los AM con trastornos depresivos se produce una respuesta amplificada y prolongada, con mayor secreción de IL-6 hasta 2 semanas postinmunización antiinfluenza, comparados con AM con menor o ningún grado de depresión32. Se ha señalado que, en presencia de trastornos depresivos, se reduce la población de células NK y aumentan las células T de memoria, T helper y Th17, mediadoras de inflamación, creando un estado de inmunosenescencia33.
Nutrición e inmunocompetenciaLa alimentación es un determinante de la respuesta a la enfermedad, al afectar la expresión de genes y las vías metabólicas34. Los compuestos ingeridos actúan como mediadores celulares y definen en gran medida cómo se envejece35. Una nutrición adecuada puede conducir a un envejecimiento con mayor y mejor resistencia a fragilidad, enfermedad y muerte. La deficiencia de nutrientes puede relacionarse con las dificultades del AM para ingerir alimentos y la sarcopenia36, factor de riesgo de fragilidad, con la consecuente incapacidad de respuesta al estrés.
A continuación, se sintetiza el rol de algunos componentes alimentarios sobre la inmunocompetencia.
ProteínasEn el envejecimiento, la pérdida de masa muscular y aumento de tejido adiposo origina mioesteatosis37. Para mantener la independencia, evitando la pérdida de masa muscular, se requiere una ingesta proteica adecuada. El AM tiene mayor requerimiento proteico, en relación con la insulinorresistencia, la inflamación, la reducción de los niveles de factor de crecimiento insulínico tipo-138, y la respuesta a la proteína ingerida no es adecuada debido a una resistencia a la síntesis de nueva proteína muscular o menor capacidad para utilizarla.
Vitamina D (colecalciferol)Se obtiene de alimentos y se sintetiza en la piel por la radiación ultravioleta, para formar en el hígado la 25-hidroxivitamina D [25(OH) D], que define su estado nutricional. Posteriormente se forma la 1,25(OH) 2D (calcitriol), que se une a elementos de respuesta en regiones promotoras de genes específicos, incluyendo algunos de la inflamación, reprimiendo su inducción39. Se le considera un inmunonutriente a través de múltiples mecanismos40. En infecciones virales mantiene la homeostasis, al aumentar la expresión de genes codificantes de enzimas antioxidantes, formar una barrera física y mejorar la inmunidad celular innata y adaptativa41. En el caso de la inmunidad celular innata, induce la producción de péptidos (catelicidina y defensinas) de acción antibacteriana y antiviral42. Esta vitamina puede reducir la producción de citoquinas proinflamatorias y algunos tipos de interferón, incrementando las antiinflamatorias43. Aunque se han realizado revisiones sistemáticas con metaanálisis de estudios retrospectivos de severidad de COVID-19 y los niveles de la vitamina en diferentes países, la evidencia es insuficiente para considerarla efectiva en la prevención y tratamiento de COVID-1944. Sin embargo, la mayoría de los AM presenta valores bajos, por lo que la suplementación puede ser recomendable en este grupo. Los suplementos de vitamina D, para elevar los niveles de 25(OH) D45 en pacientes con COVID-19, puede ser útil considerando que la deficiencia podría contribuir a la severidad del cuadro clínico al potenciar la «tormenta de citoquinas» asociada.
Ácidos grasos n-3Los ácidos grasos poliinsaturados (AGPI) de 20 carbonos, araquidónico (ARA, 20:4n-6) y eicosapentaenoico (EPA, 20:5n-3), originan eicosanoides que participan directamente en el proceso inflamatorio. Estos son generados a partir de los AGPI liberados desde membranas, metabolizados por ciclooxigenasas, lipooxigenasas y monooxigenasas CYP450. Asimismo, a partir del AGPI de 22C, docosahexaenoico (DHA, 22:6n-3) se generan docosanoides por vías metabólicas semejantes. Los metabolitos generados (eicosanoides, resolvinas, maresinas y protectinas) son mediadores prorresolución de la inflamación, que modulan la intensidad y la duración de la respuesta inflamatoria46 y contribuyen a restituir la homeostasis9. Además, afectan la expresión de genes que actúan sobre el crecimiento y la estructura muscular, contribuyendo a reducir la fragilidad47. La dieta occidental actual contiene cantidades muy superiores de AGPIn-6 (alta disponibilidad de ARA), predominando sus metabolitos proinflamatorios, que aumentan la permeabilidad endotelial y actividad quimiotáctica de leucocitos, en lugar de aquellos n-3 provenientes de EPA y DHA, cuya principal fuente son los alimentos de origen marino, que promueven la síntesis de metabolitos antiinflamatorios y que resuelven la inflamación, como las resolvinas D y E48, con acción protectora de infecciones bacterianas y virales. Estos AGPIn-3 modulan los dominios lipídicos de membranas, inhiben receptores Toll-like y la activación del factor nuclear potenciador de las cadenas kappa de células B activadas (NF-kB), suprimen la presentación de antígenos a CD4, la formación de sinapsis inmunológica, la secreción de citoquinas y activación de células T helper46. Estas propiedades se complementan con una acción directa sobre el inflamasoma49, aunque su efectividad en la protección contra virus es aún controversial50. En todas las situaciones, EPA y DHA contribuyen a contrarrestar la situación inflamatoria. Actualmente se estudia el uso de formulaciones parenterales con EPA y DHA como coadyuvantes de la fármaco-inmunoterapia en el manejo clínico de los pacientes COVID-1951.
Vitaminas antioxidantesEn la respuesta inflamatoria se generan agentes prooxidantes, como las especies reactivas de oxígeno (ERO), frente a la exposición a péptidos o lipopolisacáridos microbianos. Las ERO son mediadoras de la inflamación y dañan la célula, oxidan los AGPI, afectan factores de transcripción como NF-kB, e inducen la generación de eicosanoides y citoquinas proinflamatorias52. A continuación, se describe brevemente el rol de algunos antioxidantes exógenos en el funcionamiento del sistema inmune.
Vitamina CEjerce numerosas acciones inmunomoduladoras, incluyendo la mantención de la integridad de las barreras epiteliales53. Por su alto poder reductor, es un antioxidante y regenera al α-tocoferol y al glutatión, con los que actúa conjuntamente, protegiendo los lípidos de membrana, plasma y lipoproteínas. Actúa sobre la capacidad inmune involucrando la actividad de células NK, la proliferación de linfocitos, la fagocitosis, la quimiotaxis, la migración de neutrófilos y la hipersensibilidad retardada, y en presencia de infección inhibe la generación de ERO, evitando el daño proteolítico en el sitio de la inflamación53.
Vitamina EMezcla de tocoferoles y tocotrienoles que rompen las reacciones en cadena del proceso oxidativo, previniendo la oxidación de los AGPI. Afecta la inmunidad celular y humoral, aumentando la proliferación linfocítica, niveles de inmunoglobulinas, respuestas antigénicas, actividad de células NK y producción de IL-2. Su efecto más reconocido es la reducción de citoquinas proinflamatorias, relevante en infección viral54.
CincSu deficiencia es frecuente, debido a que las principales fuentes son mariscos y carnes, que los AM no consumen con frecuencia, comprometiendo su inmunidad innata y adaptativa. La deficiencia aumenta la susceptibilidad al estrés oxidativo, favorece la producción de citoquinas proinflamatorias y la linfopenia, reduciendo también la actividad de células NK55. Su exceso produce efectos deletéreos comparables con los de su déficit, por lo que es importante el mantenimiento de niveles adecuados56.
SelenioEn ratones deficientes se observa mayor inflamación en infecciones virales, hecho asociado a mayor estrés oxidativo, y al no ser capaces de producir selenoproteínas, como glutatión peroxidasa antiviral, los virus mutan a formas más virulentas57. Zhang et al.58 observaron una asociación entre la recuperación de COVID-19 y el contenido de selenio en el cabello de pacientes de diferentes zonas de China. Así, se plantea la posible protección del selenio en la función inmune ante la infección viral causante de la pandemia: la deficiencia impacta la respuesta inmune, y hace más virulento al agente causante del estrés oxidativo.
HierroEs esencial para el crecimiento, proliferación y diferenciación de las células inmunes, y su deficiencia afecta especialmente la inmunidad celular59. En infección se reducen sus niveles circulantes (hipoferremia) mientras aumentan los depósitos (hiperferritinemia), disminuyendo su disponibilidad para los patógenos. La consecuencia es una «anemia inflamatoria»60, frecuente en poblaciones con alta carga de infecciones. Su suplementación dietética como medida preventiva ante la infección por SARS-CoV-2 es controversial, ya que puede exacerbar la inflamación y reducir la captación intestinal del mineral por generación de hepcidina, pudiendo ser utilizado por el virus para su replicación en macrófagos, hepatocitos y enterocitos61. En casos de anemia, se prefieren las fórmulas intravenosas de hierro a las orales, para prevenir la expresión de hepcidina enteral, con la consecuente inflamación. Asimismo, en pacientes críticos COVID-19 es necesario considerar la tendencia a trombosis a nivel individual antes de administrar agentes eritropoyéticos, mitigando con anticoagulantes62.
Los casos descritos sucintamente ejemplifican la importancia de los nutrientes en la prevención de la inmunosenescencia63. La dieta aporta además numerosos otros constituyentes que pueden mejorar la inmunidad, como es el caso de compuestos fenólicos, carotenoides, prebióticos, probióticos, entre otros bioactivos. A modo de ejemplo, los compuestos fenólicos son fitoquímicos entre cuyas acciones destacan las antioxidantes y antiinflamatorias. Sus mecanismos de acción incluyen la modulación de vías de señalización y actividad de enzimas que participan en la inflamación, como tirosina y serina-treonina proteincinasas, inhiben el NFκB, la óxido nitroso sintasa, la ciclooxigenasa-2, proteincinasa activada por mitógenos y proteincinasa-C, reducen las citoquinas proinflamatorias y aumentan las antiiinflamatorias. Como antioxidantes, captan radicales libres y ERO, e inducen la expresión de enzimas endógenas antioxidantes. Al tener muy baja biodisponibilidad, permanecen en el colon, donde actúan como prebióticos, modificando favorablemente la microbiota intestinal64.
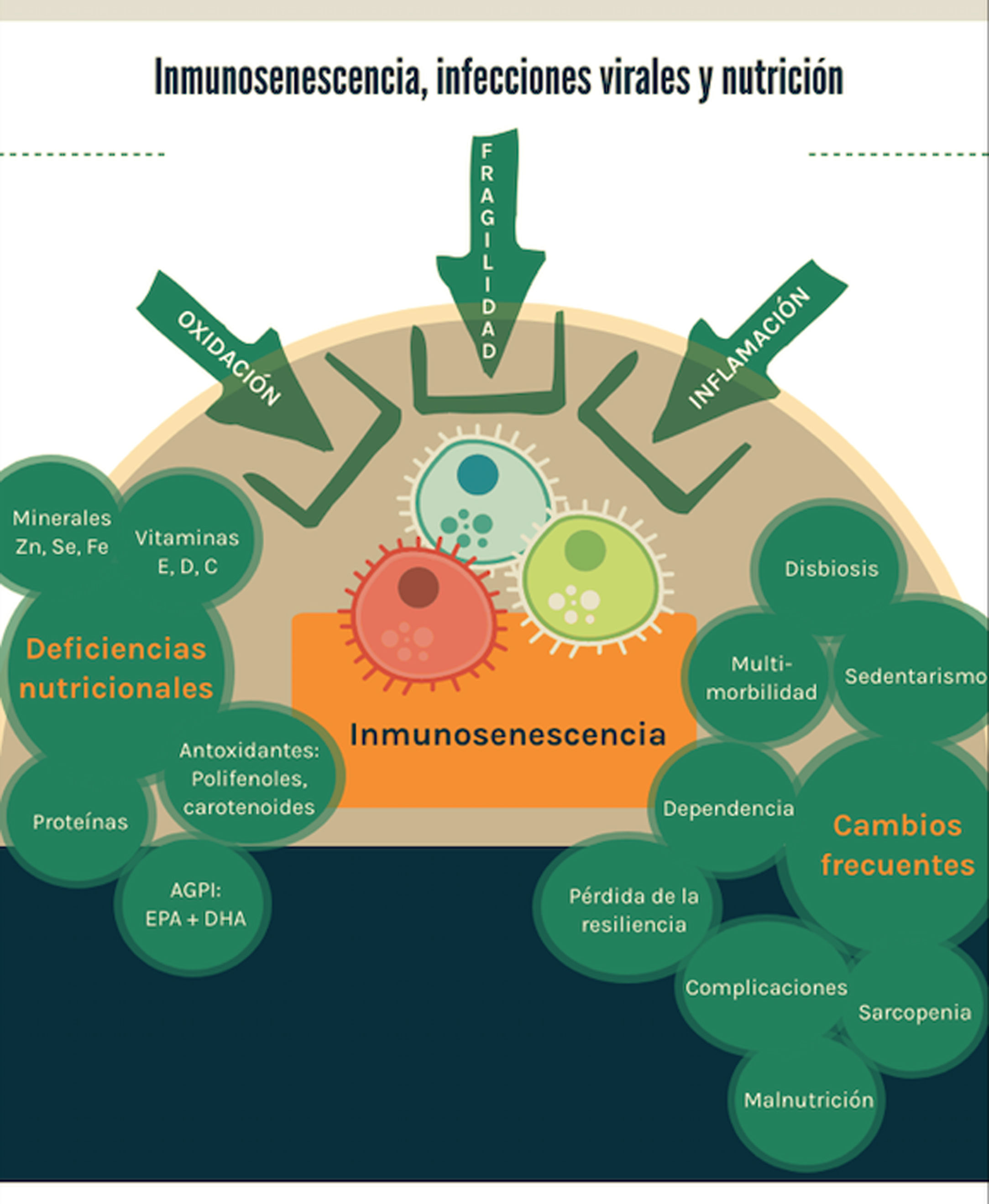
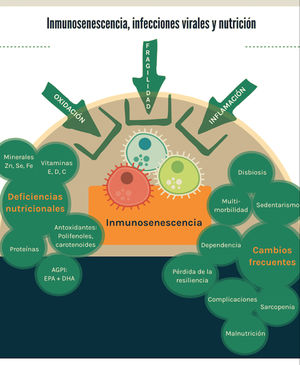
Finalmente, en la figura 1 se esquematizan los principales resultados de esta revisión.
Los principales factores que contribuyen a la inmunosenescencia son la fragilidad, la inflamación y la oxidación. Desde la perspectiva de la nutrición basada en evidencia, existen deficiencias nutricionales con evidencia preclínica y clínica que aportan al fenómeno, así como características frecuentemente observadas en los adultos mayores que constituyen factores de riesgo para las infecciones virales.
En tiempos de pandemia, el mercado ofrece múltiples productos (suplementos) con eventual efecto inmunopotenciador; sin embargo, la nutrición basada en evidencia exige una revisión del estado del arte en el tema. La recomendación actual más efectiva es una alimentación saludable mantenida en el tiempo, que contribuye a retardar la fragilidad y la inmunosenescencia.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.