REVISION
Inmunopatogenia del envejecimiento: el deterioro de la inmunidad innata y su repercusión sobre la inmunidad específica. Restauración por AM3
Villarrubia, V. G. y Navarro, S. R.
Departamento de Inmunología, I. F. Cantabria. Madrid. España.
Correspondencia:
Vicente G. Villarrubia. Cornisa 11, 1º A.
28230 Las Rozas.
Madrid.
E-mail: ifc@ifc.
Recibido el 22-7-99;
aceptado el 15-12-99.
RESUMEN
En este artículo se discuten parte de los acontecimientos inmunológicos que suceden como consecuencia del proceso fisiológico de envejecimiento. Estos hechos se contemplan como un disbalance, a favor del segundo, entre los mecanismos de inmunidad específica celular (coordinados por linfocitos Th1) y los de inmunidad específica humoral (dirigidos por linfocitos Th2). Desde el punto de vista del autor, en este disbalance juegan un papel esencial tanto las alteraciones de las células dendríticas presentadoras de antígenos (CPA) como los trastornos que suceden en el denominado entorno de la presentación antigénica, en el que macrófagos y células NK (inmunidad natural o innata), y sus citoquinas relacionadas, IL-12 e IFN-*, tienen especial importancia. La traducción clínica de estas alteraciones se manifiesta por una exquisita sensibilidad de los ancianos a las infecciones, sobre todo aquellas provocadas por patógenos intracelulares. De igual manera, estas alteraciones explican el por qué de la menor respuesta de los ancianos a las vacunas dirigidas contra estos gérmenes. Curiosamente, estos trastornos de la inmunidad innata se manifiestan de forma aguda en edades medio-avanzadas ( ~ 60 años), tendiendo a desaparecer en los centenarios. Para finalizar, se contemplan algunos aspectos terapéuticos en base a la capacidad de AM3 (un inmunomodulador) para revertir algunos de los defectos que acontecen en el entorno celular y molecular de la presentación antigénica. En este sentido, se muestra la capacidad del fármaco para restaurar las actividades de macrófagos y células NK.
Palabras clave
Vejez. Respuestas Th1 y Th2. Inmunidad natural o innata. Inmunomodulación. AM3.
Immunophysiopathology of the elderly: The alterations of the innate immunity and their repercusions on specific immunity. Restoration with AM3
SUMMARY
In this article the authors update on the immunologic disturbances related to the ageing process. These alterations are seen as a consequence of a disbalance between Th1 and Th2 immune responses. Moreover, alterations in antigen-presenting cells (APC), as well as in natural immune mechanisms mediated by macrophages and NK cells and their related cytokines (IL-12 and IFN-*) (environment of the antigen presentation), appear to be the responsible for these disturbances. These immune alterations are clinically manifested by an increased susceptibility to the parasitation of intracellular pathogens and by low responses to vaccination against these and other germs. Finally, a new therapeutic approach with AM3 (a natural immunomodulator able to reverse some of these immune alterations) is discussed.
Key words
Aging. Th1 and Th2 responses. Natural immunology. Immunomodulation, AM3.
INTRODUCCION
En el año 1986 publicamos una de las primeras experiencias sobre la baja actividad citotóxica de macrófagos peritoneales y de células «natural killer» (NK) esplénicas en ratones viejos, así como la reversión de estos fenómenos tras el tratamiento con un inmunomodulador: AM3 (1). El motivo de este estudio inmunológico estuvo basado en experiencias básicas previas que mostraban cómo los animales viejos eran menos resistentes que los animales jóvenes al desarrollo metastático de un hepatocarcinoma experimental (2), experiencias que fueron ampliadas en estudios posteriores (3, 4). Desde entonces hasta ahora, el estudio de los fenómenos inmunológicos que acontecen como consecuencia de la vejez ha sido una parte importante tanto en la Inmunología como en la moderna Gerontología. A estos nuevos acontecimientos les dedicamos hace dos años una extensa revisión (5).
En estos últimos dos años, la «sorprendente revelación» sobre las nuevas pirámides de población, junto a la eclosión de datos referidos al tema que nos ocupa, han hecho que estemos asistiendo a la proliferación de reuniones científicas dedicadas al estudio de la inmunidad en la vejez. Por ello, el objeto del presente trabajo es el de analizar aquellas características inmunológicas que puedan ayudarnos a definir un fenotipo inmunosenescente de la manera más correcta posible, y que este fenotipo nos sirva a la hora de iniciar tratamientos encaminados a paliar algunos de los defectos inmunológicos que caracterizan a algunos ancianos, sobre todo aquellos procesos que se traducen clínicamente por un menor estado de resistencia antiinfecciosa.
VEJEZ E INMUNOLOGIA
Como ha sido recientemente publicado, la población de ancianos es cada vez mas vieja (6). En España, el 14,2% de la población actual supera la edad de 65 años y se prevé que suba hasta el 15% en el año 2000 (7). Estos últimos datos, que son similares a los observados en otros países occidentales, demuestran definitivamente que la población anciana es cada vez mas vieja, sin que de esta tendencia escapen otras naciones (China y otros países asiáticos) en los que las pirámides de población tienden a parecerse cada vez más a las occidentales (8).
Debe de resultar obvio que la vejez no sería un problema si no fuera acompañada de trastornos discapacitantes, y de una cierta tendencia a la aparición de enfermedades crónicas que merman la salud: fundamentalmente cáncer y enfermedades infecciosas, cuyas relaciones con el sistema inmunológico son mas que conocidas. En lo que concierne a la mayor incidencia de cáncer en los individuos de edad avanzada, los hechos no están nada claros, no existiendo datos científicos y epidemiológicos contundentes que comprueben esta suposición (9).
En relación a una mayor incidencia de enfermedades infecciosas durante la vejez, los resultados son igualmente controvertidos, aunque se acepta que con la senescencia se incrementan la susceptibilidad y gravedad de ciertas enfermedades virales y bacterianas (9-11), lo que sin duda se traduce por un riesgo mayor de muerte cuando la infección acontece (11, 12). En este sentido, se sabe que entre 50.000 y 70.000 adultos mueren cada año en EE. UU. por infección pneumocócica, gripe o hepatitis B, procesos que se supone se verían reducidos mediante el uso de vacunas dirigidas contra dichos gérmenes (12). Aunque es evidente que el número de vacunaciones en adultos es muy bajo en relación a los niños, también es cierto que los viejos son peores respondedores a la vacunación (5, 12). Estas pobres respuestas a las vacunas están también relacionadas con la peor capacidad del anciano para responder frente a las infecciones naturales (5), lo que ya claramente sugiere que la inmunidad frente a determinados patógenos se encuentra comprometida en la vejez (5, 9-12).
Por estos y otros hechos, actualmente se considera que el estudio del sistema inmunológico suministra una información crucial sobre los mecanismos básicos que operan en los procesos de senescencia, y el estudio de la inmunidad constituye por tanto una pieza de investigación básica en la moderna Gerontología. Los resultados que se derivan de este conocimiento intentan ser aplicados por los geriatras en la prevención y tratamiento de enfermedades infecciosas, y potencialmente cáncer, en el individuo anciano.
Desgraciadamente, las cosas no son tan fáciles, siendo difícil encontrar un patrón único y universal que defina inmunológicamente al anciano (5, 13). Esta dificultad viene dada en gran parte por la reconocida heterogeneidad fisiológica de los sujetos, en los que la edad fisiológica puede no corresponderse con la edad cronológica. Además, otros factores tales como la diferente exposición ambiental, el diferente estado nutricional (14, 15) y psicológico (16), etc, contribuyen notablemente a que la definición inmunológica de sujeto anciano no pueda ser definitivamente aplicada a cualquier sujeto mayor de 70 años. En este sentido, la reciente demostración del «bienestar inmunológico» de los individuos centenarios (17, 18) es una prueba más que evidente de la dificultad para definir un fenotipo inmunosenescente universal. En cualquier caso, en este artículo trataremos de resumir algunas de las características inmunológicas que, por más frecuentes, pueden servirnos para aproximarnos al conocimiento de la inmunosenescencia.
INMUNOPATOGENIA DEL ENVEJECIMIENTO
Antes de comenzar con la descripción de las alteraciones que acontecen en la vejez, conviene precisar que se excluyen de las mismas a los individuos centenarios, por presentar éstos una condición especial a la que anteriormente hemos definido como de «bienestar inmunológico» (Para una información más completa sobre los mismos, ver refs. 17 y 18). Por ello, en este estudio hablaremos fundamentalmente de la edad medio-avanzada, que comprendería a aquellos sujetos con edades próximas a los 60 años, por ser esta la edad en la que, sin saber todavía por qué, las alteraciones inmunológicas son más evidentes. Curiosamente, existe la sensación de que es durante esta época de la vida cuando tiene lugar la mayor incidencia de tumores, que además manifiestan una especial gravedad.
Alteraciones de la inmunidad específica humoral
Las primeras observaciones sobre cambios inmunológicos relacionados con la edad (tabla I) datan de los años treinta, durante los cuales se puso de manifiesto la menor capacidad de los viejos para producir nuevos anticuerpos (neo-Ac) frente a antígenos extraños (10). Posteriormente se vio que no todos los Ac disminuían con la edad, y que un exceso en la producción de auto-Ac y de inmunoglobulinas monoclonales era lo que contribuía a mantener normales los niveles de inmunoglobulinas séricas en el anciano (10). Este exceso en la producción de inmunoglobulinas (Igs) monoclonales llevó a la definición del cuadro conocido como «gammapatía monoclonal benigna», que sigue siendo una de las alteraciones mas reconocidas en la vejez (19).
Tabla I. Características inmunológicas de la vejez. I. Alteraciones de la inmunidad específica humoral. | |
| Alteraciones inmunológicas | Repercusiones clínicas |
| êProducción de Neo-Ac | ê Resistencia antiinfecciosa |
| (subpoblación BCD5-) | ê Respuesta a las vacunas |
| Los Neo-Ac son de baja afinidad | ê Protección vacunal |
| èProducción de Auto-Ac | ¿Tendencia a la autoagresión? |
| (subpoblación BCD5+) | |
| èProducción de Igs monoclonales | Gammapatía monoclonal benigna |
| ¿Transformación maligna a mieloma? | |
| èProliferación linfocitaria B maligna | Linfomas MALT |
| Ac: anticuerpos; BCD5 - y BCD5+: diferentes subpoblaciones de linfocitos B; Igs: inmunoglobulinas. MALT: «Mucose-Associated Lymphoid Tissue». | |
Más recientemente, se ha sugerido que estos trastornos en la producción de Ac en la vejez se deben a incrementos en la actividad de una subpoblación de linfocitos B responsable de la producción de auto-Ac (BCD5 +), en detrimento de otra (BCD5 -) productora de neo-Ac (20) (tabla I). Actualmente, sin embargo, se considera que el declive en la capacidad para formar neo-Ac no reside tanto en trastornos intrínsecos de los linfocitos B como en aquellos que acontecen en los linfocitos T «helper» (Th), que colaboran con las células B en la producción de Ac. De esta manera (ver más adelante), se han descrito alteraciones en la expresión de algunas moléculas de coestimulación y/o sus ligandos, cual sucede con la glicoproteína CD40L en los linfocitos T y la proteína B7-2 en las células B (13), lo que sin duda alguna dificulta el lenguaje intercelular entre linfocitos T y B. En el caso de los defectos en la expresión de B7-2, se ha sugerido que este mecanismo sería el responsable del fallo en la generación de la diversidad de Ac (hipermutación), que define a los animales mas jóvenes (21). Como veremos en el siguiente apartado, los cambios en el perfil de citoquinas que acontecen en la vejez permiten confirmar la hipótesis (5) de que durante el proceso de envejecimiento se observa una cierta preponderancia de las respuestas inmunológica de mediación humoral coordinadas por linfocitos Th2 en detrimento de las de mediación celular, las cuales son dirigidas por linfocitos Th1.
En cualquier caso, la traducción clínica de los defectos en la síntesis de neo-Ac se manifiesta fundamentalmente (tabla I) por una disminución de la respuesta antiinfecciosa y por pobres respuestas a la vacunación frente a virus (influenza y hepatitis B) (5, 12), S. pneumoniae (12) y toxoide tetánico (22), entre otras vacunas. En el caso particular de la gripe, los índices de protección adquiridos por la vacunación descienden desde el 65-80% en adultos jóvenes hasta 30-40% en los viejos (12), lo que claramente demuestra los serios defectos inmunológicos que, a nivel humoral, pero con responsabilidad celular, acontecen como consecuencia de la vejez.
Finalmente, los excesos en la producción de auto-Ac y de Igs monoclonales se han pretendido relacionar respectivamente con incrementos en la incidencia de enfermedades autoinmunes y mieloma (19) (tabla I), sin que hasta el momento existan datos convincentes que soporten esta sugerencia. Sin embargo, parece hoy claro que en determinados procesos de tipo autoinmune que acontecen en edades medio-avanzadas y en la vejez, cual así sucede en la tiroiditis de Hashimoto, existe un riesgo elevado de desarrollar linfomas de tipo B que expresan el marcador BCD5 - (23). Curiosamente, este tipo de linfomas hoy denominados como MALT («Mucose-Associated Lymphoid Tissue») en relación a su origen aparecen también bajo la forma de linfomas gástricos en sujetos de edades avanzadas con infección crónica por Helicobacter pylori, lo que claramente sugiere que en la inmunopatogenia de la enfermedad están implicados mecanismos de autorreactividad de linfocitos B tumorales, con producción de autoanticuerpos dirigidos contra estructuras propias (23) (tabla I).
Alteraciones de la inmunidad específica celular: Influencia del género (sexo)
Aunque con las lógicas excepciones, existe la opinión generalizada de que los trastornos inmunológicos más llamativos en el anciano son aquellos que interesan a los mecanismos encargados de la resistencia frente a gran parte de los patógenos intracelulares (incluidos la mayoría de los virus) y frente a los tumores: esto es, los mecanismos de inmunidad celular (5, 11-16).
Lo primero que llamó la atención fue que la proliferación de linfocitos T tendía a declinar con la edad, y que estos defectos estaban relacionados tanto con déficits en la producción de interleuquina 2 (IL-2) como con defectos en la recepción celular de la misma (tabla II). De esta manera, los sujetos ancianos no solamente producen menos IL-2 sino que existe una severa disminución de los receptores celulares para esta citoquina (12, 24, 25). Para algunos autores (12, 26, 27), estos defectos serían los responsables de la derivación de linfocitos T «naive» hacia linfocitos T memoria en la vejez. De hecho, la mayoría de las células T en adultos jóvenes son «naives» mientras que en el viejo expresan marcadores propios de las células memoria (26, 27) (tabla II). En referencia a esta situación, diversos estudios han demostrado la excesiva presencia de células T CD8+ memoria en los sujetos ancianos, bien que estas expresen el marcador fenotípico característico CD45RO+ (13) o bien el marcador CD45RA- (28). En referencia a este último marcador, que define teóricamente a las células «naive», hay que señalar que su comportamiento es el de células memoria, ya que reaccionan inmediatamente al desafío antigénico y expresan un perfil de citoquinas característico de las células preactivadas o memoria con producción concomitante, y en grandes cantidades de interferón gamma (IFN-*), interleuquina 4 (IL-4) e interleuquina (IL-10), lo que explicaría su comportamiento supresor sobre las respuestas de células T (28). Cómo veremos mas adelante, estas células representan una expansión clonal característica de la vejez que expresa el fenotipo CD8+ CD28- CD45RA- (tabla II).
| Tabla II. Características inmunológicas de la vejez. II. Alteraciones de la inmunidad específica celular. | |
| Alteraciones de la inmunidad | Repercusiones clínicas |
| êProliferación linfocitaria T | ê Tests de hipersensibilidad retardada |
| ê Producción de IL-2 | (Anergia cutánea) |
| ê Expresión de receptores para IL-2 | |
| Alteraciones de la distribución linfocitaria | ê Memoria a largo plazo frente a nuevas infecciones y/o nuevas vacunas |
| ê Linfocitos T «naive» | |
| è Linfocitos T memoria | |
| Alteraciones de la derivación linfocitaria | ê Resistencia frente a patógenos intracelulares |
| èê Producción de IFN-* | ê Eficacia vacunas frente a patógenos intracel. |
| è Producción de IL-4 e IL-10 | |
| è Derivación a Th2 en detrimento de Th1 | ¿Presencia de infecciones víricas latentes? |
| Expansión clonal de TCD4 + y TCD8 + | ¿Riesgo de malignización linfocitaria? |
| ê Apoptosis linfocitaria | |
| El género femenino y la multiparidad parecen influir en la mejor conservación inmunológica. | |
| Los hechos reseñados en cursiva han sido propuestos como indicadores de mortalidad (ver descripción en el texto). IL: interleuquinas; IFN-*: interferón gamma; Th: linfocitos T «helper». | |
Pero quizás el aspecto mas interesante en el tema que nos ocupa sea el de las posibles alteraciones en la regulación de la actividad funcional de estas células. En este sentido, se ha descrito que las células T de los ratones viejos producen mayores cantidades de citoquinas con el perfil Th2 (IL-4 e IL-10) que los jóvenes (26, 29). De igual manera, los humanos viejos producen más IL-4, IL-5 (28, 30) e IL-10 (28, 31) que los sujetos mas jóvenes. Teniendo en cuenta el papel de estas citoquinas en la derivación de las respuestas inmunológicas hacia respuestas de mediación humoral (Th2) (5, 31-33), todo ello unido al déficit en la producción de IFN-* (30, 31), se entiende que los sujetos ancianos presenten alteraciones más o menos severas en los mecanismos de resistencia frente a patógenos intracelulares, incluidos los virus (tabla II). Aunque otros autores han demostrado que los ancianos producen niveles altos de IFN-* en las células de sangre periférica (28), no cabe hoy duda que las acciones conjuntas de IL-10 e IFN-* tienden a polarizar las respuestas hacia Th2 (34), anulándose así el efecto positivo del IFN-* sobre la respuesta Th1. De igual manera, la depresión en los mecanismos Th1 sería la responsable de la menor respuesta a las vacunas dirigidas contra patógenos intracelulares, como así lo demuestra la menor capacidad del anciano para producir linfocitos T citotóxicos (LTC) y linfocitos memoria en respuesta a la vacuna de la gripe (35) y otras vacunas dirigidas contra patógenos intracelulares (5, 32, 33) (tabla II).
Finalmente, hay que destacar que nuevos datos señalan que los sujetos ancianos presentan expansiones clonales de linfocitos CD4 + y CD8 + que no aparentan representar signos de malignidad, si bien se ha sugerido que las mismas pudieran ser originadas por estímulos persistentes derivados de infecciones latentes o recidivantes provocadas por virus influenza, citomegalovirus (CMV), herpes varicela zoster (HVZ) o virus de Epstein Barr (VEB), entre otros (36). En este sentido, un reciente trabajo relaciona la expansión clonal linfocitaria con la infección latente por CMV, y no con alteraciones intrínsecas de la vejez (37) (ver discusión más adelante). Para algunos autores (38), estas expansiones T serían el equivalente celular de la «gammapatía monoclonal benigna» característica del anciano. A pesar de su origen desconocido, su persistencia parece estar relacionada con defectos en los mecanismos de muerte celular programada (apoptosis) (39, 40) (tabla II).
Las repercusiones clínicas de estas alteraciones de la inmunidad celular son parcialmente desconocidas, si bien se piensa que influyen de manera definitiva en:
a) la menor resistencia del anciano frente a las infecciones, sobre todo las provocadas por patógenos intracelulares, y algunos tumores (5, 9-15, 25, 33, 41-43);
b) la menor capacidad de memoria inmunológica a largo plazo de los sujetos ancianos (35, 44), lo que les imposibilita para responder adecuadamente a determinadas vacunas, principalmente antivirales y antitumorales (tabla II).
Mas importante aún, algunas de las alteraciones en los mecanismos de inmunidad celular parecen servir incluso como factores pronósticos de morbilidad y mortalidad. Así, la anergia cutánea a los tests de hipersensibilidad retardada (principal manifestación clinicopatológica de una respuesta T dependiente) en humanos (41, 42) y el aumento de linfocitos T CD8 en humanos (43) y de linfocitos T memoria en ratones (43) parecen ser indicadores de una muerte presumida como no muy lejana (tabla II).
Otra consideración ligada al tema que nos ocupa, y a la que todavía no se le ha dado la importancia que se merece, tiene que ver con la influencia del género (sexo) en estas alteraciones de la inmunidad celular durante la vejez. De hecho, es suficientemente conocida la mayor supervivencia de las mujeres con respecto a los hombres. Pues bien, un reciente artículo (45) refiere un mejor estado de conservación inmunológica en ratonas viejas multíparas. Este mejor estado viene definido por índices mas elevados en los cocientes de linfocitos T/B, CD4/CD8 y memoria/«naive» que los machos y que las ratonas vírgenes. Para los autores de este trabajo, esta mejor preservación inmunológica sería debida a los retardos en la maduración inmunológica provocados por la inmunosupresión que acontece durante la preñez.
Desde nuestro punto de vista, existen otra serie de factores, también ligados a la influencia hormonal sobre el sistema inmunológico, que podrían tener especial importancia en este hecho (46). De esta manera, es bien sabida la capacidad de altos niveles de estrógenos y de la progesterona para derivar las respuestas inmunológicas hacia Th2; es decir, hacia la formación de Ac (47, 48), lo que ya implica en la mujer un freno ontogenético a las respuestas de mediación celular, freno que se vería potenciado como consecuencia del embarazo (46, 48). Estos hechos podrían contribuir, al igual que ocurre en las ratonas viejas multíparas (45), a explicar el mejor estado de conservación inmunológica en la mujer anciana, lo que podría repercutir en una mejor calidad de vida antiinfecciosa durante esta época de su vida. En cualquier caso, la influencia del sexo en la fisiología y la fisiopatología del comportamiento inmunológico empieza ahora a ser seriamente analizada (48).
MECANISMOS ACCESORIOS DE LA INMUNIDAD Y VEJEZ
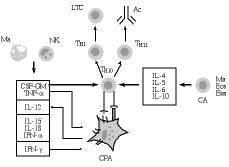
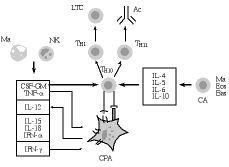
La activación de los linfocitos T tiene lugar cuando el receptor de células T (RCT) reconoce al antígeno (Ag), que le es presentado, en el contexto del complejo mayor de histocompatibilidad (CMH), por una célula presentadora del Ag (CPA) (Fig. 1). Esta señal no es, sin embargo, suficiente para poner en marcha una respuesta inmunológica; más bien al contrario, ello puede llevar a un estado de anergia (parálisis linfocitaria) frente al Ag en cuestión (49). La activación adecuada de las células T precisa además de otras señales (señales de coestimulación), que les son suministradas por las células accesorias de la inmunidad (CA en la Fig. 1), entre las que destacan las propias CPA [células dendríticas (CD) y macrófagos], las células NK, eosinófilos y basófilos, entre otras (5, 32, 33, 46). En este contexto, las señales accesorias son procuradas a los linfocitos T vírgenes («naive), bien por unas proteínas de coestimulación exhibidas por las CPA, bien por una serie de citoquinas segregadas en el entorno de la presentación antigénica por las células accesorias.
Figura 1.Influencia de las células presentadoras de antígeno (CPA) y de las citoquinas segregadas por otras células accesorias (CA) en la generación de las respuestas inmunológicas. Ma: macrófagos; NK: células «natural killer»; CSF-GM: factor hematopoyético para la serie granulocito-monocito; TNF-*: factor * de necrosis tumoral; IL-12, IL-15 e IL-18: interleuquinas 12, 15 y 18; IFN: interferones * y *; Th0, Th1 y Th2: linfocitos T helper; LTC: linfocitos T citotóxicos; Ac: anticuerpos; IL-4, IL-5, IL-6 e IL-10: interleuquinas 4, 5, 6 y 10; Eos: eosinófilos; Bas: basófilos.
En el primer caso, diferentes moléculas de coestimulación exhibidas en la superficie de las CPA, tales como las proteínas B7-1 (CD80), B7-2 (CD86) y CD40, son respectivamente reconocidas por los receptores CD28, CTLA4 y CD40L de los linfocitos T, lo que conduce a su activación y proliferación definitivas (50-53). En el segundo, la actuación de citoquinas segregadas por células accesorias, como el factor hematopoyético para la serie granulocito-monocítica (CSF-GM), el factor * de necrosis tumoral (TNF-*) y la interleuquina 12 (IL-12) son suficientes para provocar la inducción de LTC tanto in vitro como in vivo (5, 32, 33, 54-60). Otras citoquinas, como los interferones * y *, y las interleuquinas 15 y 18 (IL-15 e IL-18) juegan también un papel importante en la derivación hacia Th1 y, por ende, en la iniciación de respuestas de mediación celular (59, 60) (Fig. 1).
Por otra parte, la derivación hacia Th2 parece producirse en un entorno celular y molecular diferente al expuesto (Fig. 1), en el que predominan las acciones de las interleuquinas 4, 5, 6 y 10 (IL-4, IL-5, IL-6 e IL-10) y posiblemente del factor beta trasformante del crecimiento (TGF-ß) (32, 33, 37, 59, 60). De acuerdo a recientes estudios en asma (37), los basófilos y los eosinófilos juegan un papel esencial en esta derivación hacia las respuestas de mediación humoral, a través de la producción de las citoquinas citadas.
Parece entonces claro, que estos mecanismos de coestimulación son parte esencial en la puesta en marcha de respuestas inmunológicas específicas. Sin embargo, de todos los aspectos inmunológicos de la vejez, la función de las células accesorias de la inmunidad ha sido, por ahora, la menos estudiada.
Alteraciones de los mecanismos de presentación antigénica en la vejez
En lo que concierne a las posibles alteraciones de las CPA en la vejez, algunos datos recientes señalan la misma capacidad de los sujetos ancianos para generar CD que los jóvenes (61). Sin embargo, estas CD viejas manifiestan ciertos defectos para atravesar barreras tisulares, lo que parece conducir a su acumulación persistente en sangre periférica (62). Es lógico pensar que esta acumulación sanguínea impediría que las CPA alcanzaran los sitios en donde tiene lugar la presentación antigénica (distribución tisular, en la tabla III), con lo cual las respuestas inmunológicas se verían notablemente afectadas. Quizás este mecanismo de disminución de la distribución tisular de las CPA sea el que explique la menor densidad de las células dendríticas de Langerhans (CL) en ratas, gatos (63) y humanos (64, 65) de edades avanzadas, lo que ya implica que las posibilidades de captación, procesamiento y presentación antigénica se encuentran disminuidas con la edad en prácticamente todas las especies. Si a ello le añadimos los trastornos numéricos y funcionales de las CL provocados por la radiación solar crónica en humanos (tabla III) (64-67), se puede entender que estas alteraciones de la función accesoria en la piel son en gran parte las responsables de los cuadros de fotoenvejecimiento y de la aparición de cáncer cutáneo que caracteriza a las edades avanzadas (67).
Tabla III. Características inmunológicas de la vejez. III. Alteraciones de la función accesoria: células presentadoras de antígeno (CPA), macrófagos y células NK. | |
| Alteraciones de la función accesoria | |
| De las CPA | Del EPA |
| êDistribución tisular | Trastornos funcionales de los macrófagos |
| Acumulación en sangre periférica | ê Actividad citotóxica |
| ê CL en la epidermis | ê Producción óxido nítrico (NO) |
| êCL por radiación UV | ê Recambio celular ante situaciones de demanda |
| êMigración a ganglios linfáticos | ¿ê Producción de IL-12? |
| êProteína coestimulante B7-2 | Trastornos funcionales de las células NK |
| ê Actividad citotóxica | |
| ¿ê Producción de IFN-*? | |
| EPA: entorno celular y molecular de la presentación antigénica; CL: células de Langerhans; UV: ultravioleta; IL-12: interleuquina 12; IFN-*: interferón gamma. | |
Finalmente, los trastornos operados en las CD durante el envejecimiento fisiológico parecen afectar también al tráfico desde los tejidos hacia los ganglios linfáticos regionales, en donde tiene lugar la presentación antigénica a los linfocitos T (13). La severidad de esta última alteración se ve agravada por los defectos, ya señalados en el apartado dedicado a la inmunidad humoral, en la expresión del ligando para CD40 (CD40L), así como por los defectos en la expresión de la proteína coestimulante B7-2 (13, 21) (tabla III). Igualmente, la expansión linfocitaria, ya citada, de células CD4 y CD8 es caracterizada por una falta de expresión del receptor CD28 (células CD28-) (27, 36, 68, 69), lo que impediría el adecuado reconocimiento de las moléculas de coestimulación presentes en las CPA y, por ende, la puesta en marcha de una correcta respuesta inmunológica. Que este fenómeno sea debido a la deprivación del CD28 causada por una infección latente (sujetos seropositivos) por CMV (37) o a un trastorno característico del envejecimiento (68, 69) es una cuestión que aún queda por dilucidar.
Así pues, existen suficientes razones para suponer que la vejez también puede ser definida por trastornos en los mecanismos de presentación antigénica llevados a cabo por las CPA (tabla III). Dado el carácter iniciático de los mismos, se puede especular con que gran parte de las alteraciones inmunológicas descritas en este trabajo sobre todo aquellas que competen a la inmunidad celular encuentran su razón de ser en trastornos primarios de estos mecanismos.
Pero si las alteraciones de las CPA son interesantes para explicarnos algunos de los mecanismos que operan en el proceso de envejecimiento inmunológico, en el caso de las células productoras de citoquinas coestimulantes, los hechos, como veremos a continuación, son mas intrigantes, tanto desde el punto de vista fisiopatológico como del terapéutico.
Alteraciones del entorno de la presentación antigénica (EPA) y vejez: el papel de la inmunidad innata
Desde nuestro punto de vista, la vejez también podría ser definida por la existencia de trastornos severos en lo que en su día denominamos como el entorno celular y molecular de la presentación antigénica (5, 32, 33). De acuerdo a esta idea, también expresada por otros autores (59, 60, 70, 71), las respuestas inmunológicas específicas de tipo celular se encuentran fuertemente influenciadas por los mecanismos de inmunidad natural o innata. Esta influencia es ejercida por dos células fundamentales, macrófagos y células NK, y sus citoquinas correspondientes, IL-12 e IFN-*, las cuales ejercen sus acciones positivas favoreciendo la derivación de linfocitos T naive hacia Th1, y colaborando así en la puesta en marcha de respuestas específicas de mediación celular. De igual manera, la IL-12 inhibe la producción de IL-4 (60, 72), con lo que las respuestas de mediación humoral quedan, cuanto menos, mitigadas en sus acciones efectoras.
Pues bien, lo primero que llama la atención en los ratones viejos son los graves defectos en la funcionalidad de los macrófagos. En efecto, como ya demostramos hace tiempo (1, 3, 4), la actividad citotóxica antitumoral de los macrófagos se encuentra seriamente comprometida en estos animales (tabla II). Dado el reconocido papel de estas células en la lucha antiinfecciosa, es de suponer que la menor resistencia de los viejos a las infecciones viene en parte determinada por las alteraciones de este sistema celular. De hecho, es bien sabido que uno de los mecanismos más potentes de resistencia antimicrobiana (73) y antitumoral (74) es el suministrado por los macrófagos productores de óxido nítrico (NO). Pues bien, algunos autores han demostrado la baja capacidad de los macrófagos de ratones viejos para generar NO (75) (tabla III).
En lo que concierne a la producción de citoquinas por estos macrófagos, otros autores sugieren la presencia de defectos en la producción de IL-12 en los sujetos ancianos (76). De esta manera, se observan graves fallos en la generación de LTC y en la producción in vitro de IFN-* frente a la vacuna de la gripe, defectos que son corregidos por la adición exógena de IL-12 (76). Así pues, los macrófagos de los individuos ancianos presentan defectos severos tanto en sus actividades citotóxicas directas como en la producción de citoquinas coadyuvantes para la puesta en marcha de respuestas de mediación celular (tabla III).
En lo que concierne a las células NK, los hechos son más intrigantes. De esta manera, la mayoría de los estudios coinciden en señalar una baja actividad citotóxica de estas células, tanto en los ratones viejos (1, 3, 4, 77) como en humanos de edades media-avanzada (16, 17, 77) y avanzada (77-79). Algunos de estos trabajos refieren que el número de células NK está aumentado en sangre periférica pero, sin embargo, su actividad citotóxica se encuentra significativamente disminuida (79) (tabla III). Un artículo reciente clarifica la situación mostrando este mismo aspecto en los sujetos con infección latente por CMV, sugiriendo así una expansión clonal de las células NK similar a la observada con los linfocitos T CD28-, con pérdida de la función efectora citotóxica (37). Paradójicamente, la actividad NK se halla prácticamente normalizada en los sujetos centenarios (17, 18), lo que sin duda alguna contribuye al estado de «bienestar inmunológico» definido al principio de este escrito, y caracterizado fundamentalmente por una mejor resistencia frente a las infecciones víricas.
El envejecimiento del entorno celular de la presentación antigénica, posible responsable de gran parte de las alteraciones inmunológicas de la vejez: el posible papel del complemento en la generación de un cuadro de caos inmunológico
En suma, todo parece indicar que las alteraciones de la inmunidad natural o innata juegan un importante papel en la inmunopatogenia de la vejez y, que dada la influencia de la misma sobre los mecanismos de inmunidad específica de tipo celular (5, 32, 33, 59, 60, 70, 71, 80), ello va a permitir explicar, como veremos a continuación, gran parte de los trastornos que acontecen durante el proceso fisiológico de envejecimiento.
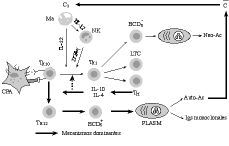
Según se muestra en la figura 2, en acuerdo a lo ya relatado, existe en la vejez una tendencia excesiva hacia la derivación de las respuestas específicas hacia Th2. Esta tendencia se ve favorecida por dos hechos esenciales:
Figura 2.El envejecimiento del entorno celular de la presentación antigénica como posible responsable de muchas de las alteraciones de la vejez. La hipótesis del caos inmunológico aplicada a la vejez. C3: factor C3 del complemento; C: sistema del complemento; Ma: macrófago; IL-12: interleuquina 12; NK: célula natural killer; IFN-*: interferón gamma; BCD5-: subpoblación de linfocitos B; Neo-Ac: neoanticuerpos; TH0: linfocitos T helper naive; TTH1: linfocitos T H1; LTC: linfocitos T citotóxicos; IL-4 e IL-10: interleuquinas 4 y 10; TM: linfocitos T memoria; Plasm: plasmocitos; Auto-Ac: autoanticuerpos; Igs: inmunoglobulinas.
1) el deterioro de los mecanismos de inmunidad natural, con déficits en la producción de IL-12 por parte de los macrófagos y CD, y el consiguiente déficit en la producción de IFN-* por parte de las células NK y LTC;
2) la preponderancia de IL-10 e IL-4, ambas paradójicamente sintetizadas por linfocitos T memoria (Fig. 2), que fueron generados en el curso de la multitud de estimulaciones antigénicas durante la vida. Todo ello hace que las respuestas específicas se vean dirigidas hacia la síntesis de anticuerpos, bien en la forma de neo-Ac, bien más frecuentemente hacia la producción de Igs monoclonales y auto-Ac.
Aunque las causas íntimas de estos defectos de la inmunidad natural son desconocidas, no cabe duda que existen algunos hechos que las explican. Entre ellas habría que citar las acciones negativas de IL-10 y de algunos factores del complemento sobre la producción de IL-12. En referencia a este último hecho, hoy parece claro que el bloqueo del receptor CD46 de los macrófagos por parte de Ac o por el factor C3b del sistema del complemento pueden provocar la anulación de la producción de IL-12 (81, 82) (Fig. 2). Si a ello le unimos la reconocida capacidad del complemento para activar directamente los linfocitos B a la producción de Igs (81), y que gran parte de los gérmenes conocidos son capaces de activar el complemento, se puede entender la excesiva tendencia de los viejos a derivar las respuestas hacia Th2, en detrimento de las Th1. De otra parte, es sabido que la vejez también se caracteriza por una transición de IgG1 a IgG3 (83) y de cómo la afinidad del fragmento C1q del complemento es mayor por la IgG3 que por las demás Igs (84).
Como hemos sugerido recientemente, este mecanismo, al que denominamos como de «caos inmunológico» (80), podría representar no solamente un proceso de escape para los virus, sino también para algunos tipos tumorales. La importancia de este mecanismo de freno de las respuestas Th1 es tal, que se sabe como el fragmento C3 está notablemente aumentado en el lumen uterino y en el epitelio glandular durante el embarazo (85, 86) como consecuencia de la acción de los estrógenos (85), sugiriendo una vez más los efectos de estas hormonas en la polarización de las repuestas hacia Th2, y mostrando así un preciso mecanismo de preservación ontogenética ante el poder destructivo de las respuestas celulares frente al embrión.
INMUNOMODULACION EN LA VEJEZ: EL PAPEL DE AM3 (INMUNOFERON)
La búsqueda de productos para tratar de paliar la elevada incidencia de cuadros patológicos que acontecen durante la vejez es una constante histórica en los campos de la medicina y de la paramedicina. Desgraciadamente, la mayoría de estos compuestos adolecen de un adecuado posicionamiento científico, que permita una aplicación razonada de los mismos. En las experiencias que se describen a continuación se muestra la potencialidad de AM3 (Inmunoferón ® I. F. Cantabria, Madrid, España) para paliar algunos de los defectos inmunológicos descritos anteriormente, sobre todo aquellos que conciernen a los mecanismos de inmunidad natural o innata. Como veremos, estas acciones repercuten positivamente en la respuesta inmunológica específica del huésped, sobre todo en lo que concierne a la respuesta vacunal.
AM3: composición, mecanismo de acción, toxicidad y posología
AM3 (glicofosfopeptical) ha sido químicamente definido como un compuesto polisacárido/proteína. El polisacárido es un gluco-manano (120 kd) aislado de la pared celular de una cepa de Candida utilis, y la proteína (perfectamente caracterizada desde el punto de vista químico) pertenece al componente nutritivo no germinado de la semilla del ricino. Este compuesto orgánico (principio activo) se encuentra adsorbido en una matriz inorgánica de calcio fosfato-sulfato. El fármaco es activo por las vías oral, intraperitoneal y subcutánea, si bien su administración en humanos es solamente oral. Dado que AM3 no interfiere con los mecanismos de metabolización de xenobióticos, el fármaco puede ser conjuntamente administrado con antibióticos, antivirales y citostáticos, entre otros agentes terapéuticos. Aun más, el tratamiento adyuvante con AM3 potencia los efectos de antibióticos (87) y de reconocidos antivirales, cual es el caso de la ribavirina (88).
El mecanismo de acción está relacionado con la capacidad del fármaco para inducir la producción endógena de IL-12 e IFN-* (33, 88), entre otras citoquinas, lo que explica la habilidad del mismo para modular las respuestas inmunológicas de mediación celular, en las que, como hemos visto, están implicados los macrófagos, las células NK y los linfocitos Th1. Estas respuestas son consideradas esenciales en los mecanismos de resistencia frente a patógenos intracelulares, fundamentalmente virus.
AM3 carece de toxicidad en animales y humanos. Los efectos adversos descritos tras su administración oral incluyen a casos leves a moderados de intolerancia gástrica, así como casos anecdóticos de alergia cutánea («rash» y prurito). La seguridad del fármaco parece relacionarse con: a) la vía de administración, oral; b) la habilidad de AM3 para inhibir la sobreproducción de factor alfa de necrosis tumoral (TNF-*) (88-90), citoquina que, como se sabe, es la responsable de la mayoría de los efectos tóxicos desencadenados por otros conocidos inmunomoduladores, incluidas algunas citoquinas (91, 92).
En todas las experiencias descritas aquí, AM3 fue siempre administrado por vía oral. En las experiencias en animales, los ratones recibieron dosis comprendidas entre 50 y 150 mg (dosis más activa)/kg/día durante cuatro hasta 15 días consecutivos. En los ensayos clínicos en humanos, AM3 fue siempre administrado a la dosis de 3 g/día (2 cap. de 500 mg cada 8 horas) durante 12 hasta 60 días consecutivos. En el caso del tratamiento en humanos, la posología obedece a un estudio «dose-finding» doble-ciego, comparado con placebo, que fue llevado a cabo en personas de edad media-avanzada afectas de bronquitis crónica (93). En dicho estudio se pudo comprobar cómo tanto la actividad quimiotáctica y fagocítica de los polimorfonucleares neutrófilos (frente a C. albicans), como la actividad citotóxica de las células NK de sangre periférica (frente a la línea tumoral K-562) era máxima a la dosis expuesta de 3 g/día, y comenzaba a ponerse en evidencia a partir de los 12 días de tratamiento continuado con el fármaco.
El tratamiento con AM3 restaura los mecanismos de inmunidad natural o innata en ratones y humanos de edad medio-avanzada
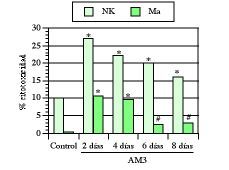
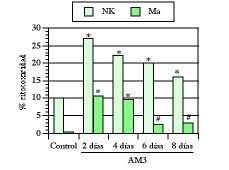
Como ya hemos visto en este trabajo, la edad medio-avanzada, al contrario que la avanzada, se caracteriza por la aparición de una serie de alteraciones que comprometen fundamentalmente a los mecanismos de inmunidad natural. Por ello, las primeras experiencias fueron encaminadas a saber los efectos de AM3 sobre la inmunidad innata en ratones maduros adultos (17 semanas). En una serie de trabajos se vio cómo el tratamiento con AM3 restauró las actividades citotóxicas de los macrófagos peritoneales y de las células NK esplénicas hasta niveles comparables a los obtenidos en ratones jóvenes (1, 3, 4). Aun más, a pesar de la interrupción de los tratamientos, tanto las actividades citotóxicas de los macrófagos como de las células NK continuaron significativamente más elevadas que en los respectivos controles no tratados (Fig. 3).
Figura 3.El tratamiento con AM3 restaura y mantiene la actividad citotóxica de macrófagos (Ma) y de células natural killer (NK) en ratones viejos. AM3 (Inmunoferón ®, I. F. Cantabria, Madrid) se administró p.o (150 mg/kg/día) durante cuatro días. Las actividades citotóxicas de los Ma peritoneales y de las células NK esplénica se evaluaron a los 2, 4, 6 y 8 días de finalizado el tratamiento. La relación célula efectora/célula diana representada es de 100/1 para las células NK y de 40/1 para los macrófagos. * P< 0,001 y # P< 0,05 vs los respectivos controles (Modificada de Ref. 4).
En otra serie de experiencias llevadas a cabo en el Consejo Superior de Investigaciones Científicas (CSIC) se comprobó cómo este efecto restaurador de AM3 sobre la actividad NK se daba también en ratones más viejos (32 semanas) (94), lo que claramente demostraba que estas alteraciones inmunológicas debidas a la edad podían ser revertidas farmacológicamente.
Tomados en conjunto, estos datos demuestran definitivamente la capacidad de AM3 para restaurar los mecanismos de inmunidad natural mediados por macrófagos y células NK en animales de edades avanzadas, llevándolos a límites similares a los obtenidos en animales jóvenes. Teniendo en cuenta la importancia de estas células en los mecanismos de resistencia antiinfecciosa del huésped, los resultados obtenidos contribuyen a explicar gran parte de las actividades antiinfecciosas, inmunológicamente mediadas, exhibidas por el fármaco en diferentes modelos experimentales de desafío infeccioso in vivo, tales como S. aureus (87) virus Punta Toro (88), Listeria (95), E. coli (96), Cándida (97, 98) y B. abortus (99), entre otros gérmenes.
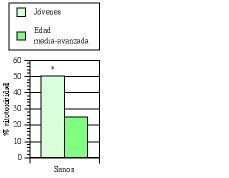
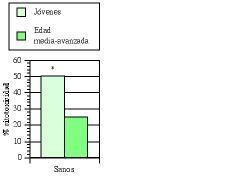
Los estudios de inmunidad natural en humanos se llevaron principalmente a cabo en pacientes de edad media-avanzada (edad media de 60 años) afectos de bronquitis crónica (BC) (77, 93, 100, 101). Cómo ya hemos expuesto en algunas publicaciones (77, 101), los defectos de la inmunidad natural se ven potenciados por la presencia de esta enfermedad, sobre todo en individuos fumadores (102, 103). En un primer ensayo clínico doble ciego (77, 100) se comprobó que el tratamiento con AM3 restauraba la actividad de las células NK en los pacientes con BC hasta niveles comparables a los obtenidos en sujetos jóvenes sanos (Fig. 4). Igualmente, se demostró la capacidad de AM3 para aumentar las cifras de monocitos en sangre periférica, y para potenciar la quimiotaxis de los mismos y de los polimorfonucleares neutrófilos en estos pacientes (tabla IV). En el segundo ensayo (93), un estudio «dose-finding», se vio nuevamente la capacidad de AM3 para potenciar la actividad citotóxica de las células NK.
Figura 4.El tratamiento con AM3 restaura la actividad NK en pacientes de edad media-avanzada afectos de bronquitis crónica (BC). AM3 (Inmunoferón ®, I. F. Cantabria, Madrid) se administró durante 60 días consecutivos a la dosis de 6 cáps./día. La actividad NK de las células mononucleadas de sangre periférica en los diferentes subgrupos de edad estudiados se evaluó en el momento basal y a los 60 días del tratamiento con AM3 o placebo (Modificada de Ref. 76).
Tabla IV. La administración de AM3 a pacientes de edad media-avanzada afectos de bronquitis crónica incrementa significativamente el número y quimiotaxis de los monocitos, así como la quimiotaxis de los polimorfonucleares (PMNs) de las células de sangre periférica. | ||||
| Basal | Final | |||
| Parámetros | Placebo | AM3 | Placebo | AM3 |
| PMNs, n= 10 | ||||
| Quimiotaxis (%) | 25 ± 7 | 22 ± 8 | 27 ± 7 | 35 ± 8* |
| Monocitos, n= 20 | ||||
| Nº/mm3 | 408 ± 16 | 405 ± 13 | 416 ± 16 | 447 ± 15** |
| Quimiotaxis (%) | 84 ± 5 | 82 ± 5 | 84 ± 5 | 93 ± 4** |
| El momento final corresponde a 60 días de tratamiento con AM3 para los monocitos y 12 días para los polimorfonucleares (PMN); n: Nº de pacientes en los que se evaluaron los parámetros citados; * P< 0,05 y ** P< 0,001 vs placebo y basal. | ||||
En resumen, existen suficientes datos para afirmar que AM3 restaura las actividades de macrófagos y de células NK en animales y humanos de edad avanzada. Según ya hemos reseñado en algunas publicaciones (33, 77, 88), estas acciones sobre los mecanismos de inmunidad innata parecen estrechamente relacionadas con la capacidad del fármaco para inducir la producción endógena de IL-12, IFN-* e IFN-*, citoquinas, como se sabe, responsables de la activación de macrófagos y células NK. En este sentido, las experiencias recogidas en la tabla V demuestran claramente la capacidad de AM3 para potenciar la producción de interferón en ratones viejos sometidos a diferentes estímulos inductores.
Tabla V. El tratamiento con AM3 (Inmunoferón) potencia la producción de interferón (IFN) sérico frente a diferentes inductores en ratones Balb/c jóvenes y viejos. | ||
| Inductores | Niveles de IFN (UI/ML) dependiendo de la edad | |
| Jóvenes (8 semanas) | Viejos (32 semanas) | |
| Placebo | 0 | 0 |
| AM3 | 16 ± 3,3 | 10 ± 2,6 |
| LPS (Y) | 150 ± 8,6 | 45 ± 2,6 |
| LPS (Y) + AM3 | 725 ± 28 * | 120 ± 7,8 * |
| LPS (E) | 1800 ± 132 | 160 ± 9,3 |
| LPS (E) + AM3 | 2960 ± 182 # | 390 ± 14 # |
| Modificada de Ref. 92. AM3 fue administrado p.o a las dosis de 150 mg/kg/día durante una semana tras la administración de los inductores; LPS: lipopolisacáridos de (Y) Yersinia enterocolítica y (E) Escherichia coli, se inocularaon por vía i.v. en una sola dosis de 1 µg/ratón; * P< 0,02 vs LPS (Y) y # P< 0,02 vs LPS (E). | ||
Igualmente, hoy sabemos que AM3 despliega importantes actividades hematopoyéticas, que son fundamentalmente mediadas por CSF-GM (104, 105). Teniendo en cuenta la capacidad de este factor hematopoyético para potenciar la actividad presentadora de antígenos de los macrófagos, que se produce a través de mecanismos de renovación de estas células en médula ósea (106), se puede entender que, junto con la capacidad del fármaco para inducir la producción de IL-12 y de IFN-*, el tratamiento con el mismo sea capaz de inducir respuestas inmunológicas específicas.
En relación a este hecho, un estudio reciente demuestra que el tratamiento con AM3 parece potenciar la respuesta a la vacunación frente a la hepatitis B en pacientes de edad medio-avanzada y avanzada afectos de uremia crónica en tratamiento de hemodiálisis (107). En este estudio preliminar se seleccionaron 22 de estos pacientes que habían sido respondedores, aunque bajos respondedores (título de anti-HBs entre 10 y 50 UI/L), a la vacunación de la hepatitis B. Pasado un año, todos los pacientes recibieron un nuevo refuerzo vacunal con el fin de comprobar la existencia o no de una respuesta anamnéstica, que demostrara la presencia de una buena memoria inmunológica o la potenciación de una respuesta de carácter secundario. Como se muestra en la tabla VI, solamente los pacientes que recibieron AM3 junto al refuerzo vacunal fueron capaces de mostrar una auténtica respuesta de carácter anamnéstico, claramente manifiesta por títulos elevados de anti-HBs. En resumen, estos hechos demuestran la capacidad de AM3 para potenciar la respuesta inmunológica específica, aun a pesar del grado de inmunocompromiso de estos pacientes; inmunocompromiso debido por una parte a la presencia de uremia crónica (108) y, de otra, a su edad avanzada.
Tabla VI. El tratamiento con AM3 potencia la respuesta secundaria a la revacunación frente a la hepatitis B en pacientes de edad avanzada afectos de uremia crónica. | ||||
| Grupos | Respondedores (anti-HBs >10 UI/L) | Respondedores idóneos (anti-HBs > 100 UI/L) | ||
| n (%) | MGT | n (%) | MGT | |
| Control (n= 10) | 10 (100) | 82,5 | 3 (30) | 226,7 |
| AM3 (n= 12) | 12 (100) | > 450 | 10 (83) * | > 766 |
| MGT: media geométrica de los títulos de anti-HBs; * P< 0,05 vs control. (Ver descripción en texto). | ||||
CONCLUSIONES
En resumen, parece claro por todo lo expuesto que la transición a la vejez se acompaña de una serie de cambios inmunológicos que podrían ayudar a definir la existencia de un fenotipo inmunosenescente. Este fenotipo estaría caracterizado por alteraciones más o menos severas en los mecanismos de inmunidad celular, entre las que destacan: a) un agotamiento de la población de linfocitos T vírgenes («naive»), con incremento de los linfocitos T memoria; y, b) un estado de pasividad funcional en los mecanismos de inmunidad innata mediados por macrófagos y células NK. Cómo consecuencia de estos hechos, se va a producir una derivación de las respuestas hacia mecanismos de inmunidad humoral. Curiosamente, estos últimos hechos son similares a los que acontecen, aunque por otros motivos y con diferente evolución, durante la época neonatal (5, 46).
Finalmente, los estudios inmunológicos realizados con AM3 en animales y humanos permiten afirmar la capacidad del fármaco para restaurar algunos de los mecanismos de inmunidad natural o innata en esa edad tan crucial de la vida, y de cómo esta restauración va a repercutir positivamente en un mejor estado de reactividad antiinfecciosa y en una mejor reacción de los mecanismos inmunológicos específicos implicados en la respuesta vacunal.
AGRADECIMIENTOS
A la Sra. Elena Cánovas Fernández por su inestimable colaboración en la elaboración de este trabajo.
BIBLIOGRAFIA
1.Spreafico F, Luini W, Sozzani S, Sada G, Villarrubia VG. Restoration by AM3 of the NK and Macrophage natural cytotoxic activities in aged and in cyclophosphamide-depressed mice. En: 5th NCI-EORTC Symp. on new drugs in Cancer Therapy. Amsterdam 22-24 Oct, 1986. Abstr 5.23.
2.Villarrubia VG, Moreno Koch MC. Acción de las células linfomonocitarias (LM) obtenidas del líquido ascítico de ratones con tumor CaH, sobre el número de tomas y supervivencia. En: Valladares Y, ed. «Memoria y Actas del Primer Congreso de Investigación sobre el Cáncer en España» 1983;II:681-6.
3.Villarrubia VG, Sada G, Luini E, Sozzani S, Spreafico F. Restauración por AM3 de la actividad citotoxica antitumoral de células NK y macrófagos en animales inmunocomprometidos. Oncología 1987;10:283-91.
4.Villarrubia VG. La respuesta biológica frente al cáncer e infecciones: Modificadores de la respuesta biológica. Tesis Doctoral, Facultad de Medicina, Universidad Complutense, Madrid. Julio; 1992.
5.Villarrubia VG. Inmunidad, infección y respuesta a las vacunas. Influencia de la edad: los fenotipos inmunoneonatal e inmunosenescente. Inflamación 1995;6:109-25.
6.Campion EW. The oldest old. N Engl J Med 1994;330:1819-20.
7.Sergio Alonso. Informe de Diario Médico. 28 de Julio; pág. 3.
8.Holden C. Live long and prosper? Science 1996;273:42-8.
9.Pawelec G. Immunosenescence in man: perspectives. En: 5th Eucambis Congr. Córdoba (España), 14-18 Mayo; 1997: Abstr. 01.
10.Schwab R, Walters CA, Weksler ME. Host defense mechanisms and aging. Semin Oncol 1989;16:20-7.
11.Breitenbucher RB, Peterson PK. Infections in the elderly. En: Mandell, Douglas, Bennett, eds. Principles and practice of Infectious Diseases. New York, Churchill Livingstone; 1990. p. 2315-20.
12.Gardner P, Schaffner W. Immunization of adults. N Engl J Med 1993; 328:1252-8.
13.Miller RA. The aging immune system: Primer and prospectus. Science 1996;273:70-4.
14.Chandra RK. Efecto de los suplementos de vitaminas y oligoelementos sobre la respuesta inmunitaria y las infecciones en los individuos ancianos. Lancet (edic. Esp) 1993;22:197-200.
15.Kubena KS, McMurray DN. Nutrition and the immune system: A review of nutrient-nutrient interactions. J Am Diet Assoc 1996;96:1156-64.
16.Levy SM, Herberman RB, Lee J, Whiteside T, Beadle M, Heiden L, et al. Persistently low natural killer cell activity, age, and environmental stress as predictors of infectious morbidity. Nat Immun Cell Growth Regul 1991;10:289-307.
17.Sansoni P, Cossarizza A, Brianti V, Fagnoni F, Snelli G, Monti D, et al. Lymphocyte subsets and natural killer cell activity in healthy old people and centenarians. Blood 1993;82:2767-73.
18.Franceschi C, Monti D, Sansoni P, Cossarizza A. The immunology of exceptional individuals: the lesson of centenarians. Immunol Today 1995; 16:12-6.
19.Axelsson U, Bachmann R, Hallen J. Frequency of pathological proteins (M-components) in 6,995 sera from an adult population. Acta Med Scand 1966;179:235-41.
20.Weksler ME. Immune senescence and adrenal steroids: immune dysregulation and the action of dehydroepiandrosterone (DHEA) in old animals. Eur J Clin Pharmacol 1993;45(S):21-3.
21.Miller C, Kelsoe G. Ig VH hypermutation is absent in the germinal centers of aged mice. J Immunol 1995;155:3377-84.
22.Kishimoto S, Tomino S, Mitsuya H, Fujiwara H, Tsuda H. Age related decline in the in vitro and in vivo synthesis of anti-tetanus toxoid antibody in humans. J Immunol 1980;125:2347-52.
23.Shipp MA, Mauch PM, Harris NL. Non-Hodgkin´s lymphomas. En: DeVita VT Jr, Hellman S, Rosenberg SA, eds. Cancer. Principles & Practice of Oncology. 5th edit. Philadelphia Lippincott-Raven Publishers; 1997. p. 2165-220.
24.Gillis S, Kozak R, Durante M, Weksler ME. Immunological studies of aging. Decreased production of and response to T cell growth factor by lymphocytes from aged humans. J Clin Invest 1981;67:937-42.
25.Makinodan T. Immunologic aspects of aging, págs. 459-61. En: Geokas MC, moderator. The aging process. Ann Intern Med 1990;113:455-66.
26.Ernst DN, Hobbs MV, Torbett BE, Glasebrook AL, Rehse MA, Bottomly K et al. Differences in the expression profiles of CD45RB, Pgp-1, and 3G11 membrane antigens and in the patterns of lymphokine secretion by splenic CD4 + T cells from young and aged mice. J Immunol 1990;145:1295-302.
27.Pilarski LM, Yacyshyn BR, Jensen GS, Pruski E, Pabst HF. Beta 1 integrin (CD29) expression on human postnatal T cell subsets defined by selective CD45 isoform expression. J Immunol 1991;147:830-7.
28.Nociari MM, Telford W, Russo C. Postthymic development of CD28-CD8+ T cell subset: age-associated expansion and shift from memory to naive phenotype. J Immunol 1999;162:3327-35.
29.Hobbs MV, Weigle WO, Ernst DN. Interleukin-10 production by splenic CD4+ cells and cell subsets from young and old mice. Cell Immunol 1994;154:264-72.
30.Caruso C, Candore G, Cigna D, DiLorenzo G, Sireci G, Dieli F, Salerno A. Cytokine production pathway in the elderly. Immunol Res 1996;15: 84-90.
31.Cakman I, Rohwer J, Schutz RM, Kirchner H, Rink L. Dysregulation between TH1 and TH2 T cell subpopulations in the elderly. Mech Ageing Dev 1996;87:197-209.
32.Villarrubia VG, Sánchez L, Alvárez-Mon M. Las nuevas vacunas y la respuesta inmunológica. La memoria inmunológica. I. Respuesta humoral frente a respuesta celular. Med Clin (Barc) 1996;107:146-54.
33.Villarrubia VG, G. Calvo C, Sada G. Las nuevas vacunas y la respuesta inmunológica. II. El entorno de la presentación antigénica. Adyuvantes como inductores de linfocitos T-inductores de respuestas de mediación celular. Med Clin (Barc) 1996;107:185-96.
34.Inoue T, Asano Y, Matsuoka S, Furutani-Seiki M, Aizawa S, Nishimura H, et al. Distinction of mouse CD8+ suppressor effector T cell clones from cytotoxic T cell clones by cytokine production and CD45 isoforms. J Immunol 1993;150:2121.
35.Powers DC, Belshe RB. Effect of age on cytotoxic T lymphocyte memory as well as serum and local antibody responses elicited by inactivated influenza virus vaccine. J Infect Dis 1993;167:584-92.
36.Schwab R, Szabo P, Manavalan JS, Weksler ME, Posnett DN, Pannetier C, et al. Expanded CD4+ and CD8+ T cell clones in elderly humans. J Immunol 1997;158:4493-9.
37.Looney RJ, Falsey A, Campbell D, Torres A, Kolassa J, Brower C, et al. Role of cytomegalovirus in the T cell changes seen in elderly individuals. Clin Immunol 1999;90:213-9.
38.Posnett DN, Sinha R, Kabak S, Russo C. Clonal populations of T cells in normal elderly humans: the T cell equivalent to «bening monoclonal gammapathy». J Exp Med 1994;179:609-18.
39.Zhou T, Edwards III CK, Mountz JD. Prevention of age-related T cell apoptosis defect in CD2-fas-transgenic mice. J Exp Med 1995;182: 129-37.
40.Wang E. Senescent human fibroblasts resist programmed cell death and failure to suppress Bcl is involved. Cancer Res 1995;55:2284-92.
41.Wayne SJ, Rhyne RL, Garry PJ, Goodwin JS. Cell-mediated immunity as a predictor of morbidity and mortality in subjects over 60. J Gerontol Med Sci 1990;45:M45-8.
42.Ferguson FG, Wikby A, Maxson P, Olsson J, Johansson B. Immune parameters in a longitudinal study of a very old population of Swedish people: a comparison between survivors and nonsurvivors. J Gerontol A Biol Sci Med Sci 1995;50:B378-82.
43.Miller RA, Turke P, Chrisp C, Ruger J, Luciano A, Peterson J, et al. Age-sensitive T cell phenotypes covary in genetically heterogeneous mice and predict early death from lymphoma. J Gerontol 1994;49:B255-62.
44.McElhaney JE, Meneilly GS, Beattie BL, Helgason CD, Lee SF, Devine RD, Bleackley RC. The effect of influenza vaccination on IL 2 production in healthy elderly: implications for current vaccination practices. J Gerontol Med Sci 1992;47:M3-8.
45.Barrat F, Lesourd BM, Louise A, Boulouis H-J, Vincent-Naulleau S, Thibault D, et al. Surface antigen expression in spleen cells of C57Bl/6 mice during ageing: influence of sex and parity. Clin Exp Immunol 1997;107:593-600.
46.Villarrubia VG, González P, Navarro SR, Calvo CG, de las Heras M, Alvarez-Mon M. Patogenia inmunológica/inflamatoria del asma: El predominio ontogénico TH2 y su relación con los mecanismos de desvío inmunológico durante las épocas fetal y neonatal. Implicaciones terapéuticas. Allergol Immunopathol 1999;27:213-31.
47.Kanda N, Tamaki K. Estrogen enhances immunoglobulin production by human PBMCs. J Allergy Clin Immunol 1999;103:282-8.
48.Whitacre CC, Reingold SC, O´Looney PA, and the Task Force on Gender, Multiple Sclerosis and Autoimmunity. A gender gap in autoimmunity. Science 1999;283:1277-8.
49.Aichele P, Brduscha-Riem K, Zinkernagel RM, Hengartner H, Pircher H. T cell priming versus T cell tolerance induced by synthetic peptides. J Exp Med 1995;182:261-6.
50.Boussiotis VA, Freeman GJ, Gribben JG, Nadler LM. The role of B7-1/B7-2: CD28/CLTA-4 pathways in the prevention of anergy, induction of protective immunity and down-regulation of the immune response. Immunol Rev 1996;153:5-26.
51.Van Gool SW, Vandenberghe P, de Boer M, Ceuppens JL. CD80, CD86 and CD40 provide accessory signals in a multiple-step T-cell activation model. Immunol Rev 1996;153:47-83.
52.Sperling AI, Bluestone JA. The complexities of T-cell co-stimulation: CD28 and beyond. Immunol Rev 1996;153:155-82.
53.Liu Y, Wenger RH, Zhao M, Nielsen PJ. Distinct costimulatory molecules are required for the induction of effector and memory cytotoxic T lymphocytes. J Exp Med 1997;185:251-62.
54.Ahlers JD, Dunlop N, Alling DW, Nara PL, Berzofsky JA. Cytokine-in-adjuvant steering of the immune response phenotype to HIV-1 vaccine constructs. Granulocyte-macrophage colony-stimulating factor and TNF-* synergize with IL-12 to enhance induction of cytotoxic T lymphocytes. J Immunol 1997;158:3947-58.
55.Lanzavecchia A. Licence to kill. Nature 1998;393:413-4.
56.Ridge JP, Di Rosa F, Matzinger P. A conditioned dendritic cell can be a temporal bridge between a CD4+ T-helper and a T-killer cell. Nature 1998;393:474-8.
57.Bennett SRM, Carbone FR, Karamalis F, Flavell RA, Miller JFAP, Heath WR. Help for cytotoxic-T-cell responses is mediated by CD40 signalling. Nature 1998;393:478-80.
58.Schoenberger SP, Toes REM, van der Voort EIH, Offringa R, Melief CJM. T-cell help for cytotoxic T lymphocytes is mediated by CD40-CD40L interactions. Nature 1998;393:480-3.
59.Romagnani S. Induction of Th1 and Th2 responses: a key role for the natural immune response? Immunol Today 1992;13:379-81.
60.Trinchieri G. Interleukin-12: A proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adative immunity. Annu Rev Immunol 1995;13:251-76.
61.Steger MM, Maczec C, Grubeck-Loebenstein B. Morphologically and functionally intact dendritic cells can be derived from the peripheral blood of aged individuals. Clin Exp Immunol 1996;105:544-50.
62.Grubeck-Loebenstein B, Steger MM, Saurwein-Teissl M, Bodnar Z, Maczec M. Complex immunological alterations occur in SENIEUR compatible healthy elderly donors. En: 5th Eucambis Congr. Córdoba (España), 14-18 Mayo; 1997: Abstr. 27.
63.Saint-André Marchal I, Dezutter-Dambuyant C, Martin JP, Willett BJ, Woo JC, Moore PF, et al. Quantitative assessment of feline epidermal Langerhans cells. Br J Dermatol 1997;136:961-5.
64.Thiers BH, Maize JC, Spicer SS, Cantor AB. The effect of aging and chronic sun exposure on human Langerhans cell populations. J Invest Dermatol 1984;82:223-7.
65.Gilchrest B, Murphy GF, Soter NA. Effect of chronologic aging and ultraviolet radiation on Langerhans cells in human epidermis. J Invest Dermatol 1982;79:85-8.
66.Gonzalez S, Pathak MA, Cuevas J, Villarrubia VG, Fitzpatrick TB. Topical or oral treatment with an extract of Polypodium leucotomos prevents acute sunburn and psoralen-induced phototoxic reactions as well as depletion of Langerhans cells in human skin. Photomed Photoimmunol Photodermatol 1997;13:50-60.
67.Villarrubia VG, González S, Cuevas J. Alteraciones inmunológicas provocadas por la radiación ultravioleta. Su relación patogénica con el fotoenvejecimiento y la aparición de cáncer de piel. Piel 1996;11: 462-70.
68.Fagnoni FF, Vescovini R, Mazzola M, Bologna G, Nigro E, Lavagetto G, et al. Expansion of cytotoxic CD8+ CD28- T cells in healthy aging people, including centenarians. Immunology 1996;88:501-7.
69.Effros RB, Boucher N, Porter V, Zhu X, Spaulding C, Walford RL, et al. Decline in CD28+ T cells in centenarians and in long-term T cell cultures: a possible cause for both in vivo and in vitro immunosenescence. Exp Gerontol 1994;29:601-9.
70.Garside P, Mc Imowat A. Polarization of Th-cell responses: a phylogenetic consequence of nonspecific immune defence? Immunol Today 1995;16:220-3.
71.Fearon DT, Locksley RM. The instructive role of innate immunity in the acquired immune response. Science 1996;272:50-4.
72.Manetti R, Parronchi P, Giudizi MG, Piccinni MP, Maggi E, Trinchieri G, Romagnani S. Natural killer cell stimulatory factor (interleukin 12 [IL-12 ]) induces T helper type 1 (Th1)-specific immune responses and inhibits the development of IL-4-producing Th cells. J Exp Med 1993;177: 1199-1204.
73.Nathan CF, Hibbs JB Jr. Role of nitric oxide synthesis in macrophage antimicrobial activity. Curr Opin Immunol 1991;3:65-70.
74.Tsung K, Meko JB, Peplinski GR, Tsung YL, Norton JA. IL-12 induces T helper 1-directed antitumor response. J Immunol 1997;158:3359-65.
75.Kissin E, Tomasi M, McCartney-Francis N, Gibbs CL, Smith PD. Age-related decline in murine macrophage production of nitric oxide. J Infect Dis 1997;175:1004-7.
76.Mbawuike IN, Acuna CL, Walz KC, Atmar RL, Greenberg SB, Couch RB. Cytokines and impaired CD8+CTL activity among elderly persons and the enhancing effect of IL-12. Mech Ageing Dev 1997;94:25-39.
77.Villarrubia VG, Moreno Koch MC, G.Calvo C, González S, Álvarez-Mon M. The immunosenescent phenotype in mice and humans can be defined by alterations in the natural immunity. Reversal by immunomodulation with oral AM3. Immunopharmac ol Immunotoxicol 1997; 19:53-74.
78.Penschow J, McKay IR. NK and NK cell activity of human blood: differences according to sex, age and disease. Ann Rheum Dis 1980;39:82-6.
79.Facchini A, Mariani E, Mariani AR, Papa S, Vitale M, Mazoli FA. Increased number of circulating Leu 11+ (CD16) large granular lymphocytes and decreased NK activity during human aging. Clin Exp Immunol 1987;68:340-7.
80.Villarrubia VG, Alvarez-Mon M, Chirigos MA, Herrerías JM. Virus de la hepatitis B (VHB) y la respuesta inflamatoria/inmunológica. I. El entorno natural de la presentación antigénica y el caos inmunológico inducido por el virus. Rev Esp Enf Digest 1997;89:919-28.
81.Karp CL, Wysocka M, Wahl LM, Ahearn JM, Cuomo PJ, Sherry B, Trinchieri G, Griffin DE. Mechanism of suppression of cell-mediated immunity by measles virus. Science 1996;273:228-31.
82.Sutterwala FS, Noel GJ, Clynes R, Mosser DM. Selective suppression of interleukin-12 induction after macrophage receptor ligation. J Exp Med 1997;185:1977-85.
83.Powers DC. Effect of age on serum immunoglobulin G subclass antibody responses to inactivated influenza virus vaccine. J Med Virol 1994;43: 57-61.
84.Schumaker VN, Calcott MA, Speigelberg HL, Müller-Eberhard HJ. Ultracentrifuge studies of the binding of IgG of different subclasses to the C1q subunit of the first component of complement. Biochemistry 1976; 15:5175-81.
85.Sundstrom SA, Komm BS, Ponce de León H, Yi A, Teuscher C, Lyttle CR. Estrogen regulation of tissue-specific expression of complement C3. J Clin Invest 1989;264:16941-7.
86.Isacsson KB, Coutifaris C, García C-R, Lyttle CR. Production and secretion of complement component 3 by endometiotric tissue. J Clin Endocrinol Metab 1998;69:1003-9.
87.Gillissen G, Breuer-Werle, M. L''action additive d''un inmunomodulateur sur l''effect thérapeutique des antibiotiques. Path Biol 1983;31:548-50.
88.Villarrubia VG, Herrerías JM, Álvarez-Mon M, Chirigos MA. Virus de la hepatitis B y la respuesta inflamatoria/inmunológica. II. Una nueva oportunidad de tratamiento para la hepatitis B crónica y una sugerencia para el tratamiento de otras enfermedades víricas persistentes. Rev Esp Enf Digest 1998;90:514-22.
89.Alonso JL, Morejón M, Pivel JP. AM3, a new antagonist of lypopolysaccharide (LPS) induced tumor necrosis factor (TNF) production. Immunobiol 1987;Abstr 175:F2.
90.Alonso JL, Brieva A, Garrido MC, Pivel JP. Serum of AM3-treated mice suppresses the in vitro endotoxin-induced macrophage TNF-activity. En: Proc 2nd Int Conf on Tumor Necrosis Factor and related cytokines. Napa/California (USA), Jan 15-20, 1989;Abstr WA 352.
91.Daniels HM, Meager A, Eddleston ALWF, Alexander GJM, Williams R. Spontaneous TNF-* and IL-1* production during successful interferon-* therapy in chronic hepatitis B virus infection. Lancet 1990;335:875-7.
92.Butler LD, Mohler KM, Layman NK, Cain RL, Riedl PE, Puckett LD, Bendele AM. Interleukin-2-induced systemic toxicity: Induction of mediators and immunopharmacologic intervention. Immunopharmac Immunotox 1989;11:445-87.
93.Meroni G, Villarrubia VG, Álvarez-Mon M, Sada G, Zanussi C. Dose-finding evaluation of AM3 in patients with chronic bronchitis. En: Proc 2nd Int Cong on BRMs (Biological Response Modifiers). January 29-31, 1993. San Diego, California (USA). Abstr 37.
94.Moya P, Baiseras P, Barasoaín I, Rojo JM, Bonda B, Alonso ML, et al. Inmunoferón (AM3) enhances the activities of early-type interferon inducers and natural killer cells. Immunopharmacol Immunotoxicol 1987;9: 243-6.
95.Tuduri P, Pivel JP. Effect of AM3 on survival in immunosuppressed mice infected with Listeria monocytogens. En: Advances in the Biosciences. Vol 68. Great Britain; Pergamon Journals Ltd, 1994. p. 399-41.
96.Rodríguez F, Brieva A, Tuduri P, Velasco R, Martínez A, Rodríguez-Novas G, et al. Estudio de la influencia de un nuevo fármaco sobre el sistema inmune y su relación con la resistencia a la infección provocada en ratón. Rev Clin Esp 1983;169:191-3.
97.Gillissen G, Breuer-Werle M. Influencia de un inmunomodulador sobre la fagocitosis en el test de clearance. Rev Clin Esp 1984;1:17-9.
98.Cañavate ML, Pontón J, Amurrio C, Regulez P, Cañada JL, Saura A, Cisterna Cáncer R. Efecto de un nuevo inmunomodulador sobre la funcionalidad de macrófagos de ratón. Rev Clin Esp 1984;3:159-62.
99.Larrad L, Benito R, Lasierra MP, Spreafico M, Gomez Lus R. Efecto de AM3 sobre la capacidad microbicida de macrófagos esplénicos de conejo en la infección provocada por Brucella abortus. Infectológika 1985;1:38-40.
100.Veneroni G, Álvarez de Mon M, Sada G, Villarrubia VG. Immunomodulatory effects of AM3 in patients with chronic bronchitis. A double-blind clinical trial. En: Proc. 2nd Int Cong on BRM (Biological Response Modifiers). January 29-31, 1993. San Diego, California (USA). Abstr 3.
101.Prieto A, Reyes E, Martínez B, Monserrat J, Bernstein ED, García Calvo C, et al. Defective natural killer and phagocytic activities in COPD are restored by Glycophosphopetical (Inmunoferon). (Sometido a publicación).
102.Phillips B, Marshall ME, Brown S, Thompson JS. Effect of smoking on human natural killer cell activity. Cancer 1985;56:2789-92.
103.Takeuchi M, Nagai S, Izumi T. Effect of smoking on natural killer cell activity in the lung. Chest 1988;94:688-93.
104.Real A, Guenechea G, Bueren JA, Maganto G. Radioprotection mediated by the haemopoietic stimulation conferred by AM5: a protein-associated polysaccharide. Int J Radiat Biol 1992;62:65-72.
105.Guenechea G, Bueren JA, Maganto G, Tuduri P, Guerrero A, Pivel JP, Real A. AM5, a protein-associated polysaccharide, stimulates hematopoiesis and modulates the expression of endogenous hematopoietic growth factors in murine long-term bone marrow cultures. Stem Cells 1995;13:175-84.
106.Doherty TM, Coffman RL. Leishmania antigens presented by GM-CSF derived macrophages protect susceptible mice against challenge with Leishmania major. J Immunol 1993;150:5476-83.
107.García Calvo C. AM3 como adyuvante a la vacunación contra la hepatitis B. Tesis Doctoral. Facultad de Medicina, Universidad Complutense de Madrid (España); 1996.
108.Tolkoff-Rubin NE, Rubin RH. Uremia and host defenses. N Engl J Med 1990;322:770-2.