Evaluar los efectos de un programa de intervención neuropsicológica basado en mindfulness en la evolución clínica de la enfermedad de Alzheimer.
Material y métodoSe realizó un ensayo clínico aleatorizado de dos años de duración a doble ciego. En el estudio participaron 127 personas mayores con enfermedad de Alzheimer probable según criterios de la NINCDS-ADRDA. Se agruparon los enfermos en tres grupos experimentales (estimulación cognitiva, relajación muscular progresiva y mindfulness) y un grupo control. Todos los enfermos estaban en tratamiento con donepezilo. Se evaluaron las capacidades cognitivas con el CAMCOG y MMSE, el área funcional con el RDRS-2 y el área psicopatológica con el NPI. Se desarrollaron tres sesiones a la semana durante 2 años con medidas semestrales de seguimiento.
ResultadosLas mediciones de la función cognitiva global, la funcionalidad y los trastornos de conducta asociados a la demencia indicaron que los enfermos del grupo experimental basado en mindfulness se han mantenido estables durante los dos años, mientras que los controles y el resto de los grupos experimentales muestran un leve pero significativo empeoramiento de sus capacidades mentales.
ConclusiónEl programa de intervención neuropsicológica basado en mindfulness se ha asociado con la estabilidad cognitiva y funcional y mejoras significativas en la situación psicopatológica de los enfermos de Alzheimer en fase leve y moderada. Estos resultados apoyan la idea de que la intervención basada en mindfulness puede producir un beneficio clínicamente relevante en el tratamiento de la demencia. Se debe seguir trabajando en esta línea para confirmar estos datos.
The purpose of this research was to assess effects of a mindfulness based neuropsychological intervention on the clinical course of Alzheimer's disease.
Material and methodA two year randomized and double blind clinical trial was conducted on 127 probable Alzheimer's disease patients, according to NINCDS-ADRDA scale. Patients were grouped into three experimental groups (cognitive stimulation, progressive muscular relaxation, and mindfulness) plus a control group. All participants were receiving donepezil. Cognitive skills were assessed with CAMCOG and MMSE, functional area with RDRS-2, and NPI was used for psychopathology screening. Three treatment sessions per week were carried out for two years, and follow up measurements were taken every six months.
ResultsThe global cognitive function, functionality and behavioral disorders measurements indicated that patients from the experimental group based on mindfulness were stable during the two years, while patients from the control group, as well as the other experimental groups, showed a mild but significant worsening of their mental capacities.
ConclusionThe mindfulness based neuropsychological program showed better cognitive and functional stability, as well as significant improvement in the psychopathological condition of mild to moderate Alzheimer’ patients. These results support the idea that a mindfulness based intervention can produce a clinically relevant improvement in the treatment of dementia. More research is needed to confirm these data.
La práctica de mindfulness o atención plena se puede definir como la conciencia sin prejuicios de la experiencia en el momento presente con una actitud de aceptación y afecto1. Mindfulness produce efectos beneficiosos y específicos sobre los procesos cognitivos2, la actividad cerebral3 y la salud física y mental4, que potencialmente son relevantes para el control clínico de la enfermedad de Alzheimer (EA).
Existe una gran cantidad de documentos científicos que avalan la eficacia de los tratamientos basados en mindfulness en la reducción de síntomas como el estrés4, la hipertensión5, la ansiedad6 y la depresión7, todos ellos factores de riesgo en la EA.
La EA es de etiología multifactorial y su curso se manifiesta mediante una sintomatología heterogénea con déficits en la capacidad cognitiva, funcional y el desarrollo de síntomas psicológicos y conductuales asociados a la demencia (SPCD). Por esta razón, un tratamiento eficaz debe abordar estos aspectos. En este sentido, la práctica basada en mindfulness supone la realización de ejercicios en los que intervienen las capacidades cognitivas implícitas en el desarrollo de las actividades de la vida diaria (AVD) básicas, instrumentales y avanzadas. Además estas prácticas generan un estado de serenidad que favorece la prevención de la psicopatología.
Los tratamientos basados en mindfulness han demostrado que durante su práctica se incrementa la irrigación cerebral en áreas corticales y subcorticales8, incluido el hipocampo3, aumenta la conectividad entre diferentes estructuras cerebrales y la densidad neuronal3,9,10, cambia la función cerebral en estado de reposo11, se activan áreas cerebrales que intervienen en la ejecución de la atención12, la consciencia corporal13 y la regulación emocional14. Todas estas capacidades se deterioran a lo largo de la EA. Por ello, participar de forma activa en un programa basado en mindfulness debería ser beneficioso para las personas mayores con EA.
Los pioneros en adaptar el programa de reducción de estrés basado en mindfulness (MBSR, Mindfulness-Based Stress Reduction)4 en personas mayores con demencia fueron Lantz et al.15. Estos autores desarrollaron un programa de grupo para reducir los SPCD en una residencia. La eficacia de esta intervención en el manejo de la conducta de personas mayores con demencia se ha venido repitiendo en diferentes investigaciones desde entonces16–18. Sin embargo, no tenemos datos sobre su eficacia para evitar la aparición de la comorbilidad psicopatológica en estadios iniciales.
También se ha empezado a aplicar el programa MBSR en personas con deterioro cognitivo leve produciéndose datos prometedores sobre su eficacia en el área cognitiva19. Sin embargo, se deben mejorar los estudios con la realización de ensayos clínicos controlados con más sujetos experimentales. Otras técnicas que podríamos encuadrar dentro de los tratamientos basados en mindfulness, como la práctica del ejercicio de yoga «Kirtan Kriya» o prácticas derivadas del Zen, también están mostrando su utilidad en la mejoría de la cognición en personas mayores con EA leve20–23.
A pesar de que los posibles beneficios de la práctica de mindfulness en la EA podrían ser fáciles de observar, tradicionalmente no ha estado muy claro cómo realizar esta práctica con los enfermos de Alzheimer. El principal obstáculo ha sido el papel que la pérdida de la memoria inmediata juega en el curso de la enfermedad, pues se puede esperar que los enfermos simplemente se olviden de practicar. Para superar este obstáculo, el programa desarrollado por nosotros de estimulación para enfermos de Alzheimer basado en mindfulness, (MBAS, mindfulness-based Alzheimer¿ stimulation) se construyó en torno a tres pilares básicos: 1.°) los cuidadores, 2.°) las AVD básicas e instrumentales y 3.°) la conciencia del momento presente. El objetivo principal ha sido instruir a los cuidadores y enfermos a practicar la atención focalizada del momento presente antes de empezar o durante el desarrollo de las AVD. Para llevar a cabo esta tarea, y para articular la profundización de la práctica de una manera adecuada y significativa, el cuidador y el enfermo acudieron a una sesión de grupo tres veces por semana durante dos años.
El objetivo general de este estudio ha sido explorar si la práctica de mindfulness, añadida al tratamiento farmacológico con donepezilo, puede ser eficaz como tratamiento integral para frenar el deterioro clínico de la EA. Para ello este tratamiento debe mejorar la eficacia que muestra el tratamiento farmacológico sobre dos áreas definidas por consenso24 para paliar la EA: las capacidades cognitivas y funcionales. También se ha introducido la psicopatología porque el tratamiento farmacológico antidemencia también mejora los SPCD. Las hipótesis de las que hemos partido para comprobar la eficacia del tratamiento han sido:
- 1)
El tratamiento de mindfulness con donepezilo será más eficaz que el tratamiento farmacológico aislado (grupo control) en la evolución clínica de la EA.
- 2)
El tratamiento con mindfulness será al menos tan eficaz como el programa basado en relajación en el control de los SPCD. Sin embargo, se espera que el programa de mindfulness sea más eficaz que el grupo de relajación en el mantenimiento de la capacidad cognitiva y funcional.
- 3)
No se espera que la práctica de mindfulness presente una mejor evolución en el área cognitiva que el grupo de estimulación cognitiva, pues en este se entrenan específicamente estas capacidades. Sin embargo, se espera una mejoría en el área funcional y psicopatológica pues el entrenamiento de mindfulness está orientado hacia estas áreas.
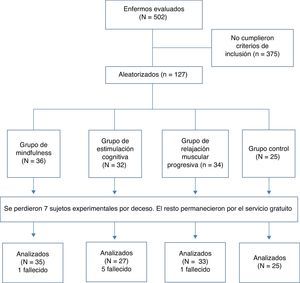
La muestra inicial estuvo constituida por 127 sujetos que cumplieron los criterios de inclusión. Se realizó una evaluación neuropsicogeriátrica integral25 de 502 personas mayores con diagnóstico de EA. Los candidatos acudieron voluntariamente a la Unidad de detección de problemas de memoria Marjorie Warren de la Fundación Canaria Lidia García entre el año 2009 y 2010. En la figura 1 se puede observar la inclusión de los participantes en el estudio siguiendo las directrices de Moher et al26.
Diagrama de flujo de las fases del ensayo clínico controlado aleatorizado longitudinal Alzheimer Canarias. Fuente: Moher et al.26.
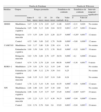
Los sujetos del estudio no presentaban diferencias en variables sociodemográficas (edad, género, estado civil, residencia, formación académica, profesión), y clínicas (años de evolución de la enfermedad, dislipemias, hormonas tiroideas, historia de psicopatología, etc.) como puede observarse en la tabla 1. Las personas interesadas en una descripción más detallada de la muestra pueden solicitarla al investigador principal.
Características sociodemográficas y clínicas de la muestra previas al estudio
| Variables sociodemográficas | Estadísticos de contraste | ||
| Kruskal-Wallis | Valor de p | ||
| Género | 120 | 1,74 | 0,62 |
| Mujeres | 66 | ||
| Hombres | 54 | ||
| Edad | |||
| Media | 80,11±6,74 | 9,24 | 0,25 |
| Estado civil | 1,72 | 0,63 | |
| Soltero | 5 | ||
| Casado | 73 | ||
| Viudo | 42 | ||
| Población | 1,89 | 0,60 | |
| Rural | 42 | ||
| Urbano | 78 | ||
| Formación académica | 4,27 | 0,23 | |
| Sin formación | 1 | ||
| Estudios primarios | 106 | ||
| Bachillerato | 21 | ||
| Universitarios | 12 | ||
| Profesión | 3,24 | 0,36 | |
| Ama de casa | 75 | ||
| Obrero no especializado | 24 | ||
| Obrero especializado | 22 | ||
| Administrativo | 13 | ||
| Técnico medio | 7 | ||
| Maestro | 4 | ||
| Otros universitarios | 4 | ||
| Empresario | 12 | ||
| Variables clínicas | % de enfermos | Kruskal-Wallis | Valor de p | |
| HTA | 51,6 | 1,26 | 0,74 | |
| DM I | 3,1 | 2,57 | 0,46 | |
| DMII | 11,2 | 6,93 | 0,07 | |
| TSH | 8,1 | 2,09 | 0,55 | |
| Dislipemias | 39,1 | 9,94 | 0,01* | |
| Psicopatología | 44,1 | 3,19 | 0,36 | |
| Consumo antidepresivos | 31,7 | 0,80 | 0,85 | |
| Consumo ansiolíticos | 31,7 | 0,99 | 0,80 | |
| Consumo antipsicóticos | 3,1 | 2,23 | 0,52 | |
| Biomarcador | APO-E | 3,62 | 0,30 | |
| 2/3 | 2 | |||
| 3/3 | 58 | |||
| 3/4 | 24 | |||
| 4/3 | 21 | |||
| 4/4 | 15 | |||
Personas mayores de 65 años con «EA probable» según los criterios de la NINCDS-ARDA27,28 en fase leve o moderada con una puntuación en el MMSE mayor o igual a 18 puntos29 correspondiente a un estadio de deterioro global (GDS) de Reisberg30 3 o 4. También tenían que vivir en su domicilio y estar en tratamiento farmacológico con donepezilo.
Criterios de exclusiónCualquier enfermedad neurológica que no fuera «EA probable» en un estadio leve o moderado, por ejemplo «EA posible»27, demencias de origen vascular, asociadas a Parkinson, cuerpos de Lewy, etc. Se excluyeron todos los casos en tratamiento con rivastigmina, galantamina y/o memantina y personas que acudieran a centros de día.
También se eliminaron de la muestra inicial los enfermos con síntomas psicológicos y conductuales graves, abuso de sustancias tóxicas y una enfermedad sistémica inestable o tan evolucionada que posiblemente redujera la esperanza de vida a menos de dos años.
InstrumentosSe ha realizado un protocolo de evaluación neuropsicológica centrado en tres áreas clínicas: la eficacia cognitiva, el desempeño funcional y la psicopatología. A la vista de nuestro objetivo, y de la conveniencia de mostrar los efectos de la intervención en las áreas afectadas por la EA, se ha utilizado la siguiente batería de instrumentos:
- •
Medidas de eficacia cognitiva: pruebas cognitivas incluidas en el CAMDEX-R31 (MMSE y CAMCOG). Las áreas evaluadas en el CANCOG son: 1.) orientación; 2.) lenguaje (comprensión: respuesta motora y verbal, comprensión lectora; expresión: denominación, definiciones, repetición, lenguaje espontáneo; 3.) memoria (fijación; recuerdo: imágenes, información reciente y remota; reconocimiento); 4.) atención-concentración; 5.) praxis (copia y dibujo; escritura: espontánea y dictada; praxis ideacional, ideomotora y reconocimiento táctil); 6.) cálculo; 7.) función ejecutiva; 8.) pensamiento abstracto: semejanzas y 9.) percepción visual: reconocimiento de personas, objetos, funciones. Las áreas evaluadas en el CANCOG son: 1) orientación; 2) lenguaje (comprensión: respuesta motora y verbal, comprensión lectora; expresión: denominación, definiciones, repetición, lenguaje espontáneo); 3) memoria (fijación; recuerdo: imágenes, información reciente y remota; reconocimiento); 4) atención-concentración; 5) praxis (copia y dibujo; escritura: espontánea y dictada; praxis ideacional, ideomotora y reconocimiento táctil); 6) cálculo; 7) función ejecutiva (pensamiento abstracto: semejanzas) y 8) percepción visual (reconocimiento de personas, objetos y funciones).
Las características psicométricas del CAMDEX-R31 han mostrado que el CAMCOG muestra una fiabilidad con un coeficiente «Phi» 0,90 y una correlación de Pearson de 0,97. La validez del CAMCOG presenta una sensibilidad del 95% y una especificidad del 96%. Los datos de validez en esta prueba para el MMSE muestran una sensibilidad del 96% y especificidad del 80%. En nuestro estudio solo hemos utilizado la puntuación general que se deriva de los indicadores citados.
- •
Escala de valoración funcional: la escala de la evaluación rápida de la discapacidad (RDRS-2)32. Esta escala mide la ayuda para las AVD, el grado de incapacidad y problemas especiales del enfermo. Se decidió incluir esta escala por ser un instrumento utilizado ampliamente en demencias32 con una fiabilidad con un coeficiente intraclase de 0,86 y un alfa de Cronbach de 0,91. La validez de la escala presenta un 82% de sensibilidad y un 88% de especificidad.
- •
Medida psicopatológica: el inventario neuropsiquiátrico (NPI)33. Esta escala está formada por 12 ítems que evalúan 10 áreas de comportamiento: delirios, alucinaciones, agitación-agresividad, depresión-disforia, ansiedad, exaltación-euforia, apatía-indiferencia, desinhibición, irritabilidad-labilidad, conducta motora anómala, sueño y apetito. Las características psicométricas del NPI en su adaptación española33 muestran una fiabilidad con un coeficiente «Phi» 0, 85 y un alfa de Cronbach de 0,85. Los valores de la validez muestran una sensibilidad de 95% para la escala de depresión, de 88% para la escala de alucinaciones y de 100% para todas las restantes. En cuanto a la especificidad los valores obtenidos giraban en torno al 85% (apatía/indiferencia) y 100% (alucinaciones).
El diseño seleccionado para el estudio ha sido un ensayo clínico controlado aleatorizado (ECA) a doble ciego de dos años de duración. Se realizó un diseño de medidas repetidas con una medida inicial antes de iniciar el tratamiento y cuatro medidas de seguimiento semestrales. La evaluación era realizada por el neuropsicólogo de la unidad de memoria que no intervenía en la aplicación de los tratamientos.
Se comparó la combinación de donepezilo y mindfulness con otros tratamientos integrales utilizados tradicionalmente (estimulación cognitiva y relajación muscular progresiva) y un grupo control de cuidados habituales en el hogar en tratamiento farmacológico. Todos los sujetos experimentales que participaron en el estudio estaban en tratamiento farmacológico antidemencia, pues su ausencia no es ética. Los tres tratamientos experimentales, MBAS, relajación muscular progresiva y estimulación cognitiva fueron implementados por tres psicólogos clínicos independientes.
La participación en el estudio fue siempre voluntaria y requería la lectura, comprensión y firma de un consentimiento informado por parte del enfermo y el cuidador principal. Cuando un enfermo cumplía los criterios de inclusión, la administrativa cegada de la unidad de memoria se encargaba de asignarlos aleatoriamente a alguno de los grupos del estudio denominados A, B, C y D.
IntervenciónLos tres grupos experimentales realizaron cada semana tres sesiones grupales de 90 minutos a lo largo de dos años, resultando un total de 288 sesiones. El grupo experimental de estimulación cognitiva realizó una intervención basada en el programa de psicoestimulación integral (PPI)34, el grupo de relajación desarrolló un programa basado en la relajación muscular progresiva35, mientras que el grupo de mindfulness se basó en un modelo que combinaba prácticas adaptadas del MBSR4,17, las prácticas de «Kirtan Kriya»22 y ejercicios de integración sensorial36.
Los ejercicios del programa de mindfulness han sido desarrollados en un doble formato17: prácticas formales desarrolladas en las sesiones grupales y prácticas informales en casa.
Durante las prácticas formales se ha seguido la siguiente secuencia de ejercicios:
- 1.
Orientación temporal y espacial: se comenzaba cada clase tomando consciencia del lugar en el que se está sentado, reconociendo a cada uno de los miembros del grupo, especialmente los situados a nuestra derecha e izquierda. Se finalizaba esta primera fase verbalizando el deseo de tener una sesión en armonía, sin dificultades en la que se pueda estar en paz para practicar y estimular la atención al presente. Esta práctica es un ejercicio de «meditación Metta»37.
- 2.
Se realizan ejercicios de yoga en silla, por ejemplo el participante permanece tumbado y levanta los pies apoyándolos sobre una silla, o simplemente flexiona la cintura con el puño cerrado e intenta tocar los pies, etc.
- 3.
Ejercicio de atención a la respiración, simplemente observar y concentrarse como entra y sale el aire por la nariz4.
- 4.
Ejercicio guiado de atención plena basado en el «escaneo corporal» propuesto por Kabat-Zinn4. Este ejercicio se basa en recorrer mentalmente el cuerpo mientras se presta atención a las sensaciones corporales como frío, calor, cosquilleo, dolor, etc.
- 5.
Ejercicio de atención plena basado en el «Kirtan Kriya»25. Este ejercicio se basa en la unión sucesiva del dedo pulgar con cada uno de los dedos mientras se canta un mantra Saa, Taa, Naa, Maa y se realiza una visualización.
- 6.
Ejercicio guiado de atención plena basado en alguno de los cinco sentidos17,36 durante 10 minutos. Se realizan diferentes ejercicios mediante visualizaciones, discriminación auditiva de sonidos, aromaterapia con inciensos, masajes, etc.
El segundo apartado del programa, la práctica informal en casa, se basa en la elección de 10 momentos durante el día donde el enfermo y el cuidador pudieran practicar los ejercicios aprendidos en las sesiones. Se les recomendaba 3 minutos antes de las comidas, antes de levantarse y antes de dormirse y durante 2 o 3 paseos diarios en mañana o tarde.
Análisis estadísticoEn este estudio se ha realizado un análisis estadístico con pruebas no paramétricas porque los resultados no presentan una distribución normal en todas las variables utilizadas para medir la eficacia de la intervención.
La normalidad de la muestra y la homogeneidad de las varianzas se comprobó mediante la aplicación del estadístico de Kolmogorov-Smirnov con las probabilidades de Lillieffors para el caso y la varianza de poblaciones desconocidas que necesitan ser estimadas en las principales variables del estudio. Las probabilidades obtenidas fueron: área cognitiva (CAMCOG: p=0,02; MMSE: p=0,04), funcionalidad (RDRS-2: p=0,02) y psicopatología (NPI: p=0,00).
Las pruebas no paramétricas se dividieron en análisis intragrupo e intergrupo. Los análisis intragrupo se realizaron para conocer la evolución de las puntuaciones en el grupo de forma longitudinal, y análisis intergrupo para saber qué tratamiento era más eficaz. Las diferencias intragrupo generales se analizaron con la prueba de Friedman, aplicando la prueba Wilcoxon con la corrección de Bonferroni cuando existían diferencias significativas para conocer a partir de cuándo se producía un deterioro significativo en las diferentes capacidades. El análisis de las diferencias intergrupos se realizó con las pruebas H de Kruskal-Wallis para analizar diferencias generales, aplicando posteriormente la prueba Mann-Whitney con la corrección de Bonferoni para establecer entre qué grupos existían diferencias. En todos los casos se han considerado significativas aquellas diferencias con p<0,05, teniendo en cuenta que la corrección de Bonferroni permite tomar decisiones probabilísticas para estimar las diferencias intragrupo con una p<0,005 y para las diferencias intergrupo con una p<0,008.
ResultadosLos resultados se van a exponer teniendo en cuenta las variables cognitivas, funcionales y psicopatológicas. En la tabla 2 se pueden observar los estadísticos descriptivos de las diferentes variables durante el estudio.
Evolución de las puntuaciones en el Estudio Longitudinal Canarias Alzheimer
| Medidas | Grupos | Estadísticos | Línea base | 6 meses | 12 meses | 18 meses | 24 meses |
| MMSE | Mindfulness | Media | 22,45 | 22,31 | 21,48 | 21,65 | 20,85 |
| Desv. típ. | 2,80 | 3,17 | 3,45 | 3,34 | 3,80 | ||
| Estimulación cognitiva | Media | 23,67 | 22,44 | 22,07 | 21,04 | 19,19 | |
| Desv. típ. | 3,11 | 4,06 | 3,67 | 4,18 | 6,12 | ||
| Relajación muscular | Media | 21,87 | 21,52 | 19,64 | 19,39 | 17,52 | |
| Desv. típ. | 3,36 | 3,93 | 4,67 | 5,78 | 7,20 | ||
| Control | Media | 21,60 | 19,80 | 18,12 | 15,56 | 14,12 | |
| Desv. típ. | 2,42 | 3,57 | 3,90 | 5,15 | 5,11 | ||
| CAMCOG | Mindfulness | Media | 71,40 | 72,46 | 71,17 | 71,20 | 68,49 |
| Desv. típ. | 9,80 | 10,73 | 11,70 | 11,97 | 14,50 | ||
| Estimulación cognitiva | Media | 75,22 | 72,22 | 69,22 | 65,19 | 59,48 | |
| Desv. típ. | 9,28 | 12,68 | 14,08 | 19,11 | 22,13 | ||
| Relajación muscular | Media | 67,24 | 66,09 | 62,00 | 60,79 | 52,42 | |
| Desv. típ. | 8,99 | 11,50 | 14,27 | 16,02 | 20,47 | ||
| Control | Media | 66,84 | 60,12 | 52,08 | 48,76 | 41,32 | |
| Desv. típ. | 7,93 | 10,03 | 15,53 | 16,35 | 17,17 | ||
| NPI | Mindfulness | Media | 10,71 | 9,09 | 8,03 | 8,00 | 9,29 |
| Desv. típ. | 18,40 | 13,98 | 9,22 | 8,49 | 8,13 | ||
| Estimulación cognitiva | Media | 13,93 | 21,15 | 23,44 | 24,74 | 22,48 | |
| Desv. típ. | 21,13 | 17,26 | 16,23 | 12,85 | 14,62 | ||
| Relajación muscular | Media | 11,45 | 12,79 | 18,79 | 18,91 | 23,21 | |
| Desv. típ. | 15,41 | 13,68 | 14,36 | 12,76 | 15,92 | ||
| Control | Media | 14,56 | 20,00 | 22,60 | 26,84 | 27,92 | |
| Desv. típ. | 22,14 | 22,76 | 17,38 | 16,57 | 15,42 | ||
| RDRS-2 | Mindfulness | Media | 25,06 | 26,83 | 25,86 | 27,09 | 26,82 |
| Desv. típ. | 3,32 | 5,43 | 5,76 | 7,76 | 6,49 | ||
| Estimulación cognitiva | Media | 29,19 | 30,07 | 29,70 | 29,60 | 31,96 | |
| Desv. típ. | 7,88 | 8,07 | 7,75 | 7,27 | 10,60 | ||
| Relajación muscular | Media | 26,67 | 29,03 | 28,91 | 28,94 | 29,25 | |
| Desv. típ. | 4,88 | 4,95 | 5,79 | 6,89 | 5,63 | ||
| Control | Media | 28,64 | 31,32 | 34,32 | 35,44 | 40,92 | |
| Desv. típ. | 5,08 | 6,53 | 7,67 | 10,17 | 10,73 |
En la tabla 3 se puede observar la evolución clínica global que ha tenido cada uno de los grupos a lo largo del estudio. Lo más destacable es que el grupo control, únicamente tratado con donepezilo, se deterioró significativamente en todas las variables, mientras que los grupos de estimulación cognitiva y relajación lo hicieron en la capacidad cognitiva y psicopatología. El grupo de mindfulness no presentó diferencias significativas en sus puntuaciones a lo largo del estudio.
Análisis no paramétricos intragrupos
| Prueba de Friedman | Prueba de Wilcoxon | ||||||||||
| Medidas | Grupos | Rangos promedio | Estadísticos de contraste | Estadísticos de contraste | Intervalo temporal significativo | ||||||
| Línea base | 6 meses | 12 meses | 18 meses | 24 meses | Chi-cuadrado | Valor de p. | Z | Valor de p. | |||
| MMSE | Mindfulness | 3,47 | 3,39 | 2,74 | 2,93 | 2,47 | 11,08 | 0,025* | −2,31 | 0,020 | No existen |
| Estimulación cognitiva | 3,85 | 3,09 | 3,13 | 2,89 | 2,04 | 19,52 | 0,001* | −3,37 | 0,001** | 24 meses | |
| Relajación muscular | 3,73 | 3,55 | 2,94 | 2,53 | 2,26 | 22,37 | 0,000* | −3,297 | 0,001** | 12 meses | |
| Control | 4,52 | 3,60 | 3,08 | 2,02 | 1,78 | 54,99 | 0,000* | −3,60 | 0,000** | 12 meses | |
| CAMCOG | Mindfulness | 3,01 | 3,17 | 3,00 | 3,26 | 2,56 | 4,14 | 0,39 | No existen | ||
| Estimulación cognitiva | 3,89 | 3,59 | 3,04 | 2,72 | 1,76 | 30,42 | 0,000* | −3,22 | 0,001** | 18 meses | |
| Relajación muscular | 3,82 | 3,58 | 2,88 | 2,76 | 1,97 | 28,54 | 0,000* | −4,1 | 0,000** | 24 meses | |
| Control | 4,74 | 3,76 | 2,78 | 2,28 | 1,44 | 66,58 | 0,000* | −3,36 | 0,001** | 6 meses | |
| RDRS−2 | Mindfulness | 2,79 | 3,01 | 2,79 | 3,21 | 3,19 | 2,49 | 0,65 | No existen | ||
| Estimulación cognitiva | 2,62 | 3,06 | 3,12 | 2,70 | 3,50 | 5,41 | 0,25 | No existen | |||
| Relajación muscular | 2,46 | 3,35 | 3,13 | 2,87 | 3,19 | 5,49 | 0,24 | No existen | |||
| Control | 1,78 | 2,32 | 3,10 | 3,36 | 4,44 | 43,55 | 0,000* | −3,58 | 0,000** | 12 meses | |
| NPI | Mindfulness | 2,86 | 2,96 | 2,91 | 2,97 | 3,30 | 2,60 | 0,63 | No existen | ||
| Estimulación cognitiva | 2,06 | 2,94 | 3,35 | 3,57 | 3,07 | 15,45 | 0,004* | −2,087 | 0,037 | 24 meses | |
| Relajación muscular | 1,91 | 2,23 | 3,33 | 3,17 | 4,36 | 54,33 | 0,000* | −3,94 | 0,000** | 12 meses | |
| Control | 2,24 | 2,74 | 2,78 | 3,64 | 3,6 | 15,93 | 0,003* | −2,94 | 0,003** | 24 meses | |
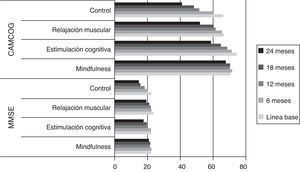
La figura 2 muestra la evolución de las puntuaciones cognitivas globales. Los datos en el MMSE muestran cómo se producen diferencias significativas entre los grupos experimentales y el control. A partir de los 12 meses con estimulación cognitiva (X2=170,5; p=0,002) y mindfulness (X2=233,000; p=0,002), y a partir de los 18 meses con relajación (X2=224,000; p=0,003).
En el CAMCOG se produjeron diferencias significativas desde el inicio del estudio (X2=13,278; p=0,004). Estas diferencias se produjeron a favor del grupo de estimulación cognitiva en comparación con el control (X2=168,500; p=0,002) y el de relajación (X2=242,000; p=0,002). Es importante destacar que estas diferencias se mantuvieron con el grupo control durante todo el estudio (p.ej. 24 meses: X2=134,500; p=0,000), sin embargo desaparecieron con el grupo de relajación desde los 6 meses (X2=287,000; p=0,018) hasta el final del estudio (X2=341,500; p=0,122). Por tanto, el grupo de relajación y estimulación cognitiva son equivalentes a lo largo del estudio en la cognición medida con el CAMCOG.
El grupo de mindfulness muestra puntuaciones significativas desde los 6 meses en comparación con el grupo control (X2=176,500; p=0,000) y desde los 12 meses con el de relajación (X2=335,500; p=0,003).
En resumen, la capacidad cognitiva medida en este estudio con las pruebas cognitivas del CAMDEX-R (CAMCOG y MMSE) muestra una equivalencia entre los grupos de estimulación cognitiva y mindfulness en esta capacidad. Si bien el grupo mindfulness presenta una mayor tendencia al mantenimiento de las mismas. También es importante destacar que el grupo de mindfulness evoluciona mejor a lo largo del estudio que los grupos de relajación y el control, mientras que el de estimulación cognitiva solo mejor que el control.
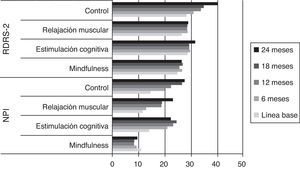
Capacidad funcionalEn la figura 3 puede observarse la evolución en la evaluación de la capacidad funcional medida con el RDRS-2. Los datos muestran cómo se producen diferencias significativas generales entre los grupos experimentales y el control a partir de los seis meses (X2=8,319; p=0,040). Sin embargo, el análisis de los grupos mostró que las diferencias se producen desde los 12 meses con el grupo de mindfulness (X2=162,000; p=0,000) y al final del estudio (24 meses) con el grupo de relajación (X2=122,000; p=0,006) y el de estimulación cognitiva (X2=153,500; p=0,002).
En conclusión, no existen prácticamente diferencias significativas en la capacidad funcional, salvo las diferencias desde los doce meses del estudio a favor del grupo de mindfulness en comparación con el de control. Estos datos eran esperables, pues los sujetos están en una estadio leve moderado de la enfermedad y estas capacidades se mantienen más estables en esta etapa. No obstante, es importante destacar que si se entrena específicamente esta área se produce una mejoría desde el primer seguimiento.
Alteraciones psicopatológicasLa evaluación de la psicopatología medida con el NPI mostró cómo se producen diferencias significativas entre los diferentes grupos a partir de los seis meses (X2=10,712; p=0,013). Estas diferencias se producen únicamente a favor del grupo de mindfulness en comparación con el resto de los grupos. El análisis de los grupos mostró que mindfulness presenta mejores puntuaciones en comparación con el grupo de estimulación cognitiva desde los 6 meses (X2=261,5; p=0,002), mientras que cuando se compara con el de relajación (X2=301,000; p=0,001) y el control (X2=210,000; p=0,001) lo hace desde los 12 meses.
Los datos del área psicopatológica parecen mostrar que la práctica de un tratamiento orientado a la disminución de los síntomas psicopatológicos previene la aparición de la psicopatología comórbida en el curso clínico de la EA. En la figura 3 puede observarse la evolución de estas puntuaciones.
DiscusiónEn la última década ha habido un estancamiento en el desarrollo de nuevos fármacos antidemencia38. Sin embargo, desde diferentes disciplinas neurorrehabilitadoras se han seguido proponiendo tratamientos alternativos39. En esta línea se ha propuesto el MBAS, pues se esperaba que se consiguiera un efecto positivo sobre la evolución clínica de la EA en el mantenimiento de la capacidad cognitiva, funcional y psicopatológica, que ha sido nuestra primera hipótesis. En este sentido, este estudio muestra cómo un tratamiento combinado entre donepezilo y mindfulness produce un mayor beneficio clínico global que el tratamiento farmacológico aislado o con otras combinaciones con estimulación cognitiva o relajación. De esta forma hemos respondido a la segunda hipótesis, pues de forma general el mindfulness presenta una mejor evolución a largo plazo en todas las variables, salvo en el MMSE, que la práctica con relajación muscular.
Por último, queremos destacar que en el área cognitiva el MBAS, en comparación con el grupo de estimulación cognitiva, se ha mostrado tan eficaz o incluso mejor, pues las puntuaciones intragrupo no muestran una pérdida de puntuación significativa, aspecto que sí se produce en aquel grupo desde los 18 meses. Además, el mindfulness también muestra un claro efecto beneficioso sobre la psicopatología desde los 6 meses del estudio. En este sentido, respondemos adecuadamente a la tercera hipótesis del estudio, a la vez que nos surge un nuevo planteamiento de por qué estás prácticas preservan la capacidad cognitiva global en la EA.
Este estudio nos permite plantear nuevas hipótesis explicativas sobre el efecto global del mindfulness en la EA. En primer lugar, el desarrollo de tareas orientadas hacia las AVD permite la estimulación implícita de las capacidades cognitivas globales. Además, el entrenamiento continuado de la atención sostenida preserva la codificación de la información, mejorándose potencialmente las rutas frontales. Esto favorecería que se mantenga la funcionalidad y se prevenga la aparición de la psicopatología.
En general estos hallazgos son importantes porque permiten plantear la posibilidad de contar con un nuevo tratamiento no farmacológico para la EA. Este, añadidos a los ya existentes, como la estimulación cognitiva o la estimulación cognitiva enriquecida40 ofrece la oportunidad de mejorar la atención a la enfermedad y favorecer la calidad de vida de los enfermos y sus familiares en un estadio leve o moderado de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses