El dolor irruptivo se define como una exacerbación aguda del dolor de rápida aparición, corta duración y de intensidad moderada o elevada, que ocurre de forma espontánea o en relación con un evento predecible o no predecible a pesar de existir un dolor basal estabilizado y controlado. Sin embargo, existen dudas sobre la definición, terminología, epidemiología y valoración del dolor irruptivo sin una clara contestación y consenso, especialmente en la población anciana. En esta revisión no sistematizada se intentarán sintetizar y resumir los aspectos más relevantes del dolor irruptivo en los ancianos en base a las escasas publicaciones existentes en dicho grupo poblacional.
Breakthrough pain is defined as an acute exacerbation of pain with rapid onset, short duration and moderate or high intensity, which occurs spontaneously or in connection with a predictable or unpredictable event despite there being stabilised and controlled baseline pain. However, there are doubts about the definition, terminology, epidemiology, and assessment of breakthrough pain, with no clear answers or consensus, especially in the elderly population. This non-systematic review summarises the most important aspects of breakthrough pain in the elderly, based on the limited publications there are in that population group.
El dolor es una experiencia sensorial y emocional compleja, multidimensional, que abarca percepciones, emociones y comportamientos. El dolor crónico es un problema muy prevalente, que afecta al 11% de la población, alcanzando el 25-40% de la población anciana que vive en la comunidad, pero llegando al 70% de la población institucionalizada1. Este dolor contribuye a generar problemas de incapacidad funcional, está condicionado por aspectos mentales e influenciado por aspectos sociales del entorno, y su diagnóstico puede pasar desapercibido, perpetuándose en el tiempo, disminuyendo la calidad de vida e incrementando el consumo de recursos sanitarios y sociales.
Portenoy y Hagen describieron hace más de 25 años el cuadro de dolor irruptivo (DI) y lo definieron como una exacerbación transitoria del dolor experimentado por un paciente relativamente estable y con adecuado control del dolor basal2. Desde entonces, y a pesar de un amplio cuerpo doctrinal, persisten preguntas sobre la definición, terminología, epidemiología y valoración sin una clara contestación y consenso3, a lo que hay que añadir la escasa representación de la población anciana en los estudios en los que se analiza el DI, y por tanto la imposibilidad de extrapolar los resultados obtenidos en los estudios a dicha población. En este artículo se intentará sintetizar/resumir los aspectos más relevantes del DI en los ancianos en base a las escasas publicaciones existentes en dicho grupo poblacional.
Definición y epidemiologíaDefiniciónLa definición de DI varía entre diferentes países, utilizándose distintos términos. El término utilizado en inglés (breakthrough) no tiene una traducción fácil en castellano o en italiano4. La definición y nomenclatura de DI se basa en el dolor oncológico, trasladándose posteriormente al dolor no oncológico.
Davies et al.5 definieron el DI como una exacerbación aguda del dolor de rápida aparición, corta duración y de intensidad moderada o elevada, que ocurre de forma espontánea o en relación con un evento (trigger: gatillo) predecible o no predecible a pesar de existir un dolor basal estabilizado y controlado.
En ocasiones, tanto en la práctica como en la literatura científica, se utiliza el término de forma inadecuada al referirse a cualquier episodio de dolor que aparece en pacientes con dolor crónico, e incluso para episodios dolorosos en pacientes que no lo padecen, debiendo utilizarse únicamente el término de DI para describir los episodios de dolor que cumplen los criterios diagnósticos6.
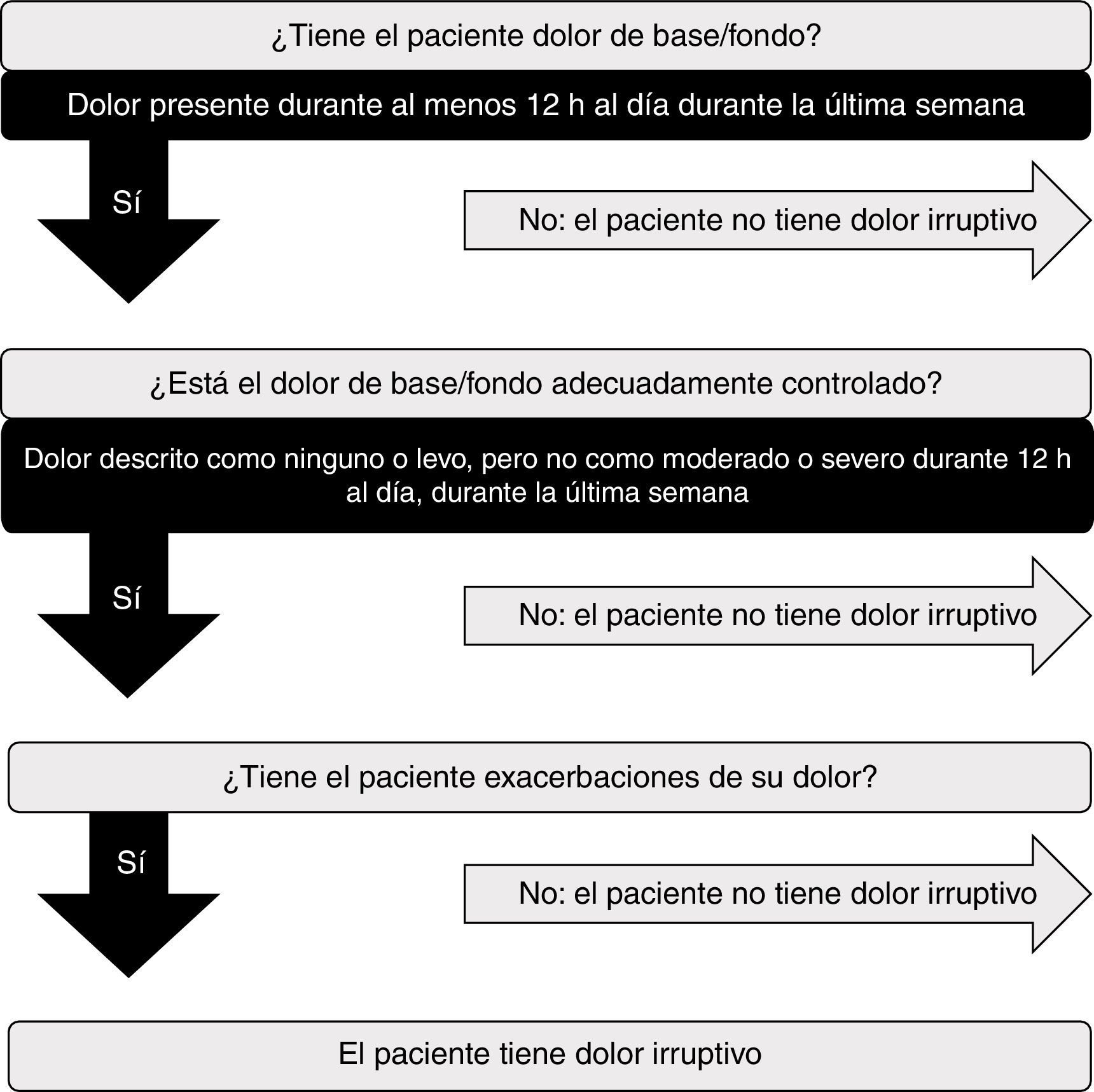
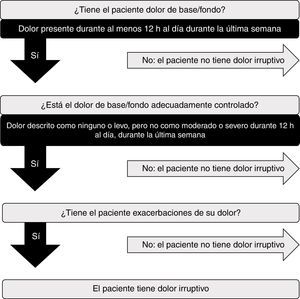
Se ha propuesto algún algoritmo sencillo que en base a la respuesta afirmativa de 3 preguntas pueda ayudarnos al diagnóstico5:
- 1.
¿El paciente tiene un dolor basal (dolor presente más de 12h al día durante las semanas previas)?
- 2.
¿Está el dolor basal controlado de una forma adecuada (dolor definido como ausente o moderado durante más de 12h al día en las semanas previas)?
- 3.
¿Tiene el paciente exacerbaciones transitorias del dolor?
La prevalencia de DI oncológico varía ampliamente entre el 40 y el 80% y esto es la consecuencia de la gran heterogeneidad en la metodología utilizada7. En un estudio de la International Association for the Study of Pain se obtuvo una prevalencia del 64,8% en 1.095 pacientes con dolor oncológico, mayor en aquellos con un dolor basal de mayor intensidad y con deterioro funcional8. Aunque es más frecuente en las fases avanzadas (89%) de la enfermedad neoplásica, tiene un mayor impacto en las fases iniciales (35%), donde debe ser evaluado de una forma más exhaustiva9. El DI es consecuencia directa de la neoplasia en el 70-80% de los casos, como consecuencia del tratamiento en el 10-20%, y en el 10% restante es de otro origen no relacionado con el proceso neoplásico; además, es posible identificar el «trigger» en la mitad de los pacientes10.
En un estudio multicéntrico11 que incluía 13 países y 1.000 pacientes con DI, el 44% presentaba un dolor de tipo incidental, el 41,5% era de tipo espontáneo o idiopático y el 14,5% era de tipo mixto. El número medio de episodios de DI era de 3 al día, el tiempo medio para alcanzar la máxima intensidad del dolor era de 10min y aquellos de tipo incidental eran más lentos. La duración media del episodio era de 60min, siendo la intensidad del dolor leve en el 4%, moderado en el 34% y grave en el 62% de los casos. Desde un punto de vista epidemiológico, se debe diferenciar la prevalencia e incidencia del DI de tipo oncológico de aquel no oncológico.
Recientemente se ha realizado una revisión sistemática12 de 27 artículos para conocer la prevalencia del DI en el paciente oncológico. La prevalencia global era del 59,2%, obteniéndose la prevalencia más baja (39,9%) en pacientes ambulatorios y las más alta (80,5%) en los hospitalizados.
En España, un estudio realizado en 2002 en pacientes oncológicos bajo cuidados paliativos presenta una prevalencia de DI del 41%, con una frecuencia de 1-5 episodios por paciente y día y una intensidad de 7,3 utilizando la escala analógica visual. Este estudio también objetivó cómo el 25% de los pacientes con DI no recibían tratamiento13.
No existe ningún estudio epidemiológico sobre la incidencia del DI en población exclusivamente anciana, si bien en la revisión realizada por Deandrea et al.12 en 2014 se incluyen 8 artículos13–20 en los que la edad media de los pacientes es>65 años, por lo que su análisis podría estimar de forma más o menos real la incidencia de DI en dicha población. La media de edad de dichos artículos es de 70 años, con una incidencia media de DI del 49,1%, que la sitúa dentro del rango observado en la población general en dicha revisión (entre el 40-80%).
El National Breakthrough Pain Study21 es un estudio observacional, sobre un total de 1.278 pacientes con dolor crónico no oncológico, que identifica a 1.023 (80%) con DI. Este dato es superior a la prevalencia del 48 y 74% obtenida en otros estudios22.
Portenoy et al. realizaron un estudio sobre la prevalencia de DI no oncológico, obteniendo una prevalencia del 74% en el grupo no oncológico, que era superior a la del grupo oncológico (51-64%), si bien la frecuencia del dolor era de 2 episodios al día, ligeramente inferior a la del grupo oncológico (4 episodios al día). El tiempo hasta alcanzar la máxima intensidad y la duración media era similar en ambos grupos23. La localización del DI no oncológico era en columna lumbar (52%), y con relación a sus características fisiopatológicas, eran somáticas (38%), neuropáticas (18%), viscerales (4%) o mixtas (40%).
En contraste con el dolor oncológico, que ha sido bien estudiado, no hay muchas evidencias sobre el impacto que el dolor no oncológico tiene sobre el estado general de salud.
En un estudio de la American Pain Foundation se demostró que el DI afecta al estado emocional en el 82% de los pacientes, a la capacidad para realizar las actividades de la vida diaria en el 76% y al 83% de los pacientes les impide participar de forma voluntaria en diversas actividades24.
Características y valoración del dolor irruptivo en el ancianoEl DI se asocia con un mal pronóstico, y un manejo adecuado depende de la combinación de una correcta valoración, un tratamiento individualizado apropiado y una adecuada reevaluación.
CaracterísticasEl DI es un dolor heterogéneo, con variaciones intra- e interindividuales. Los episodios, incluso en el mismo individuo, pueden tener características muy diferentes, lo que dificulta su adecuada identificación y valoración. Los episodios de DI se caracterizan por25:
- -
Comienzo rápido y de elevada intensidad (escala analógica visual≥7).
- -
Alcanzan la máxima intensidad en un tiempo breve (3-5).
- -
Duración media de 15-30min.
- -
Suele presentarse en la misma localización que el dolor basal y, en general, es provocado por el mismo mecanismo fisiopatológico.
- -
Varios episodios a lo largo del día (media 1-4).
- -
Parece haberse identificado un patrón circadiano del DI, el 60% ocurre entre las 10-18h, lo que supone una reducción del uso de medicación de rescate durante la noche o primeras horas de la mañana26.
- -
En la mayoría de los pacientes, los episodios de DI interfieren con sus actividades diarias6.
Dentro de la valoración del DI, debemos considerar 2 tipos27:
- •
Dolor incidental: se desencadena tras realizar un movimiento (voluntario o involuntario) o una actividad física. El dolor incidental constituye un factor predictor de pobre respuesta farmacológica. Incluye 3 subtipos:
- o
Predecible o volitivo: aquel en el que hay una clara relación causal con el movimiento (al levantarse, cambiar de postura, masticar…).
- o
Impredecible o no volitivo: desencadenado por factores involuntarios, como espasmos vesicales o intestinales.
- o
Procedimental: relacionado con un procedimiento terapéutico (al curar una herida…).
- o
- •
Dolor idiopático o espontáneo: no existen desencadenantes identificados, aparece sin previo aviso. Su duración suele ser mayor que el incidental, interfiere más con la funcionalidad y el manejo resulta más complejo, debido a que no es posible prevenir su aparición.
En líneas generales, los episodios de dolor incidental tardan menos tiempo en alcanzar una alta intensidad y aquellos episodios no tratados tienen una menor duración. Los pacientes con dolor incidental suelen reportar con más frecuencia interferencia con las actividades de la vida diaria, particularmente con la habilidad para caminar y para la actividad laboral. En contraste, los pacientes con dolor espontáneo, con mayor frecuencia tienen interferencia con el sueño y el humor.
ValoraciónA la vista de lo expuesto, cuando nos planteemos la valoración de un posible episodio de DI, no debemos considerar como tal:
- •
Episodios de dolor intenso sin la existencia de dolor basal previo (dolor transitorio).
- •
Episodios de dolor intenso en un paciente con dolor basal inadecuadamente controlado (dolor no controlado).
- •
Episodios de dolor durante la titulación de una analgesia opioide.
- •
Dolor fin de dosis.
En líneas generales, en todo paciente con dolor (oncológico/no oncológico) debe ser valorada la presencia o no de DI. Los objetivos de la valoración son determinar la etiología del dolor, su fisiopatología y los factores que pueden indicar o contraindicar intervenciones específicas. Una valoración inadecuada puede conducir a la utilización de un tratamiento inapropiado o inefectivo28.
En el momento actual no existe un instrumento de valoración validado en la clínica. De hecho, la mayor recomendación es el uso de cuestionarios estándar para el dolor. En las diferentes guías, y basándonos también en la valoración geriátrica integral, se recomienda interrogar sobre los aspectos5 que se resumen en la tabla 1.
Aspectos a tener en cuenta en la valoración del dolor irruptivo
| Cualidad del dolor | Frecuencia |
| Localización | Irradiación |
| Intensidad | Signos y síntomas asociados |
| Patrón temporal (momento de inicio y duración) | Interferencia con actividades de la vida diaria, ánimo, sueño… |
| Factores que lo desencadenan y exacerban | |
| Tratamiento previo empleado | Respuesta a otras intervenciones |
Las escalas habituales de valoración de dolor no son adecuadas para el DI, porque fracasan en evaluar las características temporales que son únicas para el DI, por ejemplo, la duración y frecuencia de los episodios y la presencia de factores precipitantes (aspectos fundamentales en el manejo de este tipo de dolor). Se ha propuesto un algoritmo diagnóstico para la identificación y valoración del DI. Las guías proponen una versión actualizada del algoritmo desarrollado por Portenoy en 1999, que utiliza criterios más estrictos para definir el concepto de dolor basal controlado6,28 (fig. 1).
Como refleja el estudio de Webber et al.28, existen dificultades para encontrar el «gold standard» en el diagnóstico de una entidad compleja como es el DI. A pesar de ello, destacamos las siguientes escalas específicas de valoración del DI:
- 1.
Breakthrough Pain Questionnaire2(BPQ): desarrollado por Portenoy y Hagen. Se desarrolló empleando los principios de la valoración del dolor oncológico y las características del DI. No ha sido validado formalmente, aunque ha sido empleado en un número no desdeñable de ensayos clínicos.
- 2.
Alberta Breakthrough Pain Assessment Tool (ABPAT)29: desarrollado en colaboración con pacientes y expertos para valorar específicamente el DI en investigación. Aunque se están llevando a cabo nuevos estudios para su total validación, su longitud (22 páginas) limita mucho su aplicabilidad en la práctica diaria. Recientemente se ha propuesto una versión abreviada del test por Mercadante30.
- 3.
Breakthrough Pain Assessment Tool (BAT)30: se desarrolló para simplificar la valoración del DI. El BAT incluye 2 páginas con 14 cuestiones en relación con características temporales, cualitativas y terapéuticas del DI que intentan facilitar el diagnóstico, manejo y monitorización periódica. De las 14 cuestiones, 9 se relacionan con el dolor per se y 5 con el tratamiento del dolor. Existe evidencia inicial para la validación de esta herramienta.
En definitiva, existen herramientas específicas para valorar el DI no aplicables todavía a día de hoy de forma generalizada en la práctica clínica. En este contexto complejo, se debería recomendar a los pacientes un diario del dolor para monitorizar las fluctuaciones y las características del mismo.
Manejo de dolor irruptivo en el ancianoDefinir y tratar el dolor en el anciano es en muchas ocasiones complicado por la existencia de múltiples problemas médicos asociados31. Los ancianos son más susceptibles a presentar efectos secundarios con los opioides, precisando habitualmente menor dosis para obtener un mismo beneficio analgésico, por lo que se debe ser cautelosos con la titulacion32. El problema fundamental es la escasa representación de la población anciana en los ensayos clínicos en los que se evalúa el beneficio-riesgo de los opioides en el DI, y por tanto, la imposibilidad de extrapolar los resultados obtenidos en los ensayos clínicos a dicha población. En este apartado se intentará sintetizar/resumir el tratamiento del DI en los ancianos en base a las escasas publicaciones existentes en dicho grupo poblacional. Las consideraciones generales para un correcto tratamiento del DI se podrían resumir en la tabla 2.
Consideraciones generales para el tratamiento del dolor irruptivo
| 1. El DI es un síntoma que puede aparecer en cualquier momento de la evolución de la enfermedad y debe de ser tratado y controlado tan pronto como aparezca |
| 2. Es importante identificar y actuar sobre el agente específico que provoca el DI, pudiendo hacerlo de manera preventiva (por ejemplo, el DI tipo incidental con la deambulación programada del aseo o de las curas) |
| 3. El tratamiento analgésico del DI es específico y no sustituye al tratamiento del dolor basal (con opioides) |
| 4. El DI varía de una persona a otra, por lo que no se puede establecer una terapia generalizada. Cada anciano recibirá un tratamiento individualizado, acorde a su situación funcional, mental y social, y especialmente de acuerdo a su adherencia terapéutica, para evitar una inadecuada dosificación y aparición de efectos secundarios |
Son muchos los autores5,7,34,37 que, con los resultados de que disponemos, consideran como mejor opción para optimizar el tratamiento del DI bien la morfina parenteral, bien las distintas presentaciones de fentanilos transmucosos (FTM), adecuando siempre una u otros a las características del paciente en relación con su cavidad bucal, su capacidad de comprensión del tratamiento a seguir y su ubicación (domicilio, unidad hospitalaria), que condicionará su mayor o menor gravedad clínica y adherencia al tratamiento.
El fármaco analgésico ideal para el tratamiento ambulatorio del DI ha de ser un analgésico potente capaz de mimetizar las características de dicho dolor (potente efecto analgésico, corta duración, fácil de utilizar, pocos efectos secundarios, etc.)
Clásicamente se ha recurrido a las formulaciones orales de liberación rápida de morfina y oxicodona para el tratamiento del DI. Sin embargo, estas formulaciones orales no son capaces de mimetizar las características del episodio de DI, ya que tras su administración por vía oral el inicio de acción es lento (se sitúa en unos 30-40min) y su duración de acción es más larga (vida media entre 4 y 6h) que la del episodio de DI (habitualmente inferior a las 2h). Además, tanto la morfina como la oxicodona son fármacos hidrofílicos, lo que dificulta su administración por vía transmucosa. La metadona administrada por vía oral tendría un inicio de acción más rápido (de unos 10-15min), sin embargo, su duración de acción es prolongada y la posología y su farmacocinética no están bien establecidas, siendo su manejo complicado, sobre todo en la población anciana.
Posteriormente se han incorporado al arsenal terapéutico las formulaciones transmucosas orales de fentanilo (FTM), con un inicio de acción más rápido (en torno a los 5-10min) cuando son administrados correctamente y con una vida media más corta (de 1-2h). Con ello, se podría conseguir en teoría un inicio de analgesia más rápido, sin añadir mayores efectos secundarios al tratamiento analgésico de base. Sin embargo, en la práctica clínica, en determinadas ocasiones estas formulaciones transmucosas orales de fentanilo son absorbidas tan solo parcialmente por vía transmucosa y otra parte es absorbida por vía digestiva como consecuencia de su deglución (porcentaje variable en función de la práctica del paciente y el tipo de FTM utilizado).
Como primera medida a la hora de abordar el manejo del DI es fundamental:
- 1.
Controlar el dolor crónico de base, valorando si el tratamiento opioide que recibe el paciente se adapta a las guías clínicas habituales38–40, junto al control del tratamiento específico del DI33–35.
- 2.
Valorar el tratamiento de la causa del DI en los casos en que sea posible (por ejemplo, radioterapia en las lesiones óseas localizadas o zolendronato o denosumab en las lesiones óseas con metástasis múltiples).
En todos estos casos y además en aquellos en los que no se puede tratar la causa será precisa una estrategia específica para las crisis de DI.
Desde la revisión Cochrane41 en el año 2013 existe una clara uniformidad de criterio de que el tratamiento farmacológico ante un DI debería realizarse con opioides de liberación inmediata33–36. La mayoría de los estudios analizados en dicha revisión son estudios de registro de los distintos fentanilos realizados por las compañías farmacéuticas, los cuales se comparan con placebo, siendo pocos los que se analizan frente a morfina de liberación rápida u otros FTM. En comparación con el placebo o con la morfina oral de liberación inmediata, los FTM orales o nasales obtienen un mayor alivio del dolor, así como una mejor valoración global. Existen 2 estudios que comparan morfina, intravenosa en uno de ellos y oral en el otro, con FTM, siendo ambas maniobras terapéuticas eficaces42. Los autores concluyen que deberían realizarse más estudios comparativos directos entre los distintos FTM, utilizar herramientas de evaluación validadas y comunicar datos dicotómicos (donde cada participante está en una u otra categoría, pero no en ambas) para obtener resultados más fiables y poder establecer el mejor tratamiento posible del DI.
La discusión en el momento actual se sitúa en cuál es el tratamiento más indicado acorde a los beneficios y al coste:
- 1.
Administrar las históricas «dosis de rescate» de opioides hidrofílicos de liberación rápida, con inicio de acción en 30-45min y duración de 4-6h (morfina, oxicodona, hidromorfona o tapentadol, estas 2 últimas no comercializadas en España) cuando aparece el dolor. La vía de administración habitual es la oral, y ocasionalmente subcutánea o intratecal. El principal inconveniente de esta opción es el desajuste que existe entre las crisis de DI de inicio en 1-3min y de duración media de unos 30min con la administración del opioide correspondiente. Cada dosis de este opioide requiere más de 30min para hacer efecto y su pico plasmático se produce después de 40-60min. Podría plantearse como opción válida en aquellos casos de DI incidental en los que podamos «adelantarnos» al inicio del dolor (por ejemplo, un dolor nociceptivo somático con la deambulación por una metástasis ósea en la cadera). En el caso de la morfina intravenosa, subcutánea o intratecal este problema se reduce en parte, pero su uso es más restringido, ya que difícilmente puede ser llevado a cabo en el domicilio por el paciente anciano y/o su familia cuidadora. Su principal beneficio, el bajo coste, sobre todo el de la morfina.
- 2.
Administrar opioides de acción rápida, pero lipofílicos (fentanilo de acción rápida por mucosas), que por sus características farmacológicas presentan un comienzo de acción rápido de 5 a 15min, gran potencia analgésica y de duración desde 2 hasta 4-5h9,37. Hoy en día se dispone de diferentes presentaciones, que van desde el primer FTM que apareció en 1990, el citrato de FTM, a los comprimidos sublinguales y el espray nasal, que aparecieron posteriormente, o el más reciente, la película bucal (similar a los parches transdérmicos de fentanilo, pero de administración en la mucosa oral), todo ellos con diferencias en cuanto a la administración, posología, inicio y duración de acción. En teoría estos fármacos serían los indicados por su rapidez, potencia y duración de acción, similares a las propias características del DI. En contra estarían principalmente el coste económico y la dificultad de titulación, especialmente en ancianos, por sus características descritas anteriormente.
Importante destacar no solo cómo debería tratarse el DI, sino cómo no debería tratarse (tabla 3).
Errores en el manejo del dolor irruptivo
| 1. Administrar analgésicos coadyuvantes (anticonvulsionantes, antidepresivos, antiespasmódicos, bifosfonatos, antiperistálticos, corticoides, etc.). Estos tratamientos adyuvantes son muy importantes según las distintas etiologías para el control del dolor de base, pero no para las crisis de DI |
| 2. Administrar analgésicos no opiáceos, especialmente antiinflamatorios no esteroideos y paracetamol. Claramente no tienen ninguna indicación en el DI por lento inicio de acción (mínimo 30min) y larga duración de acción (horas), pero sobre todo por su toxicidad gastrointestinal y cardiovascular limitadoras de la dosis |
| 3. Aumentar la dosis de analgesia del opioide de dolor de base. Este abordaje no es adecuado para el control del DI, ya que los opiáceos de liberación controlada, como la morfina, la oxicodona, la hidromorfona, el tapentadol, etc., tienen un inicio lento y una larga duración de acción, con un importante riesgo de acumulación del fármaco opioide de base y, por lo tanto, de mayor riesgo de efectos adversos, sobre todo en los ancianos |
A continuación se desarrollan algunas de las preguntas más comunes que surgen a la hora de enfrentarse al manejo del DI en los ancianos.
1. De los diferentes opioides de liberación rápida/inmediata, ¿cuál sería el adecuado?
Una revisión33 del National Institute for Health and Care Excellence (NICE) publicada en mayo de 2013 (incluye solo 3 estudios44–46 que consideran de suficiente calidad como para sacar conclusiones) muestra los siguientes datos:
- -
El espray nasal de fentanilo, en los 2 únicos estudios incluidos45,46, se asocia con una mejoría del dolor a los 15 y 30min, pero no a los 45 y 60min en relación con la morfina de liberación inmediata.
- -
El FTM oral, en el único estudio incluido, se asocia con una mejoría del dolor a los 15, 30, 45 y 60min, en comparación con la morfina de liberación inmediata, si bien cabe destacar que existe un estudio español (no incluido en esta revisión NICE) de fentanilo sublingual versus morfina oral cuya conclusión es que el fentanilo sí puede ser una opción terapéutica más efectiva que morfina oral42.
- -
Realizando un estudio económico, el coste del fentanilo es de 4 a 5 veces superior (según las presentaciones del fentanilo) al coste de la morfina de liberación inmediata. Así, sus conclusiones, dado los pocos estudios de que se disponen (lo que origina una moderada-baja evidencia), y sobre todo por el coste económico, son que, ante un DI oncológico, lo más recomendable es ofrecer como primera línea morfina de liberación inmediata y, si no se controla dicho DI, referir al paciente a una unidad especializada.
Sin embargo, llegado a este punto son necesarias las siguientes reflexiones: no parece adecuada dicha recomendación basándose sobre todo en el coste. Estos enfoques pueden ser considerados discriminatorios (si el paciente tuviera dinero y a la luz de los resultados, ¿cuál sería el recomendado?) y, sobre todo, ser el principio de una peligrosa corriente, especialmente en los ancianos, en donde lo económico sea la principal bandera a seguir. Aunque el principio ético de justicia es importante (la cuestión económica), no lo es menos el de beneficencia y el de no maleficencia, sin olvidar el principal, el de autonomía (¿cuál sería la opción de tratamiento elegida por el paciente si el sistema le permitiera elegir?).
No obstante son muchos los autores y distintas guías clínicas9,34,37,44 los que no están de acuerdo con las directrices excesivamente estrictas y economicistas marcadas por el NICE, considerando como mejor opción para optimizar el tratamiento del DI bien la morfina intravenosa, bien los FTM, adecuando siempre uno u otros a las características del paciente en relación con su cavidad bucal, su capacidad de comprensión del tratamiento a seguir y su ubicación (domicilio, unidad hospitalaria), que condicionará su mayor o menor gravedad clínica. El uso del FTM de liberación inmediata debe de seguir las mismas consideraciones que cualquier opioide de liberación rápida, es decir, no se debe administrar a ningún paciente que no esté en tratamiento con opioides para el control de su dolor oncológico de base y el paciente debe de ser tolerante a opioides.
2. ¿Qué dosis es la adecuada?
La titulación de la dosis del opioide de acción rápida es sin duda una de las más importantes en el manejo del DI. Para ello este proceso debe ir de la mano de la evaluación, valorando la respuesta a la dosis indicada de opioide, con el alivio del dolor y de sus efectos secundarios, y modificando rápidamente la dosis establecida. Esto lleva sin duda a un cambio en la rutina asistencial diaria de los pacientes ancianos con dolor, con un proceso de educación del paciente (explicar con lenguaje claro y adecuado al nivel educacional y cognitivo de la persona mayor y su familia), así como lo más importante, un seguimiento frecuente, en algunas ocasiones casi diario, ya sea por vía telefónica o por vía de enfermería, de contacto con el paciente mayor y/o su familia para evaluar la respuesta de alivio del dolor/efectos secundarios. Si estas premisas no se cumplen, la titulación del opioide será difícil y con frecuencia incorrecta y con habituales efectos secundarios, como la falta de alivio del dolor, somnolencia excesiva, cuadros confusionales, caídas, náuseas y vómitos, aumento del estreñimiento, etc., que comprometerá la confianza del paciente y la familia. Y sin duda con un mayor coste, debido a una falta de eficiencia no por la indicación del tratamiento en sí, sino por una incorrecta forma de trabajar o de aplicación por parte del equipo médico del tratamiento indicado. Cumplidas estas premisas, en la práctica clínica, las formas de titulación más aceptadas son las siguientes:
- •
Opioides de liberación rápida (morfina, oxicodona): titular con una dosis de inicio proporcional a la dosis de base, 16 de la dosis total del opioide en cuestión, como dosis de rescate, teniendo en cuenta la comorbilidad del paciente, sobre todo la insuficiencia renal o hepática, que llevará a ajustes posológicos.
- •
Fentanilos de acción inmediata por mucosas: titular con la mínima dosis de inicio hasta control del dolor sin superar la dosis máxima. Según el estudio de corte transversal11, multicéntrico, europeo (incluido España), de casi 1.000 pacientes oncológicos con DI, solo en un 20% de los casos el tratamiento elegido fue el FTM, probablemente en relación con el desconocimiento sobre su utilidad/indicación en el DI.
3. ¿Qué recomendaciones/estudios existen sobre el manejo del DI en ancianos?
No existe ningún ensayo clínico específico que evalúe la eficacia/seguridad del tratamiento con opioides en el DI en ancianos. En 2014, Mercadante y Giarratano47 realizaron una revisión sobre los estudios publicados entre 1998 y 2013 que evaluaban la utilización de opioides en el manejo del DI en ancianos. De los 358 estudios encontrados, se seleccionaron por su calidad y tipo de estudio (ensayo clínico) únicamente 16, de los cuales en solo 3 se aportan datos sobre pacientes mayores de 60-65 años (lo que suma un total de 95 pacientes). En ellos, la dosis de opioide basal requerida era menor, sin existir diferencias ni en la escalada de dosis de los opioides ni en los efectos secundarios de los mismos. A pesar de esas diferencias, los autores concluyen que ningún estudio analizado en su revisión proporciona información significativa respecto a los ancianos.
Pautex et al.48 publican en 2014 una revisión sobre las opciones de tratamiento del DI en ancianos. En ella concluyen que las mejores prácticas para el manejo del DI, sobre todo en pacientes de edad avanzada, son a día de hoy en gran parte empíricas. Se necesita más investigación en el campo del DI, especialmente para definir mejores estrategias en su manejo y para explorar las posibilidades de utilización de las vías de administración alternativas a la vía oral de opioides, mejorando nuestra comprensión sobre los FTM en el anciano. Dejando fuera la hidromorfona y el tapentadol de acción rápida (por no estar comercializada en España) y la metadona, que por su acumulación no es de indicación en el anciano por un mayor riesgo de efectos secundarios, las consideraciones para el tratamiento del DI en las personas mayores se podrían resumir en la tabla 4.
Tratamiento de los subtipos de dolor irruptivo en las personas ancianas
| Dolor irruptivo sin factor precipitante (dolor idiopático): considerar utilizar fentanilo de acción rápida por mucosas |
| Dolor irruptivo con factor precipitante (dolor incidental) |
| Predecible (por ejemplo, movimiento, aseo, cura de úlceras, etc.): considerar utilizar opioides de liberación rápida tipo morfina, oxicodona, dependiendo del opioide de base del paciente |
| Impredecible (por ejemplo, tos, micción, digestiva, etc.): considerar utilizar fentanilo de acción rápida por mucosas |
Por último, hay que recalcar que el mejor manejo del DI en el anciano es el manejo integral35, es decir, el multidimensional. El manejo del DI es inadecuado si junto al correcto manejo farmacológico no se añade el apropiado manejo de las diferentes dimensiones tan o más importantes que el propio DI. Nos referimos al correcto manejo del resto de las comorbilidades que interfieren con el dolor, así como a los diferentes condicionantes funcionales, cognitivos, afectivos y sociales que condicionan el manejo centrado en el paciente mayor y su familia. Es necesario atender a las necesidades de rehabilitación, de intentar una oligofarmacia, con ajuste de dosis a su función renal/hepática, y con un adecuado soporte social domiciliario. La valoración geriátrica integral es la herramienta guía para un correcto manejo de cualquier dolor en el anciano38,39,49.
ConclusionesEl DI constituye una entidad heterogénea, de complejo diagnóstico y manejo, que debe ser siempre considerado en los pacientes ancianos con dolor, tanto en aquellos con enfermedad oncológica como no oncológica, para poder realizar un abordaje óptimo. En esta revisión hemos querido destacar la elevada prevalencia de DI sobre todo oncológico, la necesidad de establecer un correcto diagnóstico para poder así instaurar un adecuado tratamiento y la necesidad de realizar ensayos clínicos dirigidos a población anciana. En la tabla 5 se definen a modo de resumen final las consideraciones en el manejo del DI en el anciano.
Principales consideraciones en el manejo del dolor irruptivo en el anciano
| 1. El dolor irruptivo oncológico es un dolor de inicio rápido (3min), intenso (escala analógica visual≥7) y corta duración (30min) que aparece sobre un dolor oncológico de base ya controlado con opioides |
| 2. El dolor irruptivo se clasifica en dolor episódico o dolor irruptivo idiopático (sin factor precipitante) y en dolor incidental (con factor precipitante predecible o impredecible) |
| 3. Para poder tratar adecuadamente el dolor irruptivo es básico diagnosticarlo y, sobre todo, una correcta evaluación atendiendo a sus características y repercusiones sobre el paciente |
| 4. El tratamiento farmacológico más óptimo del dolor irruptivo sería el uso de fentanilos de acción rápida por mucosas para el dolor irruptivo episódico e incidental (con factor precipitante impredecible), y el uso del resto de opioides de liberación inmediata, morfina/oxicodona, para el dolor incidental con factor precipitante predecible (antes del aseo, cura de úlceras, rehabilitación, etc.) |
| 5. La valoración geriátrica integral es la herramienta guía para un correcto manejo multidimensional (funcional, mental y social) del paciente anciano |
Los autores declaran no tener ningún conflicto de intereses. La Fundación Ghünenthal patrocina las reuniones del Comité de Expertos del dolor en el anciano, facilitando el viaje de los miembros en cada reunión.
José Antonio López Trigo. Geriatra. Ayuntamiento de Málaga. Presidente de la SEGG.
Pedro Gil Gregorio. Jefe de Servicio de Geriatría del Hospital Clínico San Carlos de Madrid.
Javier Gómez Pavón. Servicio de Geriatría. Hospital Central de la Cruz Roja. Madrid.
Aurora Viloria Jiménez. Servicio de Geriatría. Unidad de Cuidados Paliativos. Hospital Clínico Universitario San Carlos. Madrid. Miembro Grupo de Trabajo Cuidados Paliativos de la SEGG.
Juan Pérez Cajaraville. Director de la Unidad de Tratamiento del Dolor de HM Hospitales. Madrid.
Cecilio Álamo González. Catedrático de Farmacología. Facultad de Medicina. Universidad de Alcalá de Henares. Madrid.
Luis Cabezón Gutiérrez. Servicio de Oncología Médica. Hospital Universitario de Torrejón. Torrejón de Ardoz, Madrid.
José Gutiérrez Rodríguez. Servicio de Geriatría. Hospital Monte Naranco. Oviedo.
Cesáreo Fernández Alonso. Geriatra. Servicio de Urgencias. Hospital Clínico San Carlos de Madrid.
Rosa López Mongil. Geriatra. Centro Asistencial Dr. Villacián. Valladolid. Miembro Grupo de Trabajo Asistencia Sanitaria en Residencias de la SEGG.
José María Gómez Argu¿elles. Servicio de Neurología. Hospital Virgen de la Cruz. Cuenca. Coordinador Grupo de Trabajo Dolor Neuropático de la SEN.
Enrique Zamorano Bayarri. Medicina Familiar y Comunitaria. Centro de Salud Sant Antoni de Vilamajor (Barcelona). Miembro Grupo de Trabajo de Dolor de la SEMERGEN.