Diferentes autores han puesto de manifiesto la utilidad del análisis histológico en el diagnóstico de la infección protésica; sin embargo, todavía hoy, su validez clínica es motivo de controversia. El objetivo del presente manuscrito es describir y analizar la validez clínica del análisis histológico en el diagnóstico de infección protésica en el paciente sometido a un recambio protésico de cadera o rodilla.
Material y métodosSe presenta un estudio retrospectivo que incluye 133 recambios protésicos de cadera y rodilla realizados en nuestro centro entre 2008 y 2020. Se realizó un análisis estadístico descriptivo, bivariado y se determinó la validez clínica del análisis histológico.
ResultadosLa validez clínica del análisis histológico ofreció una sensibilidad del 48%, una especificidad del 91%, un valor predictivo positivo del 55% y un valor predictivo negativo del 88%.
ConclusionesLa determinación de la validez clínica del análisis histológico pone de manifiesto una especificidad elevada. Dicho análisis supone una herramienta diagnóstica apropiada para detectar pacientes sanos, con ausencia de infección.
Different authors have demonstrated the usefulness of the histological analysis in the diagnosis of prosthetic joint infection; however, its clinical validity is still controversial. The aim of this article is to describe and analyze the clinical validity of histological analysis in the diagnosis of prosthetic infection in patients undergoing hip or knee prosthetic replacement.
Material and methodsWe present a retrospective study including 133 hip and knee prosthetic replacements performed in our center between 2008 and 2020. A descriptive, bivariate statistical analysis was performed and the clinical validity of the histological analysis was determined.
OutcomesThe clinical validity of the intraoperative histology offered a sensitivity of 48%, a specificity of 91%, a positive predictive value of 55% and a negative predictive value of 88%.
ConclusionsThe determination of the clinical validity of histological analysis shows a high specificity. This analysis is an appropriate diagnostic tool for detecting healthy patients, with no infection.
La cirugía de reemplazo articular es uno de los procedimientos quirúrgicos más exitosos y costo-efectivos en cirugía ortopédica, pues ha demostrado disminuir el dolor y restaurar la función en pacientes con artrosis avanzada1. El envejecimiento de la población y el progreso en la técnica quirúrgica, cada vez más depurada, ha motivado un incremento significativo en el número de prótesis implantadas2,3. A pesar de sus numerosos beneficios, la cirugía protésica no está exenta de complicaciones, entre las que destaca la infección.
En la infección protésica resulta fundamental una correcta orientación diagnóstica que permita realizar el tratamiento más apropiado. El diagnóstico se basa en una alta sospecha clínica, una exploración física adecuada, una analítica de sangre que incluye un hemograma y la determinación de reactantes de fase aguda, entre los que destaca la proteína C reactiva (PCR), estudios radiológicos y una artrocentesis diagnóstica. A pesar de ello, en muchos casos, estas pruebas no ofrecen un rendimiento diagnóstico elevado que permita realizar un diagnóstico precoz y preciso4.
Motivados por los inconvenientes de los test diagnósticos preoperatorios disponibles en la actualidad, todavía hoy se continúa realizando el análisis histológico descrito por Mirra et al.5. Así pues, desde los primeros trabajos presentados por dichos autores se han publicado numerosos manuscritos que ponen de manifiesto los beneficios de dicho análisis en el diagnóstico de la infección protésica. A pesar de ello, su validez clínica continúa siendo motivo de controversia.
El objetivo del presente trabajo es describir y analizar la validez clínica de la histología intraoperatoria en el diagnóstico de infección protésica en el paciente sometido a un recambio protésico de cadera o rodilla.
Material y métodosDiseño del estudioSe presenta un estudio retrospectivo que incluye 147 recambios protésicos de cadera y rodilla realizados en nuestro centro hospitalario entre 2008 y 2020.
ParticipantesLos participantes del estudio fueron pacientes intervenidos de recambio de artroplastia de rodilla o cadera en uno o dos tiempos. Se excluyeron los casos en los cuales no se pudo acceder al resultado de los cultivos intraoperatorios y aquellos recambios en los que no se llevó a cabo el test de Mirra. Todos los participantes se clasificaron como pacientes con infección y pacientes sin infección atendiendo a los criterios descritos por McNally et al.6.
Técnica quirúrgicaTodos los procedimientos se llevaron a cabo por cirujanos experimentados de la Unidad de Cadera y la Unidad de Rodilla del Servicio de Cirugía Ortopédica y Traumatología del Hospital Universitario Virgen de la Victoria de Málaga. En el recambio de cadera se realizó un abordaje lateral de Hardinge y en la revisión de rodilla se llevó a cabo un abordaje longitudinal anterior. La anestesia fue raquídea en la mayoría de los pacientes, salvo en aquellos con alguna contraindicación para la misma, en cuyo caso se llevó a cabo una anestesia general. En todos los casos se realizó una profilaxis antibiótica preoperatoria con cefazolina intravenosa una hora antes del procedimiento, salvo en los pacientes con alergia, en los que se administró vancomicina. En los recambios protésicos de rodilla se utilizó un manguito de isquemia en la raíz del muslo.
Durante el procedimiento se enviaron al menos 3 muestras de tejido a anatomía patológica para su análisis intraoperatorio, que se extrajo de la membrana de interfase en íntimo contacto con el implante protésico7.
Tradicionalmente, el análisis histológico se ha realizado siguiendo los criterios descritos por Mirra et al.5, que realizaban un registro del número de polimorfonucleares (PMN) en 5 campos microscópicos distintos, que clasificaban de la siguiente manera: ausente, 1+ (de 1 a 5 células por campo), 2+ (de 6 a 49 células por campo) y 3+ (más de 50 células por campo). Sin embargo, en nuestro centro hospitalario dicho análisis se realizó atendiendo a la adaptación descrita por Feldman et al.8, considerándose patológico >5PMN por campo de gran aumento (×40) de media, en 5 campos separados. La identificación y recuento de PMN se realizó en cortes por congelación, evitando las zonas con aspecto fibroso, tras una tinción con hematoxilina-eosina, en base a su núcleo lobulado y escaso ribete citoplasmático (evitando núcleos fragmentados). El servicio de Anatomía Patológica comunicó a los cirujanos el número de PMN por campo durante la misma intervención.
Asimismo, en todos los casos se recogieron al menos 5 muestras intraoperatorias que se enviaron a microbiología para cultivo y antibiograma.
VariablesSe recogieron y analizaron variables demográficas (sexo, edad, índice de masa corporal [IMC]), hábitos tóxicos (tabaquismo), comorbilidades (diabetes mellitus [DM], enfermedad reumatológica [ER]), presencia de signos clínicos de infección previos al recambio (fiebre, exudado a través de la herida, fístula), parámetros analíticos preoperatorios (valor de la PCR, resultado del cultivo de la artrocentesis), parámetros radiográficos (signos de aflojamiento en radiografía simple, resultado de gammagrafía), diagnóstico que motivó la artroplastia de cadera en la cirugía inicial (coxartrosis o fractura), tipo de fijación (cementación), número de PMN por campo, resultado del análisis histológico (< o>5PMN por campo), resultado de los cultivos intraoperatorios (considerándose representativos ante la presencia de al menos 2 muestras con el mismo microorganismo)6, así como si el recambio se realizó en uno o en dos tiempos.
Análisis estadísticoLos datos recogidos se introdujeron en una base de datos Excel y se analizaron con el software Statistical Package for Social Sciences (SPSS®). En el análisis descriptivo, las variables cuantitativas se expresaron con medidas de tendencia central (media aritmética, mediana y moda) y mediante medidas de dispersión (rango y desviaciones típicas). Las variables cualitativas se expresaron mediante porcentajes. Con la intención de facilitar la lectura e interpretación de las variables analizadas, los datos se representaron de manera gráfica.
Considerando el tamaño muestral, la normalidad de las variables cuantitativas recogidas en el estudio se valoró con el test de Kolmogorov-Smirnov. Respecto a las variables cuantitativas, se llevó a cabo un contraste de hipótesis para muestras independientes, utilizando la prueba T-Student para las variables con distribución normal y las pruebas no paramétricas U de Mann-Whitney y Kruskal-Wallis en las variables que no seguían una distribución normal. El análisis de las variables cualitativas se realizó con el test Chi-cuadrado de Pearson. Asimismo, se llevó a cabo un análisis de la correlación entre el valor de la PCR preoperatoria y el número de PMN apreciados en el test de Mirra mediante el coeficiente no paramétrico Rho de Spearman.
Con la intención de determinar la validez clínica del test de Mirra en el diagnóstico de la infección protésica, objetivo principal del presente trabajo, se calcularon los siguientes parámetros: sensibilidad (S), especificidad (E), valor predictivo positivo (VPP), valor predictivo negativo (VPN), probabilidad pretest (prevalencia), probabilidad postest positivo y probabilidad postest negativo.
No existen fuentes de financiación, ni otros conflictos de interés relacionados directa o indirectamente con el contenido del estudio. La inclusión en el estudio no supuso un daño ni perjuicio para los pacientes incluidos en este. Durante todo el trabajo se siguieron de forma cuidadosa todos los principios éticos dispuestos en la Declaración de Helsinki, con su última revisión en Fortaleza, Brasil 2013. En todas las fases del estudio se ha respetado lo establecido por la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales.
ResultadosLa muestra preliminar incluyó 147 recambios protésicos, sin embargo, de la base de datos original se excluyeron 14 casos debido a la imposibilidad para acceder a los resultados de los cultivos intraoperatorios, por lo que el análisis estadístico final incluyó un total de 133 recambios protésicos. El seguimiento medio fue de 6 años (1-12 años).
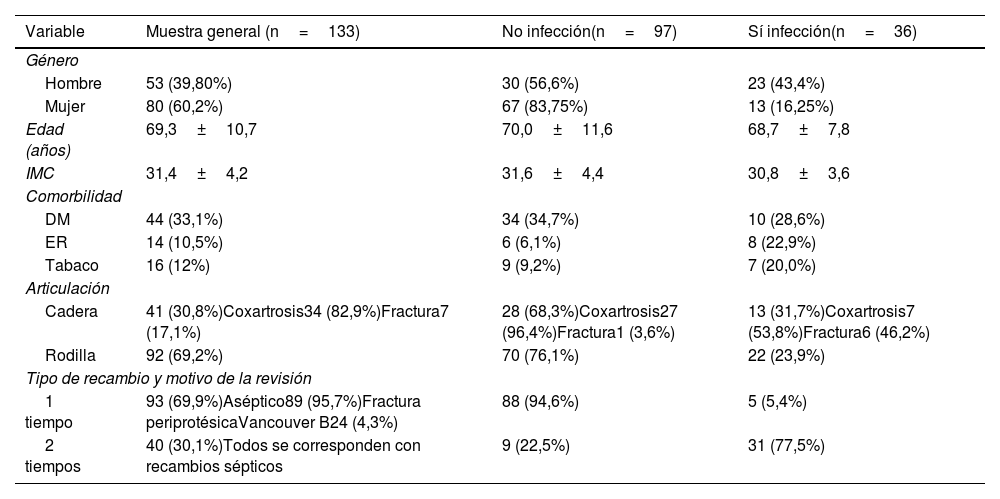
A continuación, se exponen las variables demográficas, tipo de articulación, tipo de recambio y motivo de la revisión para la muestra general, para el grupo clasificado como infectado (infección confirmada) y para el no infectado (tabla 1)6.
Distribución de variables demográficas, articulación, tipo de recambio y motivo de la revisión
| Variable | Muestra general (n=133) | No infección(n=97) | Sí infección(n=36) |
|---|---|---|---|
| Género | |||
| Hombre | 53 (39,80%) | 30 (56,6%) | 23 (43,4%) |
| Mujer | 80 (60,2%) | 67 (83,75%) | 13 (16,25%) |
| Edad (años) | 69,3±10,7 | 70,0±11,6 | 68,7±7,8 |
| IMC | 31,4±4,2 | 31,6±4,4 | 30,8±3,6 |
| Comorbilidad | |||
| DM | 44 (33,1%) | 34 (34,7%) | 10 (28,6%) |
| ER | 14 (10,5%) | 6 (6,1%) | 8 (22,9%) |
| Tabaco | 16 (12%) | 9 (9,2%) | 7 (20,0%) |
| Articulación | |||
| Cadera | 41 (30,8%)Coxartrosis34 (82,9%)Fractura7 (17,1%) | 28 (68,3%)Coxartrosis27 (96,4%)Fractura1 (3,6%) | 13 (31,7%)Coxartrosis7 (53,8%)Fractura6 (46,2%) |
| Rodilla | 92 (69,2%) | 70 (76,1%) | 22 (23,9%) |
| Tipo de recambio y motivo de la revisión | |||
| 1 tiempo | 93 (69,9%)Aséptico89 (95,7%)Fractura periprotésicaVancouver B24 (4,3%) | 88 (94,6%) | 5 (5,4%) |
| 2 tiempos | 40 (30,1%)Todos se corresponden con recambios sépticos | 9 (22,5%) | 31 (77,5%) |
No se incluyeron los segundos tiempos de recambios sépticos, los recambios parciales, ni tampoco infecciones agudas tratadas con limpieza, desbridamiento y recambio de polietileno.
Antes de realizar el recambio protésico, se llevó a cabo una artrocentesis diagnóstica en 22 pacientes (16,5%). El cultivo de la muestra extraída resultó positivo en 14 pacientes (10,5%). Del mismo modo, en todos los pacientes se realizó una analítica de sangre con la intención de valorar los reactantes de fase aguda. Se apreció un valor medio de PCR de 19,2±29,6mg/l. En el momento de realizar el recambio protésico solo 2 pacientes (1,5%) tenían fiebre y 15 (11,3%) presentaban exudado a través de la herida.
En relación con la radiología convencional preoperatoria, hasta 111 pacientes (83,5%) presentaron signos de aflojamiento protésico. Además, se realizó una gammagrafía en 54 pacientes, que fue positiva en 50 (92,6%).
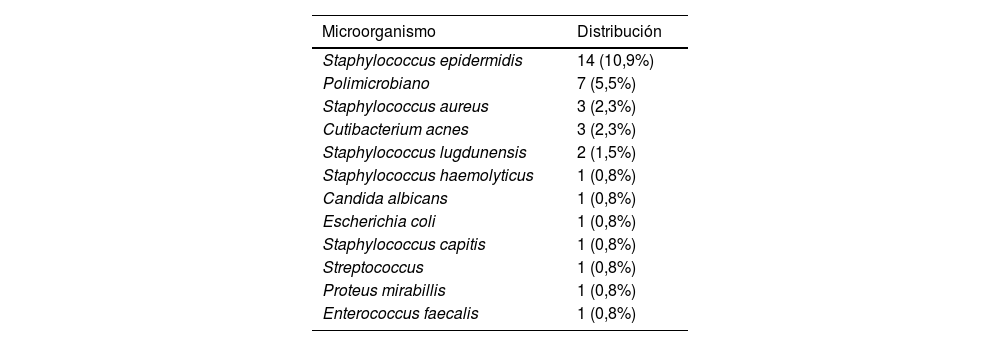
El resultado del cultivo intraoperatorio fue negativo en 97 recambios (72,9%), frente a 36 recambios (27,1%) en los que el resultado fue positivo (con al menos 2 muestras positivas)6. De los 36 recambios con resultado positivo, 5 (13,9%) fueron recambios en un tiempo y 31 (86.1%) recambios en 2 tiempos. Los microorganismos aislados en los cultivos intraoperatorios se describen en la tabla 2.
Microorganismos aislados en los cultivos intraoperatorios. Frecuencias y porcentajes
| Microorganismo | Distribución |
|---|---|
| Staphylococcus epidermidis | 14 (10,9%) |
| Polimicrobiano | 7 (5,5%) |
| Staphylococcus aureus | 3 (2,3%) |
| Cutibacterium acnes | 3 (2,3%) |
| Staphylococcus lugdunensis | 2 (1,5%) |
| Staphylococcus haemolyticus | 1 (0,8%) |
| Candida albicans | 1 (0,8%) |
| Escherichia coli | 1 (0,8%) |
| Staphylococcus capitis | 1 (0,8%) |
| Streptococcus | 1 (0,8%) |
| Proteus mirabillis | 1 (0,8%) |
| Enterococcus faecalis | 1 (0,8%) |
Microorganismos aislados en el subgrupo calificado como infección polimicrobiana:
- 1)
Staphylococcus epidermidis y Staphylococcus aureus: 3 pacientes
- 2)
S. aureus y Pseudomona aeruginosa: 3 pacientes
- 3)
S. epidermidis y Candida albicans: 1 paciente
Respecto al análisis histológico, el recuento medio de PMN fue de 4,68±9,36. Así pues, el resultado fue positivo en 22 pacientes, de los cuales 4 (18,2%) se habían tratado con un recambio en un tiempo y 18 (81,8%) con un recambio en 2 tiempos (primer tiempo) (p<0,001). El resultado positivo fue más frecuente entre los pacientes varones (13 [24,5%] vs. 9 [11,3%], p=0,029). Asimismo, de los 22 pacientes con análisis histológico positivo, un total de 12 (54,5%) presentaron cultivos intraoperatorios positivos. Por el contrario, el análisis histológico fue negativo en 111 pacientes, de los que 98 (88,3%) tuvieron cultivos intraoperatorios negativos (p<0,001).
Aunque los 4 pacientes con fractura periprotésica Vancouver B2 tratada con recambio en un tiempo presentaron cultivos intraoperatorios negativos, 2 (50%) tuvieron un resultado positivo en el análisis histológico.
Se observó que el resultado positivo en el análisis histológico fue más frecuente ante la presencia de microorganismos como el S. epidermidis, Staphylococcus lugdunensis, Staphylococcus capitis, Streptococcus, Enterococcus faecalis o la infección polimicrobiana (p<0,001).
En la misma línea, entre los pacientes con un análisis histológico positivo se apreciaron valores superiores en la PCR preoperatoria (29,1±27,1mg/l vs. 9,0±11,7mg/l, p<0,001). El valor de la PCR presentó una correlación estadísticamente significativa respecto al número de PMN observados en el análisis histológico (Rho de Spearman=0,272, p=0,045).
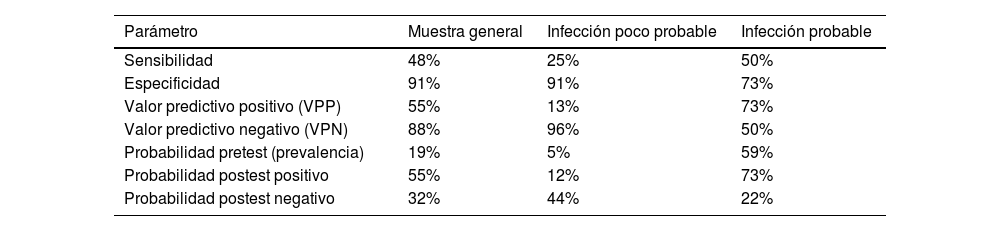
La validez clínica del test de Mirra en nuestro centro hospitalario se calculó para la muestra general (133 recambios), así como para los pacientes clasificados como infección poco probable (82 recambios) e infección probable (51 recambios) atendiendo a los criterios descritos por McNally et al.6 (tabla 3).
Validez clínica para muestra general, para los pacientes clasificados como infección poco probable e infección probable
| Parámetro | Muestra general | Infección poco probable | Infección probable |
|---|---|---|---|
| Sensibilidad | 48% | 25% | 50% |
| Especificidad | 91% | 91% | 73% |
| Valor predictivo positivo (VPP) | 55% | 13% | 73% |
| Valor predictivo negativo (VPN) | 88% | 96% | 50% |
| Probabilidad pretest (prevalencia) | 19% | 5% | 59% |
| Probabilidad postest positivo | 55% | 12% | 73% |
| Probabilidad postest negativo | 32% | 44% | 22% |
El análisis histológico, descrito en 1976 por Mirra et al.5, es una herramienta útil en el diagnóstico de la infección protésica. Diversos trabajos han puesto de manifestó sus ventajas, no obstante, también presenta algunos inconvenientes, entre los que destaca su validez clínica, que continúa siendo motivo de controversia.
Diversos autores han descrito que el análisis histológico posee una validez clínica apropiada9, con cifras de sensibilidad y especificidad que podrían alcanzar el 100% y el 98%, respectivamente10. En nuestra serie, destaca una especificidad elevada (91%), a diferencia de la sensibilidad, que presenta un valor inferior al descrito en la literatura. A este respecto, en nuestro entorno se han implementado acciones de mejora basadas en una estandarización de la recogida y el procesamiento de la muestra que pretenden incrementar la validez clínica del test.
En la literatura publicada, en la mayoría de los casos el VPN ofrece mejores resultados que el VPP, lo que concuerda con lo apreciado en nuestra serie para la muestra general y el grupo con infección poco probable. Sin embargo, en nuestro registro también puede observarse como el VPP incrementa su valor en el grupo de pacientes clasificados como infección probable, atendiendo a la clasificación descrita por Mcnally et al.6, pasando del 55 al 73%11,12.
En relación con la enfermedad reumatológica, y en concreto la artritis reumatoide (AR), algunos autores sugieren que podría ser causa de falsos positivos al realizar el análisis histológico como herramienta diagnóstica en el paciente con sospecha de infección protésica, con un VPP en torno al 25%13. A este respecto, en nuestra serie se registraron 14 casos con enfermedad reumatológica, de los cuales 5 presentaban AR. De estos 5 pacientes, 3 obtuvieron un resultado positivo en el análisis histológico, sin embargo, solo un paciente presentó cultivos intraoperatorios positivos (66,7% de falsos positivos).
En la misma línea, en consonancia con lo descrito por Muñoz-Mahamud et al.14, en nuestra muestra se apreció un porcentaje elevado de falsos positivos en el análisis histológico realizado en pacientes sometidos a un recambio protésico por una fractura periprotésica Vancouver B2.
Tradicionalmente, el microorganismo más frecuente en la infección protésica es el S. epidermidis, seguido del S. aureus, aspecto coincidente con lo observado en nuestro trabajo, en el que el microorganismo más frecuente fue el S. epidemidis (14 casos, 10,9%), seguido de la infección polimicrobiana (7 casos, 5,5%) y el S. aureus (3 casos, 2,3%). Aunque existe poca bibliografía respecto a la infección polimicrobiana, algunos autores advierten que podría ser la responsable de hasta el 15% de las infecciones protésicas, lo que concuerda con lo apreciado en nuestro registro, en el que ocupan el segundo lugar por orden de frecuencia (7 casos, 5,5%)15,16.
Entre los resultados del presente trabajo se muestra la correlación existente entre el valor de la PCR preoperatoria y el resultado del análisis histológico. Diferentes autores advierten que la decisión de realizar un recambio en uno o en dos tiempos no debe basarse solo en el resultado del análisis histológico, sino que deben utilizarse herramientas diagnósticas adicionales, entre las que destaca la PCR preoperatoria17. Así pues, esta tampoco debería usarse de forma aislada como prueba de cribado en la infección protésica, sobre todo en procesos crónicos18.
Entre las limitaciones del presente trabajo se encuentran la ausencia de grupo control y el carácter retrospectivo, pues los resultados proceden del análisis de una base de datos proveniente de historias clínicas. Asimismo, la muestra es heterogénea, pues incluye recambios protésicos realizados en cadera y en rodilla.
ConclusiónEl análisis de la validez clínica del análisis histológico pone de manifiesto una especificidad elevada. En nuestro estudio, el análisis histológico supone una herramienta diagnóstica apropiada para detectar pacientes sanos, con ausencia de infección. Asimismo, resulta fundamental el uso de pruebas diagnósticas adicionales, entre las que destaca la PCR preoperatoria.
Nivel de evidenciaNivel de evidencia III.
Declaración de transparenciaEl autor para la correspondencia, en nombre del resto de las personas firmantes, garantiza la precisión, transparencia y honestidad de los datos y la información contenida en el estudio; que ninguna información relevante ha sido omitida; y que todas las discrepancias entre autores/autoras han sido adecuadamente resueltas y descritas.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríaTodas las personas firmantes han contribuido en el diseño del trabajo, recogida y análisis de los datos, interpretación de los resultados, así como en la redacción y revisión del manuscrito definitivo.
Conflicto de interesesNo existen conflictos de interés relacionados directa o indirectamente con el contenido del estudio.