Evaluar el efecto de 2 protocolos diferentes de ácido hialurónico (AH) intraarticular (hylan G-F20) sobre la regeneración del cartílago articular en lesiones condrales agudas de espesor completo.
Material y métodoSe realizaron lesiones condrales de espesor completo de 3×6mm en los cóndilos femorales de conejos New Zealand, tratados con una dosis única o tres dosis de AH. Los animales fueron sacrificaron a las 12 semanas y el tejido regenerado fue evaluado mediante observación directa e histología con la escala ICRS.
ResultadosMacroscópicamente, en ambos grupos tratados con AH los defectos se rellenaron con tejido irregular, con zonas similares al cartílago hialino y otras en las que se observaron áreas deprimidas con exposición de hueso subcondral. El análisis histológico demostró en ambos grupos tratados con AH un tejido similar al cartílago hialino comparado con el grupo control. Sin embargo, la puntuación de la escala Internacional Cartilage Repair Society (ICRS) no mostró diferencias entre los grupos tratados con AH.
ConclusiónEl uso de dosis única o 3 dosis de AH en lesiones condrales agudas tiene un beneficio limitado y similar en la regeneración del cartílago articular.
To evaluate the effect of 2 different protocols of intra-articular hyaluronic acid (HA, hylan G-F20) to articular cartilage regeneration in acute full-thickness chondral defects.
Materials and MethodsFull-thickness chondral defects of 3x6mm were performed into the lateral femoral condyles of New Zealand rabbits, treated with a single or three doses of HA. The animals were sacrified at 12 weeks and the regenerated tissue was evaluated by direct observation and histology with the ICRS scale. Macroscopically, in both groups treated with HA the defects were filled with irregular tissue with areas similar to hyaline cartilage and others in which depressed areas with exposed subchondral bone were observed. Histological analysis showed in both groups treated with HA a hyaline-like cartilage compared to control group. However, the score of the International Cartilage Repair Society (ICRS) scale did not show differences between the groups treated with HA.
ConclusionThe use of single dose or 3 doses of AH in acute chondral lesions has a limited and similar benefit in articular cartilage regeneration.
Las lesiones condrales de la rodilla son frecuentes en atletas, especialmente durante la práctica de deportes de contacto1. Sabemos que estas lesiones tienen un potencial de reparación muy limitado, incluso las lesiones de pequeño tamaño que, sin tratamiento, pueden predisponer a la degeneración articular, con discapacidad funcional y un alto coste de tratamiento2. En el manejo de las lesiones del cartílago articular se han propuesto múltiples opciones de tratamiento como son las perforaciones subcondrales, microfracturas, autoinjertos osteocondrales e implante de condrocitos autólogos, con resultados, a veces, pobres3,4. También se han recomendado nuevas opciones terapéuticas para prevenir el desarrollo de la artrosis tras sufrir lesiones condrales focales, como son fármacos orales de acción lenta (SYSADOAS), como la glucosamina y el condroitín sulfato, y las inyecciones intraarticulares, como el ácido hialurónico (AH), que tienen un mecanismo de protección articular5–8. El AH es un mucopolisacárido de alto peso molecular (5 - 7×106Da) con las propiedades viscoelásticas del líquido sinovial esencial para desarrollar una función articular normal. El AH tiene, por lo tanto, un efecto mecánico y también un efecto curativo sobre las células del cartílago y de la membrana sinovial. En pacientes con artrosis, la concentración de AH en el líquido sinovial de la rodilla se reduce de 2 a 3 veces y su peso molecular también disminuye hasta alcanzar niveles mínimos, 2×105Da8,9.
Las inyecciones intraarticulares de AH han demostrado aliviar el dolor y mejoran la función articular en pacientes con artrosis de rodilla, a corto y medio plazo10,11. Estudios experimentales han demostrado que el AH disminuye la expresión de las metaloproteinasas (MMP) y de la IL-1 en la sinovial y previene cambios en los proteoglicanos (PG) de la matriz, disminuyendo la inflamación sinovial, y aumentando el contenido de PG12–14. Kaplan et al.15, realizaron un estudio sobre lesiones condrales agudas en ovejas, demostrando que 3 dosis de AH mejoraban los parámetros histológicos y el contenido de PG del cartílago articular.
Nuestras hipótesis fueron que el uso de AH aumenta la regeneración del cartílago hialino en lesiones condrales focales y que 3 inyecciones de AH aumentan la regeneración tisular. Por ello, el objetivo de nuestro estudio es evaluar, en un modelo animal, la regeneración del cartílago articular con dos protocolos diferentes de tratamiento con AH de alto peso molecular, en lesiones condrales agudas de espesor completo.
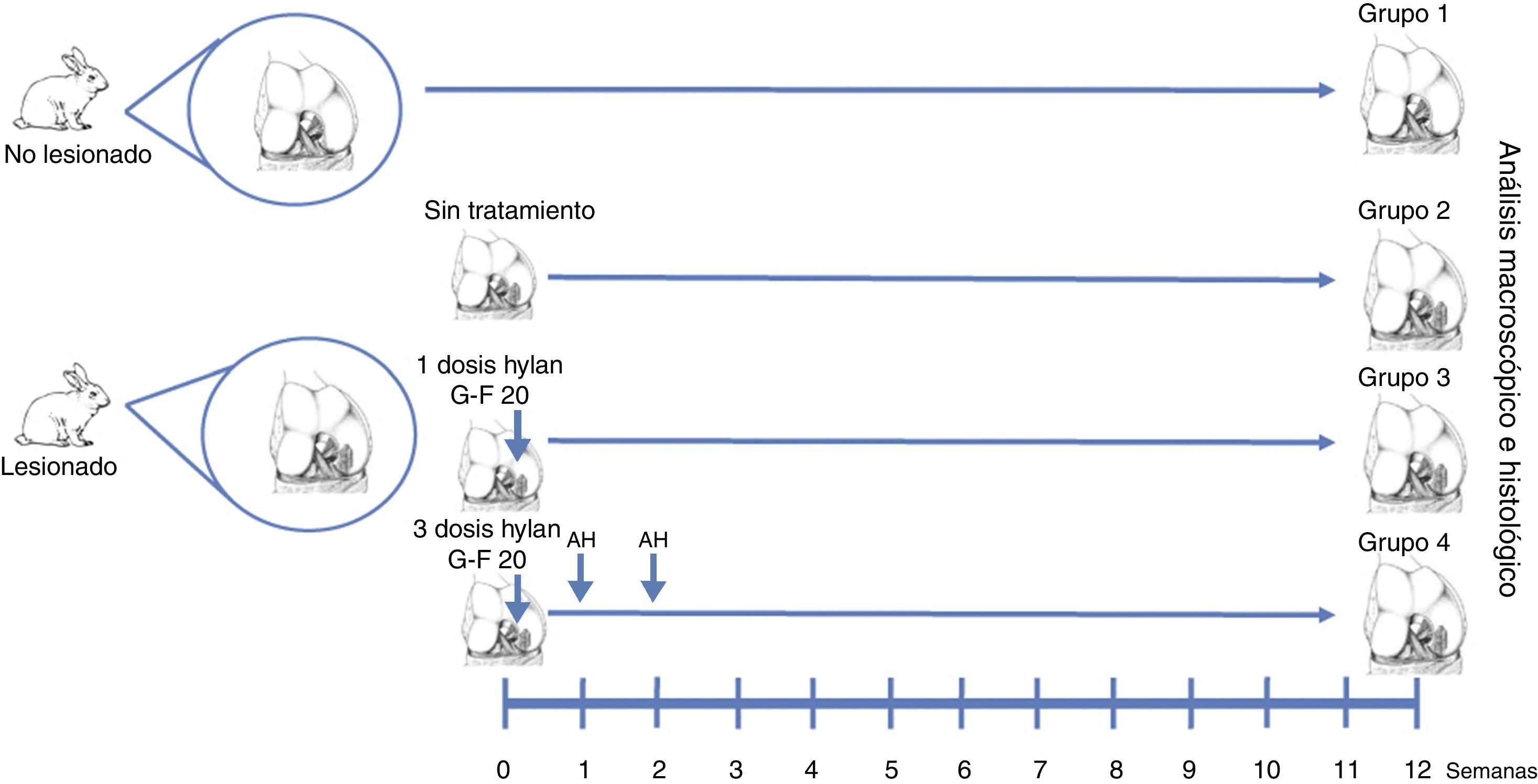
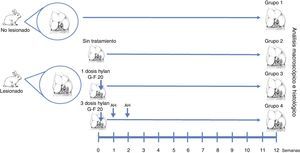
Materiales y métodosEfectuamos lesiones condrales de espesor completo en los cóndilos femorales (n=30) de 15 conejos New Zealand, machos, de 3 meses de edad, y entre 2,5 y 3,5kg de peso, siguiendo el protocolo de trabajo expuesto en la figura 1.
Los animales se mantuvieron en jaulas separadas, de 40cm×40cm×60cm, a una temperatura y humedad constante, con un ciclo de luz-oscuridad de 12/12 horas y con alimentación ad libitum y también deambularon libremente, sin inmovilización.
El protocolo de investigación fue aprobado por el Comité de Ética de la Facultad de Medicina Clínica Alemana-Universidad del Desarrollo. Todos los procedimientos se efectuaron bajo condiciones de asepsia, utilizando anestesia intramuscular con ketamina (35mg/kg), xilazina (5mg/kg) y acepromazina (1mg/kg). Se utilizó además enrofloxacino (10mg/kg) y tramadol (4mg/kg) en aplicación preoperatoria y hasta 2 días después de la cirugía.
Técnica quirúrgicaLos defectos condrales fueron de espesor completo, de 3×6mm, realizados en las áreas de carga de los cóndilos femorales laterales de cada rodilla, a través de una artrotomía parapatelar longitudinal16. Los defectos condrales fueron realizados con un osteótomo de 3mm hasta la capa calcificada, la cual fue retirada con una cucharilla cuidando de no dañar el hueso subcondral. Los cóndilos fueron divididos en 4 grupos. En el grupo 1, no se realizó defecto y tampoco tratamiento (grupo normal, n=12). En el grupo 2, se realizó un defecto condral pero no recibieron tratamiento alguno (grupo lesionado no tratado, n=6). En el grupo 3, se realizó el defecto condral y recibieron una dosis única de AH (Hylan G-F 20®, 3,5mg/0,5ml) al finalizar la cirugía (grupo dosis única de Hylan G-F 20, n=6). En el grupo 4, se realizó el defecto condral y recibieron 3 dosis semanales de AH (Hylan G-F 20® (grupo 3 dosis Hylan G-F 20, n=6).
No se observaron complicaciones y ningún animal debió ser sacrificado antes de finalizar el estudio. Los conejos fueron sacrificados, a las 12 semanas, con una sobredosis intravenosa de pentobarbital, y los cóndilos fueron resecados para su estudio.
Análisis macroscópicoTodos los cóndilos (n=30) fueron observados de forma directa, inmediatamente después de su obtención. Se registraron las características de color del tejido, apariencia de la superficie articular y la presencia o no de exposición de hueso subcondral.
Análisis histológicoLos cóndilos (n=30) fueron fijados en formalina, decalcificados en EDTA y luego embebidos en parafina. Se realizaron cortes sagitales del tejido de 10μm de grosor. Los cortes fueron teñidos con hematoxilina/eosina (H/E) y analizados, en ciego, por un especialista entrenado de anatomía patológica, utilizando la escala International Cartilage Repair Society (ICRS) para evaluar la reparación del cartílago17. Esta escala está compuesta por 6 categorías y se asigna la puntuación de acuerdo a la característica más representativa presente en cada muestra.
Análisis estadísticoLa unidad de análisis utilizada en este estudio fue cada cóndilo femoral lateral (n=30). La puntuación de la escala de la ICRS (medianas) fue analizada mediante la prueba de U de Mann-Whitney y los valores de p<0,05 se consideraron como estadísticamente significativos.
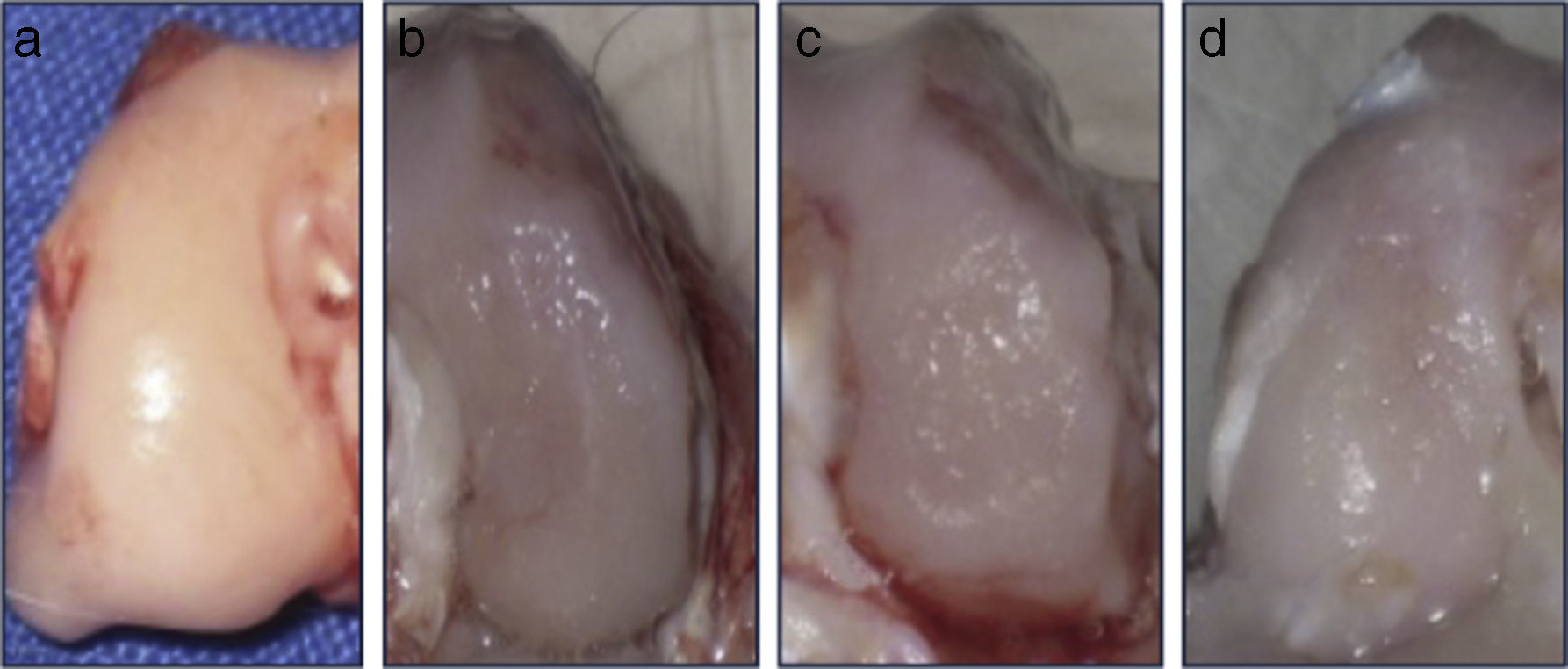
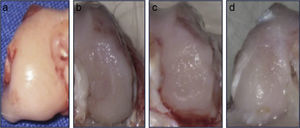
ResultadosAnálisis macroscópicoEl grupo 1 (grupo normal) presentó un tejido suave, brillante y semitransparente. A las 12 semanas de la intervención, los cóndilos femorales del grupo 2 (grupo lesionado no tratado) presentaron un tejido muy fino, irregular, de aspecto rugoso y con un área de lesión bien definida. En el grupo 3 (grupo dosis única de AH), el tejido era fino, con apariencia hialina pero con áreas deprimidas y exposición de hueso subcondral. En el grupo 4 (grupo 3 dosis AH), el nuevo tejido formado fue levemente irregular y fino, similar al observado en el grupo 3 (fig. 2). En los grupos intervenidos, si bien los defectos fueron claramente diferenciados del cartílago circundante, no se observaron signos degenerativos articulares.
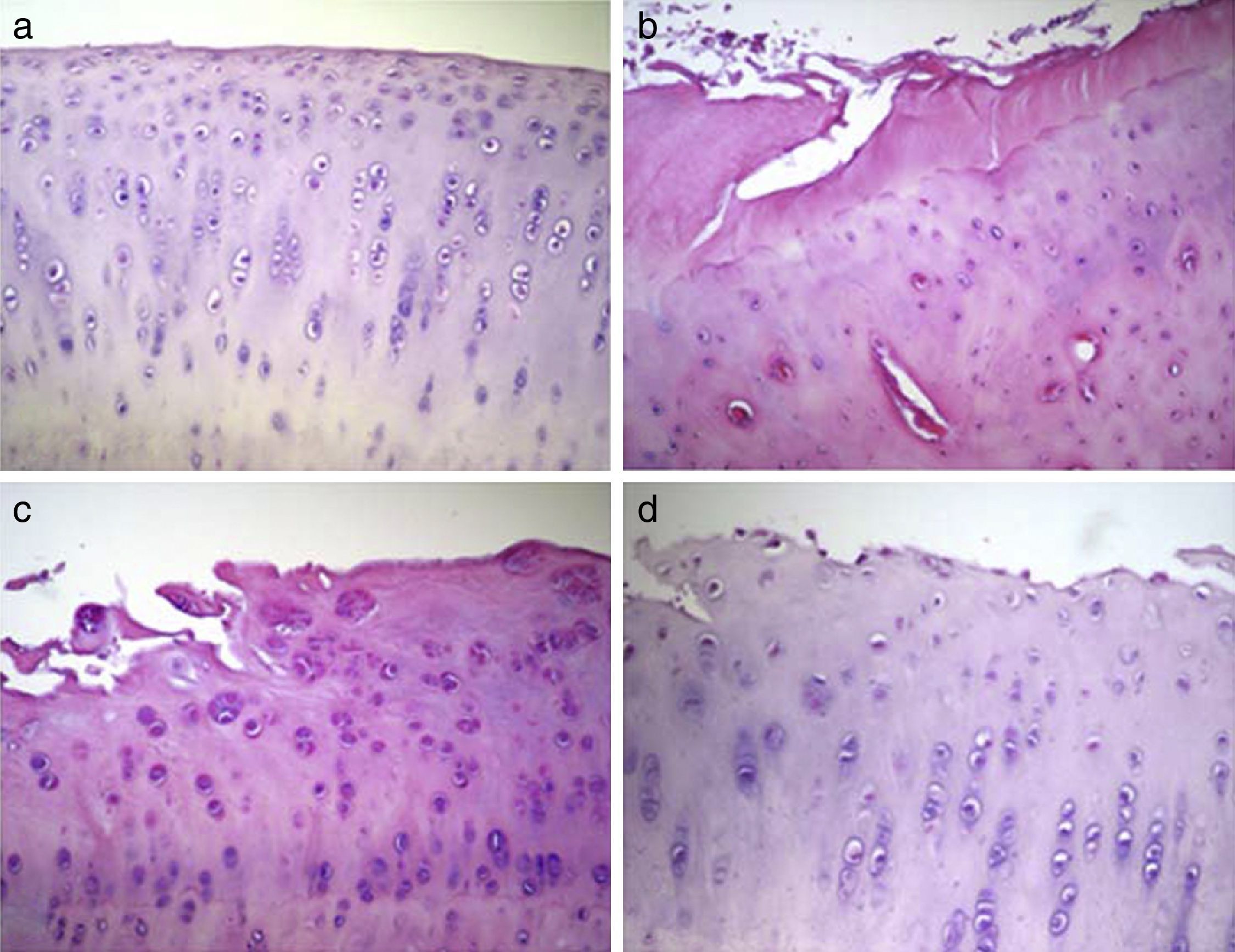
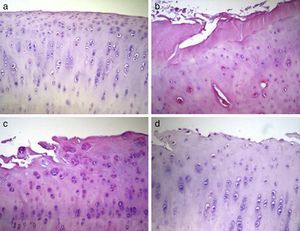
Análisis histológicoLos cóndilos del grupo 1 presentaron una superficie articular regular con una matriz hialina y condrocitos organizados en columnas. En los cóndilos del grupo 2, se observó que la mayoría presentó una superficie irregular con una matriz de fibrocartílago y condrocitos desorganizados en su distribución. En el grupo 3, la mayoría de las muestras presentaron una superficie irregular con una matriz predominantemente hialina pero con una distribución celular con columnas y zonas de clusters. Finalmente, en el grupo 4 los cóndilos presentaron superficies irregulares con gran variabilidad en la distribución celular entre las muestras, observándose muestras con una distribución desorganizada y otras con una columnar y de clusters (fig. 3).
Análisis histológico del cartílago 12 semanas después de la intervención. Los datos mostrados son representativos de 4 cortes (20X) por animal. a) Grupo 1 o normal (n=12); b) Grupo 2 o lesionado no tratado (n=6); c) Grupo 3 o dosis única de Hylan G-F 20 (n=6); d) Grupo 4 o 3 dosis de Hylan G-F 20 (n=6).
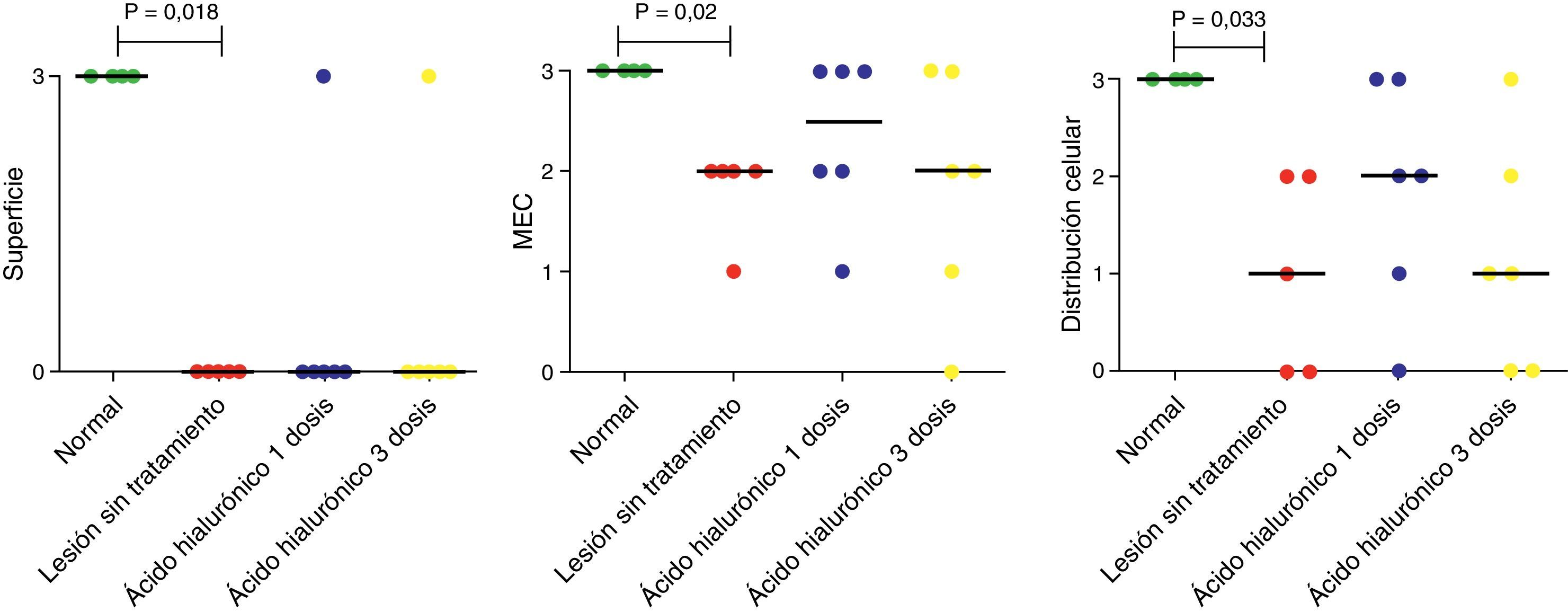
El análisis cuantitativo de los datos histológicos demostró que la viabilidad celular, el compromiso del hueso subcondral y la mineralización del cartílago se mantuvo sin cambios en todos los grupos. Sin embargo, la superficie articular, la matriz extracelular y la distribución celular varió de un grupo a otro (fig. 4). Los cóndilos del grupo 1 presentaron la máxima puntuación (3 puntos); las muestras del grupo 2 demostraron una reducción significativa de puntuación en las tres categorías (3-0, 3-2, 3-1, respectivamente) (p<0,05). Tanto los cóndilos del grupo 3 como los del grupo 4 presentaron una mediana para la categoría de superficie igual a la del grupo 2 (0-0–0) (p>0,05). En la categoría de matriz y distribución celular, los grupos 3 y 4 presentaron más muestras con características hialinas que el grupo 2, sin embargo estas diferencias no fueron estadísticamente significativas.
DiscusiónEn el presente estudio, en conejos, no pudimos demostrar que el tratamiento de lesiones condrales de espesor completo con Hylan G-F 20® mejore significativamente la regeneración del cartílago articular a los 3 meses. Además, al comparar el protocolo de dosis única con 3 dosis semanales, no encontramos diferencias en las características macroscópicas e histológicas del tejido neoformado. En estos grupos, los defectos se rellenaron con un tejido mixto, de características hialinas y de fibrocartílago, con una presentación variable entre las muestras. De acuerdo a estos resultados, el uso de Hylan G-F 20®, en lesiones condrales agudas, tiene algún efecto aunque no parece ser significativo.
En clínica se ofrecen múltiples opciones para el tratamiento de lesiones condrales. Sin embargo, ninguna de estas estrategias ha sido capaz de regenerar el cartílago articular3,4. Actualmente, la viscosuplementación intraarticular con AH se utiliza como una alternativa en los pacientes con artrosis y se han publicado estudios, multicéntricos, a doble ciego, aleatorizados y comparados contra placebo, que incluyen un elevado número de pacientes, demostrando que la infiltración con AH es una intervención segura, bien tolerada, que otorga un alivio mantenido del dolor y mejora la función del paciente con pocas reacciones adversas10,18,19. Sin embargo, estos estudios se han efectuado, en su mayoría, sobre pacientes artrósicos que poco tienen que ver con las lesiones condrales aisladas.
Por otro lado, algunos estudios experimentales han publicado buenos resultados con el AH en la regeneración y viabilidad celular de los condrocitos, pero estos modelos no son comparables con nuestro trabajo ya que evalúan lesiones condrales parciales20,21 y no de espesor completo como en nuestro trabajo.
La viscosuplementación con AH ha sido evaluada en lesiones aisladas del cartílago articular asociada con las microfracturas21,22. Strauss et al.22 demostraron, en conejos, que el uso de microfracturas asociadas a 3 dosis semanales de AH rellenan el defecto condral y mejoran la apariencia macroscópica del tejido. Adicionalmente, los cambios degenerativos articulares disminuyeron significativamente con el uso de AH. Esto podría ser explicado por el efecto sinérgico de ambos procedimientos y no de cada uno por separado.
El modo de acción preciso del AH en la reparación del cartílago aún no se conoce con certeza. Sin embargo, existen estudios que demuestran que el efecto no es sólo a través de sus propiedades mecánicas, sino que también tendría otras funciones como el aumento de la producción endógena de AH, la inhibición de la degradación de PG y un efecto antiinflamatorio in vitro23–25 que generará un ambiente más favorable en la articulación, retrasando el desarrollo de los cambios degenerativos y que promueve la regeneración del cartílago hialino. Sin embargo, de acuerdo a nuestros resultados, estos beneficios serían solo teóricos.
No hemos encontrado estudios, experimentales o clínicos, que comparen el uso del mismo AH en dosis única contra 3 dosis. Strauss et al.22 asociaron a las microfracturas un protocolo de 3 o 5 dosis semanales de AH, señalando una diferencia estadísticamente significativa en favor del uso de 3 dosis, a los 3 meses, aunque la apariencia macroscópica e histológica del tejido formado en la lesión, a los 6 meses, fue similar a la del grupo control.
Una limitación de nuestro estudio es que sólo evaluamos parámetros morfológicos y no funcionales. Sin embargo, nuestro objetivo fue describir el efecto de dos diferentes protocolos de tratamiento con AH, analizando su capacidad regenerativa en el tratamiento de lesiones condrales y no su impacto en la función articular. Probablemente, la mayor fortaleza del presente trabajo es el uso de un método fácil y reproducible, en cuanto al uso de un mismo procedimiento anestésico, técnica quirúrgica y manejo perioperatorio. El hecho de que los resultados macroscópicos e histológicos fueran similares entre ellos también sugiere que nuestro análisis fue preciso y representa una doble comprobación del tejido generado.
En el presente estudio, nosotros demostramos que el uso de un protocolo de 3 dosis de AH en comparación con la dosis única no mejora significativamente la regeneración del cartílago hialino en lesiones condrales agudas de espesor completo en conejos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.