En los últimos 15 años, la densitometría ósea se ha utilizado para analizar los modelos de remodelado periprotésico determinados por diferentes diseños de vástagos femorales no cementados1,2, tanto de primera como de segunda generación. Los vástagos no cementados de primera generación, generalmente de diseño recto, con collar y recubrimiento poroso extendido, se han asociado con una pérdida ósea de proximal a distal, atribuida al efecto puente3-5. En estos implantes se han observado descensos de hasta un tercio de la masa ósea en áreas proximales, pérdidas menores en áreas intermedias del implante y cambios no significativos en las regiones diafisarias.
Por el contrario, los vástagos femorales no cementados de segunda generación representan un cambio en la filoso-fía de diseño. Generalmente están fabricados de titanio y presentan un diseño anatómico que mejora su encaje en el canal femoral. Buscando el anclaje metafisario el recubrimiento poroso queda limitado al tercio proximal, con el eventual uso de sustancias osteoconductoras como la hidroxiapatita6-9. Estos vástagos han demostrado una menor pérdida ósea remodelativa, tanto en zonas proximales como metafisarias, así como una mayor conservación en zonas diafisarias.
Otros conceptos de vástagos femorales no cementados, como los diseños en cuña10,11, los implantes a medida o los vástagos de rigidez reducida12, también han mostrado cifras variables de pérdida ósea por remodelado.
El vástago femoral ABG-I®, considerado de segunda generación, ha mostrado, además de un buen comportamiento clínico y radiográfico13, un remodelado óseo con descensos de masa ósea de hasta el 30% en calcar y trocánter menor y del 15-17% en zonas metafiso-diafisarias, con seguimientos de 5 años14. El rediseño de este implante (ABG-II)® pretende mantener los buenos resultados clínicos y conseguir una mayor conservación de la densidad ósea a largo plazo. El propósito de este estudio es cuantificar la variación de masa ósea que determina el remodelado periprotésico con este implante, en un grupo de pacientes, a lo largo de los tres primeros años tras la intervención.
MATERIAL Y MÉTODO
Para conocer el remodelado periprotésico causado por el vástago ABG-II® se diseñó un estudio prospectivo, controlado, con inclusión de pacientes entre los meses de febrero y octubre del año 2000. Para calcular el tamaño de la muestra se consideró un error de precisión debido al observador del 1,4%; un error tipo alfa igual a 0,05 y una potencia del 80% para una variación de la densidad ósea de 130 mg de calcio por centímetro cuadrado, resultando suficiente una muestra de 70 pacientes.
Se inició el estudio con un total de 70 pacientes, completándose el seguimiento a 3 años en 69 (30 hombres y 39 mujeres), con una edad media de 59 años (38 a 76) y un peso de 79,3 kg (49 a 110 kg). Al final del seguimiento se había perdido un paciente por enfermedad neurológica grave que no le permitía la deambulación. Los criterios de inclusión fueron: tener indicación quirúrgica para este tipo de implantes, afectación unilateral, ya que la cadera contralateral sana se utilizó como control, y la aceptación a participar en el estudio mediante la firma de un documento de consentimiento informado. El Comité local de Ética en la Investigación autorizó el estudio. Los diagnósticos que motivaron la intervención fueron 64 casos de coxartrosis, 5 de necrosis avascular y 1 de artritis reumatoide.
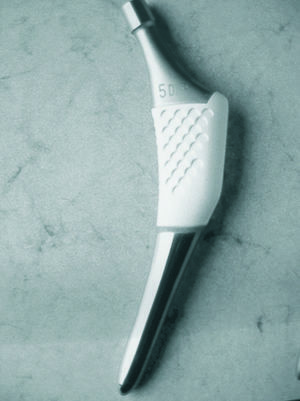
El implante utilizado fue el vástago ABG-II® (Stryker, EE.UU.), con cótilo no cementado del mismo sistema, no objeto de estudio. Se trata de un vástago anatómico no cementado, de anclaje metafisario press-fit y fabricado con una aleación de titanio, molibdeno, zirconio y hierro (fig. 1). En la metáfisis presenta un diseño anterior y posterior en forma de escamas para aumentar la estabilidad del implante recubierto de una capa de hidroxiapatita de 70 micras de espesor. La cola del implante es delgada y corta, evitando el contacto endomedular con la diáfisis; y está ultrapulida, para evitar el anclaje óseo.
Figura 1. Vástago ABG-II® que muestra la zona metafisaria con recubrimiento de hidroxiapatita y la cola, pulida, delgada y breve.
Se utilizó como criterio de evolución la variación de la masa ósea en unos recuadros de 30 por 30 píxeles de cada una de las 7 áreas de Gruen, tanto de la cadera enferma como de la sana, utilizada como control (fig. 2). Las determinaciones de masa ósea se realizaron con el densitómetro HOLOGIC® QDR 1000 (Hologic Inc, Waltham, Mas EE.UU.), en ambas caderas en el preoperatorio, al año y a los tres años postoperatorios, y en la enferma, además, a los 6 meses de la intervención. Para la fiabilidad de las exploraciones se consideró fundamental la colocación del paciente, por lo que se diseñó un protocolo de colocación. Los pacientes se colocaron en posición supina sobre la tabla del escáner, con las rodillas y las caderas en extensión y todo el miembro en posición neutra apoyado sobre un dispositivo de plástico rígido al que se fijaba con cintas de velcro. Las características técnicas del densitómetro presentaron un error de precisión en fémur de 1,5 a 2%; un error de exactitud entre 2 y 4%, hasta un 10% en pacientes obesos; radiación al paciente menor de 3mRem, tiempo de exploración 8 minutos y error debido a la variabilidad interexplorador entre 1,6-2%2,15,16. En nuestro estudio la variabilidad debida al observador se determinó mediante el análisis de un grupo de 10 voluntarios sanos en quienes se realizaron 3 determinaciones a lo largo de 6 horas, resultando una variación del 1,4%.
Figura 2. Densitometría ósea con las zonas estudiadas en las 7 áreas de Gruen.
Para el análisis estadístico se utilizó la prueba de la «t» de Student tanto para la comparación de medias entre poblaciones dependientes como para poblaciones independientes. En el primer caso para la evolución de la masa ósea en cada una de las 7 áreas femorales; en el segundo, para la evolución de masa ósea entre caderas caso y control, y las diferencias entre sexos. Para comparar la evolución de la masa ósea entre pacientes agrupados en 3 tramos de peso o según la posición final del implante se contrastaron los resultados entre los grupos utilizando, de nuevo, la prueba de la «t» de Student previa comprobación de la homogeneidad de varianzas con el test de Levene.
RESULTADOS
Los 69 pacientes en quienes se completó el estudio densitométrico presentaron una buena evolución clínica y radiográfica a los 3 años; sin complicaciones significativas ni signos de inestabilidad radiológica.
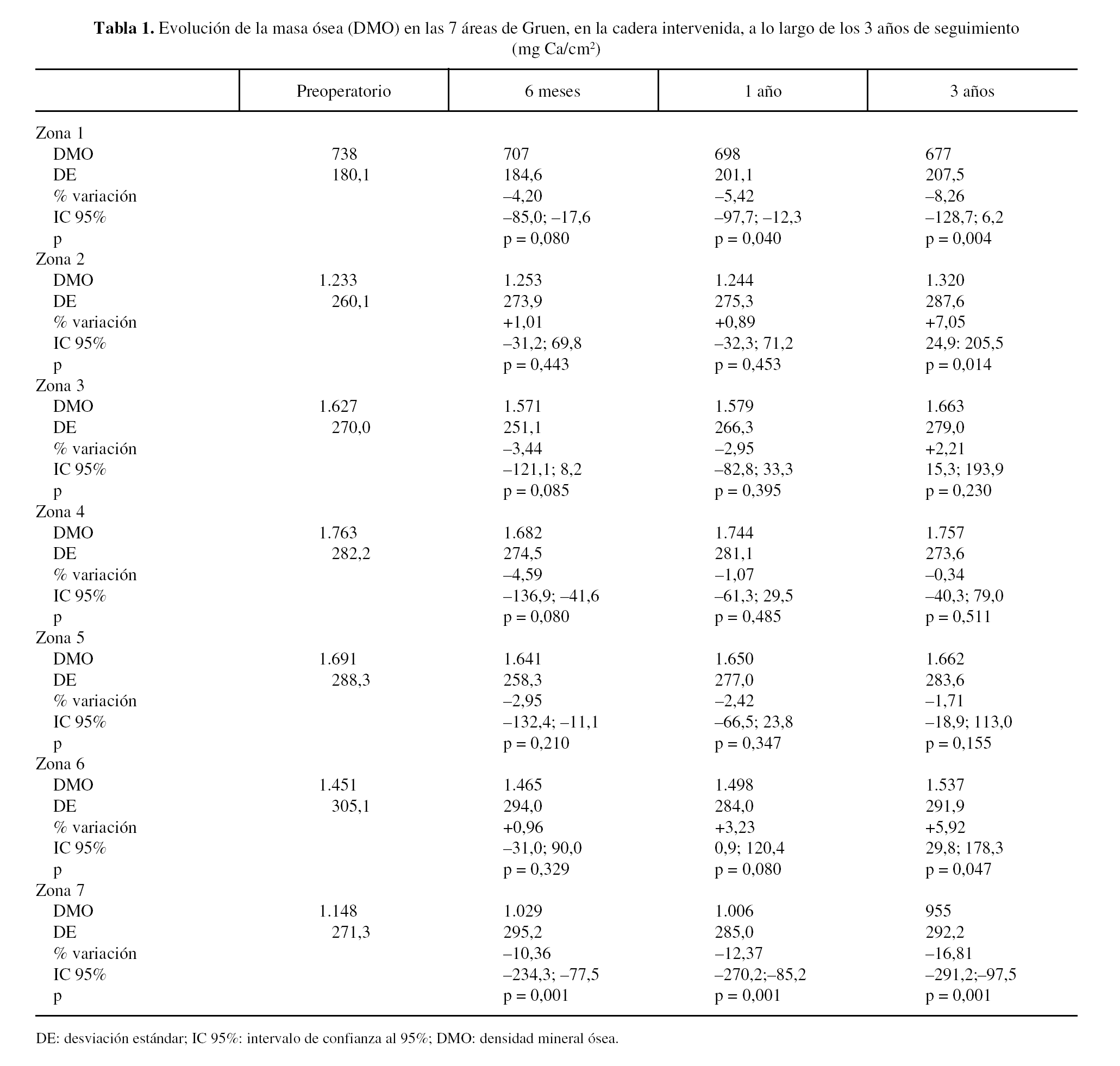
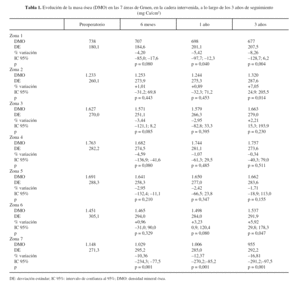
La evolución de la masa ósea en la cadera intervenida y en la sana se muestra en las tablas 1 y 2. La determinación preoperatoria en ambas caderas mostró cifras de masa ósea ligeramente superiores en la cadera sana, que oscilaban entre 0,1% en la zona 6 a 4,3% en la zona 2, aunque no fueron estadísticamente significativas, y se atribuyeron a una discreta atrofia por desuso de una articulación dolorosa.
En las caderas intervenidas, a los 6 meses de la intervención, se apreciaron descensos en 5 de las áreas estudiadas. En las áreas 1, 3, 4 y 5 el descenso osciló entre, 2,95 y 4,59%, pero únicamente en la zona 7, con caída del 10,36%, estos cambios fueron significativos. Las áreas 2 y 6 mostraron aumentos mínimos, 1,01 y, 0,96% respectivamente, sin significación estadística.
Al año de evolución se acentuó el patrón de remodelado observado. En las áreas 3, 4 y 5 el descenso variaba entre 1,07% en la zona 4 a 2,95% en la zona 3, cambios no estadísticamente significativos respecto a las determinaciones preoperatorias. Sin embargo, en las zonas 1 y 7 se apreció una progresión de la pérdida ósea significativa, atribuible a la nueva situación biomecánica de la cadera, con descensos de 5,42% y 12,37%, respectivamente. Las zonas 2 y 6 mostraron incrementos mínimos, del 0,89% en la zona 2 y del 3,23% en la 6.
Al final del tercer año se apreció un patrón de remodelado que consolidaba los cambios de los primeros 12 meses. Las zonas 2 y 6 mostraron un aumento de masa ósea de 7,05 y 5,92%, en ambos casos estadísticamente significativos. La zona 3 mostró un aumento, no estadísticamente significativo, de 2,21%; en tanto que las zonas 4 y 5 presentaban unos descensos de 0,34 y 1,71%, respectivamente. Sin embargo, en el área 1 se apreció un descenso del 8,26% y en la 7 del 16,81%.
Se estudió el comportamiento del remodelado agrupando a los pacientes en tres tramos de edad: pacientes menores de 55 años, aquellos con edades comprendidas entre los 55 y 65 años y un tercer grupo mayor de 65 años. No se apreció una influencia estadísticamente significativa de este factor en el remodelado periprotésico en ninguna de las zonas estudiadas. Semejantes resultados se obtuvieron cuando se compararon las cifras de masa ósea entre pacientes cuyo peso era menor de 75 kg y aquellos con peso mayor. Respecto a la influencia de la posición final del implante en el remodelado periprotésico, se identificaron 9 pacientes con el vástago colocado en un valgo mayor de 5°, y 6 pacientes con implantes en varo mayor de 5°. Tampoco en este caso se apreciaron patrones de remodelado diferentes en ninguna de las áreas objeto de estudio.
El sexo de los pacientes determinó ciertas diferencias. En el estudio preoperatorio se apreciaron diferencias significativas en la masa ósea entre hombres y mujeres. Los varones, generalmente con fémures más grandes, tenían cifras más altas de densidad ósea en todas las zonas, pero sólo resultaron estadísticamente significativas en la 3 (p = 0,008), 4 (p = 0,024), 5 (p = 0,010) y 6 (p = 0,011). En el seguimiento postoperatorio se mantuvieron estas diferencias entre ambos sexos. Al comparar los porcentajes de variación de la masa ósea en cada zona para los diferentes momentos del seguimiento, se apreció que los varones mostraban menor pérdida ósea que las mujeres tanto en la zona 1, ya estadísticamente significativas a los 6 meses (p = 0,0194), como en la zona 7, significativa a los 3 años (p = 0,024).
La evolución de la masa ósea en la cadera contralateral mostró pequeñas variaciones a lo largo del seguimiento. Se apreció un pequeño repunte al año de evolución, pero los cambios observados tuvieron significación estadística únicamente en zonas determinadas.
DISCUSION
La pérdida de masa ósea tras el implante de una prótesis de cadera es un proceso multifactorial, pudiendo distinguirse factores dependientes del paciente y factores dependientes del implante. Entre los primeros pueden señalarse el sexo, la masa ósea inicial, el peso y la carga a la que se somete el implante en las fases iniciales, así como la calidad de la fijación primaria. Entre los factores dependientes del implante cabe señalar la rigidez del implante, el tamaño, el tipo y extensión del recubrimiento poroso17 así como el diseño y la aleación utilizada18-21.
Los estudios densitométricos con diferentes implantes han permitido cuantificar la influencia de estos factores en el total del remodelado y proporcionan información para el rediseño de implantes en uso o para el diseño de nuevos. Uno de los vástagos más estudiados fue el AML®1-5, de diseño recto y recubrimiento poroso extendido, que mostró unas cifras de pérdida ósea en torno al 40-45% en zonas proximales, del 20% en zonas metafisarias, y sin pérdidas significativas distales, en estudios a largo plazo. Estos cambios tenían lugar en los primeros dos años tras la cirugía, permaneciendo luego prácticamente estables. Con vástagos no cementados de segunda generación, el remodelado periprotésico ha mostrado cifras más favorables6-9 que oscilan entre un 20-25% de descenso en zonas proximales, 5 a 15% de descenso en zonas metafisarias y sin cambios significativos en zonas distales. Estos cambios también tenían lugar en los primeros 2 años postoperatorios.
Los vástagos femorales con diseño en forma de cuña5,10-12 han mostrado una evolución favorable de la masa ósea tras el implante, limitándose la pérdida ósea a las zonas más proximales, con descensos que oscilan entre el 5 y el 30% según las prótesis utilizadas.
Los implantes hechos a medida, a partir de la tomografía axial computarizada (TAC) previa, buscan un anclaje metafisario óptimo, adaptado a la geometría femoral de cada paciente. Los estudios realizados con este tipo de implantes12,22-25 muestran que, en grado variable, sigue existiendo cierta atrofia proximal, fundamentalmente en zona 7, con descensos del 10-20% a los 3 años.
Los vástagos femorales de rigidez reducida9,26 presentan, durante los primeros 2 años, cifras de pérdida ósea proximal entre el 2 y el 15%, con descensos menores en zonas metafisarias y diafisarias. Se considera que estos implantes consiguen una transmisión de cargas al fémur proximal más uniforme que los vástagos anatómicos, pero existen dudas acerca de la unión entre las diferentes capas con el paso del tiempo y la posibilidad de fallos a largo plazo.
El diseño previo de este implante objeto de estudio, el ABG-I®, ha mostrado buenos resultados clínicos y radiológicos a 7 años13, pero en determinaciones densitométricas se apreciaron descensos del 25,5% en la zona 1, del 34,12% en zona 7, y en torno al 10-15% en zonas 2, 3, 5 y 6 en 5 años de evolución14. Los cambios en el diseño introducidos en 1999 dieron lugar al vástago ABG-II®, que pretendía mantener los buenos resultados clínicos, pero con una mayor conservación ósea. El nuevo diseño presenta un discreto ensanchamiento antero-posterior en la metáfisis para obtener un mayor relleno a ese nivel, una cola más corta y ultrapulida y una ampliación del recubrimiento de hidroxiapatita en el hombro y en el cuello de la prótesis.
Los resultados de este estudio sugieren que el vástago ABG-II® consigue un anclaje metafisario, estable y suficiente para una transmisión eficaz de cargas entre el implante y el fémur, capaz de favorecer la conservación ósea en zonas metafisarias y diafisarias. Persiste, no obstante, una atrofia por desuso en zonas 1 y 7, aunque de cuantía netamente inferior a los vástagos de primera generación. Esta pérdida es menor que la observada en otros diseños de segunda generación y, en general, comparable a los resultados más favorables obtenidos con vástagos a medida, de diseño en cuña o vástagos de rigidez reducida.
El patrón de remodelado que determina este implante varía únicamente en función del capital óseo en el momento de la cirugía, siendo el sexo el factor más influyente pues determina diferencias en el contenido mineral y en la rigidez femoral. Los varones, con fémures más rígidos, parecen conseguir la fijación ósea en zonas más proximales que las mujeres. Esta fijación permite la transmisión de cargas a zonas más proximales, y constituye un estímulo para la conservación ósea. Estas diferencias ya han sido observadas por otros autores27, encontrando una pérdida ósea significativamente mayor en las mujeres, aunque con el mismo gradiente de pérdida ósea, de proximal a distal.
En conclusión, el vástago ABG-II® consigue un anclaje metafisario eficaz, con transmisión de cargas al fémur proximal que minimiza la atrofia ósea a ese nivel y que constituye un estímulo suficiente para la conservación ósea en zonas más distales durante los primeros tres años. Estudios a más largo plazo permitirán conocer el remodelado tardío como consecuencia de la pérdida ósea senil involutiva.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.
Correspondencia:
J.J. Panisello Sebastiá.
Servicio de Cirugía Ortopédica y Traumatología.
Hospital Universitario Miguel Servet.
P.o Isabel La Católica, 1-3.
50009 Zaragoza.
Recibido: enero de 2005.
Aceptado: mayo de 2005.