El pie diabético (PD) es una complicación frecuente y grave de la diabetes mellitus (DM), particularmente en pacientes con enfermedad renal crónica (ERC) en terapia sustitutiva renal (TSR). Este estudio evalúa la prevalencia de PD y condiciones asociadas en pacientes con DM bajo TSR en un hospital de tercer nivel en Argentina.
Material y métodosSe realizó un estudio observacional, transversal entre diciembre de 2022 y septiembre de 2024. Se incluyeron 54 pacientes con DM tipo 1 o 2 en tratamiento con hemodiálisis (HD) o diálisis peritoneal (DP). Se evaluaron antecedentes de PD, lesiones activas o preulcerativas, neuropatía, enfermedad vascular periférica (EAP) y factores de riesgo asociados mediante examen físico y revisión de la historia clínica.
ResultadosLa prevalencia de PD fue del 40,7%, con mayor proporción en HD (48,6%) frente a DP (26,3%). Se observaron lesiones preulcerativas en el 61,1% de los pacientes y lesiones activas en el 9,3%. El 31,4% tenía antecedentes de amputaciones. La neuropatía diabética (87%) y la EAP (81,5%), condiciones estrechamente relacionadas con la aparición del PD, fueron hallazgos clave. Asimismo, se observaron diferencias significativas en factores de riesgo como el tabaquismo (42,1% DP vs. 11,4% HD, p=0,016), que puede deteriorar la microcirculación, y la obesidad (63,2% DP vs. 25,7% HD, p=0,016), la cual incrementa la presión plantar y favorece las deformidades del pie.
ConclusionesLos pacientes con DM en TSR presentan una alta prevalencia de PD y factores predisponentes. La detección temprana y el seguimiento multidisciplinario son fundamentales para prevenir complicaciones graves como úlceras y amputaciones.
Diabetic foot (DF) is a common and serious complication of diabetes mellitus (DM), especially in patients with chronic kidney disease (CKD) undergoing renal replacement therapy (RRT). This study aimed to assess the prevalence of DF and associated conditions in DM patients receiving RRT at a tertiary care hospital in Argentina.
Materials and methodsWe conducted a cross-sectional observational study between December 2022 and September 2024. A total of 54 patients with type 1 or type 2 DM undergoing either hemodialysis (HD) or peritoneal dialysis (PD) were included. History of DF, active or pre-ulcerative lesions, neuropathy, peripheral vascular disease, and associated risk factors were evaluated through physical examination and medical record review.
ResultsDF was present in 40.7% of patients, with a higher proportion in HD (48.6%) compared to PD (26.3%). Pre-ulcerative lesions were found in 61.1%, and active ulcers in 9.3%. A history of amputation was reported in 31.4% of cases. Diabetic neuropathy (87%) and peripheral vascular disease (81.5%), both closely related to DF development, were key findings. Significant differences were observed in smoking (42.1% PD vs. 11.4% HD, p=0.016), which may impair microcirculation, and obesity (63.2% PD vs. 25.7% HD, p=0.016), which increases plantar pressure and contributes to foot deformities.
ConclusionsDM patients on RRT have a high prevalence of DF and related risk factors. Early detection and multidisciplinary follow-up are essential to prevent complications such as ulcers and amputations.
La diabetes mellitus (DM), y en particular la de tipo 2, es una de las enfermedades crónicas más prevalentes a nivel global, siendo una causa significativa de complicaciones que afectan a la calidad de vida de los pacientes, especialmente aquellos con afecciones crónicas avanzadas. De acuerdo con las estimaciones de la Federación Internacional de Diabetes, cerca de 463 millones de personas padecen diabetes, una cifra que se espera que aumente a 700 millones en el año 20451. Entre las complicaciones más difíciles con alto impacto clínico se encuentra el pie diabético (PD), que puede dar lugar a ulceraciones graves y necesidad de amputaciones. El PD se define como una infección, ulceración o destrucción de los tejidos profundos del pie, asociada a neuropatía diabética y enfermedad arterial periférica en las extremidades inferiores, que causa potencialmente amputaciones de la extremidad2. La carga social y económica de esta afección es considerable, calculándose que hasta el 25% de los pacientes con diabetes desarrollarán una úlcera en el pie en algún momento de su vida1. En pacientes con DM y enfermedad renal crónica (ERC) que requieren terapia de reemplazo renal (TRR), el riesgo de complicaciones en el pie se incrementa significativamente3. Diversos estudios han demostrado que la diálisis, tanto hemodiálisis (HD) como diálisis peritoneal (DP), constituye un factor de riesgo de desarrollo de úlceras en el pie y otras lesiones debidas a factores tales como neuropatía avanzada, enfermedad arterial periférica y alteraciones inmunológicas inherentes a dichos pacientes3–5. Se ha reportado que cerca del 20% de los pacientes diabéticos que reciben diálisis desarrolan úlceras en el pie durante el primer año de tratamiento, con una tasa de amputación anual del 4% en esta población, cifra que supera la observada en otros grupos de pacientes diabéticos6.
El objetivo de este estudio es evaluar la prevalencia de PD y otras afecciones asociadas en pacientes con DM que reciben TRR, incluyendo tanto HD como DP, en un hospital de nivel terciario de Argentina.
Materiales y métodosSe realizó un estudio observacional transversal entre diciembre de 2022 y septiembre de 2024. Se incluyó a todos los pacientes mayores de 18 años con diagnóstico confirmado de DM tipo 1 o 2 DM y ERC bajo TRR activa, con HD o DP en un hospital de nivel terciario de la ciudad autónoma de Buenos Aires, Argentina. Se seleccionó a pacientes procedentes del centro de nefrología durante sus visitas clínicas rutinarias a la Unidad de Nefrología del hospital. Se consideró que los pacientes tenían DM si tenían diagnóstico de la enfermedad, o, alternativamente, recibían cualquier agente hipoglucémico. Se requirió que todos los participantes tuvieran una historia clínica electrónica completa y que acordaran someterse a examen voluntariamente físico del pie.
Se excluyó a aquellos pacientes que tuvieran una historia clínica incompleta, no iban a recibir TRR debidamente, o iban a recibirla en otro centro, o no acordaron participar en el examen físico, o no contaban con un examen reciente registrado en su historia clínica.
Los pacientes fueron clasificados en dos grupos, en virtud de la TRR recibida: HD o DP. La recopilación de los datos se realizó mediante la historia clínica electronica, además de una evaluación clínica basada en el «Formulario de evaluación del pie para pacientes con diabetes» de las guías de 2021 del Ministerio de Sanidad de Argentina7, junto con un examen físico del pie para todos los pacientes diabéticos que recibieron TRR.
Para cada participante, se recopilaron las variables siguientes: edad, sexo, tipo y duración de DM, valor más reciente de hemoglobina glucosilada (HbA1c), tipo y duración de la TRR (es decir, HD o DP), consultas durante el pasado año con el servicio ortopédico de PD y el equipo multidisciplinar de metabolismo, examen del fondo en el último año, tabaquismo, obesidad, neuropatía y enfermedad vascular periférica (EAP).
Además, se preguntó a los pacientes sobre su historia previa de úlceras en el pie, y se les evaluó conforme al consenso actual de International Working Group on the Diabetic Foot (IWGDF– actualización de 2023)8. Todos los pacientes fueron sometidos a un examen físico del pie para identificar los signos actuales de infección, ulceración o destrucción de los tejidos del pie, amputaciones previas de las extremidades inferiores (menores o mayores), lesiones preulcerativas, onicodistrofia y deformidades del pie. Se definió la deformidad de acuerdo con las recomendaciones de IWGDF9, en términos de anomalías estructurales del pie tales como dedos en martillo, dedos en maza, dedos en garra, hallux valgus, cabezas metatarsianas prominentes, neuro-osteoartropatía residual, amputaciones u otras cirugías del pie.
La presencia o ausencia de EAP fue determinada sobre la base de una ecografía Doppler de la extremidad inferior, en la que se evaluaron la presencia de placas ateroscleróticas y el nivel de obstrucción vascular.
Además, se registraron todos los pacientes que acudieron a la clínica ambulatoria de PD de la Sección de pie y tobillo de la Unidad de ortopedia y traumatología que cumplieron los criterios de inclusión. A aquellos pacientes que no fueron objeto de seguimiento regular por parte del servicio se les entregó una guía práctica de cuidados preventivos y fueron programados para visitas de seguimiento ambulatorias.
Se obtuvieron resultados globales en cuanto a prevalencia de PD de todos los pacientes, y se realizó un análisis comparativo de las variables entre ambos grupos.
El Comité de ética para protocolos de investigación de nuestro hospital aprobó el protocolo de estudio.
Análisis estadísticoEn el análisis descriptivo se expresaron los datos cuantitativos como media y desviación estándar (DE) o mediana y rango intercuartílico (RIC 25–75), dependiendo de su distribución, mientras que las variables cualitativas se expresaron como frecuencias absolutas y relativas (porcentajes).
Las comparaciones entre los grupos, en virtud del tipo de diálisis fueron realizados mediante la prueba t o de Wilcoxon para las variables cuantitativas, dependiendo de su distribución, y la prueba χ2 o exacta de Fisher para las variables cualitativas, dependiendo de los supuestos. Se consideró estadísticamente significativo un nivel de significación inferior al 5%. El análisis estadístico se realizó mediante el software STATA versión 16.0.
ResultadosDurante el periodo de estudio se analizó un total de 60 pacientes. Se excluyeron seis pacientes: dos debido a fallecimiento, tres debido a traslado a otro centro de diálisis, y uno debido a haber recibido un transplante. Finalmente, se incluyó un total de 54 pacientes con DM que recibieron TRR: 35 (64,8%) con HD y 19 (35,2%) con DP. La media de edad fue de 65,9 años (rango 34–88), siendo varones el 70,3% de la población de estudio (38/54). Todos eran pacientes con diabetes tipo 2, exceptuando uno que era de tipo 1. La media de edad para el diagnóstico de diabetes fue de 18 años (RIC: 11–23).
La Unidad de Ortopedia realizó un seguimiento de 14 pacientes (25,9%) el año precedente, y el equipo multidisciplinar de metabolismo se ocupó del seguimiento de un total de 38 pacientes (70,4%).
Entre las comorbilidades evaluadas, 47 pacientes (87%) tuvieron neuropatía diabética y 44 (81,5%) EAP. La prevalencia de neuropatía fue ligeramente más alta en el grupo DP, siendo 17 de entre 19 pacientes (89,5%), en comparación con 30 de entre 35 (85,7%) en el grupo HD. EAP fue más frecuente entre los pacientes con HD, en 33 de entre 35 (94,7%), mientras que en el grupo DP se observó en 14 de entre 19 (74,3%). Ninguna de estas diferencias fue estadísticamente significativa. Dichas afecciones fueron altamente prevalentes en ambos grupos; Sin embargo, no se estableció en este estudio ninguna asociación estadística directa con la presencia de PD.
Se identificaron otros factores de riesgo relevantes, tales como tabaquismo y obesidad, que reflejaron diferencias estadísticamente significativas entre los grupos. La prevalencia de tabaquismo fue significantivamente más alta en el grupo DP en comparación con HD, reportándose en 12 de entre 54 pacientes (22,2%): ocho de entre 19 con DP (42,1%) y cuatro de entre 35 con HD (11,4%) (p=0,016). La obesidad estuvo presente en 21 pacientes (38,9%): 12 de entre 19 con DP (63,2%) y nueve de entre 35 con HD (25,7%), reflejando una prevalencia más alta en el grupo DP, con una diferencia estadísticamente significativa (p=0,016). En cuanto a hemoglobina glucosilada (HbA1c), los valores medios fueron similares entre los grupos (HD: 7,28; DP: 7,22; p=0,908).
Para el seguimiento interdisciplinar, 38 pacientes (70,4%) fueron evaluados por el equipo de metabolismo durante el último año: 17 de entre 19 con DP (89,5%) y 21 de entre 35 con HD (60%) (p=0,051). Se documentó seguimiento por parte de la Unidad de Ortopedia en 14 pacientes (25,9%): tres de entre 19 con DP (15,8%) y 11 de entre 35 con HD (31,4%) (p=0,331) (tabla 1).
Datos demográficos y comorbilidades
| Variable | Total(n=54) | Diálisis peritoneal (n=19) | Hemodiálisis (n=35) | Valor p |
|---|---|---|---|---|
| Años bajo diálisis – mediana (RIC) | 2,00 (1,00;4,00) | 2,00 (1,50;3,00) | 2,00 (1,00;5,00) | 0,509 |
| Años con diabetes – mediana (RIC) | 18,0 (11,0;23,0) | 18,0 (12,0;30,0) | 17,0 (11,0;23,0) | 0,341 |
| Seguimiento en el último año por los ortopedistas – n (%) | 14 (25,9%) | 3 (15,8%) | 11 (31,4%) | 0,728 |
| Bajo seguimiento ortopedista– n (%) | 14 (25,9%) | 3 (15,8%) | 11 (31,4%) | 0,331 |
| Seguimiento en el último año por la clínica de metabolismo – n (%) | 38 (70,4%) | 17 (89,5%) | 21 (60,0%) | 0,051 |
| Hemoglobina glucosilada – media (DE) | 5,51 (3,44) | 7,22 (1,62) | 7,28 (1,70) | 0,908 |
| Examen de ojo realizado – n (%) | 31 (57,4%) | 15 (78,9%) | 16 (45,7%) | 0,038 |
| Tabaquismo – n (%) | 12 (22,2%) | 8 (42,1%) | 4 (11,4%) | 0,016 |
| Obesidad – n (%) | 21 (38,9%) | 12 (63,2%) | 9 (25,7%) | 0,016 |
| Neuropatía diabética – n (%) | 47 (87,0%) | 17 (89,5%) | 30 (85,7%) | 1 |
| Enfermedad vascular periférica – n (%) | 44 (81,5%) | 18 (94,7%) | 26 (74,3%) | 0,08 |
| Pulso tibial posterior – n (%) | 37 (68,5%) | 10 (52,6%) | 27 (77,1%) | 0,122 |
| Pulso tibial anterior – n (%) | 40 (74,1%) | 11 (57,9%) | 29 (82,9%) | 0,058 |
La prevalencia global de PD en la población estudiada fue del 40,7% (22/54), siendo más alta entre los pacientes que recibieron HD (48,6%) en comparación con los que recibieron DP (26,3%), aunque esta diferencia no alcanzó significación estadística (p=0,194).
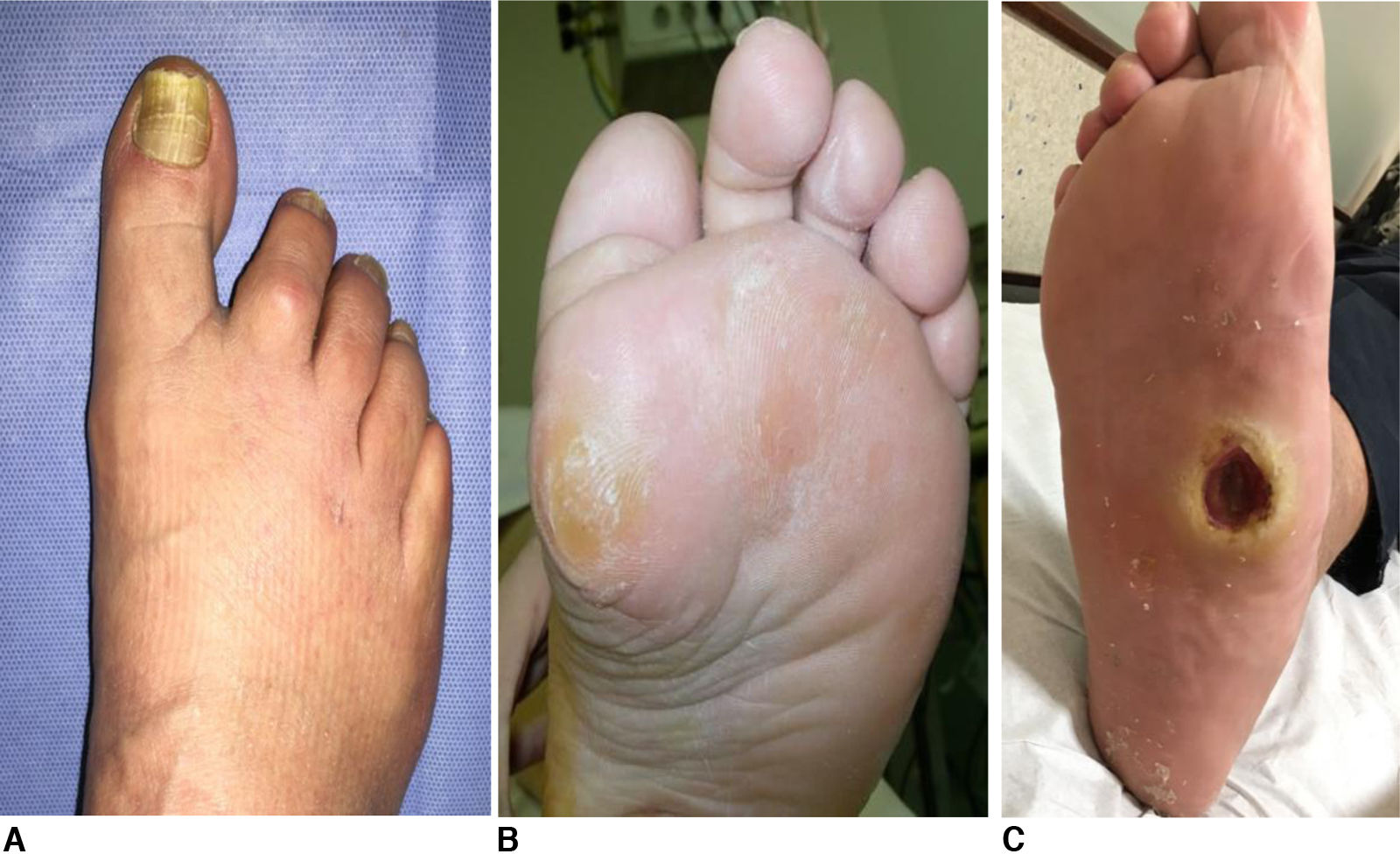
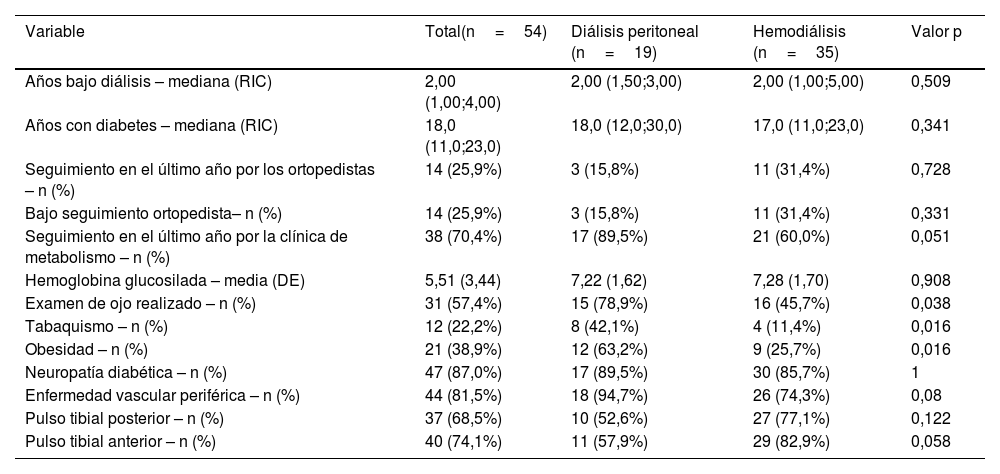
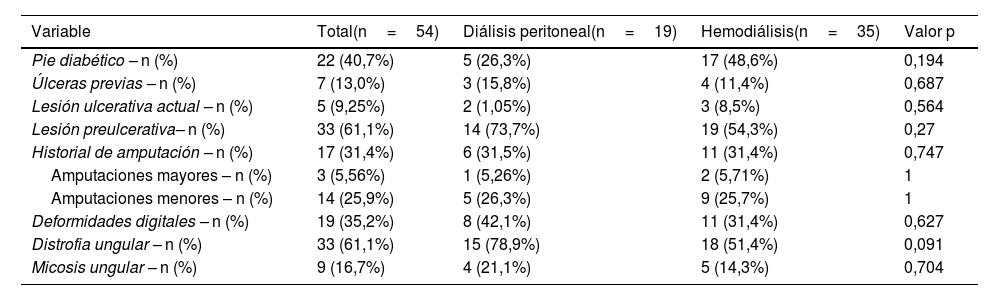
De la muestra total, cinco de entre 54 pacientes (9,2%) presentaron lesiones ulcerativas en el momento del examen, sin seguimiento previo, y 33 pacientes (61,1%) presentaron lesiones preulcerativas en el examen físico del pie, sin diferencias significativas entre los grupos HD y DP (54,3% y 73,7%, respectivamente; p=0,27) (fig. 1).
En cuanto al historial de amputaciones, en el 31,4% (17/54) de los pacientes se habían realizado amputaciones previas, con una distribución similar entre los grupos (HD: 31,4%; DP: 31,5%). De ellos, tres pacientes (5,6%) tenían historial de amputaciones mayores (por debajo de la rodilla), mientras que los 14 pacientes restantes tenían amputaciones menores. Sin embargo, no se encontraron diferencias estadísticamente significativas entre ambos grupos (tabla 2).
Prevalencia de pie diabético y examen físico
| Variable | Total(n=54) | Diálisis peritoneal(n=19) | Hemodiálisis(n=35) | Valor p |
|---|---|---|---|---|
| Pie diabético – n (%) | 22 (40,7%) | 5 (26,3%) | 17 (48,6%) | 0,194 |
| Úlceras previas – n (%) | 7 (13,0%) | 3 (15,8%) | 4 (11,4%) | 0,687 |
| Lesión ulcerativa actual – n (%) | 5 (9,25%) | 2 (1,05%) | 3 (8,5%) | 0,564 |
| Lesión preulcerativa– n (%) | 33 (61,1%) | 14 (73,7%) | 19 (54,3%) | 0,27 |
| Historial de amputación – n (%) | 17 (31,4%) | 6 (31,5%) | 11 (31,4%) | 0,747 |
| Amputaciones mayores – n (%) | 3 (5,56%) | 1 (5,26%) | 2 (5,71%) | 1 |
| Amputaciones menores – n (%) | 14 (25,9%) | 5 (26,3%) | 9 (25,7%) | 1 |
| Deformidades digitales – n (%) | 19 (35,2%) | 8 (42,1%) | 11 (31,4%) | 0,627 |
| Distrofia ungular – n (%) | 33 (61,1%) | 15 (78,9%) | 18 (51,4%) | 0,091 |
| Micosis ungular – n (%) | 9 (16,7%) | 4 (21,1%) | 5 (14,3%) | 0,704 |
Este estudio transversal aborda la prevalencia y características de PD en los pacientes con DM que recibieron TRR en un hospital de atención terciaria de Argentina. Con una prevalencia de PD del 40,7%, nuestros resultados destacan el alto riesgo de complicaciones en esta población, y refuerzan la evidencia existente acerca de que el tratamiento de diálisis bien sea HD como DP, incrementa la susceptibilidad al desarrollo de PD en pacientes con ERC avanzada. Comparativamente, los estudios previos tales como el realizado por Dòria et al.4 en una población similar de España reportaron una prevalencia de PD del 47,6% en pacientes que recibieron TRR, lo cual refleja una alineación significativa con nuestros hallazos, y sugiere que el riesgo de PD en estos pacientes es un fenómeno consistente entre las diversas regiones y ámbitos sanitarios.
Aunque nuestro estudio no incluyó un grupo control de pacientes con DM que no recibiera TRR, los estudios previos han demostrado que la prevalencia de PD es significativamente más baja en dicha población. Por ejemplo, Apelqvist et al.10 calcularon que hasta el 25% de los pacientes diabéticos desarrollan úlcera en el pie a lo largo de su vida, mientras que en nuestra muestra de pacientes bajo TRR, la prevalencia fue del 40,7%. Ello sugiere que el tratamiento de diálisis puede estar asociado a un riesgo más alto de complicaciones del pie, consistente con la literatura internacional.
La alta prevalencia de neuropatía diabética y EAP observada en nuestra muestra (87 y 81,5%, respectivamente) subraya el impacto de estas complicaciones en la salud del pie de los pacientes con DM y ERC avanzada. La neuropatía diabética, que afecta a una gran proporción de pacientes con DM, está ampliamente documentada como factor crítico para el desarrollo de PD, ya que reduce la sensación protectora en los pies, permitiendo el progreso de lesiones menores no detectadas11. En nuestro estudio, los pacientes que recibieron DP mostraron una prevalencia ligeramente más alta de neuropatía (89,5%) en comparación con aquellos bajo HD, un hallazgo consistente con el reportado por Ndip et al.5, quienes observaron una relación entre la terapia de diálisis y el incremento de la incidencia de neuropatía, debido a los factores relacionados con la terapia renal y la duración prolongada del tratamiento.
La EAP, presente en el 81,5% de nuestros pacientes, es otra afección que incrementa la probabilidad de ulceración y complicaciones graves del pie. Los pacientes bajo HD reflejaron una prevalencia más alta de EAP (94,7%) en comparación con aquellos bajo DP (74,3%). Dicho hallazgo podría atribuirse a los cambios hemodinámicos y al estrés vascular asociados a la HD, que podría exacerbar la aterosclerosis y reducir el flujo sanguíneo a las extremidades4. Los estudios previos tales como el realizado por Jones et al.11 han sugerido que la HD, al inducir cambios en la presión sanguínea y el flujo vascular periférico, puede tener un efecto adverso en la circulación de las piernas, empeorando el riesgo de ulceración.
Uno de los aspectos notables de nuestro estudio es la alta frecuencia de lesiones preulcerativas, encontradas en el 61,1% de los pacientes. Dichas lesiones, que incluyen deformidades y otras áreas de presión, son factores predictivos importantes del desarrollo de úlceras activas. La detección y el manejo tempranos de dichas lesiones son esenciales para prevenir su progresión a úlceras y, eventualmente, amputaciones. Game et al.6 destacan que las lesiones preulcerativas pueden ser indicadores tempranos del riesgo, y sugieren que los pacientes bajo TRR requieren monitorización constante para detectar y manejar dichos signos de alarma. En nuestro estudio, la elevada frecuencia de lesiones preulcerativas refuerza la necesidad de un enfoque preventivo en el manejo del PD, particularmente en el ámbito de la atención multidisciplinar.
En cuanto al historial de amputaciones, el 31,4% de los pacientes de nuestra muestra había sufrido al menos una amputación previa, en línea con los estudios que documentan una correlación entre la duración de la diálisis y el riesgo de amputación en los pacientes con DM12. En el estudio realizado por Margolis et al.13, se observó que los pacientes diabéticos bajo diálisis tienen riesgo incrementado de amputación, debido a la combinación de neuropatía, isquemia, y mala capacidad de curación de las heridas, condiciones exacerbadas por la TRR. La ausencia de diferencias significativas en cuanto a las tasas de amputación entre HD y DP en nuestra muestra puede explicarse por los factores compartidos, tales como la duración prolongada de la DM y la progresión de ambas complicaciones microvasculares y macrovasculares.
En línea con nuestros hallazgos sobre la alta prevalencia de lesiones y amputaciones en los pacientes con PD bajo TRR, el estudio reciente realizado por Sánchez Correa et al.14 reportó una tasa elevada de reamputación en los pacientes con amputaciones del pie menores. Dichos datos refuerzan la gravedad del curso clínico del PD y la necesidad de implementar estrategias tempranas de prevención y seguimiento, particularmente en poblaciones de alto riesgo tales como la evaluada en nuestro estudio.
Factores adicionales tales como tabaquismo y obesidad fueron significativamente más prevalentes en el grupo DP, en comparación con HD. Dichos factores no son solo contribuidores independientes al desarrollo de PD, sino que también juegan un papel en la progresión de la enfermedad. Ndip et al.3 resaltan que el tabaquismo empeora la microcirculación e incrementa el riesgo de infección, mientras que la obesidad contribuye a una presión excesiva en el pie y promueve el desarrollo de deformidades estructurales. En nuestro estudio, la prevalencia de tabaquismo y obesidad en los pacientes con PD sugiere que este grupo puede beneficiarse de intervenciones específicas en el estilo de vida, para reducir el riesgo de complicaciones de PD.
Este estudio aporta información relevante sobre la prevalencia y factores de riesgo del PD en pacientes con DM bajo TRR en un hospital de atención terciaria de Argentina. Una fortaleza clave de esta investigación es que pone el foco en una población de alto riesgo que está infrarrepresentada en los estudios nacionales. Ello ayuda a cubrir una brecha de la literatura en cuanto al manejo del PD en pacientes con ERC avanzada bajo TRR. Asimismo, el diseño transversal permitió identificar y caracterizar los factores específicos asociados al desarrollo de PD en un entorno clínico del mundo real, proporcionando datos cruciales para la formulación de intervenciones preventivas aplicables a los centros nefrológicos. La inclusión de una evaluación detallada de comorbilidades clave, tales como neuropatía diabética y EAP, utilizando métodos diagnósticos estandarizados, fortalece la consistencia y precisión de los hallazgos.
Sin embargo, el estudio tiene ciertas limitaciones inherentes. Siendo un estudio transversal, no es posible establecer relaciones causales entre los factores de riesgo identificados y el desarrollo de las complicaciones del PD, lo cual limita la capacidad de interpretar la secuencia temporal de los acontecimientos. Además, el tamaño muestral, aún siendo adecuado para el análisis descriptivo, puede no ser representativo de poblaciones de mayor tamaño o entornos sanitarios diferentes, restringiendo la generalizabilidad de los resultados. La ausencia de datos longitudinales sobre la progresión de las lesiones del pie y los efectos a largo plazo de los factores de riesgo en los pacientes con diferentes modalidades de TRR representan también una limitación.
Los estudios futuros con diseño longitudinal podrán proporcionar una perspectiva más profunda de la progresión del PD en esta población, y evaluar la efectividad de las intervenciones preventivas específicas a lo largo del tiempo.
ConclusiónEste estudio demuestra la alta prevalencia de PD en los pacientes con DM bajo TRR en un hospital de atención terciaria de Argentina. Nuestros hallazgos, consistentes con los estudios previos, reflejan que los pacientes que reciben HD y DP tienen riesgo elevado de complicaciones del pie, respaldando la necesidad de estrategias tempranas de prevención y manejo. La incorporación de programas sanitarios centrados en el autocuidado, la educación sobre hábitos de estilo de vida saludable, y el seguimiento multidisciplinar podrán reducir significativamente la incidencia de ulceraciones y amputaciones en esta población de alto reisgo.
Nivel de evidenciaNivel de evidencia III.
Aprobación éticaComité de ética para protocolos de investigación del Hospital Italiano de Buenos Aires IRB N° 10408.
FinanciaciónEsta investigación no ha recibido ninguna subvención específica de entidades de los sectores público o comercial, u organizaciones sin ánimo de lucro.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses relacionados con este trabajo.