Los biomateriales sintéticos obtenidos mediante ingeniería tisular ofrecen alternativa al uso de injertos autógenos y heterólogos para la reparación de defectos óseos de diferente etiología, si bien aún no existe el material ideal para este fin. El gel a base de quitosano (CS) (3-glicidoxipropil)trimetoxisilano (GPTMS) y sílice ha demostrado su eficacia en estudios experimentales desde el punto de vista biomecánico y osteointegración in vitro.
ObjetivoDemostrar que el aerogel híbrido a base de CS-GPTMS-sílice es eficaz y seguro en el tratamiento de defectos óseos en el hueso sometido a carga en el conejo.
Material y métodoSe ha realizado un estudio experimental comparativo en 12 conejos adultos Nueva Zelanda, mediante osteotomía en ambos radios como caso (osteotomía y colocación del biomaterial) y control contralateral (osteotomía y colocación del mismo hueso extraído), ambas fijadas con placa y tornillos. A las 10 semanas se realizó la eutanasia de los animales y el estudio histológico de la zona quirúrgica.
ResultadosEn todos los animales la cicatrización de la herida fue correcta y la marcha era normal a las 24-48h. En las patas caso, se observó el cierre cortical del 95.9%, frente al 98% en las patas control. Los restos de biomaterial remanente fueron observados en 5 sujetos, con una media de un 16% respecto al total de corte observado. En todas las muestras caso hubo presencia de células inflamatorias agrupadas (5-10%) siendo la diferencia significativa entre las muestras casos y controles p<0,05. En todas las muestras caso hubo aumento de la presencia de células precursoras óseas (5-10%) respecto a los controles con significación p <0,05.
ConclusionesEl aerogel a base de CS-GPTMS y sílice es biocompatible y seguro en conejos, demostrando escasa reacción inflamatoria y una buena adherencia de los osteoblastos, así como una alta tasa de reabsorción.
Synthetic biomaterials obtained through tissue engineering offer an alternative to the use of autologous and heterologous grafts for the repair of bone defects of various etiologies, although the ideal material for this purpose has not yet been developed. A gel based on Chitosan (CS) ((3-glycidoxypropyl)trimethoxysilane (GPTMS), and silica have shown efficacy in experimental studies from a biomechanical and in vitro osseointegration perspective.
ObjectiveTo demonstrate that the hybrid aerogel based on CS-GPTMS-silica is effective and safe for treating bone defects in load-bearing bone in rabbits.
Materials and methodsA comparative experimental study was conducted on 12 adult New Zealand rabbits, involving osteotomy in both radii as case (osteotomy with biomaterial placement) and contralateral control (osteotomy with placement of the extracted bone), both fixed with plates and screws. After 10 weeks, the animals were euthanized, and the surgical area was subjected to histological analysis.
ResultsFor all subjects, wound healing was successful, and normal gait was observed within 24-48hours. In case limbs, cortical closure of 95.9% was observed compared to 98% in control limbs. Residual biomaterial was observed in 5 subjects, with an average of 16% of the total analyzed area. Inflammatory cells were grouped (5-10%) in all case samples, with significant differences between case and control samples (P<.05). An increase in the presence of bone precursor cells (5-10%) was observed in all case samples compared to control samples, with significant differences (P<.05).
ConclusionsThe aerogel based on chitosan CS-GPTMS, and silica is biocompatible and safe in rabbits, demonstrating minimal inflammatory reaction, good osteoblast adhesion, and a high resorption rate.
Actualmente, en el campo de la cirugía ortopédica se emplean con frecuencia sustitutos óseos para reparar defectos de diferente etiología (fracturas, tumores, deformidades congénitas, enfermedad infecciosa, cirugía protésica y de rescate, entre otros1,2).
El envejecimiento progresivo de la población y la mala calidad ósea que conlleva la edad avanzada, unido al incremento de la esperanza y calidad de vida ha ido generando en los últimos años un aumento en la demanda de estos sustitutos óseos en las intervenciones quirúrgicas traumatológicas, suponiendo un elevado y creciente gasto económico en el sistema sanitario. En los últimos años, el problema de disponibilidad de injertos para este tipo de cirugía ha llevado a la búsqueda de biomateriales diseñados como sustitutos óseos para simular con precisión las características del hueso humano1-5.
Las propiedades clave de un biomaterial son: estructura, rugosidad, porosidad, superficie específica, propiedades mecánicas y una funcionalidad química apropiada para la biointegración en el sistema que contribuya activamente a la restauración o mejora del tejido óseo circundante2-9.
En la actualidad, los sustitutos óseos artificiales incluyen cerámicas (como hidroxiapatita y fosfato de calcio), polímeros biodegradables, metales bioinertes, biomateriales híbridos, y geles bioactivos, diseñados para imitar las propiedades estructurales, mecánicas y biológicas del hueso natural, promoviendo la regeneración ósea y su integración funcional. Entre ellos, los geles han sido ampliamente estudiados como materiales puros o híbridos ya que una de las ventajas de estos materiales reside en que sus propiedades pueden ser ajustadas mediante la elección apropiada de las fases constituyentes y controlando su contenido relativo3. Además, la adición de polímeros orgánicos en cantidades controladas permite ajustar las propiedades mecánicas de estos aerogeles híbridos bioactivos: porosidad, resistencia mecánica, etc. Por otro lado, los biomateriales aplicados a la regeneración ósea deben favorecer la adhesión de los osteoblastos, la neogénesis de matriz mineralizada, y la formación de nuevo tejido óseo2-9.
Actualmente no existe un biomaterial disponible con las características anteriormente expuestas, por esto, se ha propuesto la combinación de la tecnología sol-gel para la obtención de biomateriales basados en vidrios bioactivos.
El grupo de investigación ha desarrollado un gel a base de quitosano (CS) (3-glicidoxipropil)trimetoxisilano (GPTMS) y sílice que ha demostrado su eficacia en estudios experimentales in vitro9. Con este estudio experimental en animales se pretende demostrar que el aerogel híbrido a base de CS-GPTMS-sílice es eficaz y seguro en el tratamiento de defectos óseos en el hueso sometido a carga en el conejo.
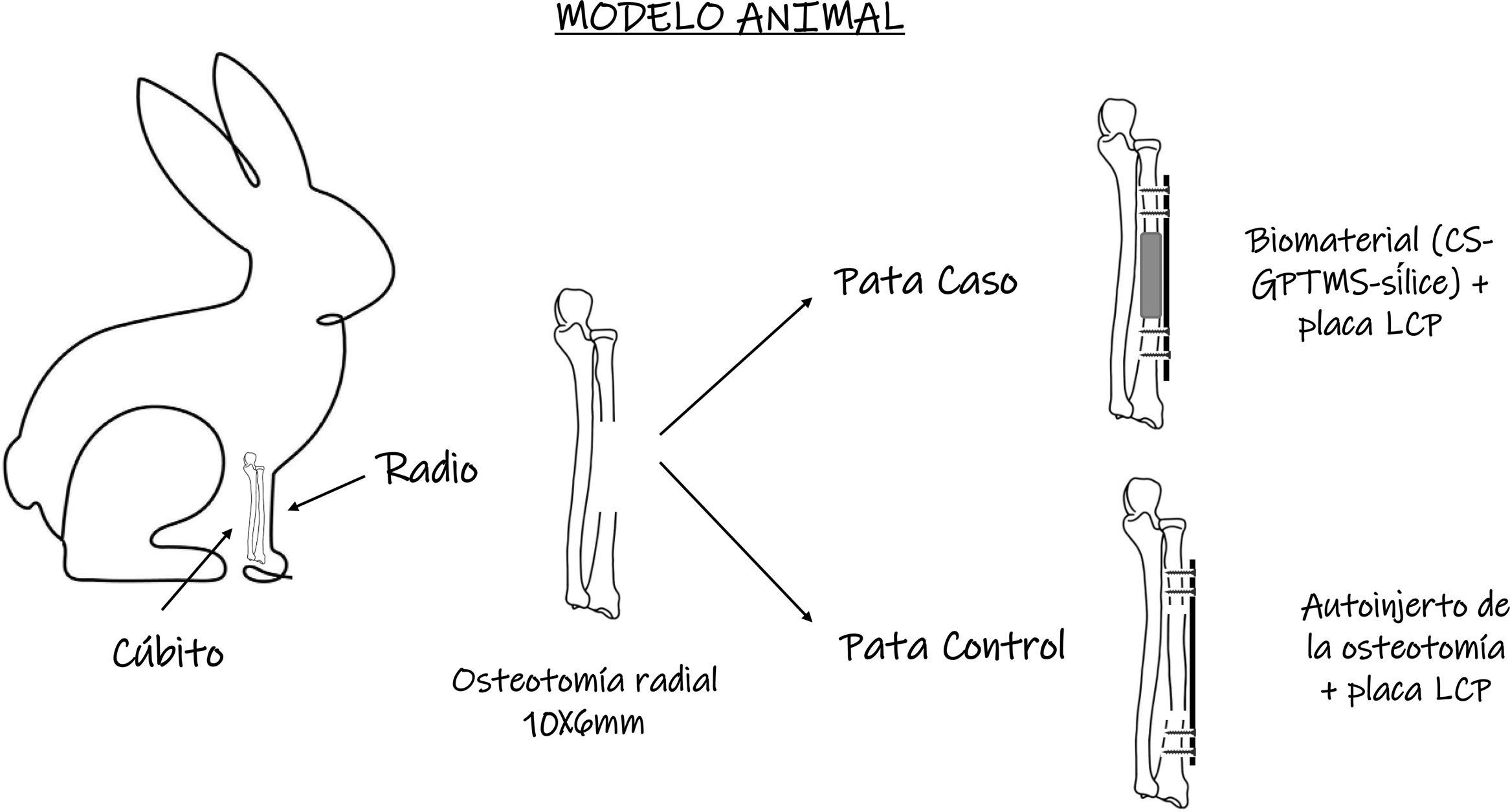
Material y métodoDiseño del estudio. Estudio experimental preliminar diseñado para evaluar la viabilidad metodológica y la seguridad de un biomaterial en un modelo animal. Su enfoque consiste en comparar la eficacia del biomaterial con el estándar de oro (autoinjerto) en la regeneración ósea, empleando un diseño controlado intraindividual en el que el mismo animal sirve como caso y control. La intervención incluye la realización de una osteotomía en la diáfisis del radio para implantar el biomaterial y el autoinjerto en extremidades contralaterales, permitiendo un análisis comparativo inicial con un tamaño muestral reducido.
Biomaterial. En cuanto al biomaterial seleccionado, se trata de un aerogel híbrido CS-GPTMS-sílice mesoporoso, desarrollado por el área de Física de la Materia Condensada de la Universidad de Cádiz, con el número de patente ES2935742B2. En el estudio preliminar para la selección del material se prepararon 10 hidrogeles con la misma composición base, pero diferente porcentaje de CS y GPTMS9. Tras el estudio mecánico y de laboratorio (inmersión en suero fisiológico simulado y cultivo de osteoblastos), se ha seleccionado una de las muestras, con resultados muy favorable para su uso como material sustituto para la regeneración del tejido óseo: CS10G4 (fig. 1).
Modelo animal. Para el desarrollo del estudio se utilizaron 12 conejos albinos adultos, raza Nueva Zelanda (Oryctolagus cuniculus), con un peso comprendido aproximadamente entre 2.500 y 3.500g al inicio del estudio y de una edad entre 28 y 32 semanas, de forma que se aseguró el cierre fisario y la finalización del crecimiento óseo. Todos los conejos usados fueron machos.
Las condiciones ambientales fueron constantes a lo largo del estudio, con un fotoperiodo programado en ciclos de 12 h luz-oscuridad (iluminación de 350 lux/m2). La temperatura se mantuvo igualmente estable, entre 22 y 24°C, con una humedad constante entre 55%± 10%. Todos los animales contaron con acceso ad libitum al agua y comida comercial estándar para conejos. Cada espécimen fue identificado mediante distintos colores (tinte no tóxico y biodegradable) con marcaje en las orejas y en su jaula correspondiente.
El estudio en animales fue aprobado por el Comité de Ética de Experimentación Animal de la Universidad de Cádiz y por la Consejería de Agricultura, Ganadería, Pesca y Desarrollo Sostenible según lo establecido en el artículo 26.1 del Decreto 622/2019. Durante todo el manejo de los animales, se siguieron las normas establecidas por la Unión Europea para la protección de animales utilizados en experimentación (EU/63/2010), así como la guía ARRIVE 2.010. Tanto la estancia de los animales como las cirugías se llevaron a cabo los Servicios Centrales de Producción y de Experimentación de la Universidad de Cádiz (código de registro de la explotación: ES110120000210). Todo el personal con acceso a los animales disponía de los certificados que autorizan el manejo de los mismos: A (cuidado de animales) para los cuidadores del centro y A, B (eutanasia) y C (realización de los procedimientos) para los cirujanos.
Cirugía. La cirugía se realizó en condiciones de asepsia y bajo sedación con quetamina, midazolam, atropina y dexmedetomidina, y anestesia local con mepivacaína y bupivacaína (tabla 1).
Se realizó una incisión dorsal de aproximadamente 4cm en ambos antebrazos, sobre tercio medio de diáfisis de hueso radial en línea entre el 3.er y 4.° dedos. Para posteriormente realizar, en ambos, una osteotomía de sustracción de unos 10mm de longitud×6mm de espesor (fig. 2). A continuación, se colocó en un antebrazo el material seleccionado CS10G4 y, en el otro antebrazo, el mismo fragmento de hueso extraído, pero invirtiendo la polaridad craneocaudal, de forma que el mismo animal sirvió de caso y control.
Posteriormente, tanto el biomaterial como el autoinjerto, se fijaron al hueso remanente con una placa puente locking-compression plate (LCP) de 6 orificios de 1,5mm, con 2 tornillos de cortical a cada lado del injerto de 1,5×8mm (fig. 2).
Tras la finalización de la cirugía, los animales intervenidos fueron retirados a una zona tranquila y cálida hasta el despertar completo (movilidad activa espontánea). Para la analgesia en el postoperatorio, se utilizó meloxicam 0,2mg/kg y buprenorfina 0,03mg/kg subcutáneo. Para la profilaxis antibiótica se empleó ampicilina 7mg/kg subcutánea.
Todos los conejos fueron valorados al primer día postoperatorio y luego semanalmente hasta la 10.ª semana. Para valoración del dolor se usaron la escala descriptiva simple y la escala de expresión facial11.
La eutanasia de los animales se realizó a las 10 semanas de la cirugía mediante sedación, la misma empleada en la cirugía (tabla 1) y sobredosis de tiobarbital sódico vía intraperitoneal a una dosis de 200mg/kg. La muerte de cada animal se confirmó mediante exanguinación del animal a través de la sección de la arteria carótida.
Todos los procedimientos de experimentación se llevaron a cabo en el Servicio Central de Producción y Experimentación Animal de Cádiz.
Estudio histológico. el fragmento de material y hueso alrededor del mismo fue extraído en bloque mediante disección meticulosa de tejidos blandos. Posteriormente se extrajeron la placa y los tornillos.
Para la descalcificación del hueso y su posterior manipulación, las muestras fueron fijadas en formol al 10% durante al menos 72h y, posteriormente, descalcificadas con ácido nítrico al 3% durante 7 días, con cambio de la dilución formol-nítrico en 2ocasiones. Se obtuvieron muestras de bloque de hueso de unos 0,5cm de longitud en las regiones de interés (A) interfase hueso/scaffold para demostrar la integración y (B) de la zona intermedia de la introducción del scaffold para valorar la neoformación de hueso. Estas 2secciones de cada hueso intervenido, fueron procesadas en procesador de tejidos Leica HistoCore Pegasus Plus (Nussloch, Alemania) durante una noche para su inclusión en parafina, al día siguiente fueron preparados los bloques de muestras para su corte y tinción con hematoxilina eosina.
Además, como tinciones especiales se realizaron:
- -
Van Gieson (picro-fucsina): tiñe de verde o verde azulado las fibras de colágena, el tejido óseo purpura o naranja, la matriz osteoide en amarillo y las fibras musculares en azul, permitiendo distinguir entre el osteoide no mineralizado y los tejidos mineralizados.
- -
Inmunomarcaje con CD68 para la identificación de tejido inflamatorio (polimorfonucleares).
Variables de estudio. Las variables recogidas fueron las siguientes.
En la fase quirúrgica: porcentaje de cierre de la circunferencia cortical, porcentaje remanente de biomaterial respecto al total del corte, presencia de células inflamatorias, porcentaje de células inflamatorias/total de células observadas, presencia de osteoblastos/osteocitos, porcentaje de osteoblastos/total de células observadas. Tanto con las células inflamatorias como con los osteoblastos, se tomaron como muestras positivas para presencia de las mismas, aquellas que mostraron acumulo o zonas con mayor actividad; las células inflamatorias o precursoras óseas dispersas fueron tomadas como normales.
En la fase de análisis histológico: sexo y peso del animal en el momento de la cirugía; tiempo quirúrgico por pata (A=caso, B=control); incidencias destacables durante la cirugía; incidencias en las 6primeras visitas (24 h postoperatorias, 48 h postoperatorias, primera, segunda, tercera y cuarta semanas, y semanas de la quinta a la décima); incidencias destacables durante la eutanasia y si presentaron hallazgos de consolidación macroscópica.
Modelo estadístico. El estudio estadístico descriptivo analizó las variables recogidas diferenciando entre cuantitativas y cualitativas; para las cuantitativas se emplearon medidas de tendencia central como la media, la mediana y la moda, mientras que para las cualitativas se utilizaron frecuencias absolutas y relativas, proporcionando una visión integral de la distribución y el comportamiento de los datos.
La comparación de las variables cualitativas se hizo mediante la prueba de χ2. La comparación de las variables cuantitativas se realizó mediante ANOVA. La influencia de la asociación entre los parámetros cuantitativos determinados se evaluó mediante el coeficiente de correlación de Pearson. El análisis pareado entre variables se realizó mediante la prueba de Wilcoxon. Se establece previamente el nivel de significatividad en el del 95% (p <0,05).
Puesto que el mismo animal sirvió de caso y control, se trataron las muestras como homogéneas.
ResultadosCirugía y eutanasia. Entre los meses de marzo y agosto del 2023 fueron intervenidos 12 conejos. El peso medio en el momento de la cirugía fue de 2.850g (2.700-2.900). El tiempo medio de cirugía fue de 37 min (19-45). El despertar de los animales se realizó de forma espontánea entre los 30 y 60 min tras la finalización de la cirugía.
A las 24h postoperatorias, todos los conejos caminaban con leve cojera, salvo uno que presentó una cojera significativa principalmente a expensas de la pata caso (A), al cual le fue administrado otra dosis de analgésico; y otro de ellos que fue fallecimiento a las 24h de la cirugía, habiendo permanecido prácticamente inmóvil durante esas 24h. Todos los conejos restantes tuvieron una evolución favorable en cuanto a la zona quirúrgica. Dos conejos presentaron inflamación leve de la pata caso, autorresuelta a la visita de la primera semana, precisando uno de ellos nueva sutura de la herida en la visita de las 24h postoperatorias, en ningún caso hubo signos de infección del sitio quirúrgico. Todos ellos presentaron curación completa de la herida entre los días 7 y 14.
Todas las eutanasias se realizaron a la semana 10 o semana 10 y un día. En el momento de la eutanasia, todos los conejos realizaban una vida normal, sin presentar signos de dolor ni cojera ni otras alteraciones del desarrollo en cuanto a comportamiento y capacidad de alimentación.
En la cirugía de extracción, 2animales presentaron crecimiento óseo por encima de la placa, en ambas patas. Tanto los casos como los controles presentaron un cierre completo del defecto óseo (fig. 3). El hallazgo más frecuente a destacar fue la sinostosis radio cubital, que ocurrió en 6 de los 11 animales que completaron el tiempo de observación, lo cual llevó en 2de los controles a la fractura del radio al separar radio y cúbito, si bien la fractura ocurrió distal 2 de a la zona de la cirugía.
Histología. En las patas caso, la media de porcentaje de cierre de la circunferencia cortical en los cortes centrales, fue del 94,5+8%. En las muestras de la periferia de la zona quirúrgica, el porcentaje de cierre fue del 96,4+8%. En las patas control, se observó un cierre cortical del 98%. No siendo esta diferencia estadísticamente significativa p> 0,05% (fig. 4).
En cuanto a los restos de biomaterial, en las muestras del centro de la zona quirúrgica fueron visibles en 5 muestras caso, con una media de un 16% respecto al total del corte (fig. 5). En las muestras de la periferia, fueron visibles en 2 de los 11 conejos que completaron el estudio, ambas con un 10% de biomaterial remanente respecto al total de corte.
En todas las muestras caso hubo presencia de células inflamatorias agrupadas: en 5 de ellos, tanto en las muestras del centro como en la muestra de la periferia, en 3 solo en el centro y en 3 solo en la periferia, siendo la diferencia significativa entre las muestras casos y controles p <0,05. En todas ellas el porcentaje de células inflamatorias fue entre un 5 y un 10% respecto al total de células observadas (fig. 5A). Solo en una de las patas control fueron visibles células inflamatorias agrupadas, en la muestra del centro.
Similar a las células inflamatorias, en todas las muestras caso hubo aumento de la presencia de células precursoras óseas (entre un 5 y un 10% de osteoblastos y osteocitos) respecto a las muestras control, con significación p <0,05. Siendo similar en las muestras del centro y en las de la periferia (fig. 5B). Solo en una de las patas control se visualizó un aumento de osteoblastos y osteocitos, en la muestra del centro.
DiscusiónEl estudio evaluó la biocompatibilidad y eficacia de un aerogel híbrido a base de CS-GPTMS y sílice en conejos, comparando su desempeño frente a autoinjertos óseos mediante análisis histológicos y observaciones clínicas a lo largo de 10semanas, concluyendo que el biomaterial es seguro, con buena integración ósea y baja reacción inflamatoria.
En cuanto al biomaterial seleccionado, la principal diferencia entre los compuestos iniciales era el contenido de GPTMS. El valor G hace referencia a la relación [GPTMS]/[CS monómero], siendo 4 en este caso. El porcentaje final de CS es 9,7%. El GPTMS aporta más densidad por lo que con ello se consigue una red más fuerte. Además, el CS10G4 tiene una alta porosidad (82.3%, similar al 79,3% de porosidad del hueso esponjoso9,12–14) y el tamaño del poro es de 11.6nm, lo suficientemente grande para la producir flujo de fluidos dentro de los mismos, y por tanto estimular los osteocitos11. En el análisis mecánico el máximo esfuerzo soportado fue mucho mayor para la muestra CS10G4, la que presentaba mayor cantidad de GPTMS. Al igual ocurrió con el módulo de Young9,14. Además este biomaterial presentó buena adherencia de los osteoblastos en cultivo in vitro en estudios previos9 (fig. 6).
Osteoblastos HOB® cultivados en muestra CS10G4 después de 48h (A, B), 72h (D, E) y 1 semana (G, H) en cultivo y examinados con microscopio confocal (40×). Los osteoblastos cultivados en vidrio se utilizaron como control de referencia, que se muestra en (C), durante 48h en cultivo (F) después de 72h en cultivo y (I) después de 1 semana. En rojo, las fibras citoesqueléticas de actina inmunomarcadas con rodamina-faloidina muestran la polarización del material y la disposición del citoesqueleto de actina en fibras de tensión. Las adherencias focales (amarillas) se inmunomarcaron con anticuerpo antivinculina. Los núcleos (azul) se marcaron con DAPI.
En cuanto al modelo quirúrgico, para el diseño del injerto y la localización del mismo se seleccionó la diáfisis radial en conejos por tratarse de un hueso accesible y de carga axial, además, con este modelo, el diseño del injerto permite muestras de pequeño tamaño pero, lo suficiente para manejarlas, y fácilmente reproducibles. Además, con este modelo, se consiguió realizar un defecto óseo masivo en un hueso de carga14–17.
Se seleccionó el conejo como modelo animal por ser filogenéticamente más cercano a los primates que los roedores y porque su sistema haversiano y su metabolismo óseo es similar al de los humanos. Además, los conejos poseen menos hueso esponjoso y corticales más frágiles, por lo que con un buen resultado en conejos cabría esperar un mejor resultado en humanos10. Sin embargo, el conejo presenta como desventaja principal la dificultad de manipulación del hueso de pequeño tamaño (aproximadamente unos 6cm de longitud del radio completo×unos 9mm de diámetro del hueso), por lo que en las 2primeras cirugías tuvo que realizarse el tallado intraquirúrgico de los cilindros de biomaterial para reducirlos en tamaño, cosa que se corrigió para las cirugías posteriores, realizando el tallado previamente.
En cuanto al tiempo quirúrgico, fue significativamente mayor en los 4 primeros animales intervenidos, debido a la inexperiencia de los cirujanos y por lo comentado respecto al tallado del cilindro de biomaterial (50 min de media frente a 30 min de media en el resto). El caso que no completó el tiempo de observación por fallecimiento en las primeras 24h, se trató del segundo animal intervenido, el despertar no fue completo y como posibles causas de la muerte se barajan un posible sangrado excesivo durante la intervención o posible enfermedad de base en el animal. No se cree que se debiera al material debido al escaso tiempo de evolución entre la colocación del mismo y la muerte, así como la ausencia de hallazgos inflamatorios importantes en el sitio quirúrgico. El animal que presentó el crecimiento óseo por encima de la placa de osteosíntesis fue el primer animal intervenido, lo cual pudo deberse a la escisión del fragmento óseo incluyendo todas las corticales y, por tanto, un callo óseo mayor.
En cuanto al estudio histológico, el cierre de la circunferencia cortical fue prácticamente completo en todas las patas caso y el porcentaje de células inflamatorias de los casos fue relativamente bajo, por lo que a las 10 semanas tras la cirugía no parece haber una gran respuesta inflamatoria, si bien fue algo superior a las patas control, esperable dado el tiempo de evolución; además, la presencia de este tipo de células fue principalmente en la zona donde faltaba hueso por formarse o alrededor de los restos de biomaterial (fig. 5A). Algo similar ocurre con las células precursoras óseas, que aparecieron principalmente alrededor de la zona de defecto de cierre de la cortical (fig. 5B).
Estas características demostradas, sugieren un potencial impacto clínico beneficioso del uso de este biomaterial en cirugía reconstructiva ósea dada la rapidez de fabricación, su fácil manejo intraoperatorio, su tasa de osteointegración y reabsorción y su escasa respuesta inflamatoria, puesto que podría servir para cubrir defectos óseos de diferentes tamaños con o sin fijación adicional mediante osteosíntesis.
Uno de los puntos fuertes de este estudio es la originalidad de la muestra, patentada y desarrollada por la Universidad de Cádiz, además del coste de producción del biomaterial. Por otro lado, también existe la posibilidad de modificaciones en los componentes del aerogel para que sea imprimible en 3D y, dado su fácil manejo, el cultivo en células mesenquimales. Estudios futuros podrían realizarse aumentando el tiempo de evolución o, en diferentes tiempos, puesto que en algunos casos la no reabsorción completa del biomaterial, el cierre parcial de la cortical y la reacción inflamatoria aún presente podría deberse a un estadio aún inicial de la integración del biomaterial en la formación de hueso18. Otra de las posibles mejoras del estudio sería la realización de diversos estudios para valorar osteointegración radiológica del biomaterial mediante una evaluación con pruebas de imagen como radiología simple o tomografía computarizada19,20. Por último, una de las principales limitaciones de este estudio, es el bajo tamaño muestral.
Como conclusión, con este estudio preliminar, podemos decir que el aerogel a base de CS- GPTMS y sílice es biocompatible y seguro en conejos, demostrando escasa reacción inflamatoria y una buena integración ósea, así como una alta tasa de reabsorción. Se precisa la ampliación de estudios en otros modelos de defectos óseos.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación de la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT): Ayuda a Proyectos de Iniciación a la Investigación (año 2021).
Nivel de evidenciaNivel de evidencia I.
Consideraciones éticasEste estudio en animales fue aprobado por el Comité de Ética de Experimentación Animal de la Universidad de Cádiz y por la Consejería de Agricultura, Ganadería, Pesca y Desarrollo Sostenible según lo establecido en el artículo 26.1 del Decreto 622/2019.
Durante todo el manejo de los animales, se siguieron las normas establecidas por la Unión Europea para la protección de animales utilizados en experimentación (EU/63/2010) en los Servicios Centrales de Producción y de Experimentación de la Universidad de Cádiz (código de registro de la explotación: ES110120000210), así como la guía ARRIVE 2.0. Percie du Sert N et al., 2014.
Conflicto de interesesLos autores declaran ausencia de conflicto de intereses.
A los Servicios de Cirugía Ortopédica y Traumatología, Reumatología y, Anatomía Patológica del Hospital Universitario Puerta del Mar, a los Servicios de Cirugía Ortopédica y Traumatología y, Farmacología Clínica del Hospital Universitario de Puerto Real. Al Instituto de Investigación e Innovación Biomédica de Cádiz (INiBiCa).