Analizar el resultado del tratamiento y la evolución de los defectos en el hueso trabecular en pacientes tratados con cerámicas osteoconductivas.
Material y métodosSe estudiaron 10reconstrucciones efectuadas en 9pacientes (6mujeres y 3hombres) con defectos epifisarios y metafisarios, con una edad media de 49 (rango: 25-65)años en diferentes etiologías, 4fracturas de tibia, 2fracturas del calcáneo, una fractura patológica de metatarsiano, un condroma de fémur distal y 2osteotomías de apertura. Los defectos se rellenaron con esferas de cerámica de β-fosfato tricálcico (β-TCP) e hidroxiapatita, de 4 y 6mm de diámetro. El tiempo medio de seguimiento fue de 22 (7-48)meses. La evaluación de la reparación se realizó con radiografías y TC.
ResultadosEn todos los casos observamos la reconstrucción trabecular. Cuando el relleno era completo se observó la formación de hueso; por el contrario, si era incompleto no se apreció la formación de hueso trabecular. Las esferas fueron completamente reabsorbidas o integradas en el momento de la evaluación. Por su parte, las esferas de hidroxiapatita mostraron un mayor contraste en las imágenes, aunque se integraron en el esqueleto óseo.
ConclusiónLa formación primaria de hueso esponjoso se puede lograr con cerámicas osteoconductivas que se pueden combinar con cualquier tipo de osteosíntesis.
The question has been raised whether benign bone defects in patients can be treated with bone forming osteoconductive ceramics achieving primarily a cancellous bone scaffold, which is under load from the beginning.
Material and methodsTen reconstructions were performed in 9patients (6women and 3male), with a mean age of 49 (25-65)years, suffering a high variety of epi- and metaphyseal defects, four tibial fractures, two calcaneal fractures, one pathological phalangeal fracture, one chondroma of the distal femur and two open-wedge osteotomies were filled with micro-chambered ceramic beads of 4 and 6mm in diameter. The mean follow up was 22 (7- 8)months. X-rays and CT-scans formed the basis for the evaluation of the reconstruction of the cancellous bone scaffolds.
ResultsAll cancellous structures were rebuilt, if completely filled with bone-forming elements. If the filling was incomplete, no physiological cancellous bone scaffold resulted. The β-TCP micro-chambered beads were completely reabsorbed or sandwich-like incorporated at the time of evaluation. The HA micro-chambered beads revealed a contrast enhancement and were integrated in the osseous construction of the bone scaffold.
ConclusionPrimary cancellous bone formation can be achieved with osteoconductive ceramic micro-chambered beads and can be combined with any osteosynthesis for stable fixation.
En ocasiones, en las fracturas epifisarias y metafisarias, especialmente en huesos osteoporóticos, tumores, quistes, cuando ha habido una infección, en el aflojamiento de los implantes y en las osteotomías de apertura se producen grandes defectos de hueso esponjoso que son difíciles de rellenar. Hay pocos estudios sobre la reparación del hueso esponjoso1,2, e incluso se ha visto que los defectos de hueso trabecular no se llegan a reparar2. Charnley y Baker1, en las biopsias tomadas de sus pacientes tratados con una artrodesis a compresión, señalaron que la curación del hueso esponjoso ofrece baja actividad osteogénica y, basados en esta observación, Radin y Rose3 explicaron la patogénesis de la artrosis señalando que la placa de cartílago calcificado distribuye las solicitaciones al hueso esponjoso elástico subyacente, por lo que cualquier defecto en el hueso trabecular altera la distribución de los impactos sobre la superficie articular. Sin embargo, la mayoría de los estudios se centran en demostrar, tras los traumatismos articulares, la incongruencia articular, la reducción insuficiente, la inestabilidad o los cambios metabólicos del cartílago articular por la propia inflamación o la necrosis celular4.
Tras su reducción, las fracturas epifisarias dejan grandes defectos de hueso esponjoso que son los responsables de desplazamientos secundarios y de las deformaciones o hundimientos epifisarios5. Por eso, en el tratamiento de las fracturas de la meseta tibial se han recomendado la utilización de aloinjertos6, injerto autólogo de cresta ilíaca7 o sustitutivos óseos8-11. La cuestión es si estos métodos consiguen reproducir la estructura original. En el caso de las fracturas metafisarias en pacientes de edad avanzada con defectos o con un hueso frágil o en las fracturas patológicas tumorales se han tratado con osteosíntesis y cemento óseo (polimetilmetacrilato [PMMA])12. El PMMA también se ha recomendado para el tratamiento de las depresiones de las fracturas metafisarias proximales de tibia en pacientes de edad avanzada para permitir una carga temprana13. También en los tumores óseos benignos, lesiones paratumorales o de bajo grado de malignidad (tumor de células gigantes) a menudo se raspan y se rellena el defecto con PMMA14. Los quistes óseos y las osteotomías de apertura, por su parte, se han rellenado con sustitutivos óseos granulados15 que no reproducen la estructura trabecular16-18.
El objetivo de nuestro estudio es conocer si los defectos causados en lesiones benignas del esqueleto pueden ser tratados con cerámicas osteoconductivas y consiguen regenerar un hueso esponjoso capaz de soportar las cargas.
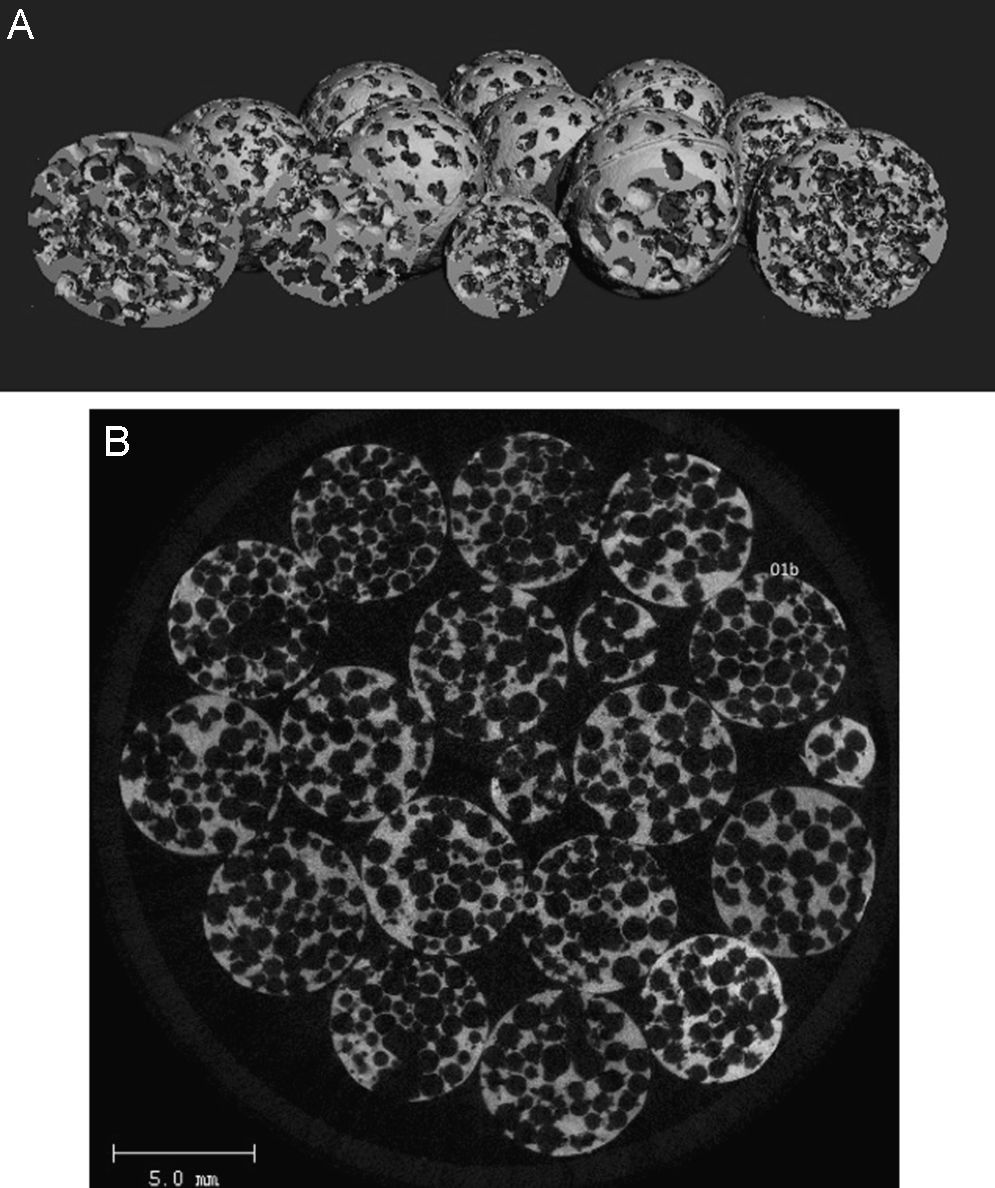
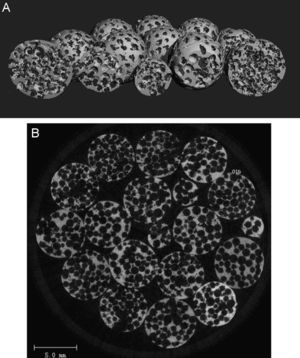
Material y métodosSe rellenaron los defectos óseos en la epífisis y metáfisis de los huesos largos en 9pacientes (tabla 1). Los defectos se rellenaron con esferas microcompartimentadas (micro-chambered) de β-fosfato tricálcico (β-TCP) y de hidroxiapatita (HA) o con una mezcla de ambos. Las esferas medían 4 y 6mm de diámetro (Ceraball®, Karl Storz Endoskope LLC & Co. KG, Tuttlingen, Alemania) (fig. 1). El estudio fue aprobado por el Comité Ético de la Universidad, y todos los pacientes firmaron el consentimiento informado. En todos los casos de fractura se utilizó placas de osteosíntesis (Synthes Inc., Friburgo, Alemania).
Demografía de la población estudiada
| Edad (años) | Sexo | Etiología | Técnica | Sustitutivo óseo | Control | Observaciones | |
| 1 | 59 | Varón | Fractura conminuta del cóndilo externo de la tibia derecha | Osteosíntesis | Ceraball® 600 TCP | RX 3, 8 meses | |
| 2 | 87 | Mujer | Fractura y hundimiento del cóndilo externo de la tibia derecha | Osteosíntesis | Ceraball® 600 TCP | RX 3 días, 2 semanas | Muerte |
| 3 | 65 | Mujer | Fractura y hundimiento del cóndilo externo de la tibia izquierda | Osteosíntesis | Ceraball® 600, TCP/HA | RX 1 día, 1, 10 y 48 meses | Osteoporosis |
| 4 | 59 | Mujer | Fractura distal de la tibia izquierda | Osteosíntesis | Ceraball® 600, TCP/HA | RX 1 día, 1, 12 meses; TC 1 mes | |
| 5 | 55 | Varón | Fractura conminuta del calcáneo izquierdo | Placa | Ceraball® 600, TCP | RX 1 día, 9 meses; TC 1 día, 10, 12, 18, 36 meses | |
| 6 | 35 | Mujer | Fractura conminuta del calcáneo derecho | Placa | Ceraball® 600, TCP | RX 12 meses; TC 1, 3 días, 15, 24 meses | Artrodesis subastragalina |
| 7 | 42 | Mujer | Condroma del fémur distal derecho | Resección | Ceraball® 600, TCP | RX 1 día; TC 48 meses; RM 36 meses | |
| 8 | 42 | Mujer | Fractura patológica del quinto metacarpiano | Osteosíntesis | Ceraball® 600, HA | RX 87 días, 2 meses; TC 13, 17 meses | |
| 9 | 25 | Varón | Genu varo derecho | Osteotomía en cuña | Ceraball® 600, TCP | RX 2 días, 1, 3, 15 meses | |
| 10 | 25 | Varón | Genu varo izquierdo | Osteotomía en cuña | Ceraball® 600, HA | RX 2 días, 1, 2, 3 meses |
Se trataron 3fracturas con depresión del cóndilo lateral de la extremidad proximal de la tibia, una fractura de tibia distal, 2fracturas conminutas de calcáneo, un condroma de fémur distal, un encondroma con fractura patológica del quinto hueso metacarpiano y 2osteotomías de apertura (tabla 1).
Después de la reducción de la fractura o de raspar los tumores benignos, se rellenaron con las esferas y se estabilizaron con la osteosíntesis adecuada para estabilizar el hueso, sin destruir el material cerámico. Las esferas se colocaron con un trocar que se aprovechó también para levantar la meseta tibial. En el resto de los casos, la colocación se efectuó directamente en la fractura o en la propia cuña producida por la osteotomía.
En nuestro estudio se incluyeron 6mujeres y 3hombres, con una edad media de 45 (25-65)años, con un seguimiento medio de 22 (7-48)meses y un seguimiento mínimo de 6meses. Se excluyó del estudio a una mujer que murió a los 8meses y cuyo último control radiográfico fue a las 2semanas. El seguimiento de los defectos se efectuó con rayosX, en 2 planos perpendiculares (AP y lateral), y con TC en el caso del tumor. La evaluación fue realizada por 3cirujanos ortopédicos independientes, quienes analizaron la estructura del hueso esponjoso; la estructura trabecular era completa si no había cavidades radiolúcidas y no había deformación en la superficie articular. Para el resultado clínico se aplicaron, según el área a estudiar, las escalas KSS, AOFAS y Dash.
ResultadosDurante la operación se observó que las esferas tenían un efecto hemostásico y no fueron destruidas por los tornillos de la osteosíntesis; además, las esferas de Ceraball® se quedaron en su lugar al coagular la sangre después del aspirado.
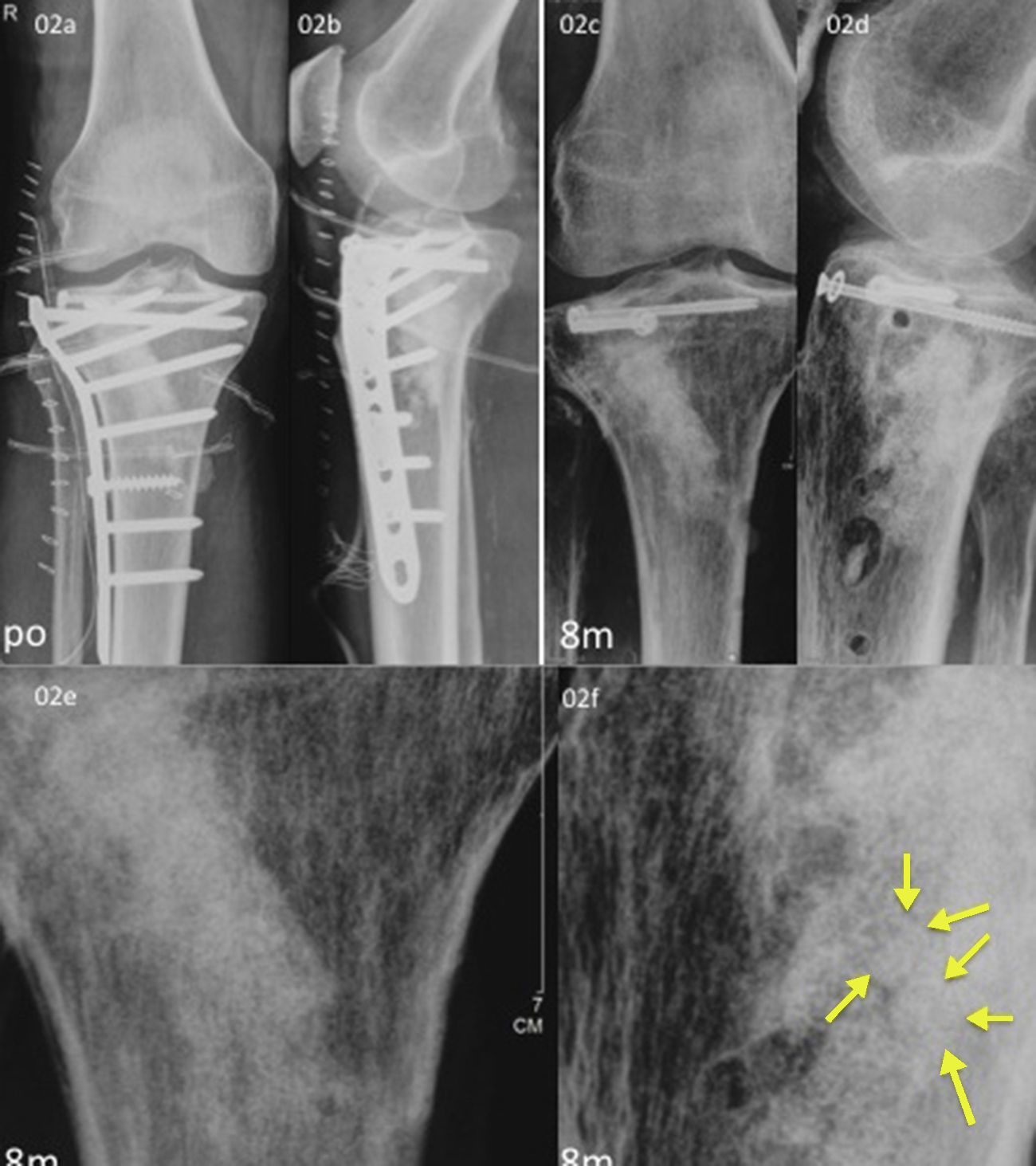
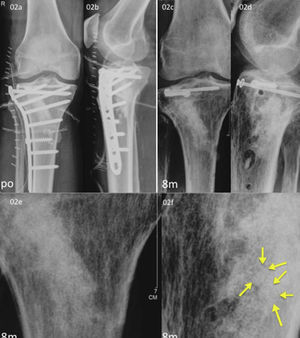
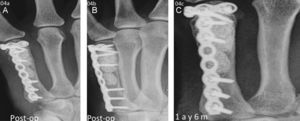
Dos de las fracturas en la extremidad proximal de la tibia se redujeron con buen resultado. Un caso fue excluido de la evaluación radiográfica. En otro caso, 8meses después de la operación el β-TCP estaba casi reabsorbido, aunque se intuía el contorno de las esferas y quedaban pequeños residuos de TCP que eran reemplazados por hueso esponjoso (fig. 2); la puntuación del paciente con el KSS fue de 85. En otra reconstrucción de la meseta tibial no se obtuvo el resultado esperado (puntuación KSS de 55), revelando una deformidad en la meseta que requerirá una nueva intervención. Sin embargo, la estructura de hueso esponjoso había sido totalmente reconstruida y el contraste de las esferas de HA era pronunciado, mientras que las esferas de β-TCP se habían reabsorbido.
La fractura distal de tibia, al año de la operación, mostraba una curación completa con una reducción anatómica. Las esferas de HA y los contornos de las esferas de β-TCP eran visibles entre los tornillos, presentando una estructura de hueso esponjoso adecuada. Parte de las esferas de Ceraball® mostraban contraste, mientras que otras habían sido reemplazadas por hueso recién formado.
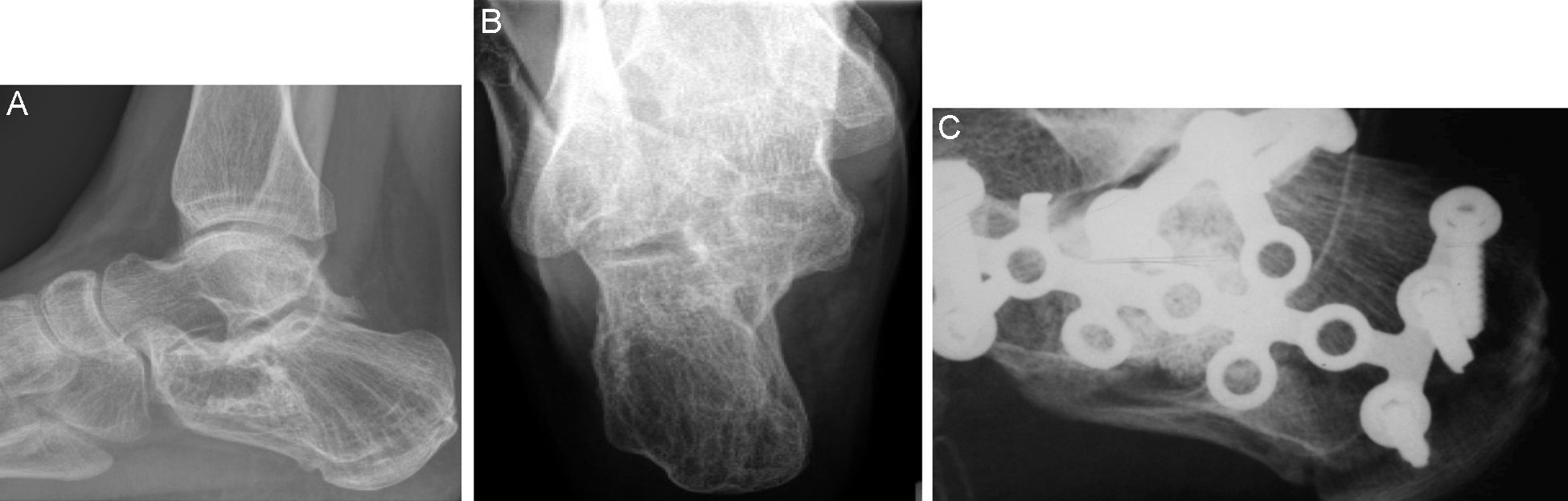
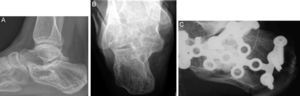
En las fracturas conminutas de calcáneo se reconstruyó la anatomía, obteniendo un resultado satisfactorio en uno de los 2casos, que formó nuevo hueso esponjoso, aunque dejando un defecto persistente con un borde esclerótico, visible en ambos planos (fig. 3). Las esferas de β-TCP se reabsorbieron y apenas eran reconocibles 22meses después de la cirugía, y la puntuación del paciente alcanzó 89puntos en la escala AOFAS. El otro caso de fractura muy conminuta (tipo SandersIV) de calcáneo no se redujo anatómicamente, curando con una grave deformidad y un mal resultado clínico (puntuación AOFAS de 49); sin embargo, mostró una estructura de hueso esponjoso normal, siendo visibles las esferas de HA. El paciente quedó a la espera de una artrodesis subastragalina.
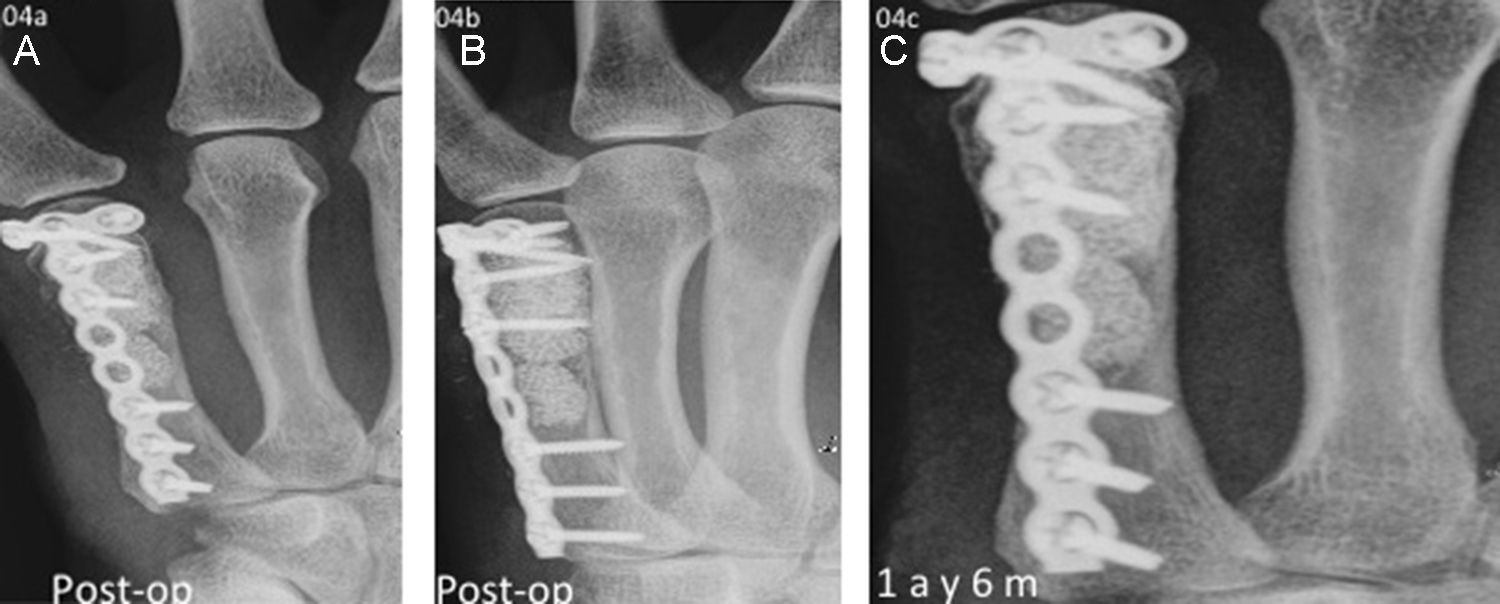
El condroma del fémur distal presentaba una cavidad que fue rellenada con 20cc de esferas y demostró la restauración completa de la estructura de hueso esponjoso con la TC. Por su parte, la fractura patológica del quinto metacarpiano por un encondroma, tratado con raspado y relleno de la cavidad con esferas de HA y osteosíntesis, presentó al año y medio una situación estable con una buena integración de las esferas de HA (fig. 4).
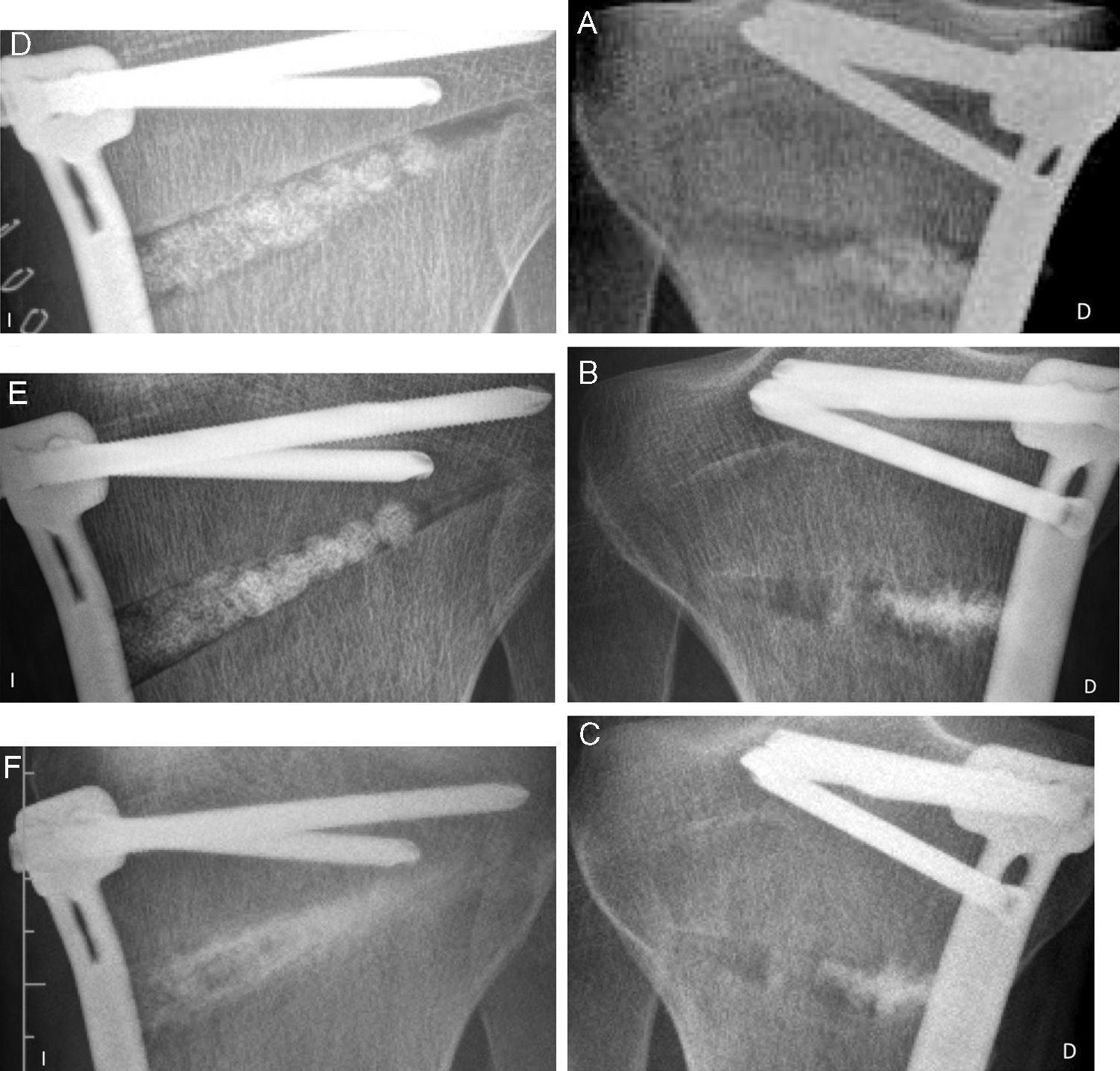
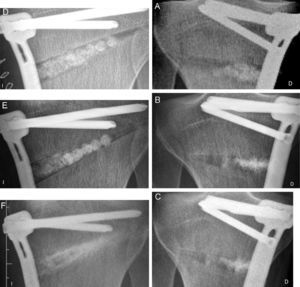
La osteotomía de apertura, en un paciente de 25años de edad, fue bilateral y fue tratada en el lado derecho con esferas de β-TCP y con una placa Tomofix® (Mathys Medizinaltechnik AG, Bettlach, Suiza), presentando el relleno incompleto del defecto óseo. El paciente comenzó la carga parcial a las 2semanas y completa a las 8semanas. La radiografía reveló a los 15meses en el lado derecho una estructura irregular de hueso esponjoso, poniendo de manifiesto defectos persistentes en la parte anterior y lateral, visibles a los 21meses (fig. 5). Por su parte, en el lado izquierdo el relleno del defecto fue completo (fig. 5). La radiografía a las 14semanas reveló una neoformación ósea en el tercio medial del defecto con la reabsorción casi completa de las esferas de β-TCP, y a los 7meses el contorno de las esferas ya no era visible (fig. 5).
A-C)Osteotomía en cuña abierta en varón de 25años de edad tratado con osteosíntesis (placa Tomofix®) y rellenado incompleto del defecto con Ceraball® β-TCP. Seguimiento de 21meses con relleno parcial y permanencia de defectos laterales y anteriores. D-F)Osteotomía en tibia contralateral siguiendo el mismo tratamiento con seguimiento de 7meses: las esferas son visibles pero son reemplazadas por hueso. A los 7meses son totalmente reabsorbidas.
Las limitaciones de nuestro estudio son claras, pues se reduce a un número de pacientes pequeño y de patologías variadas, con diferentes situaciones y técnicas quirúrgicas. No hemos podido comparar la evolución de los defectos con otros tratamientos, por lo cual decidimos ver el comportamiento en la integración con esferas de HA y de β-TCP en defectos del hueso esponjoso.
El hueso esponjoso no se regenera por sí mismo y requiere ayuda para su reparación16, y no son muchos los trabajos sobre reparación ósea metafisaria y epifisaria del hueso1,2,17, a pesar de que son lesiones muy frecuentes y en muchos casos terminaran afectando al cartílago y desarrollando una artrosis. Por eso, consideramos que todos los defectos grandes de hueso trabecular deben ser rellenados con injertos o sustitutivos18, y resulta especialmente interesante su uso en las osteotomías de apertura y en las reconstrucciones epifisarias que manifiestan dolor, incapacidad funcional o muestran un riesgo de fractura patológica19,20. Un ejemplo claro son las deformaciones e incongruencias en las fracturas de meseta tibial21,22. Los injertos de hueso autólogo están limitados y presentan dolor en la zona donante23, mientras que los aloinjertos, además de las complicaciones propias, pueden reabsorberse rápidamente6. El tratamiento con sustitutivos óseos de HA presenta, desde nuestra perspectiva, 3dificultades: resultan difíciles de manejar para rellenar un defecto, los tornillos de la osteosíntesis pueden fracturarlos24 y la integración requiere un proceso de remodelación demasiado largo18. Por su parte, los cementos de fosfato cálcico soportan mejor las solicitaciones que el injerto autólogo7. Otro aspecto a considerar es que la estructura trabecular no se regenera con los cementos óseos inorgánicos11. Las esferas microcompartimentales utilizadas en nuestro estudio han demostrado un rápido crecimiento óseo, revelando un contraste de hueso laminar mineralizado y la formación de una estructura trabecular normal17,18.
En los defectos metafisarios no hay duda de que, para los pacientes de edad avanzada que sufren fracturas conminutas pertrocantéreas o de la meseta tibial con un hueso frágil o en pacientes con cavidades tumorales, el cemento aumenta la estabilidad de la osteosíntesis y puede ser la mejor opción12-14,25,26. En los quistes óseos y en tumores benignos o de bajo grado de malignidad se ha recomendado en ocasiones el PMMA para aprovechar el calor de la polimerización y destruir las células que permanecen después de la resección del tumor o tras su raspado. Sin embargo, también tiene problemas, pues se retira con dificultad14,27, y se observa con frecuencia una zona radiolúcida, una imagen de osteólisis, al igual que sucede con las esferas de HA que no se reabsorben17. El uso de bloques de β-TCP o de HA para el relleno de grandes cavidades es incompleto, mientras que el material granulado se combina con hueso autólogo y no permite reconstruir la morfología trabecular17,28. La utilización de esferas microcompartimentadas de 4 o 6mm de diámetro permite el relleno completo de las cavidades grandes y tiene un efecto hemostático, pues las esferas detienen la hemorragia de las propias cavidades y no molestan la colocación de los tornillos de un implante estable.
En las osteotomías en forma de cuña el relleno espontáneo del espacio creado es difícil y las radiografías muestran una neoformación ósea lenta e incompleta, dejando defectos persistentes2. Los 2casos presentados en nuestro trabajo demuestran que las esferas de HA son empujadas por el propio sangrado contra la placa, por lo que quedan defectos persistentes en la parte central y lateral de la osteotomía, a pesar de que se permitió la carga completa 2semanas antes de lo recomendado en la literatura17. Sin embargo, en el lado relleno con granos de β-TCP el proceso de osteoconducción fue rápido, se consiguió una arquitectura trabecular normal y la carga fue completa, sin dolor y 4semanas antes que el lado derecho, que tuvo un relleno incompleto.
Las esferas de β-TCP permiten el relleno de cualquier defecto y pueden ser implantadas con una jeringa con solución de Ringer y una compresa húmeda para impedir que las mueva el propio sangrado. La sangre se mezcla con ellas y, una vez coagula, las estabiliza16. La forma esférica del sustitutivo presentado también ayuda a la formación ósea17, mientras que los preparados comerciales en gránulos no son adecuados para formar una estructura trabecular. Además, los gránulos de HA se deben combinar con hueso autólogo triturado28 o con β-TCP17. Las esferas microcompartimentadas son una réplica tridimensional de las trabéculas, característica del hueso esponjoso; son como un molde negativo de los espacios intertrabeculares fáciles de colonizar por un hueso nuevo que puede someterse a carga desde el principio sin precisar el remodelado, siendo el método más rápido para la reconstrucción de un defecto esponjoso. Otra ventaja es que pueden combinarse con algunos fármacos, como la BMP16. Además, esta morfología esférica las empuja fácilmente al aplicar osteosíntesis atornilladas, moviéndolas fácilmente sin llegar a destruirlas.
Nivel de evidenciaNivel de evidencia IV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflictos de intereses y que no han recibido ninguna ayuda económica para el presente manuscrito. ZOW, centro de investigación de ciencias ortopédicas, es un centro privado de investigación soportado con ayudas financieras del gobierno y de una fundación familiar.