El objetivo de este estudio es comparar la biocompatibilidad y efecto sobre osteoblastos de polimetilmetacrilato solo y PMMA al que se ha añadido, hidroxiapatita en concentraciones del 5, 10, 15 y 20%, no superando nunca esta cifra del 20%, dado que si se supera esta cifra pueden verse alteradas las propiedades biomecánicas del PMMA.
Material y métodosEstudio experimental que consiste en el estudio de la adhesividad, diferenciación y muerte celular sobre discos de PMMA y composite PMMA/HA a diferentes concentraciones.
ResultadosLos composites al 15 y especialmente al 20% presentaron mejor respuesta osteoblástica, mayores marcadores de actividad y menores marcadores de apoptosis. En las imágenes de microcopía electrónica se aprecia una mayor adhesión celular.
The purpose of this study is to compare the biocompatibility and the effect in osteoblasts of polymethyl methacrylate alone, and mixed with hydroxyapatite in different concentrations of 5, 10, 15 and 20%, without exceeding 20%, as it can alter mechanical properties of the composite.
Material and methodsExperimental study comparing osteoblast response to Polymethyl methacrylate alone and with hydroxyapatite in different concentrations.
ResultsComposites at 15 and 20% obtained better osteoblast response, with higher osteoblastic activity markers, and lower apoptosis markers. Electron microscopy images show improved adhesion of osteoblasts.
Desde hace más de 50 años el polimetilmetacrilato (PMMA) se viene usando en Cirugía Ortopédica y Traumatología para la unión de implantes al organismo1, sobre todo desde los años 60 por Charnley y Smoth. Entre el PMMA y el implante adecuado se consigue una unión resistente y duradera, pero entre el cemento y el hueso no ocurre lo mismo, ya que el PMMA limita la actividad de los osteoblastos que se encuentran en contacto con ella, observándose con frecuencia células fibroblásticas en el interfaz entre el cemento y el hueso2.
En los últimos años el uso del PMMA se ha extendido a la cirugía de columna, sobre todo en las técnicas de refuerzo para el tratamiento de las fracturas vertebrales. El tratamiento de las mismas mediante estas técnicas se inicia en el año 1987, para fracturas tanto traumáticas como patológicas, y el cemento también se comienza a emplear como suplemento para la fijación en los tornillos pediculares en casos concretos.
El PMMA utilizado en las técnicas de refuerzo vertebral tiene unas características que los diferencian del convencional, en lo que respecta a la mayor viscosidad y menor capacidad exotérmica. Sus características osteointegradoras, y la respuesta biológica al mismo no es diferente a la de los convencionales, habiéndose detectado pequeñas necrosis óseas en las vértebras tras las técnicas de refuerzo vertebral3.
Se han realizado estudios de refuerzo vertebral con materiales biocompatibles como la HA o el fosfato tricálcico, pero sus propiedades biomecánicas en lo que respecta a rigidez, dureza, resistencia y modulo de Young son muy inferiores al del PMMA4,5, por lo que no garantizan el soporte de cargas en la vértebra dañada.
Cementos de PMMA y HA se están investigando utilizando distintas concentraciones de HA, con el fin de conseguir un composite que tenga unas propiedades biomecánicas semejantes al PMMA, y una biocompatibilidad con propiedades osteoconductivas semejante a la HA6–13.
El objetivo de este estudio es comparar la biocompatibilidad y efecto sobre osteoblastos de PMMA solo y PMMA al que se ha añadido HA en concentraciones del 5, 10, y 20%, no superando nunca esta cifra del 20%, dado que si se supera esta cifra pueden verse alteradas las propiedades biomecánicas del PMMA14.
Material y métodosPreparación de los materialesLa hidroxiapatita se obtuvo de la empresa Keramat (Ames, A Coruña, España). El tamaño de partícula del polvo de HA (Ca10 [PO4] 6 [OH] 2, Ca / P = 1,67) se examinó con un analizador de tamaño de partícula (Beckman Coulter, Fullerton, CA), y la microestructura de cada polvo se examinó por microscopía electrónica de barrido (SEM), (SEM, Hitachi S-2400, Japón). El mapeo de detección y de rayos X de la composición química de los polvos se consigue utilizando un espectrómetro de dispersión de energía de rayos X (espectrómetro EDX, Kevex MS3 Sigma, EE. UU.).
Como cemento de polimetilmetacrilato utilizamos PMMA HV-R Kyphon (Medtronics España) que es el utilizado en nuestra Unidad para las técnicas de refuerzo vertebral percutáneo.
La HA en polvo fue mezclada con el monómero de PMMA a distintas concentraciones por peso (5,10,15 y 20%) en nuestro laboratorio, bajo condiciones estériles en cabina de flujo laminar vertical. La mezcla se realizó en un molino mezclador (Retsich MM400, Alemania) durante 10min con una frecuencia de vibración de 20 s.
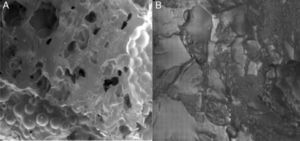
Se estudió la microestructura de la superficie de los composites creados según la concentración de HA por SEM, para valorar la rugosidad de su superficie (fig. 1).
La mezcla se deja reposar durante 24 horas siguiendo los tiempos de fraguado indicados por Medronics. Se procedió a esterilizar mediante radiación gamma en seco los discos creados.
Se utilizaron 100 discos en el proyecto, repartidos en 5 grupos en función de la concentración de HA. Aparte de los mismos se reservó una pequeña serie de 10 para el análisis con microscopía electrónica. El análisis por SEM se realizó en el Servicio de Microscopía de la Universidad de Santiago de Compostela.
Respuesta celularOsteoblastos humanos, de la línea celular ATTC Saos-2 fueron sembrados en los especímenes en forma de disco (altura = 3mm, diámetro = 6mm) a una densidad de 6 x 105 células / ml con medio de cultivo Eagle modificado de Dulbecco (DMEM-HG, Sigma, St. Louis, MO) al 10% de suero bovino fetal (FBS, Gibco BRL, MO) durante 72h (37°C, 5% CO2). Se procedió a estudiar las diferencias en la proliferación celular sobre las diferentes muestras por medio de un ensayo MTT (Sigma).
El volumen total de osteoblastos por muestra cultivados fue de 60 x 103 sobre los discos con distintas concentraciones de PMMA-HA. Preliminarmente al cultivo de células, los discos se pusieron en contacto con un volumen de DMEM para funcionalizar la superficie de los cementos durante 20 minutos, evitando las posibles interacciones hidrofóbicas que en última instancia podrían interferir con la adhesión celular. Los discos se mantuvieron en cultivo en placas de 24 pocillos (Corning, USA) durante 5, 10 y 15 días (fig. 2). El sobrenadante de cultivo era guardado metódicamente a -20°C tras los puntos finales de tiempo de cultivo. Todos los sobrenadantes se ensayaron al mismo tiempo para los marcadores de la apoptosis, proliferación y marcadores osteoblásticos.
La posible toxicidad del composite creado se estudió mediante apoptosis (muerte celular) siendo medido con inmunoensayo para la detección de los niveles de caspasa 3 y mediante el estudio con el sistema TRAIL (Sigma).
El sistema TRAIL consiste en un ensayo de inmunoabsorción enzimática usado para la detección de la enzima TRAIL (TNF-related-apoptosis-inducing-ligand), una citoquina perteneciente a la familia TNF, que promueve la apoptosis por una vía mitocondrial15. Para la detección se utilizan los sobrenadantes recogidos a 5, 10 y 15 días siguiendo el protocolo facilitado por el fabricante, y para la lectura de la absorción se utiliza un espectrofotómetro a 450nm.
La caspasa 3 es un mediador crucial en la apoptosis, utilizada habitualmente como marcador de la misma que se mide mediante técnica de ELISA16. Al igual que con el enzima TRAIL, se utilizaron los sobrenadantes recogidos a los 5,10 y 15 días. La lectura de la placa es también a una longitud de onda de 450nm.
La comprobación de los marcadores específicos de actividad de los osteoblastos se realizó a través del estudio de la producción de fosfatasa alcalina en los osteoblastos sobrenadantes recogidos a 5, 10 y 15 días, siguiendo el protocolo facilitado por el fabricante Sigma Technical Bulletin Procedure. Los osteoblastos fueron aislados utilizando 0,1% Triton-X 10mM tris-HCI (pH 7,4) por (2H, 4°C) e incubados con fosfato p-nitrofenil (Sigma Kit No.104) durante 15 minutos a 37°C, y para la lectura de la absorción se utilizó un espectrofotómetro a 405nm (MedSystems Bender).
Para la cuantificación de la hidroxiapatita se empleó el kit BioVision. Este kit de ensayo de fosfatasa alcalina es un muy sensible, sencillo, directo. Se trata de un ensayo colorimétrico diseñado para medir la actividad de ALP en muestras de suero y biológica. Lo contiene 10 tabletas de sustrato que proporcionan comodidad para múltiples usos. El kit utiliza pnitrophenyl fosfato (pNPP) como sustrato fosfatasa que se vuelve amarillo (λmax = 405nm) cuando es desfosforilado por fosfatasa acalina. El kit puede detectar 10-250 mU fosfatasa alcalina en las muestras.
Se reservó un grupo de discos para su fijación y posterior análisis por SEM. En este proceso se emplea una solución tamponada de paraformaldehído (25%) y glutaldehido (5%). Tras 12 horas de incubación, las muestras son lavadas dos veces con PBS procediéndose a la posterior deshidratación de las mismas mediante sucesivos cambios progresivos de etanol en lugar de medio de cultivo hasta llegar a un alcohol absoluto que eliminará toda presencia de agua de la muestra (30-100%).
Los análisis estadísticosEl análisis estadístico de todos los datos experimentales se realizó con SPSS (v 11.0, SPSS Inc., Chicago, IL). Se procedió a confirmar que los datos obtenidos en los ensayos se ajustaban a una distribución normal (0,1) mediante un test de Kolmorov Smirnov. Se confirma también una igualdad de varianzas lo que indica una homocedasticidad de la muestra permitiendo estudiar diferencias entre distribuciones normales. Tras dicha confirmación se aplicó a los datos la prueba t de Student. Los datos se presentan como media ± desviación estándar a un nivel de significación de p = 0,05.
ResultadosLa caracterización física de la HA resultó en los siguientes datos:
- •
Superficie específica 8,82 m2/g
- •
Composición química: ortofosafto cálcico
- •
Composición mineralógica: hidroxiapatita
- •
Tamaño medio: 300nm
- •
Análisis cuantitativo por DRX: hidroxiapatita [Ca10(PO4)6(OH)2] >99%
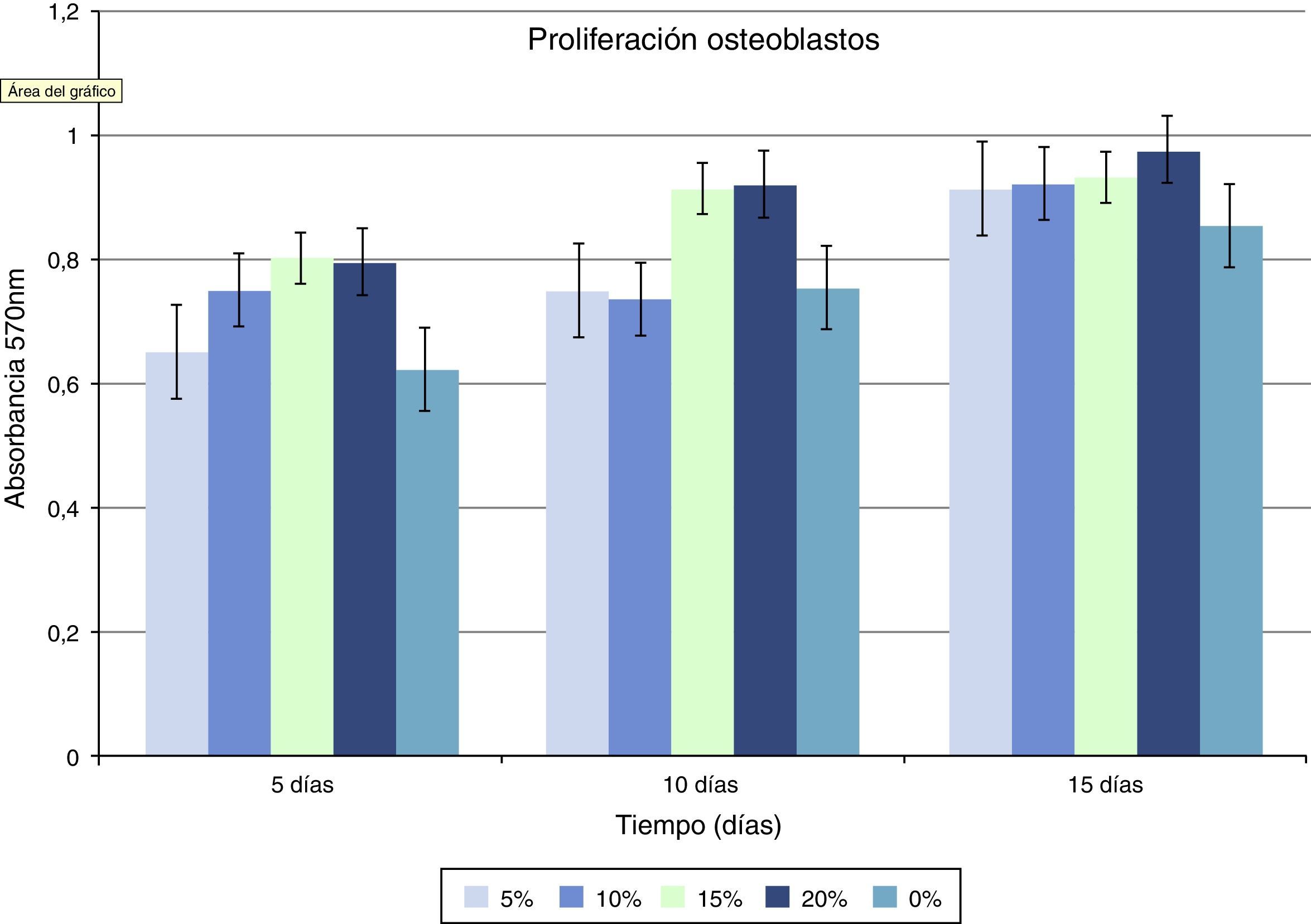
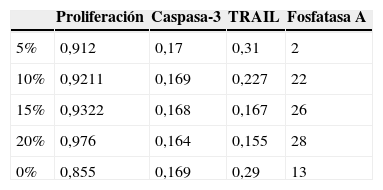
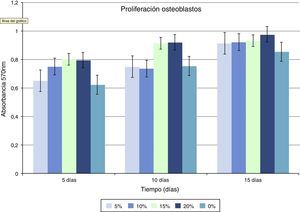
En lo que respecta a la proliferación celular, se observa que las células Saos-2 cultivadas sobre las diferentes superficies, proliferan de manera incremental en función de la concentración de HA sobre PMMA. Los máximos picos de crecimiento son obtenidos en concentraciones en torno al 15 y 20% con valores de 0,86±0,026 y 0,90±0,008 (media de proliferación a los 5,10 y 15 días). En el grupo de PMMA solo, apenas se aprecia proliferación, la cual va aumentando conforme aumenta la concentración de HA. Entre las concentraciones de 10 y 15% parece existir un punto de inflexión claro en la proliferación, siendo estadísticamente significativo el aumento de proliferación celular a partir del 15% de HA (fig. 3, tabla 1).
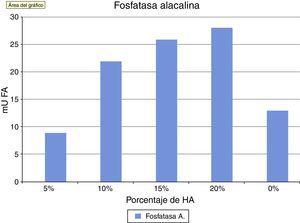
La fosfatasa alcalina es un marcador de la actividad osteoblástica sobre materiales y en sistemas in vitro. Se puede observar en la figura 4 cómo los valores de FA van aumentando en función de la concentración de HA. Los valores del grupo control son superiores al cemento al 5%, esta concentración parece no modular positivamente el fenotipo de osteoblastos existiendo variaciones muy grandes en los grupos a partir de una concentración del 10% de HA. Estos resultados al final del ensayo pueden verse en la tabla 1.
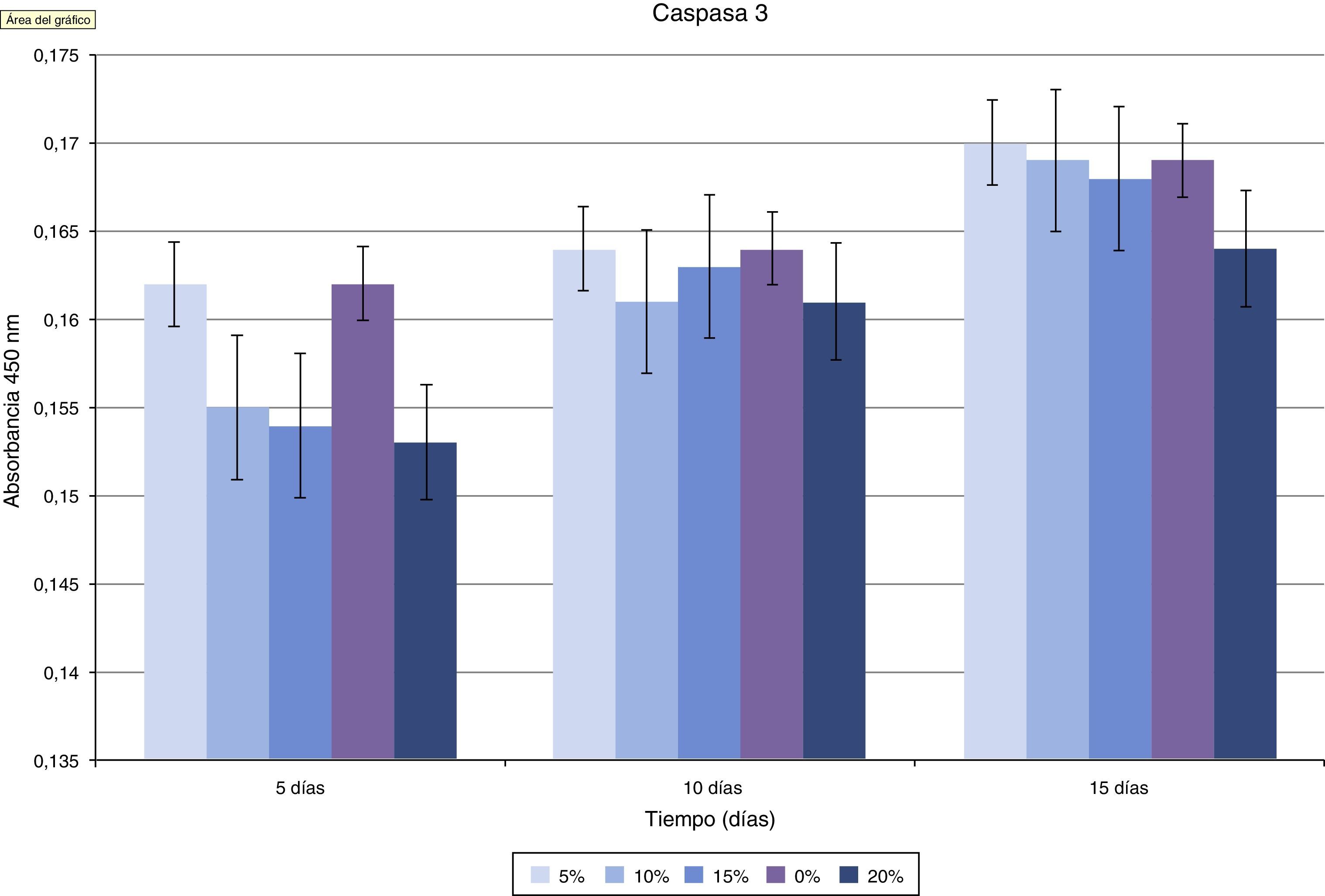
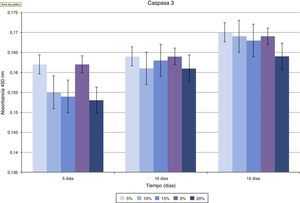
En la valoración de la toxicidad del composite creado sobre los osteoblastos se estudió la expresión de caspasa-3 (fig. 5 y tabla 1). Como se puede apreciar en la gráfica, existe una disminución progresiva de este marcador de muerte celular en función del incremento del ratio HA/PMMA. La concentración al 20% de HA muestra los mejores resultados, con la menor medición de Caspasa-3. El análisis estadístico demuestra que existen diferencias significativas.
Los valores obtenidos por el método TRAIL demuestran cómo una concentración creciente de HA embebida en PMMA llega a mejorar los valores de inflamación cuando son comparados con los grupos control. En este caso el valor de TRAIL para el espécimen del 15 y 20% ha demostrado tras un análisis estadístico la existencia de una diferencia significativa en los valores medidos por espectrofotometría en TRAIL como se muestran en la tabla 1.
En las imágenes obtenidas mediante SEM se ve objetivamente la mayor adhesión celular sobre la superficie de los implantes. Se muestra en la figura 6 la comparativa vista por SEM de las superficies de dos discos, el primero con composite al 20% de HA y el otro con PMMA puro. Se aprecia una mayor cobertura de la superficie por osteoblastos en la primera imagen. Puede compararse con las imágenes del material sin cultivar de la figura 1.
DiscusiónLa osteintegración de un implante, que vaya a permanecer en un tejido óseo, es crucial para el éxito de este a lo largo de los años.
Durante el diseño de cualquier biomaterial, la interacción con los tejidos que rodean al mismo es clave a la hora de entender la existencia de fenómenos de interfaz17. La adhesividad celular junto con la toxicidad del material son los pilares de cualquier diseño de biomateriales. Por lo tanto, la proliferación inicial y el reclutamiento de células en la superficie de un biomaterial es de gran importancia para la valoración de la bioactividad del mismo.
El PMMA ha demostrado nula capacidad osteogénica, y en diversos estudios realizados ha demostrado no tener capacidad para la adhesividad de proteínas del liquido extracelular y por lo tanto de células, pudiendo ser incluso tóxico para ellas2.. Además la reacción exotérmica creada durante su fraguado18 también es lesiva para las células que estén a su alrededor, llegando a producir una reacción inicial de necrosis19. Estudios recientes incluso han comprobado que el PMMA produce tasas de degeneración discal mayores que cementos de fosfato cálcico20, en experimentos realizados en animales.
En contraposición a lo que ocurre con el PMMA, se ha demostrado que la HA constituye un adecuado andamiaje que favorece la adhesión de proteínas del líquido extracelular, y, a través de este, se produce la adhesión de células, mediado principalmente por las integrinas21.
Se sabe que la adición de HA al monómero del PMMA no afecta al proceso de polimerización de este, pero sí puede afectar a sus propiedades mecánicas en lo que respecta a la dureza, la compresión, la resistencia a la rotura, su módulo de elasticidad, y la resistencia a la tracción, cuando la adición de HA supera el 15 o el 20%14,22-24. Pese a ello, estudios recientes, incluso afirman que composites de PMMA-HA in vivo mejoran las propiedades mecánicas del PMMA aislado, ante la fatiga de material a largo plazo25. In vitro se ha demostrado ya una mayor adhesividad osteoblástica a los composites PMMA/HA26.
En lo que respecta a la capacidad exotérmica, la adición de HA al PMMA disminuye la temperatura pico en el proceso de polimerización, lo que disminuye sus efectos lesivos sobre las células27.
En nuestro estudio los máximos picos de crecimiento celular de estirpe osteoblástica son obtenidos en concentraciones en torno al 15 y 20% con valores de 0,86±0,026 y 0,90±0,008. Entre las concentraciones de 10 y 15% parece existir un punto de inflexión claro en la proliferación, por lo que consideramos concentraciones óptimas las superiores al 15%. Parece ser que concentraciones del 15% de HA marcan la transición entre un proceso de encapsulación a un proceso de crecimiento óseo28. Esta mayor proliferación y diferenciación de osteoblastos in vitro se piensa que es debido a la presencia de HA en la superficie del cemento. Se ha demostrado que topografías más rugosas son más favorables para la adhesión celular29. También parece ser que las células reaccionan a estímulos químicos de la superficie de HA de manera preferencial en comparación con el polímero del cemento, debido a que la HA es capaz de absorber elementos de la matriz extracelular, que estimularían la adhesión de osteoblastos30.
Se realizó un examen de los osteoblastos adheridos a la superficie del PMMA-HA por SEM (fig. 6), en la que se apreció una morfología y confluencia semejante a la obtenida en otros biomateriales con propiedades osteoinductoras como son la HA aislada o el titanio.
La producción de fosfatasa alcalina está asociada a la actividad de los osteoblastos en la formación de hueso, por lo tanto la fosfatasa alcalina es considerada como un marcador de mencionada actividad osteoblástica en la mayoría de los estudios tanto «in vitro»31, como «in vivo». En nuestro estudio se puede observar como su actividad aumenta conforme aumenta la concentración de HA, consiguiendo los niveles más altos a la concentración del 20%.
Para la valoración de la toxicidad de la mezcla PMMA-HA creada hemos utilizado la Caspasa-3 como índice de apoptosis, por toxicidad del material implantado. Es sabido que el PMMA aislado produce muerte celular (apoptosis) de osteoblastos in vitro32. Hemos observado una disminución progresiva de la concentración de Caspasa 3 conforme aumenta la concentración de HA en el composite, apreciando que a concentraciones del 20% de HA, la muerte celular es semejante a la observada en los grupos control, por lo que a esta concentración podríamos considerar nula su toxicidad sobre los osteoblastos con un índice apoptótico óptimo.
También hemos realizado un estudio de la toxicidad del cemento sobre los osteoblastos con el sistema TRAIL, apreciamos que a concentraciones de 15 y 20% se aprecia una diferencia significativa con una disminución de la apoptosis con respecto a composites con menor porcentaje de HA o al propio PMMA aislado.
Como conclusión podemos decir que los composites de PMMA-HA a concentraciones entre el 15 y 20% demuestran en este estudio condiciones favorecedoras de la proliferación osteoblástica, sin alterar su capacidad osteogénica, disminuyendo la toxicidad que presenta el PMMA aislado o composites a menores concentraciones.
Se aprecia de forma subjetiva por SEM una mejor adhesividad celular sobre el composite al 15 y 20% que sobre el resto de muestras del estudio.
Serán necesarios más estudios «in vivo» para confirmar estos estudios y poder ser utilizados en la clínica.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Medcomtech la cesión del cemento para realizar las pruebas y a Keramat la hidroxiapatita para el composite.