Comparar la eficacia y seguridad de la infiltración de plasma rico en plaquetas preparado respecto a ácido hialurónico en pacientes con coxartrosis refractaria a tratamiento conservador. Así como correlacionar el impacto clínico entre las diferentes concentraciones celulares.
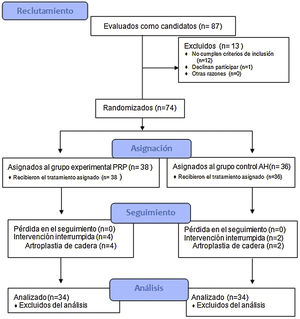
Materiales y métodosEnsayo clínico fase III, doble-ciego, controlado, en el que se aleatorizaron a los pacientes en dos grupos de tratamiento (PRP o AH) con una única infiltración de cadera ecoguiada. El seguimiento fue de 12 meses, registrando escala de dolor (EVA) y escalas funcionales (HHS y WOMAC), analgesia consumida, respondedores (criterios OARSI) y efectos adversos. Se analizaron, en el grupo experimental, las concentraciones celulares en sangre periférica y en el PRP infiltrado.
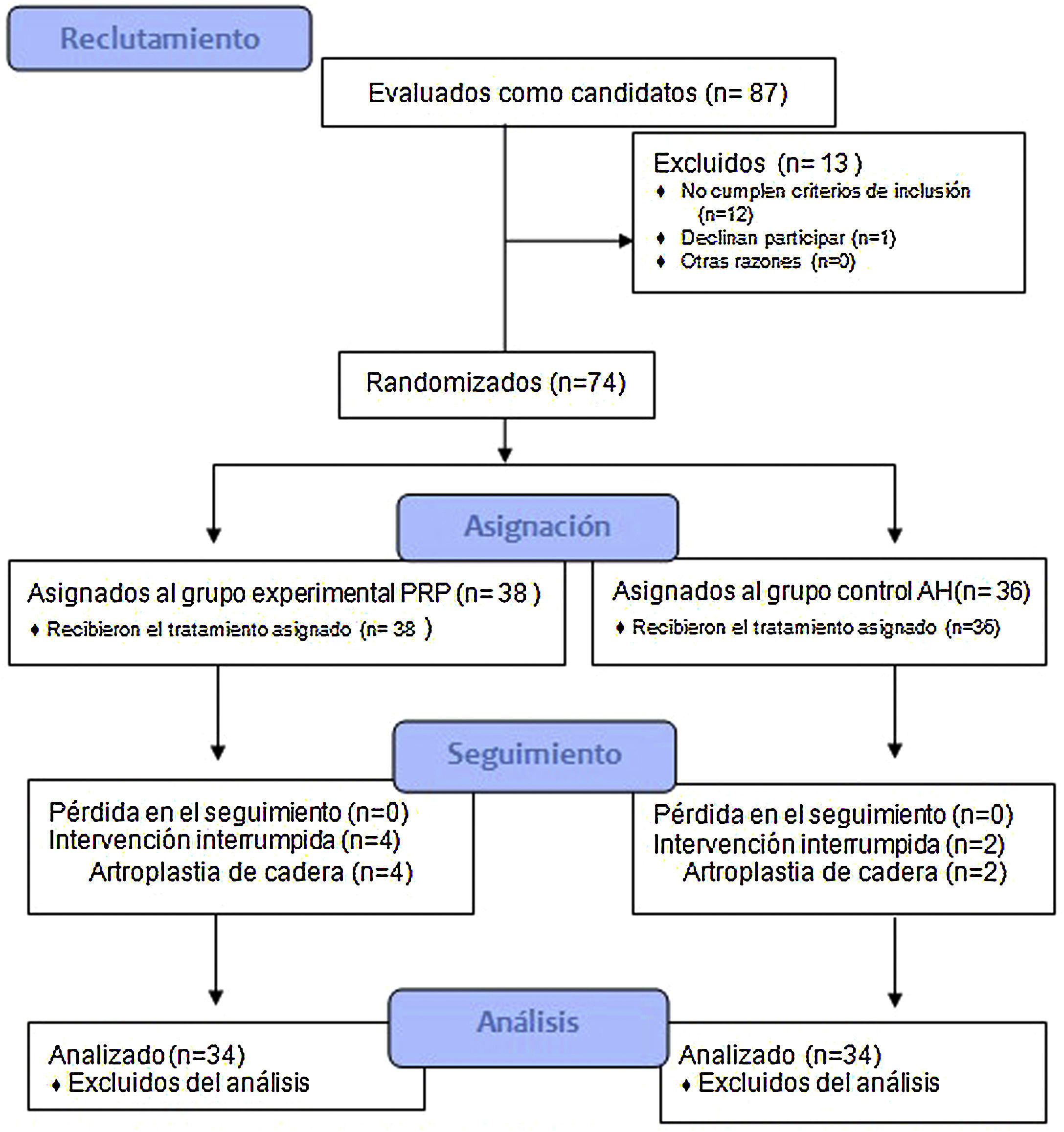
ResultadosSe incluyeron un total de 74 pacientes. Ambos grupos de tratamiento presentaron mejoría en las escalas EVA, WOMAC, HHS y reducción del consumo de analgesia en el tiempo (p<0,05). Únicamente encontramos diferencias significativas entre grupos al año de tratamiento en los valores de HHS (Grupo PRP 70,9 [3,7-58] grupo AH 60,2[43-74,2] p<0,05). No se registraton efectos adversos en ninguno de los grupos.
Encontramos correlación entre la concentración de plaquetas en pacientes respondedores (un mes postratamiento; no respondedores 449[438-578] x103 plaquetas/μl, respondedores 565 [481-666] x103 plaquetas/μl, p<0,044). Se correlaciona la concentración de leucocitos con las escalas clínico-funcionales (EVA 6 meses, r=0,748, p<0,013, subescala rigidez WOMAC 6 meses, r=0,748, p<0,013). Los pacientes con estadios de coxartrosis iniciales (KL 1 y 2) tienen mayor probabilidad de responder al tratamiento con plasma rico en plaquetas (11,51 OR, IC 95% 2,34-50,65, p<0,03).
ConclusionesLa infiltración única de PRP es eficaz en términos de mejoría funcional, reducción del dolor y disminución del consumo de analgesia en coxartrosis. Los sistemas de preparación abiertos, son un procedimiento seguro para la obtención de PRP. Se deben indicar las infiltraciones de cadera en estadios evolutivos iniciales. Se debe tener en cuenta la composición celular para garantizar una repuesta clínica positiva.
To compare efficacy and safety of a home-made platelet-rich plasma (PRP) solution versus hyaluronic acid in patients with hip osteoarthritis not responding to conservative treatment and to correlate cellular composition of PRP to clinical outcomes.
Material and methodsThis is a phase III clinical trial, double-blinded, controlled and randomised into two treatment groups (PRP and hyaluronic acid). Patients received one hip ultrasound-guided injection. Follow up was 12 months. Pain was assessed using VAS score, HHS and WOMAC were used as functional scores, analgesia, adverse events, cellular components (PRP group) in peripheral blood and in PRP were recorded. Clinical response was assessed using OARSI criteria.
ResultsSeventy-four patients were included. Both groups improved in VAS, WOMAC and HHS score and reduced the amount of analgesia (p<.05). Significant differences were seen at 1 year post-treatment in HHS score (PRP 70.9 [3.7-58], hyaluronic acid 60.2[43-74.2] p<.05). No adverse events were observed in none of the groups.
Platelet concentration was different between responders and non-responders (at 1 month, non-responders 449[438-578] x103 platelets/μl versus responders 565 [481-666] x103 platelets/μl, p<.044). There was a correlation between leukocytes concentration and clinical scores (VAS at six months, r=0.748, p<.013, WOMAC at 6 months r=0.748, p <.013). Patients with early stage hip OA showed higher response rate to PRP compared with late stage (11.51 OR, 95%CI 2.34-50.65, p<.03).
ConclusionsPlatelet-rich plasma injection improved hip function, reduced pain and the use of analgesia. It is important to bear in mind the cellular composition in order to achieve a better clinical response.
La coxartrosis se caracteriza por un proceso de deterioro del cartílago, con reacción proliferativa del hueso subcondral e inflamación de la membrana sinovial de la cadera. La osteoartritis (OA) se encuentra entre las 10 principales causas de discapacidad a nivel mundial1. En el manejo de la coxartrosis existe un único tratamiento definitivo; la artroplastia de cadera. En el arsenal de tratamientos conservadores disponibles se incluyen los tratamientos farmacológicos, fisioterápicos y las infiltraciones intraarticulares. Las infiltraciones intraarticulares (IA) constituyen una arma más de la práctica clínica diaria. Su uso está ampliamente extendido pero existen muchas incógnitas a resolver en cuanto a su eficacia y protocolo de uso2,3.
Recientemente, ha adquirido un gran protagonismo el uso de productos derivados de la sangre como el plasma rico en plaquetas (PRP)4. El PRP es un concentrado de plaquetas obtenido de la centrifugación de sangre autóloga. Su composición biológica con altas concentraciones de factores de crecimiento y su acción en la reparación y regeneración tisular ha concentrado el interés de la comunidad científica5. La administración indiscriminada independiente de la patología, grado de afectación y las características del paciente han puesto en duda su eficacia. Su acción ha sido demostrada en estudios in vitro pero no existen estudios clínicos de calidad que demuestren su eficacia y establezcan un protocolo de preparación y administración de tratamiento6-8.
Por todo ello, uno de los objetivos prioritarios de esta investigación es establecer un protocolo de procesamiento de PRP, una cuantificación y correlación de los componentes celulares con los resultados clínicos y la demostración de la eficacia del tratamiento.
Material y métodosEnsayo clínico aleatorizado, doble ciego, controlado, fase III, que incluye un total de 74 pacientes diagnosticados de osteoartritis de cadera que habían fracasado al tratamiento analgésico prolongado con AINE atendidos en la Unidad de gestión clínica de Cirugía Ortopédica y Traumatología del Hospital Virgen Macarena (Sevilla). Cumplían los criterios de inclusión y no presentaron ninguno de los criterios de exclusión (tabla 1) y manifestaron su conformidad a participar voluntariamente firmando el consentimiento informado. El estudio se llevó a cabo entre los años 2016-2018.
Criterios de inclusión y exclusión
| Criterios de inclusión |
| 1. Pacientes>30 años |
| 2. Pacientes diagnosticados de coxartrosis que a pesar de estar en tratamiento con AINE durante al menos 6 meses, manifestaran dolor persistente de más de 30 días3. Pacientes que expresaran voluntariamente su intención de participar mediante el consentimiento informado |
| 4. Mujeres en edad fértil deben tener una prueba de embarazo negativa durante la selección y debían comprometerse a utilizar un método anticonceptivo apropiado (o dos métodos anticonceptivos, de los cuales uno fuera de barrera) durante su participación en el ensayo |
| Criterios de exclusión |
| 1. Tratamiento con infiltraciones los 3 meses anteriores al estudio, tratamiento previo con AINE 24h previas a la extracción |
| 2. Tratamiento quirúrgico previo sobre la cadera afecta |
| 3. Antecedentes de VHB (excepto personas que resulten negativas al antígeno de superficie (AgHBs) con inmunidad demostrada, marcadores positivos para VHC, marcadores positivos para VIH, marcadores positivos para HTLV I/II |
| 4. Diabéticos, enfermedad cardíaca renal o hepática grave |
| 5 Alergia a ácido hialurónico, o AINE |
| 6. Historia de artropatía por cristales, artritis inflamatoria o artropatía neuropática |
| 7. Coxartrosis protusiva grave, antecedente de artritis infecciosa, deformidad excesiva (displasia acetabular, Perthes) |
| 8. Infección bacteriana activa en el momento de la inclusión o |
| alteraciones hemáticas o de coagulación |
| 9. Enfermedades autoinmunes (plaquetas al inicio <o=150.000 plaquetas/ml, Hemoglobina al inicio del estudio menor o igual a 125g/L en mujeres y 135 g/L en hombres) |
Con el objetivo de ser capaces de rechazar la hipótesis nula con una potencia estadística de al menos el 80%, con un nivel de significación del 5% y una confianza (1-α) del 95%, fue necesario incluir 33 pacientes en cada grupo. Adicionalmente, teniendo en cuenta un porcentaje estimado de pérdida por abandono de aproximadamente el 10%, se estimó necesario reclutar un total de 37 pacientes en cada grupo.
Variables a estudioSe recogieron las variables sociodemográficas de los pacientes (edad, sexo, peso, altura e índice de masa corporal, causa de coxartrosis, valoración radiográfica del grado de coxartrosis), antecedentes médicos y los resultados analíticos (hemograma de sangre periférica y hemograma de PRP). Se registraron: escala Harris Hip Score, EVA, WOMAC, respondedor-no responder (criterios OARSI, figura 1)9, consumo de analgesia (tipo, frecuencia y dosis diaria definida en cada visita. Se realizaron cultivos del preparado final de PRP. La OARSI en su guía de recomendaciones para el desarrollo de ensayos clínicos en osteoartrosis establece el ser «respondedor» o «no respondedor» a un tratamiento como indicador agregado de funcionalidad, valoración global y dolor para evaluar su eficacia9. Se considera respondedores a aquellos pacientes que presenten una mejoría ≥ 50% en el dolor o función o un cambio absoluto >20 puntos o si cumple 2/3 siguientes criterios; dolor, función o valoración global del paciente ≥ 20% o cambio absoluto de>10 puntos.
Protocolo de obtención y preparación de PRPEl método de obtención de PRP de forma manual mediante técnica abierta se realizó cumpliendo las garantías exigibles de calidad según el informe V1/23052013 de la AEMPS10 y el documento de Requisitos Técnicos y Condiciones Mínimas de La Hemodonación y de Los Centros y Servicios de Transfusión del Ministerio11.
El personal de enfermería obtuvo una muestra sanguínea (75ml) mediante punción en la fosa antecubital. Con esa muestra se obtuvo un hemograma de sangre periférica y en los 70ml restantes se añadieron 9ml de citrato sódico y se alicuotaron en 7 tubos estériles. El protocolo de preparación de PRP se basó en un sistema de centrifugación simple, pipeteo de capa plasmática y activación con cloruro cálcico. Se centrifugó a 100g durante 10 minutos (Allegra X22 Centrifuge ®). En campana de flujo y cumpliendo con todas las recomendaciones de asepsia, se seleccionó mediante técnica de pipeteo la fracción superior rica en plasma (2ml sobrenadante). De los 14ml de solución rica en plaquetas obtenido, 5ml se remitieron al análisis de hemograma, 2ml a cultivo y 1ml se congelaron a -80°c. Los 6ml restantes fueron los infiltrados al paciente.
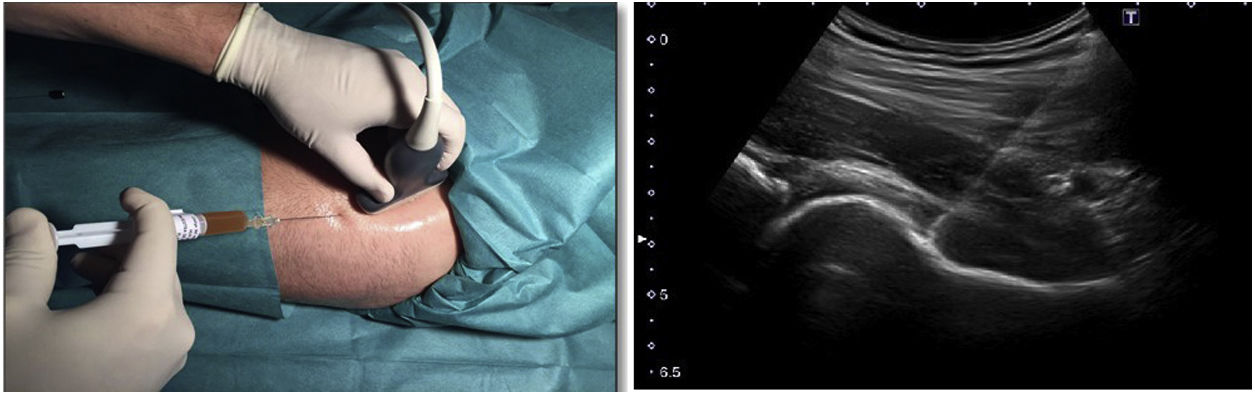
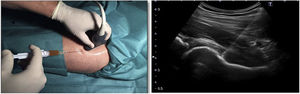
Protocolo de infiltración de caderaEn ambos grupos se realizó una infiltración de cadera ecoguiada mediante abordaje anterolateral (figura 2). Al grupo control se le inyectó 60mg/6ml de ácido hialurónico jeringa precargada (Hialano G-F, Synvisc-One ®) y al grupo intervención se le inyectó 6ml de plasma rico en plaquetas intraarticular (grupo PRP).
Análisis estadísticoEl análisis estadístico se realizó con la versión SPSS 15.0 (IBM, SPSS, Chicago, Illinois, Estados Unidos). Las variables categóricas se muestran como frecuencias y/o porcentajes y las cuantitativas como medianas/rangos intercuartílicos o media±DE. Para la comparación de variables cuantitativas se utilizó la prueba de t-Student o U de Man-Whitney en función de su ajuste o no a normalidad. En el caso de las variables categóricas se empleó el test Chi Square o el test exacto de Fisher. Para todos los cálculos se consideró estadísticamente significativo una p<0,05. Se realizó un análisis de la variable cualitativa de eficacia considerando la variable respondedor (sí o no), WOMAC, HHS y EVA, entre los dos grupos de tratamiento en cada visita. Para el estudio del análisis de tendencia se utilizó el test de Lamba de Wilks.
Para analizar la correlación entre la concentración de plaquetas y leucocitos con la respuesta clínica del paciente se utilizó el test de la correlación bivariada de Pearson o su alternativa no paramétrica (Rho de Spearman). Esta evaluación se hizo con la medición de la escala WOMAC, HHS, EVA, respondedor-no respondedor en todas las visitas en el grupo de tratamiento experimental (PRP).
Para evaluar los factores clínicos que influyeron en la respuesta clínica al tratamiento se analizó el efecto de las variables mediante el estudio multivariante de regresión logística.
Aspectos éticosEste trabajo se ha desarrollado tras la aprobación del comité ético, siguiendo las recomendaciones de la Declaración de Helsinki de 1964. Se ha obtenido consentimiento informado firmado de todos los pacientes incluidos.
Protección de los datos obtenidos en el ensayo clínicoEl contenido de los cuadernos de recogida de datos así como la confidencialidad de los datos de cada paciente ha sido respetada en todo momento. Se siguieron los procedimientos adecuados para asegurar el cumplimiento de lo recogido en la Ley Orgánica 15/99 de 13 de diciembre de Protección de Datos de Carácter Personal.
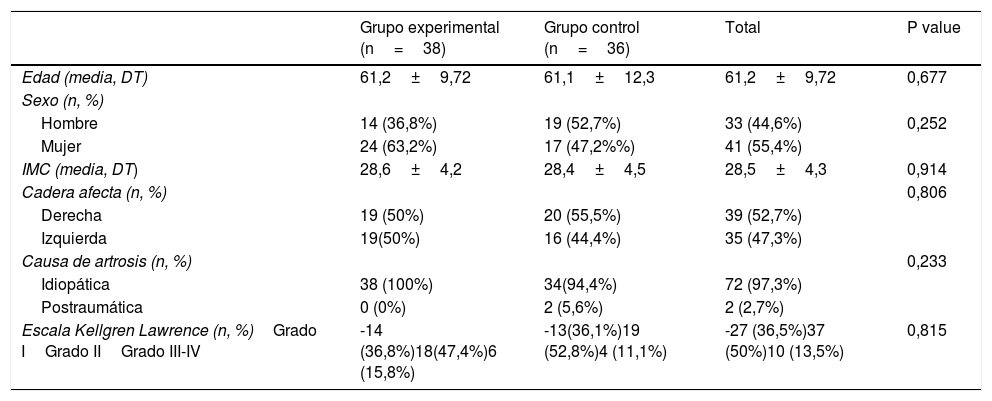
ResultadosEn el estudio se incluyeron un total de 74 pacientes, distribuyéndose en dos grupos: grupo experimental (PRP, 38 pacientes) y grupo control (AH, 36 pacientes). En la tabla 2 se describen las características basales de ambos grupos.
Análisis descriptivo de la población de estudio
| Grupo experimental (n=38) | Grupo control (n=36) | Total | P value | |
|---|---|---|---|---|
| Edad (media, DT) | 61,2±9,72 | 61,1±12,3 | 61,2±9,72 | 0,677 |
| Sexo (n, %) | ||||
| Hombre | 14 (36,8%) | 19 (52,7%) | 33 (44,6%) | 0,252 |
| Mujer | 24 (63,2%) | 17 (47,2%%) | 41 (55,4%) | |
| IMC (media, DT) | 28,6±4,2 | 28,4±4,5 | 28,5±4,3 | 0,914 |
| Cadera afecta (n, %) | 0,806 | |||
| Derecha | 19 (50%) | 20 (55,5%) | 39 (52,7%) | |
| Izquierda | 19(50%) | 16 (44,4%) | 35 (47,3%) | |
| Causa de artrosis (n, %) | 0,233 | |||
| Idiopática | 38 (100%) | 34(94,4%) | 72 (97,3%) | |
| Postraumática | 0 (0%) | 2 (5,6%) | 2 (2,7%) | |
| Escala Kellgren Lawrence (n, %)Grado IGrado IIGrado III-IV | -14 (36,8%)18(47,4%)6 (15,8%) | -13(36,1%)19 (52,8%)4 (11,1%) | -27 (36,5%)37 (50%)10 (13,5%) | 0,815 |
De los pacientes incluidos, 9 (12,1%) se encontraban en lista de espera quirúrgica de los cuales 3 (33,3%), todos pertenecientes al grupo experimental, finalmente decidieron no intervenirse por mejoría franca.
Para evaluar la eficacia, se utilizaron escalas validadas internacionalmente tanto de dolor como de funcionalidad. Así mismo, en lugar de controlar la analgesia se dejó abierta al paciente para evaluar su consumo utilizando las DDD descritas en el apartado de metodología. En nuestro estudio, ambos grupos de tratamiento presentaron mejoría tanto en escalas como en el consumo de analgesia.
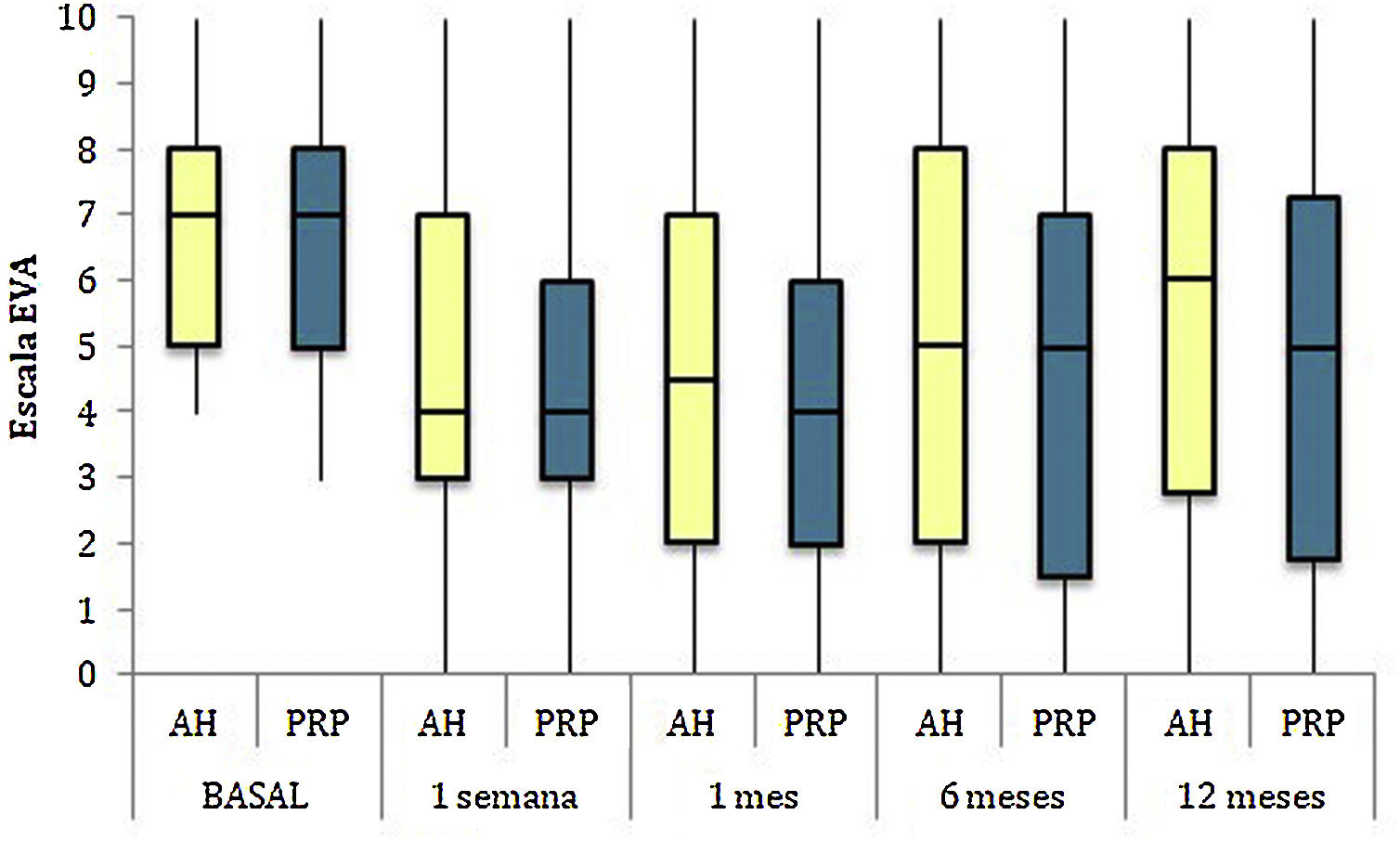
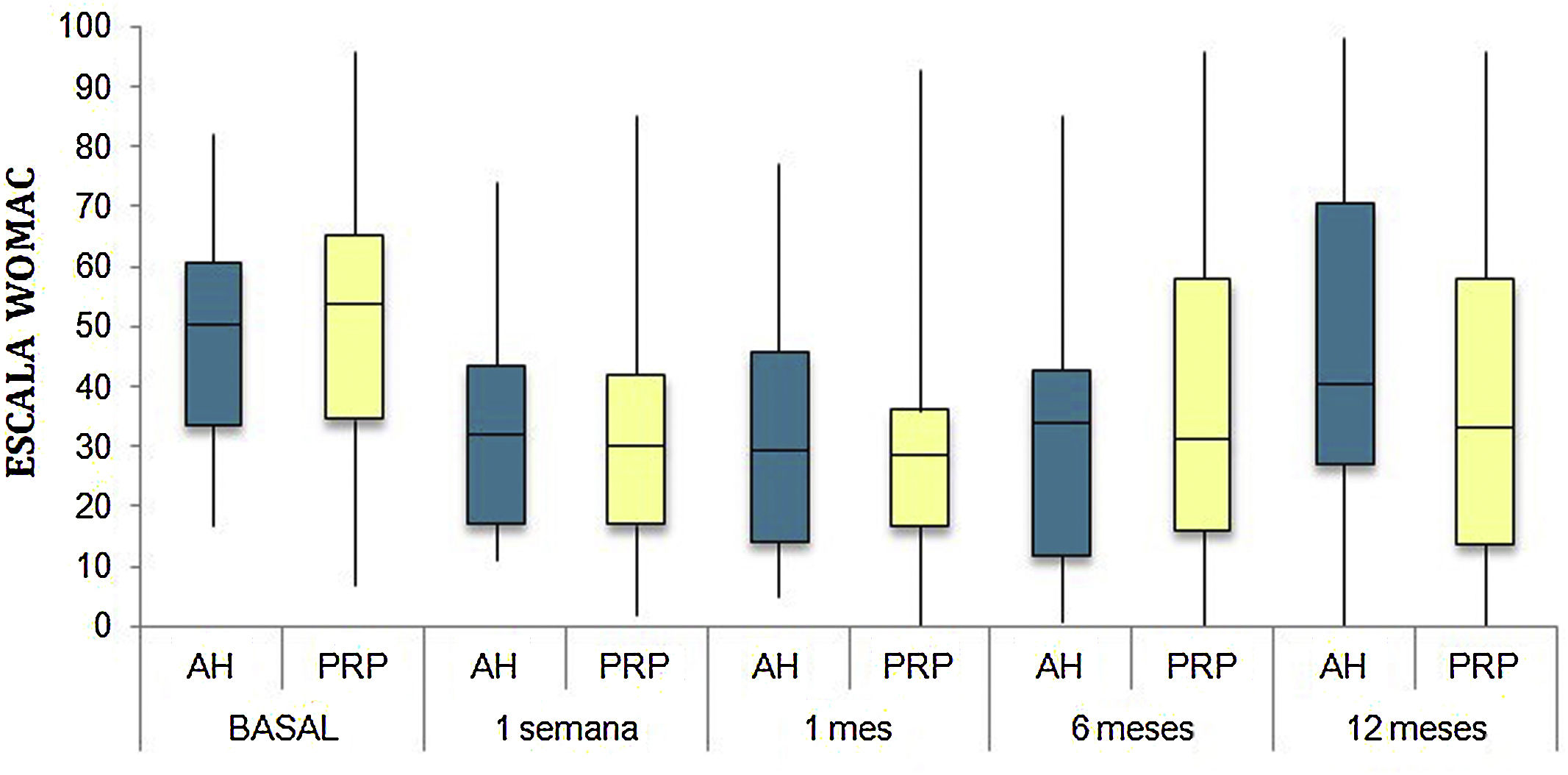
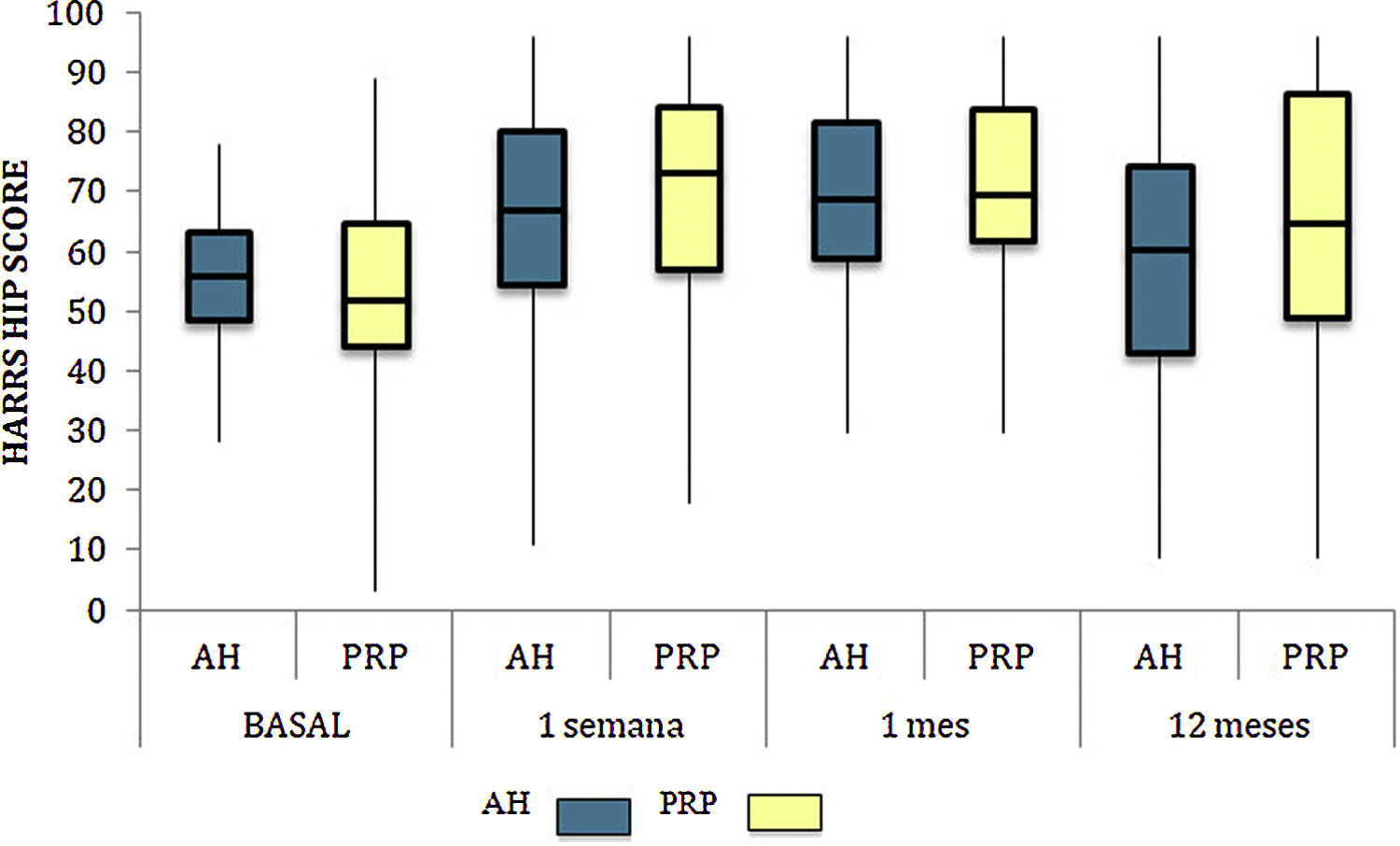
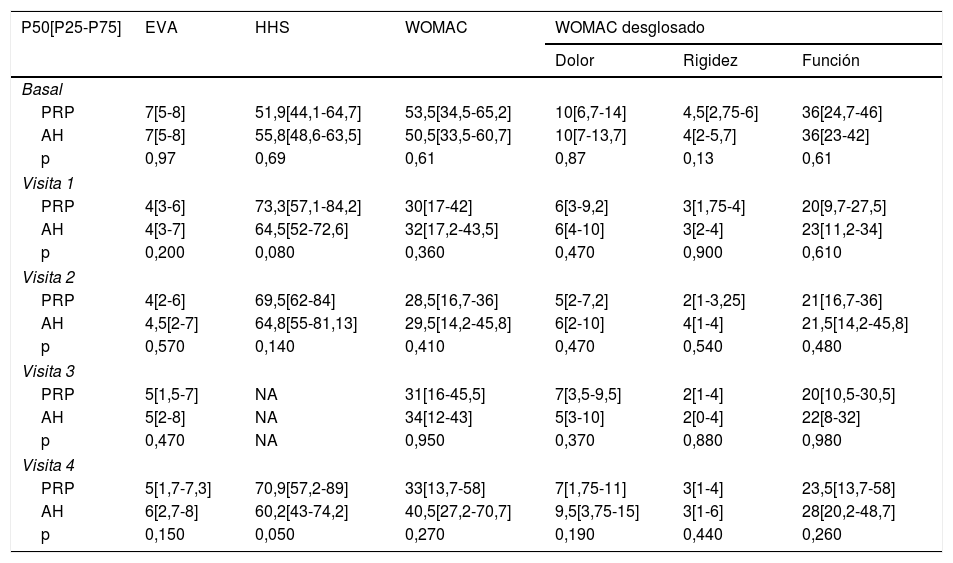
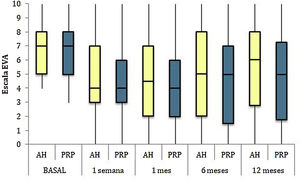
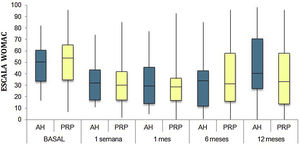
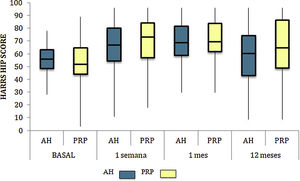
Las diferencias en las escalas al final del periodo (12 meses postinfiltración única) fueron significativamente mejores respecto a las basales de los dos grupos: WOMAC, HHS, EVA (figuras 3-5) (visita 12 meses-visita basal λ: 0,856 [VAS] p<0,01, 0,426 [HHS] p<0,01; 0,951 [WOMAC] p<0,01). Sin embargo, al comparar entre el grupo experimental y control, únicamente se hallaron diferencias estadísticamente significativas en la escala HHS a los 12 meses postratamiento (tabla 4, grupo PRP 70,9 [3,7-58] grupo AH 60,2[43-74,2] p<0,05). No se registró ningún efecto adverso.
Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC 0-100 puntos) para cada grupo de tratamiento durante seguimiento de 12 meses. Diagrama de cajas y bigotes. La línea horizontal representa la mediana, los límites de la caja representan los cuartiles y las barras de error representan el 95% IC. AH: ácido hialurónico; PRP: plasma rico en plaquetas.
Harris Hip Score (HHS; 0-100 puntos) para cada grupo de tratamiento durante seguimiento de 12 meses. Diagrama de cajas y bigotes. La línea horizontal representa la mediana, los límites de la caja representan los cuartiles y las barras de error representan el 95% IC. AH: ácido hialurónico; PRP: plasma rico en plaquetas.
Resultados de las escalas clínicas y funcionales
| P50[P25-P75] | EVA | HHS | WOMAC | WOMAC desglosado | ||
|---|---|---|---|---|---|---|
| Dolor | Rigidez | Función | ||||
| Basal | ||||||
| PRP | 7[5-8] | 51,9[44,1-64,7] | 53,5[34,5-65,2] | 10[6,7-14] | 4,5[2,75-6] | 36[24,7-46] |
| AH | 7[5-8] | 55,8[48,6-63,5] | 50,5[33,5-60,7] | 10[7-13,7] | 4[2-5,7] | 36[23-42] |
| p | 0,97 | 0,69 | 0,61 | 0,87 | 0,13 | 0,61 |
| Visita 1 | ||||||
| PRP | 4[3-6] | 73,3[57,1-84,2] | 30[17-42] | 6[3-9,2] | 3[1,75-4] | 20[9,7-27,5] |
| AH | 4[3-7] | 64,5[52-72,6] | 32[17,2-43,5] | 6[4-10] | 3[2-4] | 23[11,2-34] |
| p | 0,200 | 0,080 | 0,360 | 0,470 | 0,900 | 0,610 |
| Visita 2 | ||||||
| PRP | 4[2-6] | 69,5[62-84] | 28,5[16,7-36] | 5[2-7,2] | 2[1-3,25] | 21[16,7-36] |
| AH | 4,5[2-7] | 64,8[55-81,13] | 29,5[14,2-45,8] | 6[2-10] | 4[1-4] | 21,5[14,2-45,8] |
| p | 0,570 | 0,140 | 0,410 | 0,470 | 0,540 | 0,480 |
| Visita 3 | ||||||
| PRP | 5[1,5-7] | NA | 31[16-45,5] | 7[3,5-9,5] | 2[1-4] | 20[10,5-30,5] |
| AH | 5[2-8] | NA | 34[12-43] | 5[3-10] | 2[0-4] | 22[8-32] |
| p | 0,470 | NA | 0,950 | 0,370 | 0,880 | 0,980 |
| Visita 4 | ||||||
| PRP | 5[1,7-7,3] | 70,9[57,2-89] | 33[13,7-58] | 7[1,75-11] | 3[1-4] | 23,5[13,7-58] |
| AH | 6[2,7-8] | 60,2[43-74,2] | 40,5[27,2-70,7] | 9,5[3,75-15] | 3[1-6] | 28[20,2-48,7] |
| p | 0,150 | 0,050 | 0,270 | 0,190 | 0,440 | 0,260 |
Respecto al consumo de analgesia, medido como la dosis diaria definida, presentó un descenso de la prescripción global de analgésicos en un 73,3% (visita inicial respecto visita final; grupo control del 62,9% en el grupo experimental del 84,2%, p>0,05) sin encontrar diferencias significativas.
Siguiendo las recomendaciones de la OARSI9 analizamos a los pacientes estableciendo si fueron «respondedores» o «no respondendedores» en cada visita. En todas las visitas se observaron mayor porcentaje de pacientes respondedores en el grupo experimental encontrando el nivel máximo de respondedores en ambos grupos al mes postratamiento sin diferencias estadísticamente significativas (respondedores PRP vs. AH: visita semana 1.°,76,3 vs. 61,6%; visita un mes: 81,6 vs. 69,4%; visita 6 meses: 73,7 vs. 58,3%; visita 12 meses: 64,7 vs. 44,1%, p>0,05).
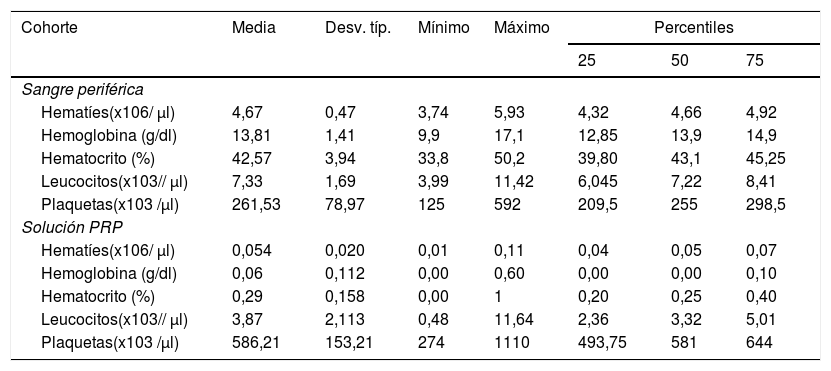
Los resultados analíticos de composición celular de las soluciones de PRP se detallan en la tabla 3. Según la clasificación de PAW obtuvimos una solución P2XB, según DEPA; DCA siendo la concentración media obtenida con nuestro protocolo de preparación de 586.216±153.208x 103plaquetas/μl.
Concentración celular en sangre periférica y solución de PRP en el grupo experimental
| Cohorte | Media | Desv. típ. | Mínimo | Máximo | Percentiles | ||
|---|---|---|---|---|---|---|---|
| 25 | 50 | 75 | |||||
| Sangre periférica | |||||||
| Hematíes(x106/ μl) | 4,67 | 0,47 | 3,74 | 5,93 | 4,32 | 4,66 | 4,92 |
| Hemoglobina (g/dl) | 13,81 | 1,41 | 9,9 | 17,1 | 12,85 | 13,9 | 14,9 |
| Hematocrito (%) | 42,57 | 3,94 | 33,8 | 50,2 | 39,80 | 43,1 | 45,25 |
| Leucocitos(x103// μl) | 7,33 | 1,69 | 3,99 | 11,42 | 6,045 | 7,22 | 8,41 |
| Plaquetas(x103 /μl) | 261,53 | 78,97 | 125 | 592 | 209,5 | 255 | 298,5 |
| Solución PRP | |||||||
| Hematíes(x106/ μl) | 0,054 | 0,020 | 0,01 | 0,11 | 0,04 | 0,05 | 0,07 |
| Hemoglobina (g/dl) | 0,06 | 0,112 | 0,00 | 0,60 | 0,00 | 0,00 | 0,10 |
| Hematocrito (%) | 0,29 | 0,158 | 0,00 | 1 | 0,20 | 0,25 | 0,40 |
| Leucocitos(x103// μl) | 3,87 | 2,113 | 0,48 | 11,64 | 2,36 | 3,32 | 5,01 |
| Plaquetas(x103 /μl) | 586,21 | 153,21 | 274 | 1110 | 493,75 | 581 | 644 |
El índice de concentración plaquetaria en el grupo de tratamiento de PRP fue de 2,22 con un rendimiento del 44,57%. La concentración media de leucocitos en la cohorte fue de 3,87±2,11 x 103 leucocitos/ μl.
Al estudiar las características de los pacientes respondedores y no respondedores, encontramos que los pacientes respondedores tenían concentraciones mayores de plaquetas con diferencias estadísticamente significativas (un mes postratamiento; no respondedores 449[438-578] x103 plaquetas/μl, respondedores 565 [481-666] x103 plaquetas/μl, p<0,044).
Al estudiar la correlación entre los valores analíticos y las escalas clínico-funcionales encontramos una correlación negativa (r=-0,359, p<0,029) entre los niveles de plaquetas y el EVA en la visita 6 meses aunque se trató de una correlación baja. Sin embargo, sí encontramos una correlación positiva alta entre las concentraciones de leucocitos y la subescala rigidez del WOMAC en los pacientes no respondedores en esa misma visita (r=0,748, p<0,013).
En el análisis multivariante realizado mediante regresión logística binomial, encontramos que la escala Kellgren-Lawrence de grados I-II se relaciona de forma independiente con la respuesta clínica en la visita a un mes (11,51 OR, IC 95% 2,34-50,65, p<0,03).
DiscusiónEl uso de los preparados de PRP están en auge en disciplinas tan heterogéneas como la medicina estética deportiva u odontología. Sin embargo, a pesar de su extendido uso la evidencia sobre su composición y eficacia clínica es muy limitada. En la literatura encontramos una elevada variabilidad en cuanto a la metolodología de preparación, posología e indicación4,5. Aunque de manera global se observa de forma consistente una tendencia a favor del uso de soluciones de PRP respecto a otros tratamientos5-7.
Parece lógico pensar que las condiciones de preparación (tiempo y velocidad de centrífugación, uso de activadores de plaquetas, procesos de congelación/descongelación, técnica abierta/cerrada) puedan alterar la composición del preparado final, de hecho, son muchos los trabajos que alertan de la enorme variabilidad que pueda aportar al medicamento final7,12–14. Esto sumado a la falta de estandarización en cuanto a su posología (número de infiltraciones, tiempo entre dosis, volumen a infiltrar) e indicaciones de uso hicieron que para este estudio quisieramos evaluar un nuevo preparado y correlacionarlo con resultados clínicos en pacientes con coxartrosis. Los resultados clínicos descritos hasta la fecha varían según el estudio. Así, Dallari et al.15 reportan diferencias en la escala WOMAC a dos y seis meses tras la infiltración con PRP y su comparador (ácido hialurónico) mientras que Battaglia et al.15 y Doria et al.16 comparten en sus estudios la ausencia de diferencias. Hasta la fecha existe un único metananálisis en coxartrosis publicado por Ye et al.17 en 2018 donde se incluyeron un total de 4 ensayos, el autor concluye que las infiltraciones con PRP muestran superioridad en la escala EVA en la primera visita tras el tratamiento (2 meses). En nuestro estudio encontramos diferencias significativas en la escala HHS al año de tratamiento y evidenciamos mejoría en las escala WOMAC y EVA pero sin diferencias significativas.
No ha sido objetivo de nuestro estudio una valoración del coste beneficio del uso del PRP en comparación con el ácido hialurónico u otro tipo de infiltraciones. Si bien es cierto, consideramos tras nuestra experiencia, que la elaboración del PRP en cámara de flujo presente en cualquier hospital representa un recurso desaprovechado actualmente que abarataría los costes y tendría un gran impacto económico en nuestro sistema de salud público.
El índice de respondedores descrito en los estudios de coxartrosis varía entre un 40% a los 6 meses (Sánchez et al.18) y un 21% a 12 meses (Dallari et al.14). En nuestro estudio, se han observado variaciones mayores en los mismos tiempos de evaluación (74% a los 6 meses, y 65% al año) y especialmente superiores (82%) al mes de tratamiento. Todo ello se ha acompañado de un descenso de la prescripción global de analgésicos en ambos grupos y una disminución de los procedimiento quirúrgicos programados, resultado en salud de gran relevancia no evaluado hasta la fecha en los estudios de PRP.
En el análisis multivariante de nuestro estudio encontramos que los grados I-II de Kellgren–Lawrence se correlacionaban de manera independiente con ser respondedor al mes 1 (11,51 OR, IC 95% 2,34-50,65, p<0,03). Estos datos concuerdan con los publicados por Dallari et al.14, que correlaciona positivamente la escala de Kellgren-Lawrence y los valores de EVA (r=0,392, p<0,04). En otras indicaciones; como en la gonartrosis, se corroboran estos resultados como es el estudio de Filardo et al.19 donde encuentra una tendencia favorable al tratamiento con PRP en aquellos pacientes con afectación radiológica menor o igual a 2 en la escala Kellgren-Lawrence.
La infiltración única de PRP preparada por técnica abierta a 100g durante 10 minutos activada con cloruro cálcico parece una práctica segura y efectiva para paciente con coxartrosis, en especial en aquellos pacientes con estadios radiológicos incipientes (grado 1-2 KL).
Está ampliamente descrito en la literatura la comparación de diferentes sistemas de preparación de PRP, cuantificando el rendimiento celular y en algunos casos la concentración de determinados factores de crecimiento y citoquinas13,14,19. Sin embargo, no está definida la correlación entre su concentración óptima y la eficacia clínica17–20. Sundman et al.21, afirman que la efectividad del PRP se debe atribuir al equilibrio metabólico entre el efecto anabólico de los factores de crecimiento y el catabólico de las citoquinas sumado a un adecuado ratio de concentración de plaquetas/leucocitos para obtener la regeneración tisular. En nuestro estudio se observa que los pacientes respondedores presentan una mayor concentración plaquetaria respecto a los no respondedores (grupo no respondedor 480,14±97,60 x103 plaquetas/ μl, respondedores 585,74±148,62 x103 plaquetas/ μl p<0,04). Además, encontramos una correlación negativa entre los valores de la escala EVA y la concentración plaquetaria (visita 3, r=-0,36, p<0,03) y una correlación positiva alta y significativa entre los resultados de la subescala rigidez del WOMAC y la concentración de leucocitos (r=0,75, p<0,01).
A la vista de estos resultados, defendemos el concepto de medicina personalizada como Doria et al.16 vaticinaban. Conocer la composición en elementos claves como son el ratio plaquetas/leucocitos, citoquinas y factores de crecimiento de la solución final de PRP según el perfil de pacientes (síndrome y tejido específico) nos permitiría seleccionar de forma más eficiente y dirigida a aquellos pacientes que se benefician de forma significativa con estos medicamentos autólogos.
Son necesarios más estudios como este que caractericen la composición del PRP y la correlacionen con la respuesta clínica para orientar al traumatólogo en el preparado idóneo según las características del paciente y su patología. A pesar de la limitación del tamaño muestral y siendo necesario validar este protocolo con un mayor número de pacientes, encontramos la máxima correlación de resultados clínicos favorables al adminitrar soluciones con una concentración mínima de 565 [481-666] x103 plaquetas/μl y pobres en leucocitos (>4,9 leucocitos x103/μl) por lo que se podría considerar un protocolo preliminar para pacientes en estadios iniciales de coxartrosis.
ConclusionesLas soluciones de PRP son tan eficaces y seguras como las de ácido hialurónico para el tratamiento de la artrosis de cadera en estadios iniciales. Su uso puede suponer una disminución del consumo de analgesia y de los tratamientos quirúrgicos. Las concentraciones celulares presentes en las soluciones de PRP se correlacionan con el resultado clínico-funcional. El facultativo debe conocer y tener en cuenta las características del producto final obtenido para poder garantizar el mejor resultado.
Nivel de evidenciaNivel de evidencia I.
FinanciaciónEl presente trabajo ha sido financiado por la Sociedad Española de Cirugía Ortopédica y Traumatología (Beca Investigación Fundación SECOT del 2014).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración en el análisis de los factores de crecimiento al Departamento de Química Analítica, Facultad de Ciencias del Instituto de Investigación Biomédica (IBS) de la Universidad de Granada.