Diagnóstico de infección protésica mediante biopsia intraoperatoria por congelación (BIPC)
Diagnosis of prosthetic infection by intraoperative freezing biopsy
LEÓN GARCÍA-VAO, A.*; MONLLAU GARCÍA, J. C.*; HINAREJOS GÓMEZ, P.*; TEY PONS, M.*; MARQUÉS LÓPEZ, F.*; DOMÍNGUEZ SOLÁ, D.**, y BALLESTER SOLEDA, J.*
Servicio de Cirugía Ortopédica y Traumatología. (Prof. J. Ballester.) ** Servicio de Anatomía Patológica. (Prof. S. Serrano.) Hospital del Mar. Universitat Autónoma de Barcelona. Barcelona.
Correspondencia:
Dr. A. LEÓN GARCÍA-VAO.
Servicio de COT.
Hospital del Mar.
Passig Marítim, 25-29.
08003 Barcelona.
Recibido: Enero de 1999.
Aceptado: Junio de 1999.
RESUMEN: La exploración clínica y las pruebas complementarias, pese a sus altos niveles de sensibilidad y especificidad, no siempre permiten diferenciar con certeza los aflojamientos protésicos sépticos de los asépticos. Experiencias previas sugieren que el recuento de leucocitos polimorfonucleares en biopsias intraoperatorias por congelación puede mejorar la fiabilidad del diagnóstico. Se presenta la experiencia con esta técnica en una serie de 40 recambios intervenidos entre los años 1995 y 1998. Considerando infección el hallazgo de uno o más polimorfonucleares por cada 10 campos de aumento se obtuvieron unos valores de fiabilidad del 85%, con sensibilidad del 100% y especificidad del 79%. Aunque persisten dudas acerca del número idóneo de polimorfonucleares que certifican el diagnóstico de infección, estos resultados sugieren que esta técnica puede contribuir al diagnóstico diferencial entre aflojamientos sépticos y asépticos en la cirugía de revisión protésica.
PALABRAS CLAVE: Prótesis. Infección. Diagnóstico. Biopsia por congelación. Recuento celular. Polimorfonucleares.
ABSTRACT: Clinical examinations and complementary tests, although highly sensitive and specific, do not always allow septic and aseptic prosthetic loosening to be safely differentiated. Prior experience suggests that the polymorphonuclear cell count in frozen intraoperative biopsy can improve diagnostic reliability. We report our experience with this technique in a series of 40 replacements made between 1995 and 1998. Infection defined as the presence of 1 or more polymorphonuclear cells per 10 enlargement fields had a reliability of 85%, 100% sensitivity and 79% specificity. Although there is some doubt about the ideal number of polymorphonuclear cells required to confirm a diagnosis of infection, these results suggest that this technique may facilitate the differential diagnosis of septic and aseptic loosening in prosthetic revision surgery.
KEY WORDS: Prosthesis. Infection diagnosis. Frozen biopsy. Cell count. Polymorphonuclear cells.
Una de las complicaciones más graves de la cirugía protésica es la infección. Aunque su incidencia se ha reducido progresivamente en los últimos 30 años hasta llegar a ser menor del 1%,3,22 el problema sigue siendo importante debido al número creciente de artroplastias que se realizan.
El diagnóstico diferencial entre aflojamiento séptico y aséptico es fundamental tanto para elegir el tratamiento adecuado como para emitir un pronóstico sobre la evolución. Algunos pacientes con aflojamiento séptico llegan al quirófano sin tener un diagnóstico de seguridad debido a que la sospecha clínica y las pruebas complementarias habitualmente utilizadas --radiología,2,5 gammagrafía,7,13 analítica19,21 y punción articular2,4,9,10,15-- no ofrecen valores de sensibilidad y especificidad de certeza, no existiendo un protocolo diagnóstico universalmente aceptado. Estudios previos1,11,18 sugieren que el recuento de leucocitos polimorfonucleares (PNM) en biopsias intraoperatorias procesadas por congelación (BIPC) puede ser útil para identificar la infección oculta en la cirugía de revisión de artroplastias de cadera o de rodilla.
El propósito del presente trabajo fue analizar de forma prospectiva la fiabilidad de esta técnica en nuestro hospital con el objetivo de ayudar al cirujano a decidir intraoperatoriamente la conducta a seguir en el reducido número de pacientes con sospecha de infección protésica no confirmada preoperatoriamente.
Material y Método
Entre Julio de 1995 y Mayo de 1998 se efectuaron en nuestro Servicio 40 recambios protésicos (15 de cadera y 25 de rodilla). En 16 de ellos existía sospecha de aflojamiento séptico según criterios clínicos, radiológicos, gammagráficos y cultivos de líquido articular. El examen clínico buscaba la presencia de episodios febriles o drenaje de la herida, la aparición de dolor y la pérdida de funcionalidad. Sólo en el caso de supuración previa se consideraba diagnóstico de infección. La radiología era considerada altamente sospechosa en el caso de aparecer zonas de osteolisis, irregularidades o pérdidas óseas. Asimismo, la positividad de la gammagrafía ósea con tecnecio-99m y la gammagrafía con leucocitos marcados con 111In, era considerado como muy sugestivo de infección cuando las áreas de captación coincidían en ambas.
Se realizó aspiración y cultivo en los 22 pacientes con recambio de prótesis de rodilla y en los cinco pacientes intervenidos de recambio de cadera que habían presentado un episodio de supuración de la herida postoperatoria, realizándose por métodos convencionales de identificación de gérmenes. En todos los casos se realizó cultivo de fragmento de tejido obtenido durante la intervención. Independientemente de los resultados de estas biopsias, los pacientes con sospecha de infección fueron tratados con antibióticos y recambiados en dos tiempos. En todos los casos se practicaron BIPC, en los de sospecha de infección para confirmar la etiología séptica del proceso y en el resto para evaluar la fiabilidad del método.
La edad media de los pacientes en el momento de la intervención fue de 68 años, siendo las dos terceras partes de la muestra mujeres y el resto varones. Las indicaciones de la primera artroplasia habían sido, en las de cadera: artrosis en 13 casos y fractura en dos, mientras que en las artroplastias de rodilla 21 fueron por artrosis y cuatro por artritis reumatoide. El tiempo medio de supervivencia del implante fue de 59 meses (mínimo: 6 y máximo: 247 meses).
Aunque la técnica de BIPC fue inicialmente descrita por Mirra y cols.,14 se siguió el procedimiento más recientemente propugnado por Athanasou y cols.1 La metodología consistió en la toma de al menos dos muestras biópsicas para estudio histológico procedentes de cápsula articular y membrana de interfaz prótesis-hueso en el momento de la revisión quirúrgica. Las muestras eran remitidas inmediatamente al laboratorio de anatomía patológica, donde se procedía a su congelación con isopentano tras inmersión de la muestra en OCT (nitrógeno líquido), a su corte en secciones de tres micras y tinción con hematoxilina-eosina. Seguidamente se buscaban las áreas de máximo infiltrado inflamatorio y se efectuaba el recuento a 400 aumentos de PMN y células plasmáticas.
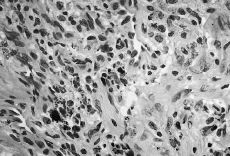
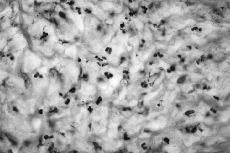
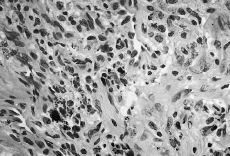
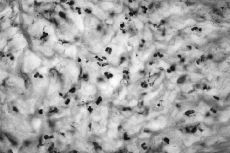
Atendiendo al número de PMN encontrados los resultados se agruparon en cuatro categorías o grupos tal como se detalla en la Tabla 1, considerándose aflojamientos sépticos los Grupos 1 al 3 (Figs. 1 y 2). En ausencia de enfermedad reumática el hallazgo de células plasmáticas también se consideró criterio de infección. Las muestras volvieron a ser estudiadas postoperatoriamente de forma convencional mediante fijación con formol, inclusión en parafina y tinción con hematoxilina-eosina, efectuándose a continuación un nuevo recuento de PMN. También se remitieron al laboratorio de microbiología muestras de líquido sinovial y tejido de la cápsula articular para cultivo en medios aerobio y anaerobio.
Tabla 1. Categorización histológica de los resultados atendiendo al recuento celular (criterios de Athanasou y cols.1). |
| -- Grupo 0: ausencia de células. |
| -- Grupo 1: una célula por cada 10 campos. |
| -- Grupo 2: una a cinco células por campo. |
| -- Grupo 3: más de cinco células por campo. |
Figura 1. Preparación histológica (tinción hematoxilina-eosina) a 400* de biopsia intraoperatoria por congelación con presencia de abundantes polimorfonucleares (Grupo 3).
Figura 2. Preparación histológica (tinción hematoxilina-eosina) a 400* de biopsia intraoperatoria por congelacióin en la que no se observan leucocitos polimorfonucleares (Grupo 0).
Resultados
Del total de 40 casos estudiados, los datos de historia clínica y exploración física fueron recogidos en todos ellos. La gammagrafía se realizó en 36 casos y el cultivo en 27 (22 rodillas con aspirado de líquido articular y cinco caderas con supuración de la herida quirúrgica). La biopsia intraoperatoria por congelación se realizó en 40 casos.
Los resultados obtenidos en el presente trabajo se exponen en la Tabla 2. En el grupo de pacientes con sospecha de fracaso mecánico, 22 BIPC resultaron negativas, mientras que dos fueron positivas, catalogadas como Grupo 1. La biopsia convencional posterior fue negativa en 23 pacientes y positiva en uno (Grupo 1), que también había resultado positivo con la BIPC. Los cultivos resultaron negativos en todos los casos. En los pacientes con sospecha preoperatoria de infección los BIPC mostraron criterios de infección en todos los casos, correspondiendo a los Grupos 2 y 3 (Tabla 3), y el recambio protésico se efectuó en dos tiempos. Las biopsias convencionales realizadas posteriormente resultaron también positivas en todos los casos. En 12 pacientes se obtuvieron cultivos que identificaban el agente causal, mientras que en cuatro no se consiguió recuperar germen alguno.
Tabla 2. Distribución de pacientes según sospecha de infección y resultado del recuento de PMN en biopsia por congelación. | |||
| PMN+ | PMN | N.° casos | |
| Sospecha de infección | 16 | 00 | 16 |
| No sospecha de infección | 2 | 22 | 24 |
| PMN: Polimorfonucleares. | |||
| Tabla 3. Distribución de pacientes en grupos según los criterios histológicos de recuento celular. | |||||
| 0 | 1 | 2 | 3 | n | |
| Sospecha de infección | 00 | 0 | 4 | 12 | 16 |
| No sospecha de infección | 22 | 2 | 0 | 00 | 24 |
La evolución posterior de estos recambios ha sido satisfactoria en 39 pacientes y mala en el otro. Hasta la fecha los aflojamientos que fueron considerados como asépticos no han mostrado signo alguno de infección posterior, incluidos los dos casos positivos en las BIPC (falsos positivos). En los pacientes catalogados como sépticos y recambiados en dos tiempos sólo uno ha presentado una recidiva de la infección, que obligó a la extracción definitiva de la prótesis.
Los resultados obtenidos con la BIPC y otras exploraciones aparecen en las Tablas 4 y 5, en las que destaca sobre todo la alta sensibilidad y valor predictivo negativo de esta prueba.
Tabla 4. Sensibilidad, especificidad, fiabilidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) para el diagnóstico de infección. | |||||
| Sensibi- lidad | Especi- ficidad | VPP | VPN | Fiabi- lidad | |
| Historia | 69 | 96 | 92 | 82 | 85 |
| (11/16) | (23/24) | (11/12) | (23/28) | (34/40) | |
| Gammagrafía | 93 | 59 | 59 | 93 | 72 |
| (13/14) | (13/22) | (13/22) | (13/14) | (26/36) | |
| Cultivo preoperatorio 85 | 75 | 93 | 90 | 82 | |
| (9/12) | (14/15) | (9/10) | (14/17) | (23/27) | |
| Biopsia intraoperatoria | 100 | 79 | 67 | 100 | 85 |
| (12/12) | (22/28) | (12/18) | (22/22) | (34/40) | |
| Los resultados están expresados como porcentajes (proporción de todos los casos). | |||||
Tabla 5. Distribución de pacientes según cultivo y resultado del recuento de PMN en biopsia por congelación. | ||
| PMN+ | PMN | |
| Cultivo positivo | 12 | -- |
| Cultivo negativo | 6 | 22 |
| PMN: Polimorfonucleares. | ||
Discusión
En general, el diagnóstico diferencial entre aflojamiento protésico séptico y aséptico es posible atendiendo a la clínica y sobre todo a las exploraciones complementarias habituales. Sin embargo, en un determinado número de casos como son las infecciones subagudas o de Tipo 2 de la clasificación de Fitzgerald y Coventry,6 el diagnóstico puede ser muy difícil de realizar.11 Los parámetros de laboratorio habitualmente monitorizados en las sospechas de infección, velocidad de sedimentación globular y proteína C reactiva no son totalmente específicos y pueden alterarse en procesos como neoplasias y reumatismos y también en otras patologías agudas y crónicas. Globalmente considerados, sus porcentajes de sensibilidad y especificidad oscilan entre el 60 y 96%.19,21-23 Del mismo modo, la radiología convencional puede presentar imágenes tales como pérdidas óseas, osteolisis e irregularidades endósticas que cuando son rápidamente evolutivas son indicativas de infección.5,8,12 La neoformación ósea perióstica con o sin aflojamiento de los componentes ha sido considerada como muy sugestiva de infección.5 Sin embargo, todas estas lesiones también pueden aparecer en otros procesos asépticos y, por el contrario, es posible la infección sin ninguno de estos signos radiológicos hasta en un 40% de los casos.21 La gammagrafía de leucocitos marcados con Indio-111 se ha revelado como un buen método para el diagnóstico de aflojamiento séptico, con una sensibilidad del 90% y una especificidad entre el 80 y 90%,7,13,16,25,26 especialmente cuando se usa de forma seriada y en combinación con tecnecio-99m.22 Por último, la punción articular, probablemente el procedimiento más específico, sólo consigue aislar el organismo causal en dos terceras partes de los casos en la mayoría de las series,12,4,9,10,15,17,19,20,22,23 mientras que presenta una elevada tasa de falsos positivos debidos a contaminación por flora saprofita cutánea.11
Mirra y cols.14 advirtieron por primera vez la relación existente entre la magnitud del infiltrado de células inflamatorias de fase aguda observado en BIPC y la presencia de infección protésica, situación corroborada por otros autores.1,11,22 Sin embargo, existe todavía controversia en los criterios de infección tanto respecto al número de células necesario para el diagnóstico como al tipo de campo de gran aumento utilizado. En ocasiones el patólogo tiene dificultades para asegurar que la célula observada en la BIPC es un PMN debido al espesor de los cortes, al artefacto citológico inducido por el proceso de congelación y a la posible superposición de células.1,11,14,22 Por otra parte, es conocido que el área cubierta por los campos de gran aumento varía en función del microscopio utilizado. Ambos factores podrían contribuir a explicar los falsos positivos que en ocasiones ofrece el método, por lo que, como otros autores, pensamos en la conveniencia de considerar criterio de infección la existencia de más de cinco células por campo (Grupos 2 y 3). Con este proceder en nuestra serie, como en otras precedentes,11 se hubieran evitado los casos de falso positivo.
Al estudiar la sensibilidad y especificidad de las distintas pruebas realizadas, destaca que la historia clínica y el cultivo preoperatorio son pruebas muy específicas, pero poco sensibles, mientras que la gammagrafía y la BIPC son pruebas de alta sensibilidad. La especificidad en nuestra serie, en cambio, ofrece unos valores no excesivamente elevados, pensamos que debido en parte a los fasos negativos en el cultivo intraoperatorio, que es el patrón que hemos tomado como diagnóstico definitivo de infección.
En nuestro medio la técnica de recuento de PNM en BIPC ha obtenido unos resultados comparables a los de series previamente publicadas.1,11,18,22 Si bien existe controversia en la determinación exacta del umbral de infección, la elevada sensibilidad y el valor predictivo negativo de nuestra serie (100%) sugieren que las BIPC tienen utilidad para descartar la existencia de infección protésica. Por otra parte, el coste económico es mínimo y la técnica en general es fácil de llevar a cabo, contando con la colaboración de un único patólogo para evitar las diferencias interobservadores previamente constatadas.22 El reducido volumen de nuestra serie no permite responder a cuestiones tales como cuánto tiempo tardan en negativizarse las BIPC tras una infección protésica y, por consiguiente, qué valor tiene el procedimiento en el segundo tiempo de un recambio. La investigación futura debería contribuir a resolver estas preguntas.
Bibliografía
1.Athanasou, NA; Pandey, R; De Steiger, R; Crook D, y Mclardy, P: Diagnosis of infection by frozen sections during revision arthroplaty. J Bone Joint Surg, 77B: 28-33, 1995.
2.Barrack RI, y Harris, WH: The value of aspirarion of the hip joint before revision total hip arthroplasty. J Bone Joint Surg, 75A: 66-76, 1993.
3.Charnley, JR: A clean-air operating enclosure. British J Surg, 51: 202-205, 1964.
4.Fehring, TK, y Cohen, B: Aspiration as a guide to sepsis in revision total hip arthroplasty. J Arthroplasty, 11: 543-547, 1996.
5.Fitzgerald, RH, Jr: Total hip arthroplasty sepsis. Prevention and diagnosis. Orthop Clin North Am, 23: 259-264, 1992.
6.Fitzgerald, RH, Jr; Nolan, DR; Ilstrup, DM; Van Scoy, RE; Washington, JA, y Coventry, MB: Deep wound sepsis following total hip arthroplasty. J Bone Joint Surg, 59A: 847-855, 1977.
7.Glithero, PR; Grigoris, P; Harding, LK; Hesslewood, SR, y Mcminn, DW: White cells scans and infected joint replacements. Failure to detect chronic infection. J Bone Joint Surg, 75B: 371-374, 1993.
8.Huddleston, HD: Femoral lysis after cemented hip arthroplasty. J Arthroplasty, 3: 285-297, 1988.
9.Kraemer, WJ; Saplys, R; Waddell, JP, y Morton, J: Bone scan, gallium scan and hip aspiration in the diagnosis of infected total hip arthroplasty. J Arthroplasty, 8: 611-616, 1993.
10.Lachiewicz, PF; Rogers, GD, y Thomason, HC: Aspiration of the hip joint before revision total hip arthroplasty. Clinical and laboratory factors influencing attainment of a positive culture. J Bone Joint Surg, 78A: 749-754, 1996.
11.Lonner, JH; Dessai, P; Dicesare, PE; Steiner, G, y Zuckerman, JD: The reliability of analysis of intraoperative frozen sections for identifying active infection during revision hip or knee arthroplaty. J Bone Joint Surg, 78A: 1553-1558, 1996.
12.Lyons, CW; Berquist, TH; Lyons, JC; Rand, JA, y Brown, ML: Evaluation of radiographic findings in painful hip arthroplasties. Clin Orthop, 195: 239-251, 1985.
13.Merkel, KD; Brown, ML; Dewanjee, MK, y Fitzgerald, RH, Jr: Comparison of indium-labeled leukocyte imaging with sequential technetium-gallium scanning in the diagnosis of low-grade musculoskeletal sepsis. A prospective study. J Bone Joint Surg, 67A: 465-476, 1985.
14.Mirra, JM; Harlam, C; Amstutz, HC; Matros, M, y Gold, R: The pathology of the joint tissues and its clinical relevance in prosthesis failure. Clin Orthop, 117: 221-240, 1976.
15.Mulcahy, DM; Fenelon, GC, y Mcinerney, DP: Aspiration arthrography of the hip joint. Its uses and limitations in revision hip surgery. J Arthroplasty, 11: 64-68, 1996.
16.Oyen, WJ; Van Horn, JR; Clessens, RA; Slooff, TJ; Van der Meer, JW, y Corstens, FH: Diagnosis of bone, joint and joint prosthesis with In-111-labeled nonspecific human immunoglobulin G scintigraphy. Radiology, 182: 195-199, 1992.
17.Phillips, WC, y Kattapuram, SV: Efficacy of preoperative hip aspiration performed in the radiology department. Clin Orthop, 179: 141-146, 1983.
18.Pons, M; Anglés, F; Sánchez, C; Matamala, A; Cuchi, E; Salavert, M; Forcada, P, y Ferrer, H: Infected total hip arthroplasty. The value of intraoperative histology. Int Orthop (SICOT), 23: 34-36, 1999.
19.Roberts, P; Walters, AJ, y Mcminn, DJW: Diagnosis infection in hip replacements. The use of fine-needle aspiration and radiometric culture. J Bone Joint Surg, 74B: 265-271, 1992.
20.Sanado Lampreave, L; Vega Encina, I; Romeo Ramírez, J; Arenas Aguirregoitia, C; Elorragiaga García, R, y Rojo López, J: Escaso valor de los cultivos de drenaje como predictores de infección en las artroplastias de cadera y rodilla. Rev Ortop Traumatol, 42: 386-388, 1998.
21.Sanzen, L, y Carlsson, AS: The diagnosis value of C-reactive protein in infected total hip artroplasties. J Bone Joint Surg, 71B: 638-641, 1989.
22.Spangehl, MJ; Younger, ASE; Masri, BA, y Duncan, CP: Diagnosis of infection following total hip arthroplasty. J Bone Joint Surg, 79A: 1578-1588, 1997.
23.Tigges, S; Stiles, RG; Meli, RJ, y Roberson, JR: Hip aspiration: A cost affective and accurate method of evaluating the potentially infected hip prosthesis. Radiology, 189: 485-488, 1993.
24.Thoren, B, y Wigren, A: Erythrocyte sedimentation rate in infection of total hip replacements. Orthopedics, 14: 495-497, 1991.
25.Wegener, WA; Velchik, MG; Weiss, D; Ter, S; Byars, A; Neptune, M, y Alavi, A: Infectious imaging with indium-111-labeled nonspecific polyclonal human immunoglobulin. J Nucl Med, 32: 2079-2085, 1991.
26.Wukich, DJ; Abreu, SH; Callaghan, JJ; Van Nostrand, D; Savory, GG; Eggli, DF; García, JE, y Berrey, BH: Diagnosis of infection by preoperative scintigraphy with indium-labeled white blood cells. J Bone Joint Surg, 69A: 1353-1360, 1987.