REVISTA DE ORTOPEDIA Y TRAUMATOLOGÍA
Volumen 42, pp 219-224
© 1996 EDITORIAL GARSI
Cirugía reconstructora protésica en tumores malignos
de la extremidad proximal del húmero
D. MIFSUT MIEDES y J. PARDO MONTANER
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario La Fe. Valencia.
Correspondencia:
Dr. D. MIFSUT MIEDES.
Trasagrario, 7, 2.°
46687 Albalat de la Ribera (Valencia).
En Redacción: Mayo de 1997.
RESUMEN: Desde 1986 hasta 1996 se han intervenido nueve pacientes por tumores óseos malignos de la extremidad proximal del húmero utilizando una prótesis tumoral para la reconstrucción del defecto óseo ocasionado. La supervivencia media de estos casos ha sido de 2 años y 10 meses, habiendo en el momento actual tres pacientes vivos. El resultado funcional ha sido satisfactorio en estos tres casos, sobre todo en cuanto a la mejoría del dolor, la aceptación emocional y la destreza manual. Las principales complicaciones han sido la infección, la recidiva local y la rotura del implante.
PALABRAS CLAVE: Hombro. Húmero. Tumores óseos. Artroplastia.
PROSTHETIC RECONSTRUCTIVE SURGERY FOR MALIGNANT TUMORS OF THE PROXIMAL HUMERUS
ABSTRACT: From 1986 to 1996, nine patients underwent surgery for malignant bone tumors of the proximal humerus in which a prosthesis was used to repair the bone defect. The mean survival of these patients was 2 years and 10 months. At present three patients are alive and all have a satisfactory functional result, particularly in terms of pain relief, emotional acceptance, and manual dexterity. The main complications have been infection, local recurrence, and implant rupture.
KEY WORDS: Humerus. Shoulder. Bone tumors. Arthroplasty.
Después de la rodilla y la cadera el húmero es el lugar donde asientan con mayor frecuencia los tumores óseos primarios.17 La resección de un tumor de la porción proximal del húmero se presenta al cirujano como un desafío para preservar la función y morfología de la extremidad sin comprometer el grado de recidiva local,8,14 de este modo tanto las lesiones primarias humerales proximales como las metástasis pueden ser tratadas mediante fijación intramedular con metilmetacrilato seguido de irradiación y las lesiones benignas pueden tratarse con procedimientos intralesionales como el curetaje e injerto óseo.17 Las lesiones de bajo grado y algunos tumores benignos permiten su reconstrucción con preservación del mecanismo abductor, mientras que los tumores de alto grado de malignidad (estadios IIB, III de Enneking) se tratan mediante resección amplia o amputación. Además, los sarcomas que se producen en este área, incluyendo las lesiones de alto grado tales como los osteosarcomas, tienen una baja tasa de recidiva local y una mayor supervivencia en su conjunto.8,20
En 1928, Linberg18 describió una técnica de resección mediante la extirpación en bloque de la escápula, la clavícula y la parte proximal del húmero con preservación de la mano y del antebrazo. La suspensión de la extremidad remanente se conseguía mediante el anclaje del tendón del bíceps al periostio de la costilla o al remanente del músculo pectoral mayor. Linberg atribuyó a Tikhoff el desarrollo de esta técnica, que se propuso en sustitución de la amputación del cuarto anterior (amputación interescapulotorácica). La resección de TikhoffLinberg daba un mal resultado funcional,19,23,25por lo que surgieron modificaciones a la misma.22 Con la llegada de nuevas tecnologías ortopédicas las opciones de reconstrucción del defecto esquelético creado por la resección de la parte proximal del húmero se han visto incrementadas; así, se pueden utilizar las artrodesis,13las prótesis metálicas o de cerámica,2,3,24,25 los aloinjertos osteoarticulares,6,13,14 los injertos autólogos9 y las combinaciones de aloinjertos y prótesis.26
El objetivo del presente trabajo ha sido evaluar los resultados obtenidos con la utilización de prótesis tumorales en dicha reconstrucción, teniendo en consideración las escasas publicaciones existentes
en referencia al citado tipo de cirugía.
Material y Método
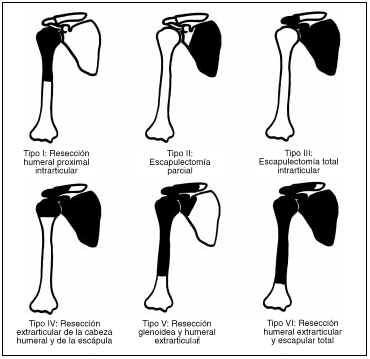
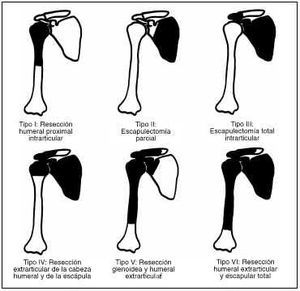
En los últimos 10 años se han tratado en la Unidad de Tumores de nuestro hospital 65 pacientes con patología tumoral de la cintura escapular, de los cuales 50 eran tumores óseos y 15 eran de partes blandas, con una mayor frecuencia de osteocondromas (23 casos), seguidos de los osteosarcomas (ocho casos) y de los sarcomas de Ewing (cuatro casos). Durante este tiempo en nueve (14%) se ha colocado una prótesis tumoral, siendo el modelo: tres prótesis espaciadoras de húmero de Espinosa, una prótesis de húmero de Campanacci y cinco Lima LTO. Se han revisado en estos pacientes los siguientes parámetros: sexo, edad, diagnóstico, tipo de lesión según la clasificación de Enneking,10 tratamiento y tipo de resección según la clasificación de Malawer21 (Fig. 1), tratamiento coadyuvante, complicaciones, resultados y supervivencia. Los resultados funcionales fueron valorados según la escala propuesta por la Musculoskeletal Tumor Society con los datos recogidos de la historia clínica y una revisión clínica específica en los pacientes vivos en la actualidad1,11 (Tabla 1).
Figura 1. Clasificación quirúrgica de las resecciones de la cintura escapulohumeral (Malawer y cols.18). A: Músculos abductores preservados. B: Músculos abductores resecados.
| Tabla 1. Sistema de valoración funcional para la extremidad superior de la Musculoskeletal Tumor Society. | ||||||
| Grados | Dolor | Función | Aceptación emocional | Posicionamiento de la mano | Destreza manual | Capacidad de elevación |
| 5 | No | Sin restricciones | Muy satisfactorio | Sin limitación | Sin limitación | Carga normal |
| 4 | Intermedio | Intermedia | Intermedio | Intermedio | Intermedio | Intermedia |
| 3 | Moderado, no incapacitante | Restricción de actividades recreativas | Satisfecho | No por encima del hombro. No pronación o supinación | Pérdida de movimientos finos | Limitada |
| 2 | Intermedio | Intermedio | Intermedio | Intermedio | Intermedio | Intermedia |
| 1 | Moderado. Incapacidad intermitente | Restricción laboral parcial | Aceptado | No por encima de la cintura | Imposibilidad de pinza | Sólo con ayuda |
| 0 | Severo. Incapacidad continua | Restricción laboral total | Insatisfecho | Ninguno | Imposibilidad de agarrar | Nula |
La serie constaba de siete mujeres y dos varones, con una media de edad de 34 años (mínimo: 18 y máximo: 69 años). El diagnóstico fue de osteosarcoma en seis pacientes, histiocitoma fibroso maligno en uno, metástasis de leiomiosarcoma de glúteo en otro y de neoplasia de mama en otro. Según la clasificación de Enneking, en ocho casos la lesión se encontraba en un estadio IIB y en un caso en estadio III, paciente que no aceptó la desarticulación escapulotorácica y a la que se practicó un tratamiento paliativo. El tipo de intervención según la clasificación de Malawer fue en ocho casos tipo IB. La reconstrucción se llevó a cabo mediante la colocación de una prótesis tumoral de los modelos mencionados. En cuanto al tratamiento coadyuvante realizado en estos casos, cuatro recibieron tratamiento quimioterápico preoperatoriamente y cuatro durante el postoperatorio. Se añadió tratamiento mediante radioterapia postoperatoria en dos casos. El tiempo medio de seguimiento fue de 3 años.
Resultados
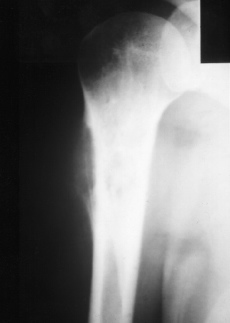
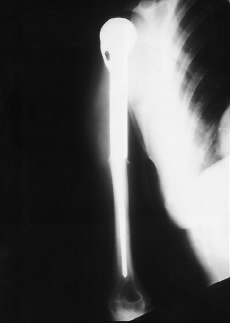
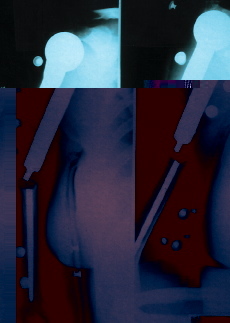
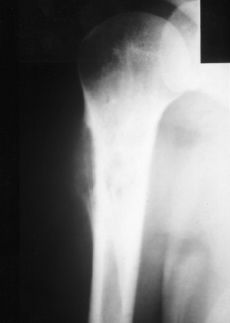
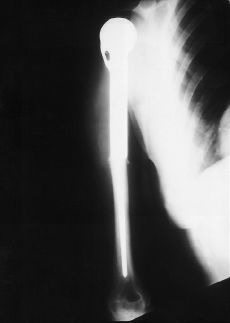
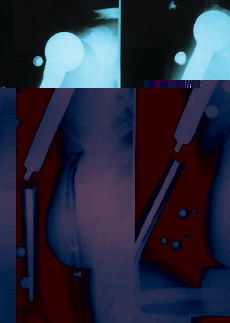
Se presentaron cuatro complicaciones en los nueve pacientes: dos recidivas locales, una rotura del implante (Figs. 2-4) y una infección. El caso con una infección profunda por Staphylococcus aureus se resolvió mediante el abordaje precoz, retirada de la parte proximal del implante (cabeza metálica), limpieza con irrigación a presión y antibioterapia específica. El caso de rotura del implante se trataba de una prótesis espaciadora de húmero de Espinosa (Figs. 3 y 4), rota a los 9 años tras una caída casual sobre el brazo afecto. Después de 11 años de evolución la paciente mantiene una buena tolerancia con una ortesis de «alkatene».
Figura 2. Osteosarcoma de húmero.
Figura 3. Prótesis espaciadora de húmero de Espinosa.
Figura 4. Rotura de prótesis tumoral.
Al tratarse en todos los casos de tumores de alto grado de malignidad, la supervivencia media ha sido baja (2 años y 10 meses), contando en el momento actual con tres pacientes vivos (Tabla 2).
| Tabla 2. Supervivencia. | ||||
| Caso | Sexo | Edad | Diagnóstico | Supervivencia |
| 1 | Mujer | 35 | Osteosarcoma | 11 años* |
| 2 | Mujer | 49 | Metástasis de leiomiosarcoma | 2 meses |
| 3 | Varón | 49 | Osteosarcoma | 15 meses |
| 4 | Mujer | 27 | Osteosarcoma | 2 años y 2 meses |
| 5 | Mujer | 21 | Osteosarcoma | 7 años* |
| 6 | Mujer | 69 | Histiocitoma fibroso maligno | 8 meses |
| 7 | Mujer | 18 | Osteosarcoma | 5 meses* |
| 8 | Varón | 26 | Osteosarcoma | 1 año y 3 meses |
| 9 | Mujer | 42 | Metástasis de neoplasia de mama | 3 años y 1 mes |
| *.Viven actualmente. | ||||
En la evaluación de los resultados funcionales, según la escala de valoración propuesta por la Musculoskeletal Tumor Society, el porcentaje de funcionalidad fue del 71% en los ocho pacientes cuya resección fue del Tipo I de Malawer y del 59% en el caso en el que se realizó una resección Tipo V. Los mejores resultados se obtuvieron en la mejoría del dolor y aceptación emocional, con una media de 4,5 y 3,6 puntos, respectivamente; se obtuvieron buenos resultados en cuanto a la destreza manual y malos en la función (importantes restricciones laborales) en el posicionamiento de la mano y en la capacidad de levantar pesos.
Discusión
Con la introducción de la quimioterapia y el mejor estudio preoperatorio mediante técnicas de imagen, principalmente la RM, la reconstrucción proximal del húmero tras la excisión de un sarcoma primario puede ofrecer un mejor resultado funcional con un bajo porcentaje de recidivas.2,6,8,12,14 La reconstrucción humeral proximal ofrece al paciente una mejor capacidad funcional, existiendo diversas opciones de reconstrucción como las artrodesis,13 los injertos óseos autólogos vascularizados o no,29 asociado o no a una prótesis de Neer,9,16 las prótesis metálicas o de cerámica2,3,28 o los injertos osteoarticulares14 y las aloprótesis intercalares o autoprótesis.27 La utilización de prótesis para reemplazar el húmero proximal, metálicas o de cerámica, han servido para proporcionar una reconstrucción articular y sustituir el húmero resecado. Las contraindicaciones a la artroplastia de sustitución por implante son la afectación del paquete neurovascular, fracturas patológicas, infecciones, inmadurez esquelética, afectación muscular extensa y zonas de biopsia inapropiadas.
En este estudio las complicaciones observadas fueron similares a las referidas por otros autores. Bos y cols.2 publicaron en 18 pacientes, con un seguimiento mínimo de 2 años, una recidiva local, y en 12 de los 18 pacientes fue necesaria su revisión por fracaso de la fijación, por subluxación persistente o por luxación. Ross y cols.28 publicaron que en 25 pacientes en los que se utilizó una prótesis con tallo intramedular tuvieron dos recidivas locales, pero sin evidencia de aflojamiento, a pesar de mencionar varios problemas técnicos peroperatorios. O''Connor y cols.26 en 11 pacientes observaron aflojamiento del implante o rotura de la cerámica en dos casos, seis de subluxación y uno de infección profunda. La mayoría de infecciones en pacientes con megaprótesis requieren un tratamiento quirúrgico, ya que la administración prolongada de antibióticos no es suficiente. Los métodos incluyen la irrigación sin retirada del implante, el desbridamiento sin retirada del implante, retirada de la prótesis, un segundo tiempo quirúrgico para la colocación de un espaciador de cemento, artrodesis con injerto de peroné vascularizado y en algunos casos la amputación.15 En nuestro caso fue necesaria la retirada parcial del implante, sin que se viera disminuida la funcionalidad del miembro afecto.
Los resultados funcionales observados en los pacientes estudiados han sido equiparables a los encontrados por otros autores como O''Connor y cols,26aunque Courpied y cols.7 referían resultados funcionales regulares utilizando una prótesis tipo Mothy; Capanna y cols.4 encontraban resultados funcionales regulares en ocho pacientes utilizando una prótesis modular de húmero proximal, y Cara y cols.5obtenían pobres resultados con prótesis isoelásticas tipo Mathys. Entre las opciones para la reconstrucción tras la resección de la zona proximal del húmero (Tipos I y V de Malawer) se encuentran las prótesis tumorales, aloinjeros osteoarticulares y combinaciones de prótesis y aloinjertos. Las ventajas de la reconstrucción con prótesis son la fijación distal inmediata, la posibilidad de realizar tratamiento con radioterapia postoperatoria y un bajo riesgo de infección comparado con las asociaciones a aloinjertos. Sin embargo, existe el riesgo de aflojamiento de implante. Por otra parte, la principal ventaja de un aloinjerto osteoarticular es la posibilidad de anclar el manguito de los rotadores mejorando la movilidad activa, pero, por el contrario, existe el riesgo de retraso en la consolidación o pseudoartrosis, fractura e infección. La asociación de aloinjerto y prótesis ofrece la posibilidad de anclar el manguito de los rotadores, eliminando el riesgo de fractura o colapso subcondral.26
Puede concluirse que los resultados funcionales con las prótesis tumorales son satisfactorios en cuanto a la mejoría del dolor, la aceptación emocional y la destreza manual, pero, en cambio, no lo son en cuanto a la función de elevación de la mano y su posicionamiento y la capacidad de levantar peso, por todo ello debe considerarse su utilización en la reconstrucción quirúrgica después de una resección de la zona proximal del húmero, sobre todo en aquellos casos en que no se ha podido conservar el mecanismo abductor (Tipos IB y VB de Malawer).
Bibliografa
1. Abudu, A; Carter, SR, y Grimer, RJ: The outcome and functional results of diaphyseal endoprostheses after tumour excision. J Bone Joint Surg, 78B: 652-657, 1996.
2. Bos, G; Sim, F; Pritchard, D; Shives, T; Rock, M; Askew, L, y Chao, E: Prosthetic replacement of the proximal humerus. Clin Orthop, 224: 178-191, 1987.
3. Burrows, HJ; Wilson, JN, y Scales, JT: Excision of tumours of humerus and femur, with restoration by internal prosthesis. J Bone Joint Surg, 57B: 148-159, 1975.
4. Capanna, R; Giunti, A; Biagini, R; Ferruzi, A; Ferraro, A; Casadei, R; Picci, P, y Campanacci, M: Modular endoprosthesis for humerus and Tikhoff-Linberg resection. En: Yamamuro, T (Ed): New Developments for Limb Salvage in Musculoskeletal Tumors. Tokyo. Springer, 1989, 547-555.
5. Cara, JA, y Cañadell, J: Reconstruction of joint defects. En: Cañadell, J; San Julián, M, y Cara, JA (Eds): Surgical Treatment of Malignant Bone Tumors. Pamplona. Eurograf, 1995, 173-177.
6. Cheng, EY, y Gebhardt, MC: Allograft reconstructions of the shoulder after bone tumor resections. Orthop Clin North Am, 22: 37-48, 1991.
7. Courpied, JP; Tomeno, B; Langlais, F; Augereau, B; Aubriot, JH; Babin, S; Moulies, D, y Pecout, B: Functional results following resection of tumors in the proximal humerus. En: Yamamuro, T (Eds): New Developments for Limb Salvage in Musculoskeletal Tumors. Tokyo. Springer, 1989, 531-536.
8. Eckhardt, JJ; Eilber, FR; Dorey, FJ, y Mirra, JM: The UCLA experience in limb salvage surgery for malignant tumors. Orthopedics, 8: 612-621, 1985.
9. Enneking, WF; Eady, JL, y Burchardt, H: Autogenous cortical bone grafts in the reconstruction of segmental skeletal defects. J Bone Joint Surg, 62A: 1039-1058, 1980.
10. Enneking, WF: A system of staping musculoskeletal neoplasms. Clin Orthop, 204: 9-24, 1986.
11. Enneking, WF; Dunham, W; Gebhardt, MC; Malawer, MM, y Pritchard, DJ: A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system. Clin Orthop, 286: 241-246, 1993.
12. Gebhardt, MC; Mankin, HJ; Schiller, AL, y Rosenthal, DI: Diagnosis and management of tumors about the shoulder. En: Rowe, CR (Ed): The Shoulder. New York. Churchill Livingstone, 1988, 565-630.
13. Gebhardt, MC; McGuire, MH, y Mankin, HJ: Resection and allograft arthrodesis for malignant bone tumors of the extremity. En: Enneking, WF (Ed): Limb Salvage in Musculoskeletal Oncology. New York. Churchill Livingstone, 1987, 567-582.
14. Gebhardt, MC; Roth, YF, y Mankin, HJ: Osteoarticular allografts for reconstruction in the proximal part of the humerus after excision of a musculoskeletal tumor. J Bone Joint Surg, 72A: 334-345, 1990.
15. Holzer, G; Windhager, R, y Kotz, R: One-stage revision surgery for infected megaprostheses. J Bone Joint Surg, 79B: 31-35, 1997.
16. Imbriglia, JE; Neer, CS, y Dick, HH: Resection of the proximal one-half of the humerus in a child for condrosarcoma. Preservation of function using a fibular graft and Neer prosthesis. J Bone Join Surg, 60A: 262-264, 1978.
17. Jensen, KL, y Johnston, JO: Proximal humeral reconstruction after excision of a primary sarcoma. Clin Orthop, 311: 164-175, 1995.
18. Linberg, BE: Interscapulo-thoracic resection for malignant tumors of the shoulder joint region. J Bone Joint Surg, 10: 344-349, 1928.
19. Lord, CF; Gebhardt, MC; Tomford, WW, y Mankin, HJ: Infection in bone allografts, incidence, nature, and treatment. J Bone Joint Surg, 70A: 369-376, 1988.
20. Malawer, MM: Surgical technique and results of limb sparing surgery for high grade bone sarcomas of the knee and shoulder. Orthopedics, 9: 597-607, 1985.
21. Malawer, MM: Tumors of the shoulder girdle. Technique of resection and description of a surgical classification. Orthop Clin North Am, 22: 7-35, 1991.
22. Malawer, MM, y Sugarbaker, PH: Resecciones de la cintura del hombro: el procedimiento de Tikhoff-Linberg y sus modificaciones. En: Sugarbaker, PH, y Malawer, MM (Eds): Ciruga del cancer musculoesquelético. Principios y técnicas. Madrid. Mosby/Doyma, 1995, 346-360.
23. Mankin, HJ; Gebhardt, MC, y Tomford, WW: The use of frozen cadaveric allografts in the management of patients with bone tumors of the extremities. Orthop Clin North Am, 18: 275-289, 1987.
24. Marcove, RC; Lewis, MM, y Huvos, AG: En bloc upper humeral interscapulo-thoracic resection. The Tikhoff-Linberg procedure. Clin Orthop, 124: 219-228, 1977.
25. Moeckel, BH; Dines, DM; Warren, RF, y Altchek, DW: Modular hemiarthroplasty for fractures of the proximal part of the humerus&