Evaluar los resultados clínicos y radiológicos de una serie de pacientes con defecto óseo glenoideo tratados mediante artroplastia total inversa de hombro asociada a injerto óseo estabilizado mediante componente glenoideo de titanio trabecular (Axioma SMR Lima®).
Material y métodosEstudio descriptivo retrospectivo de 16 pacientes consecutivos con una edad media de 68,2años. En 13 casos se trataba de artroplastias primarias y en 3, de revisión. Los datos incluidos en el estudio se obtuvieron mediante revisión de la historia clínica. El defecto glenoideo se clasificó de acuerdo con Gupta et al. La valoración clínica pre- y postoperatoria incluyó la puntuación en la escala visual analógica de dolor (EVA), el resultado de la escala Constant y el balance articular activo. Radiográficamente se valoró la integración del injerto óseo y la fijación de los componentes.
ResultadosEl seguimiento medio fue de 42,1meses. La puntuación media en la escala EVA mejoró de 7,5 puntos preoperatorios a 2,5 puntos en el último control (p=0,006) y en la escala de Constant de 35,8 puntos prequirúrgicos a 64,4 puntos (p=0,001). El balance articular activo pasó de 54° de abducción, 54° de antepulsión, 24° de rotación externa y rotación interna a trocánter preoperatorios a 120° abducción (p=0,001), 124° antepulsión (p=0,001), 63° rotación externa (p=0,001) y rotación interna a L5 en el último control clínico. En todos los pacientes se objetivó integración del injerto y la ausencia de aflojamiento de los componentes. La incidencia de complicaciones fue del 6,2%.
DiscusiónEl tratamiento de defectos glenoideos mediante artroplastia inversa e injerto óseo estabilizado mediante metaglena de titanio trabecular presenta buenos resultados clínicos, radiológicos y una baja tasa de complicaciones a corto plazo.
To evaluate the clinical and radiological results of a series of patients with a glenoid bone defect treated by reverse total shoulder arthroplasty associated with a bone graft stabilized with a trabecular titanium glenoid component (Axioma SMR Lima®).
Material and methodsRetrospective descriptive study of 16 consecutive patients with an average age of 68.2years. In 13 cases they were primary arthroplasties and in 3 revision ones. The data included in the study were obtained by reviewing the clinical history. The glenoid defect was classified according to Gupta et al. The pre- and postoperative clinical assessment included the score on the visual analogue pain scale (VAS), the result of the Constant score and the active joint balance. Radiographically, the integration of the bone graft and the fixation of the components were assessed.
ResultsThe average follow-up was 42.1months. The average VAS score improved from 7.5 preoperative points to 2.5 points in the last control (P=.006) and on the Constant score from 35.8 pre-surgical points to 64.4 points (P=.001). The average joint balance went from 54° of abduction, 54° of antepulsion, 24° of external rotation and internal rotation to preoperative trochanter to 120° of abduction (P=.001), 124° of antepulsion (P=.001), 63° of external rotation (P=0.001) and internal rotation at L5 in the last clinical control. In all patients, graft integration and the absence of component loosening were observed. The incidence of complications was 6.2%.
DiscussionThe treatment of glenoid defects by reverse total shoulder arthroplasty and a bone graft stabilized by trabecular titanium metaglene presents good clinical and radiological results and a low rate of short-term complications.
El número de pacientes intervenidos mediante artroplastia de hombro se ha incrementado de forma significativa en los últimos años, principalmente desde la introducción de las prótesis inversas1,2. La reconstrucción quirúrgica de la cavidad glenoidea constituye en muchos casos el principal reto de la artroplastia, especialmente en aquellos que asocian déficit de stock óseo, glenas displásicas o una retroversión elevada3. La restitución de la línea articular es fundamental para obtener una correcta tensión del deltoides con el fin de maximizar la función y disminuir el riesgo de inestabilidad. Por otra parte, disminuye el riesgo de impingement glenohumeral y el desarrollo de notching a largo plazo. Todo ello debe conseguirse sin comprometer la fijación primaria del componente glenoideo, pues la existencia de micromovimiento en la interfaz hueso-implante se asocia a aflojamientos prematuros y necesidad de revisión del implante4.
Existen diferentes opciones a la hora de abordar la reconstrucción de un defecto glenoideo. Entre ellas destacan el fresado excéntrico, válido en pacientes que presenten defectos óseos o alteraciones de la versión leves; la reconstrucción con injerto óseo; la utilización de componentes glenoideos con aumentación metálica, ya sea concéntrica o en forma de cuñas, y por último, los componentes a medida fabricados mediante impresión tridimensional1.
El objetivo del presente estudio fue evaluar los resultados clínicos y radiológicos de la artroplastia inversa de hombro asociada a injerto óseo estabilizado mediante una metaglena con tetón central de titanio trabecular en una serie de pacientes con defecto óseo glenoideo.
Material y métodosDatos demográficosSe realizó un estudio descriptivo retrospectivo de 16 pacientes consecutivos intervenidos entre junio de 2015 y septiembre de 2018 mediante artroplastia inversa de hombro asociada a injerto óseo glenoideo. Previo al inicio del estudio se obtuvo el consentimiento de los pacientes y la aprobación por parte del Comité de Ética de nuestro centro (Registro 17/2021).
Se incluyeron 13 mujeres (81%) y 3 hombres (19%), con una media de edad de 68,2años (rango de 58 a 80años). Respecto a la etiología, en 13 casos (81%) se trataba de una artroplastia primaria y en 3 (19%), de revisión.
Los datos de los pacientes se recogen en la tabla 1.
Datos demográficos de los pacientes de la serie
| N | Edad | Sexo | Etiología | Defecto glenoideo | Tipo de injerto | Método de estabilización | Talla y longitud del tetón |
|---|---|---|---|---|---|---|---|
| 1 | 59 | H | Revisión de prótesis inversa | C3 | Aloinjerto de fémur distal | Metaglena | S (10 mm) |
| 2 | 65 | M | Secuelas de fractura de húmero proximal | C3 | Autoinjerto de cabeza humeral | Metaglena | M (17 mm) |
| 3 | 58 | M | Luxación glenohumeral inveterada | E3A | Autoinjerto de cabeza humeral | Metaglena | XL (29 mm) |
| 4 | 66 | M | Luxación glenohumeral inveterada | E2A | Autoinjerto de cabeza humeral | Metaglena y dos tornillos canulados | M (17 mm) |
| 5 | 60 | M | Secuelas de fractura de húmero proximal | E3A | Aloinjerto de fémur distal | Metaglena | XL (29 mm) |
| 6 | 67 | H | Artropatía por manguito rotador | E3P | Autoinjerto de cabeza humeral | Metaglena | M (17 mm) |
| 7 | 76 | M | Revisión de hemiartroplastia | C2 | Aloinjerto de fémur distal | Metaglena | S (10 mm) |
| 8 | 69 | M | Artropatía por manguito rotador | C2 | Autoinjerto de cabeza humeral | Metaglena | S (10 mm) |
| 9 | 78 | M | Fractura húmero proximal y de glena | E3A | Autoinjerto de cabeza humeral | Metaglena | XL (29 mm) |
| 10 | 76 | M | Omartrosis | E3P | Autoinjerto de cabeza humeral | Metaglena | M (17 mm) |
| 11 | 67 | M | Revisión de prótesis total de superficie | C2 | Aloinjerto de fémur distal | Metaglena | S (10 mm) |
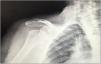
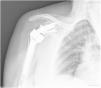
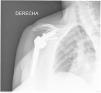
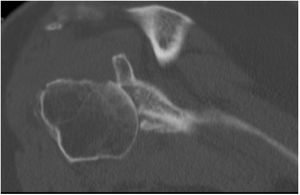
| 12 | 68 | M | Luxación glenohumeral inveterada (fig. 1) | E2A | Autoinjerto de cabeza humeral | Metaglena y dos tornillos canulados | XL (29 mm) |
| 13 | 70 | M | Luxación glenohumeral inveterada | E3A | Autoinjerto de cabeza humeral | Metaglena | XL (29 mm) |
| 14 | 62 | H | Omartrosis | E3P | Autoinjerto de cabeza humeral | Metaglena | XL (29 mm) |
| 15 | 70 | M | Artropatía por manguito rotador | E3P | Autoinjerto de cabeza humeral | Metaglena | XL (29 mm) |
| 16 | 80 | M | Secuelas de fractura de húmero proximal | E3A | Autoinjerto de cabeza humeral | Metaglena | XL (29 mm) |
El defecto óseo glenoideo se clasificó de acuerdo con el método de Seebauer2. De esta manera, los defectos se clasifican en defectos céntricos (C) y excéntricos (E). A su vez, los defectos céntricos se subclasifican en cuatro tipos: C1 (si tiene una profundidad <50% del diámetro glenoideo anteroposterior), C2 (si tiene una profundidad >50% y bóveda estable), C3 (defecto cavitario) y C4 (si existe una destrucción significativa de la glena y la bóveda). Los defectos excéntricos se subclasifican basándose en el tamaño y en la ubicación principal del defecto. Según el tamaño, podemos encontrar cuatro grados: E1 (si el defecto es pequeño), E2 (defecto <30% del stock óseo), E3 (defecto entre el 30 y el 60% del stock óseo) y E4 (defecto >60% stock óseo). Según la ubicación podemos encontrar defectos anteriores (A), superiores (S), inferiores (I) o posteriores (P).
En nuestro estudio encontramos 3 casos tipo C2 (18,7%), 2 casos C3 (12,5%), 2 casos E2A (12,5%), 5 casos E3A (31,2%) y 4 casos E3P (25%) (fig. 1).
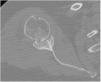
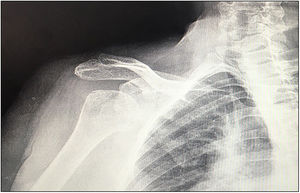
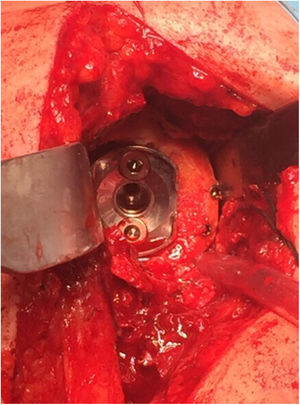
Procedimiento quirúrgicoLa cirugía se llevó a cabo mediante un abordaje deltopectoral con el paciente posicionado en silla de playa. La profilaxis antibiótica preoperatoria se realizó en todos los casos mediante 2g de cefazolina intravenosa. El tipo de implante utilizado fue la artroplastia total inversa de hombro SMR (Lima Corporate, San Daniele del Friuli, Italia). El componente glenoideo de dicha prótesis dispone de dos opciones de tetón central: el primero está fabricado en aleación de titanio poroso recubierto de hidroxiapatita y su uso está dirigido a artroplastia primaria; el segundo, utilizado en todos los casos de la presente serie, está compuesto por titanio trabecular y dispone de diferentes longitudes, entre 10,5 y 29,6mm (fig. 2). El objetivo de este último es maximizar la osteointegración a la vez que permitir el uso de injerto óseo de espesor variable. Por lo tanto, está indicado en pacientes con mala calidad ósea, artroplastia de revisión o en casos con defecto glenoideo.
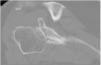
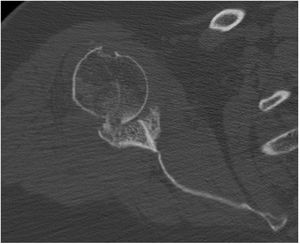
La planificación preoperatoria se realizó mediante tomografía computarizada (TC), determinándose la posición y la angulación óptimas del tetón central con el fin de obtener el máximo contacto con el hueso huésped. La TC también se utilizó para determinar el grosor del injerto requerido y la necesidad, o no, de corregir la versión glenoidea tallando un injerto en cuña medido sobre el reborde menos erosionado de la glena residual (figs. 3 y 4).
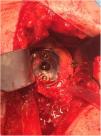
En 12 de los 13 pacientes (el 75% del total de la serie) en los que se trataba de una cirugía primaria se utilizó autoinjerto de la propia cabeza humeral del paciente. En los 4 casos restantes (25%) —3 casos de cirugía de revisión y un caso de secuela de fractura de húmero proximal, en el que la mayor parte de la cabeza humeral se encontraba necrosada— se utilizó aloinjerto óseo de cóndilo femoral. En todos los casos el tallado del injerto se llevó a cabo tratando de obtener al menos 3mm de hueso cortical en toda la circunferencia del mismo con el fin de incrementar su resistencia estructural. Tras realizar el fresado glenoideo para eliminar el remanente cartilaginoso, el injerto se estabilizó de forma provisional sobre el hueso huésped mediante agujas de Kirschner, brocando posteriormente el orificio central del tetón. En 2 pacientes intervenidos por luxación glenohumeral inveterada que presentaban un defecto excéntrico anterior severo que precisó utilizar un injerto en forma de L, tras realizar el brocado central las agujas fueron sustituidas por dos tornillos canulados de 3,0mm (fig. 5). La fijación definitiva del injerto se llevó a cabo mediante la impactación del componente glenoideo suplementado por dos tornillos, superior e inferior, de 6,5mm de diámetro. La duración media del procedimiento quirúrgico fue de 96min (rango de 65 a 140min).
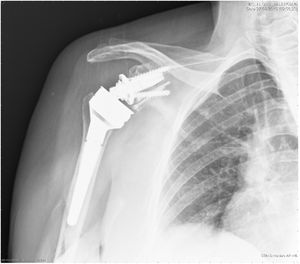
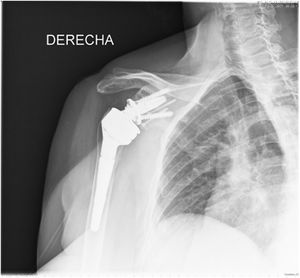
Durante el postoperatorio todos los pacientes fueron inmovilizados mediante un cabestrillo convencional, iniciando la movilización pasiva de la articulación por parte de un familiar entrenado hasta una antepulsión de 90grados el primer día tras la cirugía. La movilidad activa se demoró hasta la sexta semana postquirúrgica. El seguimiento clínico y radiológico de los pacientes se llevó a cabo en consultas externas del propio centro al mes, a los 3meses, a los 6meses, a los 12 meses, y posteriormente anualmente tras la cirugía (figs. 6 y 7).
Para la valoración y la comparación de los resultados clínicos y radiológicos se tuvo en cuenta la información obtenida en la consulta preoperatoria en la que el paciente fue incluido en lista de espera y la del último seguimiento presente en la historia electrónica de nuestro centro. Tanto la evaluación funcional como la de los resultados radiológicos fue realizada en conjunto por dos cirujanos sénior expertos en cirugía de hombro no implicados en el procedimiento quirúrgico. Para la valoración clínica se utilizaron la escala funcional de hombro de Constant5, la escala visual analógica del dolor (EVA) de cero (ningún dolor) a 10 (dolor máximo)6 y la medición del balance articular activo mediante goniómetro. En cuanto a la valoración radiológica, se estudió la integración del injerto mediante proyecciones anteroposterior, axilar y escapular7-10, la fijación del componente glenoideo según el método propuesto por Ha et al.11 y Gustas-French et al.12 y la del componente humeral según Martínez Díaz et al.13. La integración del injerto se consideró completa cuando existía evidencia radiográfica de unión, sin líneas radiotransparentes completas en las interfaces entre la placa base, el injerto óseo y/o la glena, y sin evidencia de aflojamiento de componentes en el último seguimiento clínico10. El desarrollo de notching escapular se clasificó mediante el método de Sirveaux14. Además, se obtuvo la incidencia de complicaciones intraoperatorias y postoperatorias.
Análisis estadísticoEl tratamiento de los datos se ha llevado a cabo mediante los programas estadísticos SPSS 22 y XLSTAT para MAC OS. El análisis descriptivo de las variables categóricas se expresa como frecuencia absoluta y relativa; las variables cuantitativas se describen con media y desviación estándar (DE). Se comprobó la normalidad de las variables tanto cuantitativas como cualitativas mediante la prueba de Kolmogorov-Smirnov. Al no darse una distribución normal de la muestra, para el análisis de las variables incluidas en nuestro estudio aplicamos el test no paramétrico de la Prueba de Wilcoxon de los rangos con signos. En todos los análisis estadísticos el nivel de significación se estableció en el 5%.
ResultadosEl seguimiento medio fue de 42,1meses (rango de 27 a 60meses), sin pérdidas en el seguimiento. La estancia media posquirúrgica fue de 2,5días (rango de 2 a 4días).
Los resultados preoperatorios y en el último seguimiento de la escala EVA, el test de Constant y el balance articular activo se muestran en la tabla 2.
Puntuaciones medias de la escala EVA, test de Constant y balance articular activo pre y posquirúrgicos (p<0,05)
| ABD | ATP | RI | RE | EVA | Constant | p | |
|---|---|---|---|---|---|---|---|
| Preoperatorio | 54°±16° | 54°±21° | Trocánter | 24°±10° | 7,5±1,4 | 35,8±3,8 | |
| Último seguimiento clínico | 120°±27° | 124°±23° | L5 | 63°±7° | 2,5±2,4 | 64,4±6 | p<0,05 |
ABD: abducción; ATP: antepulsión; RE: rotación externa; RI: rotación interna.
En cuanto a la valoración radiológica, se objetivó la integración del injerto óseo en todos los pacientes. Asimismo, no se observaron imágenes compatibles con aflojamiento del componente glenoideo o humeral en ningún caso. Tres de los pacientes (18,8%) desarrollaron un notching escapular tipoI de Sirveaux visible en el control radiológico a los 3años posquirúrgicos en 2 casos y, en el caso restante, a los 4años tras la cirugía.
Solamente uno de los 16 pacientes (6,2%) presentó complicaciones en el postoperatorio precoz: una neuroapraxia del nervio cubital resuelta por completo 6meses tras la cirugía.
DiscusiónLa presencia de un defecto óseo o una alteración severa de la versión glenoidea compromete los resultados de la artroplastia de hombro e incrementa la dificultad del procedimiento quirúrgico. En un estudio realizado por Gupta et al.2 constituido por una serie de 94 pacientes con defecto glenoideo de diferentes grados tratados mediante artroplastia inversa de hombro, asociando injerto óseo en los pacientes con defectos más severos, se concluyó que estos últimos presentaban los peores resultados clínicos y una mayor probabilidad de fracaso temprano de la artroplastia.
En la actualidad existen diferentes opciones en el tratamiento de los defectos glenoideos, entre las que destacan: el fresado excéntrico glenoideo; el uso de autoinjerto o aloinjerto óseos y la utilización de componentes glenoideos con aumentación metálica (cuñas) o fabricados a medida mediante impresión 3D1.
En defectos óseos menores suele optarse por el fresado excéntrico de la cavidad glenoidea. La finalidad de este procedimiento es la regularización de la superficie articular, permitiendo de este modo un contacto uniforme con el componente protésico. No existe un límite claro respecto a la cantidad de erosión glenoidea que puede corregirse con seguridad mediante este método. Sin embargo, un fresado excesivo conllevaría una medialización de la línea articular glenohumeral y, por ende, una disminución de la tensión de las partes blandas y un incremento en el riesgo de inestabilidad protésica y en la aparición de notching escapular3,15-17. Por ello, la mayoría de los autores coinciden en que alteraciones de la versión glenoidea superiores a 15grados no deberían ser tratadas únicamente con fresado, debiendo considerarse en estos casos otras opciones, como el uso de injerto óseo o de metaglenas con aumentación metálica3.
Diferentes autores han presentado buenos resultados con el uso de metaglenas con aumentación posterior metálica en forma de cuña en el tratamiento de defectos glenoideos severos18. Teóricamente, frente al uso de injerto óseo, precisan de un menor tiempo quirúrgico y evitan complicaciones tales como la reabsorción del injerto y la ausencia de incorporación del mismo. Sin embargo, presentan inconvenientes, como la ausencia de restauración del stock óseo complicando futuras revisiones; un aumento del estrés en la interfaz hueso huésped-prótesis, incrementando el riesgo de aflojamiento a largo plazo, así como un mayor coste económico del implante19.
El presente trabajo expone los resultados obtenidos en una serie de 16 pacientes con diversas patologías asociadas a defecto óseo glenoideo mediante artroplastia inversa e injerto óseo. Las principales ventajas del uso de injerto respecto al fresado excéntrico son la restauración de la reserva ósea y la preservación o restitución de la línea articular, evitando la medialización excesiva del centro de rotación. Por lo tanto, las indicaciones del injerto óseo podrían agruparse en defectos óseos asimétricos no susceptibles de tratamiento mediante fresado y defectos cavitarios o segmentarios de un tamaño suficiente que impida una fijación primaria estable del componente glenoideo3.
Las desventajas teóricas del uso de injerto óseo incluyen el incremento de dificultad de la técnica quirúrgica y la ausencia de incorporación o la reabsorción del injerto óseo sobre la superficie glenoidea, lo que podría provocar un aflojamiento prematuro de los componentes3. En este sentido, en nuestra serie obtuvimos una tasa de integración del injerto del 100%. Malhas et al.1 presentan resultados similares en un estudio de 45 pacientes con defecto glenoideo (23 cirugías primarias y 22 de revisión) tratados mediante artroplastia inversa e injerto óseo estabilizado, como en nuestra serie, con metaglena de titanio trabecular, reportando una integración del 93% con un seguimiento mínimo de 2años. Por su parte, Boileau et al.17, utilizando un componente glenoideo con un tetón central de menor diámetro que el utilizado en nuestra serie y recubierto de hidroxiapatita, obtuvieron una incorporación completa del injerto en el 98% de una serie de 42 pacientes tratados mediante artroplastia inversa y autoinjerto óseo de la cabeza humeral.
En 4 casos de nuestra serie (25%) se utilizó aloinjerto de fémur distal y en 12 (75%), autoinjerto de húmero proximal, sin observar diferencias significativas en el grado de incorporación del injerto ni en la incidencia de complicaciones entre ambas cohortes. Resultados similares presentan Lopiz et al.20 en un trabajo sobre 23 pacientes con defecto óseo glenoideo tratados mediante prótesis inversa asociada a injerto óseo, con una consolidación del 100% de los autoinjertos frente al 92% de aloinjertos (principalmente de tibia proximal). Frente a ello, Jones et al.15, en una serie de 44 pacientes tratados mediante artroplastia inversa e injerto óseo (29 autoinjerto humeral, un autoinjerto de cresta ilíaca y 14 aloinjertos de cabeza femoral), encontraron una tasa de incorporación total del injerto del 58,6% con autoinjerto y del 41,7% con aloinjerto. Sin embargo, esta diferencia en el grado de integración del injerto no se tradujo en diferencias en los resultados clínicos entre ambos grupos de pacientes. La procedencia anatómica del aloinjerto es variable según la serie consultada, presentando buenos resultados en la mayoría de los casos21. Sin embargo, algunos autores, como Ozgur et al.22, desaconsejan el uso de aloinjertos provenientes de diáfisis femoral al encontrar que el 87% de estos fracasaron pese a añadir proteína morfogenética ósea (BMP-2) en todos los casos.
Los resultados funcionales obtenidos en nuestra serie están en línea con los presentados por otros autores, como puede verse reflejado en la tabla 3.
Tabla comparativa de resultados funcionales de nuestra serie de casos y otros autores
| Casos, n | EVA | Escala Constant | ATP | RE | Complicaciones | |
|---|---|---|---|---|---|---|
| Boileau et al.17 | 45 | 66,6±11 | 146°±21° | 23°±16° | 19% | |
| Jones et al.15 | 44 | 1,5±1,9 | 58±14,9 | 116°±25° | 26°±22° | 13,6% |
| Lopiz et al.20 | 23 | 3,3±3,2 | 51,3±13,4 | 113°±34° | 13°±5° | 20% |
| Tashjian et al.23 | 19 | 1,4±2,2 | 128°±28° | 27°±12° | 21% | |
| Tashjian et al.24 | 14 | 2,5±3,1 | 130°±49° | 29°±16° | 21,4% | |
| Marquina et al. | 16 | 2,5±2,4 | 64,4±6 | 124°±23° | 63°±7° | 6,2% |
ATP: antepulsión; RE: rotación externa.
La incidencia de complicaciones, por nuestra parte, ha sido baja, con solo un caso de 16 pacientes (6,2%) que sufrió una neuroapraxia del nervio cubital. Lopiz et al.20 describen una incidencia de complicaciones del 20% en 23 pacientes tratados con artroplastia inversa e injerto con un seguimiento medio similar al del presente estudio (38meses). Otros autores presentan una incidencia de complicaciones de entre el 12 y el 31% en pacientes tratados con artroplastia inversa e injerto por defecto glenoideo, siendo las más frecuentes la inestabilidad, las infecciones y el aflojamiento aséptico1,2,15,24,25.
Limitaciones del estudioLas principales limitaciones de nuestro estudio radican en su diseño retrospectivo, el limitado número de pacientes y el escaso seguimiento clínico, que nos permite aportar solamente resultados a corto plazo de nuestra serie de pacientes. Otra limitación, común a otros de los estudios mencionados20, es la evaluación de la incorporación del injerto a la glena huésped mediante radiografía simple, dado que implica una mayor variabilidad interobservador que su valoración mediante TC. Sin embargo, Paul et al.10, en una revisión sistemática que incluyó 11 estudios con 393 pacientes intervenidos con artroplastia inversa de hombro asociando autoinjerto o aloinjerto óseo glenoideo, no encontraron diferencias estadísticamente significativas en la tasa de unión del injerto óseo cuando se utilizó la TC como complemento a las radiografías simple (tasa de integración del injerto glenoideo del 94%). Además, la heterogeneidad de las etiologías para la indicación de la cirugía, así como si estas se realizaron de manera primaria o mediante revisión de una prótesis previa, puede ser un factor que influya en los resultados funcionales de los pacientes.
ConclusionesEl uso de injerto óseo asociado a componentes glenoideos de titanio trabecular es una opción válida en el tratamiento de pacientes con defectos glenoideos mediante artroplastia inversa de hombro. Pese a tratarse de un procedimiento complejo, presenta una elevada tasa de incorporación del injerto y baja incidencia de complicaciones a corto plazo.
Nivel de evidenciaNivel de evidencia IV.
Conflicto de interesesNo existe ningún conflicto de intereses por parte de ninguno de los autores.
FinanciaciónLos autores declaran que no han recibido financiación para la realización de la presente investigación, la preparación del artículo, ni su publicación.