El tratamiento antiagregante y anticoagulante complica el manejo de los pacientes con fractura osteoporótica de cadera (FOC).
MétodosLa sección de hemostasia de la SEDAR constituyó un grupo de trabajo, con el objetivo de establecer un plan de actuación basado en la evidencia de las mejores prácticas en el manejo de los pacientes que, estando anticoagulados o antiagregados, sufren una FOC. Posteriormente un grupo multidisciplinar revalidó las recomendaciones.
ResultadosLa cirugía precoz disminuye las complicaciones y la mortalidad y mejora el bienestar y la recuperación funcional de los pacientes, mientras que la tasa de mortalidad no difiere por realizar una anestesia intradural o general.
ConclusionesAunque persisten incertidumbres se recomienda realizar la cirugía en las 24-48horas siguientes al ingreso, adaptando los bloqueos nerviosos periféricos y el tipo de anestesia (neuroaxial o general) a las condiciones hemostáticas. Se sugiere optimizar la hemostasia, la hemoglobina y la tromboprofilaxis desde el ingreso.
Antiaggregant and anticoagulant therapy complicate the management of patients with osteoporotic hip fracture.
MethodsThe haemostasis section of SEDAR established a working group to define an action plan for the management of antiaggregated or anticoagulated patients with an osteoporotic hip fracture. The suggested recommendations are based on evidence of best practices, and have been validated by a multidisciplinary group formed by 6 specialties.
ResultsEarly surgery reduces complications and mortality and improves patient comfort and functional recovery, with no difference in mortality between intradural and general anaesthesia.
ConclusionsAlthough uncertainties remain, it is recommended to perform surgery within 24-48hours of admission, adapting peripheral nerve blocks and type of anesthesia (neuraxial or general) an to the haemostatic conditions. A multimodal management of antithrombotics, and the optimisation of haemostasis, haemoglobin and venous thromboprophylaxis since admission are suggested.
La fractura osteoporótica de cadera (FOC) representa un importante problema en el Sistema Nacional de Salud. Su incidencia en España alcanza los 40.000-50.000 pacientes/año1 y provoca complicaciones clínicas graves, dependencia física y cognitiva, elevada mortalidad y gran consumo de recursos1. Característicamente son pacientes ancianos frágiles y pluripatológicos (edad media: 87 años), la mayoría mujeres (76,5%), con frecuente deterioro cognitivo o demencia (33%)1. El 40-50% de los pacientes está tratado con antitrombóticos, ya sean anticoagulantes (20-30%) o antiagregantes (70-80%), siendo el tratamiento con ácido acetilsalicílico (AAS) el más prevalente (60%)2.
El tratamiento antitrombótico tiene una repercusión dual en los pacientes con FOC. Por un lado, intervenir bajo su efecto aumenta el riesgo de hemorragia y de transfusión intraoperatoria frente a los pacientes sin antitrombóticos3 y, por otro lado, demorar la cirugía hasta que desaparece su efecto no consigue disminuir la transfusión total (desde el ingreso al alta) y puede favorecer las complicaciones y la mortalidad4. La demora quirúrgica mayor de 48horas (h) (frente a<48h) se asocia con un dolor fuerte y persistente que, unido a la fragilidad de los pacientes, y a que la FOC puede precipitar un estado proinflamatorio con hipercoagulabilidad, hacen que la demora quirúrgica que excede de 48h se asocie con mayor incidencia de delirium, eventos cardiovasculares, tromboembolia venosa, úlceras por presión, neumonía, infecciones, dependencia y mortalidad4. Esta dualidad mantiene un debate centrado en la demora quirúrgica óptima, junto a otras controversias, entre las que destacan: si al ingreso se deben mantener, suspender, revertir, o sustituir los antitrombóticos; si se pueden realizar bloqueos de nervios periféricos (BNP); cuándo se debe iniciar la tromboprofilaxis venosa farmacológica; si se puede administrar o no ácido tranexámico (ATX); cuál es el tipo de anestesia óptima y cuándo se pueden reiniciar los antitrombóticos.
El objetivo del tratamiento en el paciente con FOC es corregir la fractura y que el paciente retorne al nivel de independencia física y cognitiva que tenía antes de la FOC, con la máxima comodidad posible y el mínimo tiempo de hospitalización5–8. Cuanto menos tiempo pase desde el ingreso hasta la cirugía y movilización, mayor recuperación funcional tienen los pacientes5–8. Esto motiva que la recomendación principal de las guías sea realizar la cirugía dentro de las 24-48h tras el ingreso, a pesar del tratamiento con antitrombóticos5–8. Sin embargo, en España solo se intervienen en torno a la mitad de los pacientes en las primeras 48h (47,6% el año 2022)1,9, frente a más del 90% en los países de nuestro entorno10,11. Una de las barreras para realizar la cirugía precoz es el tratamiento previo con fármacos antitrombóticos7,9. En primer lugar, porque se intenta disminuir la hemorragia y transfusión retrasando la cirugía. En segundo lugar, porque la técnica anestésica más utilizada en nuestro país es la anestesia neuroaxial (87-89% de los pacientes1,10,11) y requiere un intervalo de seguridad sin la mayoría de los antitrombóticos12–14. Esto obviamente retrasa la cirugía respecto a otros países en los que la mayoría de los pacientes tratados con antitrombóticos se intervienen bajo anestesia general10,11. En este contexto debemos considerar que en los pacientes tratados con antitrombóticos la demora quirúrgica que excede de 48h (frente a<48h) aumenta en torno a un 20% las complicaciones graves y un 15% la mortalidad al mes, a los 3 meses y al año de la FOC15–21. Por otro lado, ambos tipos de anestesia, neuroaxial y general, muestran una mortalidad similar al mes, a los 3 meses y al año de la FOC22–26. Aunque destacan ventajas inherentes a cada técnica anestésica, la anestesia general se puede realizar en 24-48h y la anestesia neuroaxial puede disminuir las complicaciones asociadas a una vía aérea difícil y las tasas de insuficiencia respiratoria y renal postoperatorias24–26. Además, la realización de un BNP al ingreso por la FOC puede disminuir la tasa de dolor fuerte y de delirium preoperatorios27–29, y combinados con la anestesia permite reducir, por un lado, la dosis de anestésico local y los episodios de hipotensión asociados a la anestesia neuroaxial y, por otro lado, la dosis de opiáceos intra y postoperatorios y las tasas de dolor fuerte, de delirium y de neumonía postoperatorios27–29. En resumen, parece que el tipo de anestesia tiene un menor impacto en la recuperación funcional, las complicaciones y la mortalidad, que la cirugía precoz. Por tanto, la cirugía se debe realizar en las primeras 24-48h con las técnicas anestésicas que mejor se adapten a las condiciones hemostáticas y al tipo de fractura y técnica quirúrgica, en lugar de retrasar la cirugía hasta que se pueda realizar una anestesia neuroaxial, salvo excepciones12–14,22–30.
En este contexto, el Registro Nacional de Fracturas de Cadera de España considera que una línea necesaria en la mejora del proceso de la FOC es disponer de un protocolo de manejo perioperatorio de los pacientes con antitrombóticos específicos para la FOC7.
ObjetivosEl objetivo de este documento es ofrecer un plan de actuación perioperatorio multimodal que permita la realización de BNP en las primeras horas tras la FOC y la realización de la cirugía dentro de las 48h siguientes al ingreso, con seguridad, a pesar de los antitrombóticos.
¿Qué aporta este consenso frente a las guías y consensos existentes?Las recomendaciones disponibles sobre el manejo perioperatorio del tratamiento antitrombótico en cirugía programada y urgente12–14 no consideran que los pacientes con FOC se benefician de los BNP precoces27–29 y de realizar la cirugía dentro de las 48h siguientes al ingreso, a pesar de los antitrombóticos15–21. Esto implica que se dispone de menos tiempo del habitual en cirugía programada para optimizar la hemostasia y la hemoglobina y, por tanto, requiere un manejo específico basado en la evidencia disponible4–8.
Este documento considera la fragilidad de los pacientes, la hemorragia (asociada a cada tipo de FOC y técnicas quirúrgicas y anestésicas, el beneficio de la analgesia multimodal precoz con BNP y de realizar la cirugía dentro de las primeras 48h tras el ingreso, junto a la optimización de la hemoglobina y la hemostasia con un manejo adecuado de los antitrombóticos, la tromboprofilaxis venosa y las medidas de patient blood management (PBM) desde el ingreso al alta.
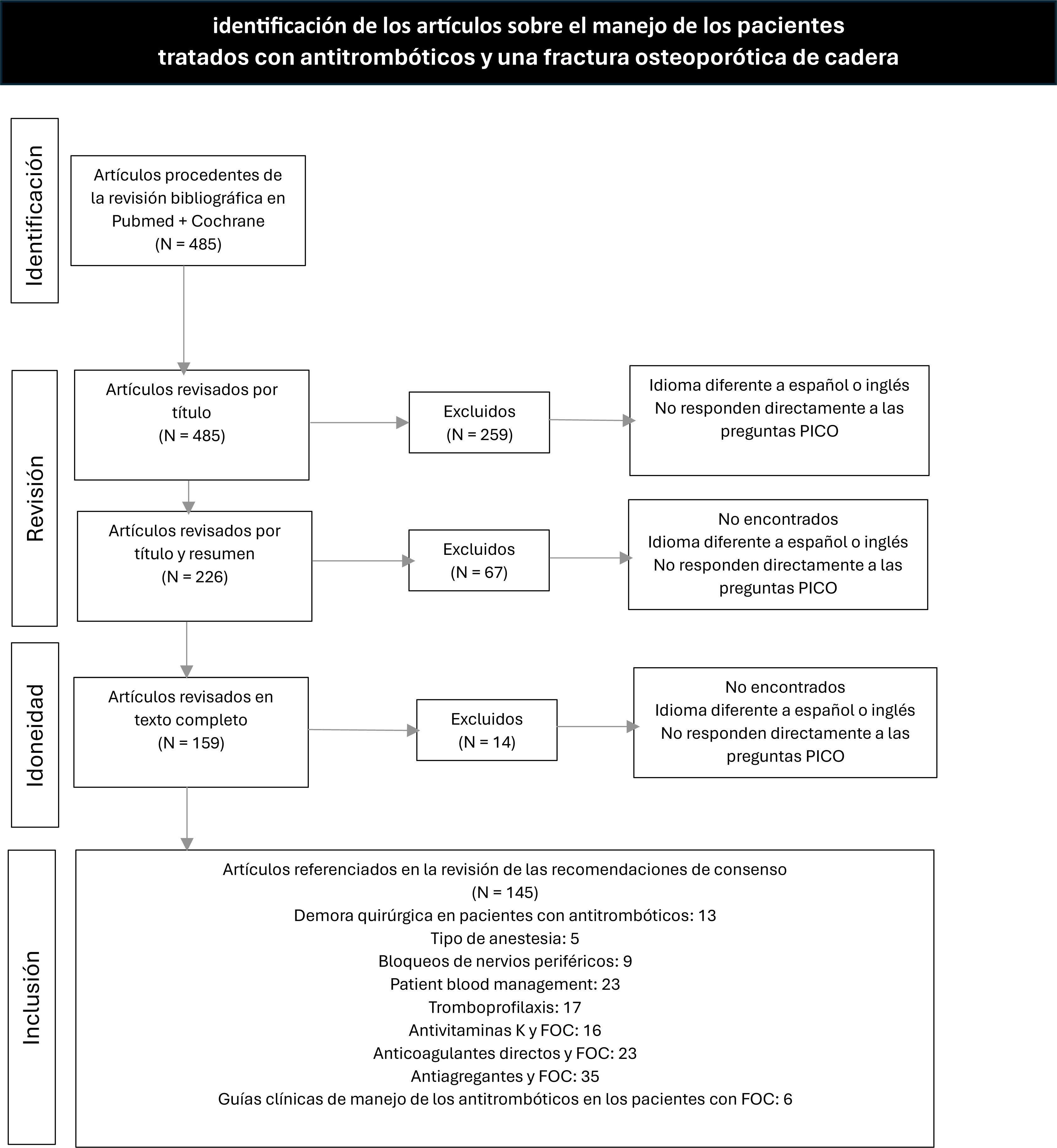
Material y métodosEl grupo de trabajo de la Sección de Hemostasia, Medicina Transfusional y Fluidoterapia de la Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor (SEDAR) se planteó las controversias actuales en el manejo de los pacientes anticoagulados o antiagregados que sufren una FOC en forma de preguntas PICO (pacientes, intervención, comparación y resultados) que se muestran en la tabla 1. La revisión bibliográfica se realizó en Pubmed, y en el registro Cochrane se incluyeron los artículos más relevantes que respondían a las preguntas PICO en español o inglés desde enero de 2015 hasta febrero de 2024. Los términos fueron: «hip fracture» AND «time to surgery», «early mobilisation», «anticoagulation», «INR», «dicumarin», «direct oral anticoagulants», «antiplatelet», «antiaggregant», «aspirin», «clopidogrel», «anesthesia», «nerve block», «venous thromboembolism», «thromboprophylaxis», «heparin low molecular weight», «iron», «tranexamic», «transfusion», «patient blood management», «guidelines», «register», and «meta analysis» (fig. 1).
Preguntas PICO sobre el manejo de los pacientes con fractura de cadera por impacto de baja energía en los pacientes previamente anticoagulados o antiagregados
| Suplemento 1 | Suplemento 2 | Suplemento 3 | Suplemento 4 | Suplemento 5 | Suplemento 6 | Suplemento 7 | Suplemento 8 |
|---|---|---|---|---|---|---|---|
| Demora y movilización precoces vs. tardía en pacientes con ATT y una FOC | Anestesia neuroaxial vs. anestesia general | BNP vs. analgesia iv en los pacientes con ATT | Medidas de patient blood management en pacientes con ATT y FOC | Tromboprofilaxis en los pacientes con ATT | Manejo de los pacientes con AVK y FOC | Manejo de los pacientes con ACOD y FOC | Manejo de los pacientes con AAP y FOC |
| 1. La cirugía precoz vs. demorada ¿afecta a la mortalidad y las complicaciones? | 1. ¿La anestesia neuroaxial asocia mejores resultados en mortalidad y complicaciones que la anestesia general? | 1. ¿Los BNP de punción única sobre territorio compresible asocian más riesgo de complicaciones que la analgesia iv? | 1. Una hemoglobina (HB) <13 g/dl (vs.> 13g/dl) al ingreso ¿asocia más complicaciones, mortalidad y reingreso hospitalario? | 1. Los diferentes tipos de FOC y de técnicas quirúrgicas ¿asocian diferentes tasas de TVP y embolia de pulmón? | 1. En los pacientes con AVK ¿la cirugía precoz (vs. demorada) afecta a la mortalidad y las complicaciones? | 1. En los pacientes con ACOD ¿la cirugía precoz (vs. demorada) afecta a la mortalidad y las complicaciones? | 1. En los pacientes con AAP ¿la cirugía precoz (vs. tardía) afecta a la mortalidad y las complicaciones? |
| 2. La movilización precoz vs. demorada¿asocia o afecta a la mortalidad, las complicaciones y el retorno al domicilio? | 2. ¿Los BNP con catéter sobre territorio compresible asocian más riesgo de complicaciones que la analgesia iv? | 2. Los diferentes tipos de FOC ¿asocian diferente sangrado y requerimientos transfusionales? | 2. ¿La edad mayor de 80 años (vs.≤80 años), la fragilidad (vs. no) y el sexo son factores de riesgo de TVP/EP? | 2. En los pacientes con AVK ¿administrar vitamina K en urgencias facilita la cirugía precoz? | 2. La cirugía precoz en los pacientes con ACOD (vs. sin ATT) ¿se diferencia en las tasas de complicaciones o mortalidad al mes? | 2. Entre los pacientes con AAP ¿la demora quirúrgica influye en la hemorragia y tasa de transfusión? | |
| 3. ¿Los BNP con punción única o con catéter sobre territorio no compresible asocian más riesgo de complicaciones que la analgesia iv? | 3. Entre los pacientes transfundidos y no ¿difieren la ferritina, el ácido fólico y la vitamina B12? | 3. ¿La cirugía precoz (frente a) puede disminuir la tasa de TVP/EP? | 3. En los pacientes con AVK y FOC ¿difiere la tasa de transfusión por intervenirlos con un INR≤1,5 vs.≤1,7? | 3. La cirugía en 24h con ATX en pacientes con xabanes y FGe>50 (vs. los controles) ¿se diferencian las tasas de transfusión, trombosis o mortalidad al mes? | 3. Entre los pacientes con AAP y cirugía precoz ¿difieren la hemorragia y tasa de transfusión por el tipo de AAP? | ||
| 4. En el periodo preoperatorio¿aporta más beneficios realizar BNP sobre territorio compresible que administrar analgesia iv única? | 4. Estar tratado con ATT frente a no estarlo ¿aumenta el sangrado tras el ingreso por la FOC? | 4. Con la cirugía precoz ¿influye el inicio de la tromboprofilaxis preoperatoria vs. postoperatoria en la tasa de mortalidad, sangrado o TVP? | 4. Los pacientes con AVK y cirugía precoz sin HBPM preoperatoria (vs. los controles con HBPM preoperatoria)¿difieren en las tasas de transfusión, trombosis o mortalidad? | 4. Los pacientes con un ACOD (no revertido) vs. un AVK (revertido) ¿se diferencian en la demora quirúrgica, las complicaciones, los reingresos o la mortalidad? | 4. ¿ Las tasas de mortalidad y de complicaciones tras la FOC ¿difieren entre los pacientes antiagregados y los controles? | ||
| 5. ¿Aporta beneficios combinar los BNP con la anestesia intradural o general frente a no hacerlo? | 5. Estar tratado con ATT frente a no estarlo ¿aumenta la tasa de transfusión en los pacientes con cirugía precoz de la FOC? | 5. En los pacientes con ATT, el uso de ATX (vs. no) ¿afecta a las tasas de mortalidad TVP, EP, SCA o ictus en los pacientes con alto riesgo trombótico (vs. no) o con dosis de ATX≥20 (vs. <20) mg/kg? | 5. En la hemorragia grave por AVK con INR>2-2,5 ¿el CCP asocia mejores resultados que el plasma fresco congelado? | 5. En los pacientes con cirugía precoz tratados con xabanes y FGe<30 (vs. FGe>30) o dabigatrán y FGe<50 (vs. FGe>50) difiere la tasa de transfusión? | 5. ¿La realización de un BNP compresible vs. profundo manteniendo los AAP o interrumpiéndolos≤24h asocian diferente riesgo de complicaciones? | ||
| 6. Combinar los ATT con antiinflamatorios no esteroideos o inhibidores COX-2¿aumenta la tasa de sangrado mayor? | 6. La combinación de hierro iv y ATX preoperatorio+tópico intraoperatorio (vs. sin ATX) ¿afecta a la tasa de trombosis? | 6. En los pacientes con AVK y cirugía precoz con INR≤1,7 ¿se diferencian las complicaciones y la mortalidad de las de los controles sin ATT? | 6. En los pacientes con un ACOD ¿la analgesia con BNP compresible de punción única asocia más riesgos que la analgesia iv? | 6. En los pacientes con clopidogrel±AAS¿con qué frecuencia se realiza una anestesia neuroaxial (vs. general) con una cirugía precoz de la FOC? | |||
| 7. En los pacientes con ATT ¿el uso de inhibidores de la bomba de protones (vs. no) disminuye la tasa de sangrado gastrointestinal? | 7. las tasas de TVP/EP y de mortalidad en los pacientes con FOC¿difieren por realizar la tromboprofilaxis con HBPM vs. otros ATT? | 7. En los pacientes con AVK e INR≤3 ¿la analgesia con BNP compresible asocia más riesgos que la analgesia iv? | 7. Los pacientes con ACOD y cirugía precoz sin HBPM preoperatoria (vs. los controles con HBPM preoperatoria)¿difieren en las tasas de mortalidad, hemorragia grave, transfusión o trombosis? | 7. En los pacientes con clopidogrel±AAS ¿cuál es la evidencia de realizar una anestesia neuroaxial con interrupción del clopidogrel≤48h? | |||
| 8. ¿La implantación de un programa de PBM (vs. no) disminuye la transfusión en los pacientes con FOC? | 8. En la FOC ¿el uso de dispositivos mecánicos puede disminuir la tasa de TVP? | 8. En los pacientes con AVK y cirugía precoz ¿se realiza más anestesia general o neuroaxial? | 8. Entre los pacientes con ACOD ¿cuál es la evidencia de realizar una anestesia neuroaxial (vs. general) a las 48h del ingreso? | ||||
| 9. En la FOC, la transfusión restrictiva frente a liberal¿afecta a la tasa de mortalidad y de complicaciones graves? | 9. Reiniciar los ACOD a dosis profiláctica a las 12-24h de la cirugía (vs. HBPM profiláctica a las 12h de la cirugía en los controles) ¿difieren las complicaciones? | ||||||
| 10. En los pacientes con ATT y cirugía precoz ¿el uso de ATX (vs. no) ¿influyen en la tasa de transfusión? | |||||||
| 11. ¿Difieren los niveles plasmáticos de ATX por su administración intravenosa vs. tópica? | |||||||
| 12. La administración de hierro iv (vs. no) ¿afecta a la Hb, la mortalidad, la transfusión, la infección, o a la estancia hospitalaria? | |||||||
| 13. Combinar hierro iv con ATX y una transfusión restrictiva ¿afecta a la tasa de transfusión y de anemia grave? |
AAS: ácido acetil salicílico; ACOD; anticoagulantes orales directos; AAP: antiagregantes plaquetarios; ATT: antitrombóticos; ATX: ácido tranexámico; AVK: antivitaminas K; BNP: bloqueo de nervio periférico; CCP: concentrado de complejo protrombínico; cirugía precoz: dentro de 48 horas tras el ingreso; cirugía tardía: a partir de 48 horas tras el ingreso; ECA: estudios controlados aleatorizados; EO: estudios observacionales; EP: embolia de pulmón; FA: fibrilación auricular; FOC: fractura osteoporótica de cadera; h: horas; Hb: hemoglobina; HBPM: heparina de bajo peso molecular; movilización precoz: sedestación en≤72h tras el ingreso; PFC: plasma fresco congelado; Ref. referencia; SCA: síndrome coronario agudo, T-: tasa; TM: tasa de mortalidad; TVP: trombosis venosa profunda; VCM: válvula cardiaca mecánica.
Se calificó el nivel de evidencia (NE) con el sistema Grado de recomendaciones, apreciación, desarrollo y evaluación (GRADE) en alto, moderado, bajo o muy bajo. Cada recomendación considera la evidencia disponible, el balance entre el beneficio y el riesgo de su implantación y su impacto en la perspectiva de los pacientes, del anestesiólogo y en el sistema de salud. Se considera «recomendación fuerte» cuando su beneficio claramente supera los posibles eventos adversos y «recomendación débil» cuando los efectos beneficiosos y adversos están equilibrados o la evidencia es de baja calidad. Si la recomendación es «fuerte» se recomienda y si es «débil» se sugiere. Las evidencias encontradas se sintetizan y exponen en los suplementos 1 a 8.
Se realizaron 3 rondas Delphi en varios pasos para decidir el grado de recomendación. Posteriormente se envió el artículo a un grupo de expertos multidisciplinar para su aprobación y se incorporaron sus comentarios.
Por último, se realizó una infografía que resume las principales recomendaciones (fig. 2).
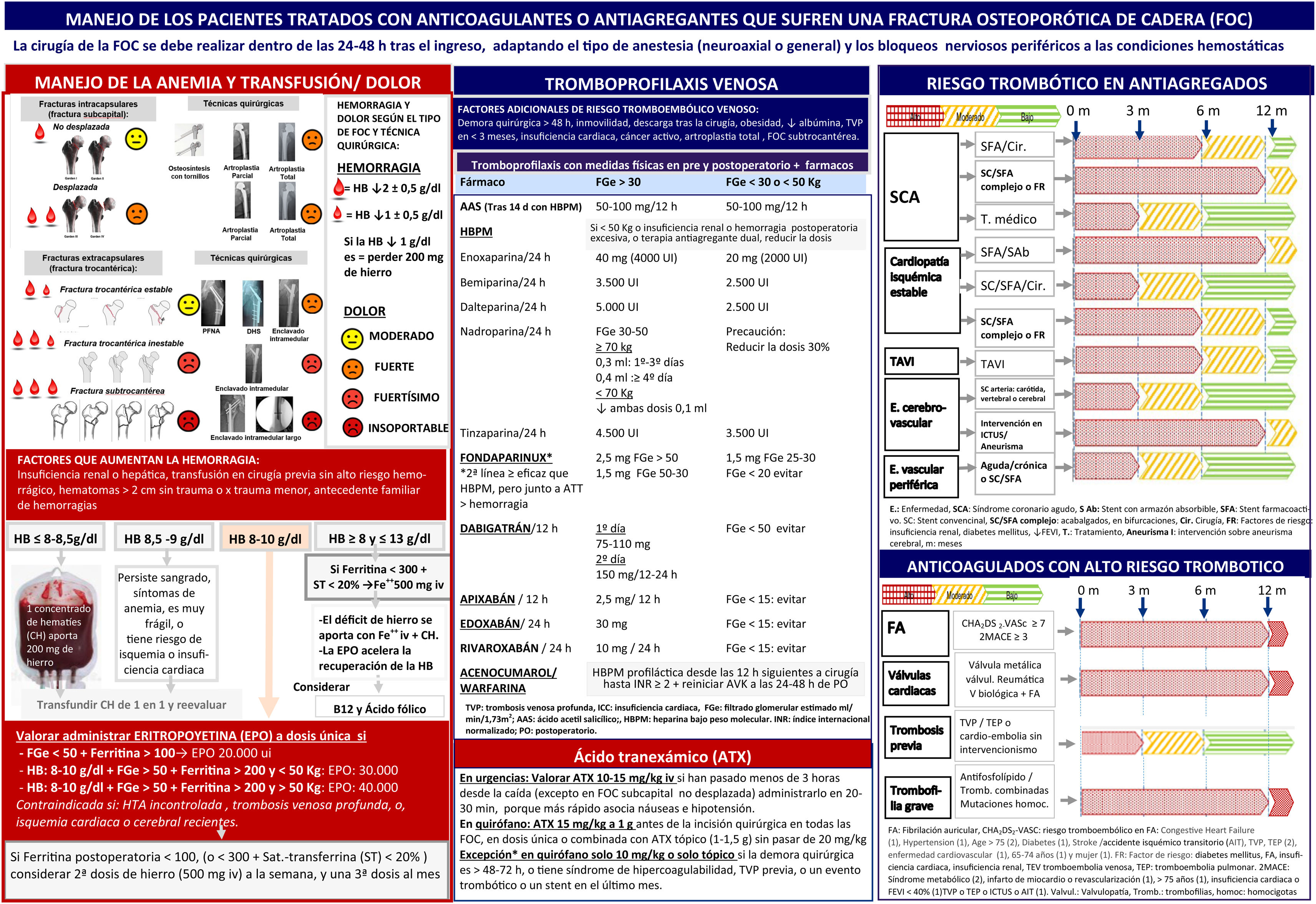
Manejo de los pacientes que estando antiagregados o anticoagulados sufren una fractura de cadera.
A. Imágenes de los tipos de fracturas y técnicas quirúrgicas. Adaptado de: Fischer et al.51, Zhu et al.52, Vallon et al.53 y Rizkalla et al.54
B. Imagen de la estratificación del riesgo trombótico en pacientes antiagregados. Actualización de dicho esquema en Sierra et al.14.
C. Imagen de la estratificación del riesgo trombótico en pacientes anticoagulados.
Fuente: elaborado por los autores
D. Imágenes del manejo preoperatorio y postoperatorio de los antitrombóticos (ATT) en los pacientes con fractura de cadera.
Fuente: elaborado por los autores.
R-1- Se recomienda realizar la cirugía dentro de las 24-48h siguientes al ingreso, pese a estar bajo tratamiento antitrombótico, utilizando esta demora para optimizar la hemostasia, la hemoglobina y las comorbilidades del paciente (NE moderado, R fuerte)4–11,15–21.
R-2- Se recomienda iniciar la movilización del paciente en las 24h siguientes a la cirugía, salvo desestabilización grave4–11,21 (NE moderado, R fuerte).
R-3- Se recomienda adaptar las técnicas regionales (bloqueos nerviosos y anestesia neuroaxial) a las condiciones hemostáticas considerando factores como el tipo de fármaco antitrombótico, el tiempo transcurrido desde la última dosis, la función renal y la hemostasia global4–14,16–20 (NE moderado, R fuerte). Los BNP profundos requieren las mismas condiciones hemostáticas que la anestesia neuroaxial y los BNP compresibles no requieren intervalo libre de antitrombóticos12 (NE moderado, R fuerte).
R-4- Se recomienda valorar la realización preoperatoria de un BNP sobre territorio compresible (fascia ilíaca o femoral) de punción única, dentro de un régimen de analgesia multimodal27–29 (NE moderado, R fuerte).
R-5- Se recomienda realizar la cirugía combinando BNP con sedación, anestesia general o anestesia neuroaxial (según las condiciones hemostáticas) (NE moderado, R fuerte)5–9,27–29.
R-6- Se recomienda sopesar los riesgos y beneficios de realizar una anestesia neuroaxial con un intervalo libre de antitrombóticos menor al recomendado en cirugía programada, frente a una anestesia general combinada con BNP en cada paciente individual12–14 (NE moderado, R fuerte).
R-7- Se recomienda valorar la realización postoperatoria de un BNP si no se ha realizado para la cirugía, dentro de un régimen de analgesia multimodal (NE moderado, R fuerte)5–9,27–29.
R-8- Se recomienda vigilar los signos de hematoma espinal (dolor lumbar, incontinencia y acorchamiento o debilidad de las extremidades inferiores) o perineural (duración excesiva del bloqueo sensitivo y/o motor) desde que se realiza la anestesia regional hasta después de introducir la tromboprofilaxis y los antitrombóticos11 (NE moderado, R fuerte).
Optimización de la hemostasia, la anemia y la transfusión (material suplementario 4) (infografía)R-9- Se recomienda comprobar la hemoglobina de los pacientes al ingreso (NE moderado, R fuerte).
R-10- Se sugiere realizar controles periódicos de hemoglobina, preferiblemente digital, y estar atento a los signos clínicos de anemia desde el ingreso hasta el quinto día del postoperatorio. Además de considerar que la hemoglobina disminuirá entre 2 y 6g/dl (equivalente a perder de 400 a 1.200mg de hierro) durante estos días, dependiendo del tipo de fractura, la técnica quirúrgica utilizada y el tratamiento antitrombótico3 (NE moderado, R débil).
R-11- Se recomienda optimizar la hemoglobina con los principios de ‘PBM desde el ingreso hasta después del alta3,31–36 (NE moderado, R fuerte).
R-12- Se recomienda interrumpir los antitrombóticos al ingreso. Sustituir los antiagregantes por AAS 100mg/24h (o Triflusal 300mg/24h en alérgicos a AAS)12,13. Evitar los antiinflamatorios no esteroideos y administrar profilaxis de hemorragia digestiva (NE moderado, R fuerte).
R-13- En las fracturas de cadera (excepto en la fractura subcapital no desplazada) diagnosticadas en menos de 3h desde la caída que se vayan a intervenir en≤48h, se sugiere valorar el uso de una dosis de ATX (15mg/kg o 1g) iv34 (NE bajo, R débil).
R-14- Se recomienda administrar ATX, antes de la incisión quirúrgica (10-15mg/kg o 1g iv) en dosis única o combinada con ATX tópico (1,5-2g) sin pasar en total de 20mg/kg35(NE moderado, R fuerte).
R-15- Se sugiere valorar reducir la dosis iv de ATX (10mg/kg) si el paciente tiene insuficiencia renal, una demora quirúrgica>72h, un síndrome de hipercoagulabilidad, episodios tromboembólicos previos, un evento trombótico o un stent de antigüedad inferior al tiempo de endotelización (stent convencional: un mes, stent liberador de fármaco: 6 meses) o se administró ATX en urgencias35–36 (NE moderado, R débil).
R-16- Se recomienda un umbral transfusional de hemoglobina postoperatoria de 8-8,5g/dl en los pacientes asintomáticos, individualizándolo si persiste la hemorragia, el paciente tiene cardiopatía isquémica, es muy anciano o es muy frágil33 (NE moderado, R fuerte).
R-17- Se recomienda reiniciar el tratamiento antitrombótico cuando la hemorragia postoperatoria esté controlada y las condiciones hemostáticas recuperadas11–13 (NE moderado, R fuerte).
Tromboprofilaxis venosa (material suplementario 5) (infografía)R-18- Tras la FOC se recomienda considerar que los riesgos de enfermedad tromboembólica venosa y de hemorragia son altos, además se deben considerar los factores de riesgo individuales3,37–40 (NE moderado, R fuerte).
R-19- Se recomienda estandarizar las medidas físicas de tromboprofilaxis en todos los pacientes, entre las que destacan: una demora quirúrgica≤48h, sentar al paciente antes de la cirugía, iniciar la movilización en las 24h siguientes a la cirugía y el uso de dispositivos mecánicos37,41 (NE moderado, R fuerte).
R-20- Se sugiere no administrar heparina de bajo peso molecular (HBPM) preoperatoria si la demora quirúrgica es≤48h en los pacientes previamente anticoagulados o con terapia antiagregante dual40 (NE bajo, R débil).
R-21- Si se prevé una demora quirúrgica>48h y la hemorragia está controlada, se sugiere valorar la tromboprofilaxis venosa farmacológica preoperatoria a partir de las 12-48h del ingreso37,40,41 (NE bajo, débil).
- -
En anticoagulados: (anticoagulantes anti vitamina K [AVK] o anticoagulantes orales directos [ACOD]) heparina de bajo peso molecular (HBPM) profiláctica+medidas físicas.
- -
En antiagregados: AAS 100mg/24h+HBPM profiláctica+medidas físicas.
- -
En los pacientes con hemorragia incontrolada: solo medidas físicas.
R-22- Si se utiliza HBPM se sugiere disminuir la dosis en los pacientes con filtrado glomerular estimado (FGe)≤30ml/min/1,73m2, con bajo peso (≤50kg) o con terapia antiagregante dual previa12,13 (NE bajo, R débil).
R-23- Se recomienda mantener un intervalo libre de HBPM antes de la cirugía considerando factores como el FGe y la dosis de HBPM12,13 (NE bajo, R fuerte).
- •
FGe>30ml/min/1,73m2.
- ∘
Dosis profiláctica→≥12h.
- ∘
Dosis intermedia o anticoagulante→≥24h.
- ∘
- •
FGe<30ml/min/1,73m2.
- ∘
Dosis profiláctica→≥24h.
- ∘
Dosis intermedia o anticoagulante→≥48h.
- ∘
R-24- Se sugiere iniciar la HBPM postoperatoria a dosis profiláctica a las 8-12h de la cirugía (24h de la anterior HBPM si se administró), demorándola a las 24h si el paciente continúa sangrando, o la punción intradural ha sido hemática o muy traumática11,37 (NE bajo, R débil).
Anticoagulantes antivitamina K: acenocumarol o warfarina (material suplementario 6)(infografía)PreoperatorioR-25- Se recomienda interrumpir los AVK y administrar vitamina K (10mgIV) al ingreso en el hospital (incluso en los pacientes con riesgo tromboembólico alto); realizar INR a las 8-12h y si el INR es>1,5→repetir la vitamina K y realizar la cirugía en 24-48h tras el ingreso, sin demorarla por un INR≤1,713,18 (NE moderado, R fuerte).
R-26- En los pacientes con alto riesgo tromboembólico se recomienda la realización de la cirugía en 24-48h con INR≤1,7 en lugar de utilizar terapia puente con HBPM o intentar un INR≤1,2518,42 (NE bajo, R fuerte).
R-27- Si se prevé realizar la cirugía en>48h se sugiere utilizar HBPM preoperatoria a partir de un INR<1,8-2.
- •
Si el riesgo tromboembólico no es alto:→HBPM a dosis profiláctica5,42.
- •
Si el riesgo tromboembólico es alto (válvulas mecánicas o fibrilación auricular con tromboembolia el último mes):→valorar HBPM a dosis intermedia o anticoagulante una vez al día para facilitar la programación quirúrgica5,42 (NE bajo, R débil).
R-28- Se sugiere adaptar el tipo de anestesia al INR monitorizado inmediatamente antes de la anestesia y la cirugía1–12:
- •
INR≤1,25: apto para anestesia neuroaxial o general (NE moderado, R fuerte).
- •
INR 1,26 a 1,5: no contraindica una anestesia neuroaxial ni un BNP profundo (NE bajo, R débil).
- •
INR>1,51- 1,7: se sugiere proceder con BNP superficiales y anestesia general (NE bajo, R débil).
R-29- Si el sangrado intraoperatorio fuera excesivo se sugiere monitorizar el INR y si es>2-2,5 valorar el uso de concentrado de complejo protrombínico a 8-10UI/kg18,42 (NE bajo, R débil).
PostoperatorioR-30- Si el sangrado está controlado se sugiere iniciar la HBPM profiláctica a las 8-12h de la cirugía (24h de la anterior HBPM si se administró) e iniciar el AVK a las 24-72h (evitando la administración simultánea de los AVK con los antibióticos porque pudieran interaccionar incrementando el riesgo hemorrágico). Se sugiere simultanear la HBPM y el AVK hasta alcanzar un INR≥2, momento en el que se debe suspender la HBPM12,13,18,42 (NE bajo, R débil).
Anticoagulantes orales directos (material suplementario 7) (infografía)PreoperatorioR-31- Se sugiere monitorizar los niveles de ACOD en los pacientes con insuficiencia renal (FGe<50 con dabigatrán o FGe<30 con xabanes) si están disponibles4,12,13,18–20. Se sugiere no retrasar la cirugía por alteraciones del estudio de coagulación estándar y si las hay, realizar anestesia general y bloqueos nerviosos superficiales4–6,12,13,18–20,43–46 (NE bajo, R débil).
R-32- Se sugiere no revertir los ACOD con reversores específicos como el idarucizumab (disponible en España) o el andexanet α¯ (no disponible actualmente). Tampoco se recomienda administrar complejo protrombínico4–6,12,13,18–20,43–45 (NE bajo, R débil).
R-33- Se recomienda no utilizar HBPM preoperatoria en los pacientes tratados con ACOD que se intervienen dentro de las 48h siguientes al ingreso37,41,42 (NE bajo, R fuerte).
R-34- Si se prevé una demora quirúrgica>48h se sugiere utilizar HBPM a dosis profiláctica preoperatoria (NE bajo, R débil).
- •
FGe>50, iniciar la HBPM profiláctica a las 24h de la última dosis del ACOD.
- •
FGe<50, iniciar la HBPM profiláctica a las 24-48h de la última dosis del ACOD.
R-35- Se sugiere realizar la cirugía entre las 24-48h siguientes a la última dosis del ACOD adaptando el tipo de anestesia a los niveles plasmáticos de ACOD, y si no están disponibles, al tipo de ACOD, FGe y el tiempo desde la última dosis3,12,13,43–46 (NE bajo, R débil). Con unos niveles de fibrinógeno y recuento plaquetario normales se sugiere3,11,12,43–46:
Con los xabanes (apixabán, edoxabán y rivaroxabán):- •
Niveles plasmáticos≤30ng/ml→aptos para anestesia neuroaxial y BNP profundos (NE moderado, R fuerte).
- •
FGe<30ml/min/1,73m2 (NE bajo, R débil):
- ∘
48h: anestesia general y BNP compresibles.
- ∘
Si la anestesia general está contraindicada excepcionalmente se podría demorar la cirugía 72h tras la última dosis para realizar una anestesia neuroaxial.
- ∘
- •
FGe≥30ml/min/1,73m2 (NE bajo, R débil):
- ∘
24h: anestesia general y BNP compresibles.
- ∘
A las 48h de la última dosis se pueden valorar la anestesia intradural y los BNP profundos.
- ∘
- •
Niveles plasmáticos<30ng/ml→aptos para anestesia neuroaxial y BNP profundos (NE moderado, R fuerte).
- •
FGe<50ml/min/1,73m2 (NE bajo, R débil):
- ∘
48h: anestesia general y BNP compresibles.
- ∘
- •
FGe≥50 y<79ml/min/1,73m2(NE bajo, R débil):
- ∘
36h: anestesia general y BNP compresibles.
- ∘
Si la anestesia general está contraindicada excepcionalmente se podría demorar la cirugía 72h tras la última dosis para realizar una anestesia neuroaxial.
- ∘
- •
FGe≥80ml/min/1,73m2(NE bajo, R débil):
- ∘
24h: anestesia general y BNP compresibles.
- ∘
A las 48h de la última dosis se pueden valorar la anestesia intradural y los BNP profundos.
- ∘
R-36- Se sugiere realizar la tromboprofilaxis venosa postoperatoria con una de las 2 opciones: HBPM o ACOD en dosis profilácticas. Cualquiera de las opciones debe iniciarse tras considerar los niveles plasmáticos del ACOD, y si no se conocen, la demora quirúrgica y el FGe (sin simultanear HBPM y ACOD el mismo día)12,20,41,46,47 (NE bajo, R débil):
- •
Demora quirúrgica de 24h:→iniciar la HBPM o ACOD a las 24h de la cirugía.
- •
Demora quirúrgica de 36-48h:→iniciar HBPM o ACOD a las 8-12h de la cirugía.
- •
Si el FGe es≤30ml/min/1,73m2 se sugiere utilizar HBPM adaptada a la insuficiencia renal.
R-37- A las 48h de la cirugía se sugiere pasar a la dosis habitual de ACOD adaptada al FGe12,20,41,46,47 interrumpiendo la HBPM si se estaba administrando (NE bajo, R débil).
Antiagregantes plaquetarios (material suplementario 4,5 y 8) (infografía)PreoperatorioR-38- Se recomienda realizar la cirugía dentro de las 24-48h siguientes al ingreso con cualquier régimen antiagregante. Los pacientes tratados con AAS a dosis ≤200mg o Triflusal a dosis ≤300mg no requieren demora13,14 (NE moderado, R fuerte).
R-39- Se sugiere interrumpir los antiagregantes plaquetarios (AAP) al ingreso y sustituirlos por AAS 100mg o triflusal 300mg (en alérgicos a AAS)13,14 (NE moderado, R débil).
R-40- Se sugiere adaptar el inicio de la tromboprofilaxis venosa preoperatoria con HBPM a la demora quirúrgica y al riesgo hemorrágico asociado al régimen antiagregante (NE moderado, R débil):
- •
Clopidogrel/prasugrel/ticagrelor+AAS: se sugiere iniciar la HBPM solo si se prevé un retraso>48h administrándola a ½ de dosis profiláctica habitual a partir de las 24h del ingreso si la hemorragia está controlada37,41,48.
- •
Otro régimen antiagregante:
- ∘
Cirugía en≤24h se sugiere no utilizar HBPM preoperatoria37,41,48.
- ∘
Cirugía en>24h se sugiere administrar AAS 100mg+HBPM a dosis profiláctica a partir de las 12-24h del ingreso.
- ∘
R-41- En presencia de AAS (≤200mg) o triflusal (≤300mg) se recomienda utilizar la anestesia neuroaxial y cualquier BNP sin catéter14 (NE bajo, R fuerte).
R-42- Se sugiere realizar los BNP compresibles sin catéter y anestesia general a las 24-48h de la última dosis de cualquier AAP (diferente a AAS ≤200mg o Triflusal ≤300mg) en monoterapia o terapia dual12–14 (NE bajo, R débil).
R-43- Excepcionalmente, si la anestesia general comporta un grave riesgo, se sugiere valorar la anestesia neuroaxial con un tiempo libre de antitrombóticos menor al recomendado en cirugía programada, exclusivamente si se cumplen los siguientes 3 requisitos13,30,49 (NE bajo, R débil):
- •
Un recuento plaquetario y de fibrinógeno normales.
- •
Ausencia de enfermedad hematológica o de tratamiento anticoagulante y cumple el intervalo libre de HBPM recomendado.
- •
Se estima que se dispone de 70.000-80.000 plaquetas/μl funcionales13 (mínimas necesarias para realizar una anestesia neuroaxial) en una de las 2 situaciones:
- 1.
El paciente agrega en las pruebas de agregación plaquetaria.
- 2.
Tras interrumpir los AAP y sustituirlos por AAS 100mg se renuevan del 10% al 15% de las plaquetas inhibidas cada día14. Según la reversibilidad y potencia antiagregante se alcanzarían≥70.000-80.000 plaquetas/μl funcionales en los siguientes plazos:
- ∘
A las 24h de la última dosis de dipiridamol o cilostazol.
- ∘
A las 48-72h de la última dosis de clopidogrel en monoterapia.
- ∘
A las 72h de la última dosis de clopidogrel/ticagrelor+AAS.
- •
En los pacientes con prasugrel se sugiere realizar BNP compresibles y anestesia general en 24-48h tras el ingreso (NE bajo, R débil).
- 1.
R-44- Si el sangrado intraoperatorio fuera excesivo, a pesar de administrar ATX, se sugiere monitorizar la hemostasia y valorar la transfusión de plaquetas y/o la administración de desmopresina (≤0,3μg/kg)14 (NE bajo, R débil).
PostoperatorioR-45- Se sugiere reiniciar los antiagregantes con la hemorragia controlada valorando el tiempo de interrupción, el tiempo hasta el inicio de acción y la potencia del AAP13,50 (NE bajo, R débil).
- •
AAS 100mg y triflusal 300mg:→6-12h postoperatorio.
- •
Clopidogrel, dipiridamol, cilostazol:→24-48h postoperatorio.
- •
Prasugrel, ticagrelor:→24-72hpostoperatorio.
R-46- Se sugiere priorizar la reintroducción del AAS y los AAP crónicos del paciente junto a medidas físicas de tromboprofilaxis venosa sobre la introducción de HBPM (NE bajo, R débil).
R-47- Se sugiere realizar la tromboprofilaxis venosa postoperatoria con HBPM a dosis profiláctica iniciándola a las 8-12h de la cirugía (manteniendo 24h de la anterior HBPM si se administró). En los pacientes con clopidogrel/presugrel/ticagrelor+AAS se sugiere utilizar la HBPM a ½ de dosis profiláctica habitual (NE bajo, R débil).
R-48- En pacientes seleccionados por un alto riesgo hemorrágico y con las tres condiciones siguientes: 1) una demora quirúrgica no mayor de 48 h; 2) que caminan tras la fractura de cadera, y 3) que no presentan factores de riesgo adicionales de trombosis venosa profunda (TVP)a, tras 14 días de tratamiento con HBPM, se sugiere valorar continuar con la HBPM y su régimen antiagregante o con una de las siguientes opciones de tromboprofilaxis:
- •
Tras 14 días con clopidogrel/prasugrel/ticagrelor+AAS+HBPM a ½ de dosis profiláctica habitual, si presenta alto riesgo hemorrágico, se sugiere valorar suspender la HBPM, si cumple las 3 condiciones37,41,48 (NE bajo, R débil).
- •
Tras 14 días con AAS 100mg/24h+HBPM, si presenta alto riesgo hemorrágico se sugiere valorar realizar la tromboprofilaxis venosa con AAS 50-100mg/12h y suspender la HBPM, si cumple las 3 condiciones37,41,48 (NE bajo, R débil).
Desde la Sección de Hemostasia, Fluidoterapia y Transfusión de la Sociedad Española de Anestesia, Reanimación y terapéutica del Dolor (SEDAR) se proponen 48 recomendaciones que ofrecen un plan de actuación perioperatoria multimodal con el objetivo de proceder con la cirugía de la FOC dentro de las 48h siguientes al ingreso con seguridad en los pacientes anticoagulados o antiagregados. Las recomendaciones resumen el manejo perioperatorio óptimo de estos pacientes de forma sencilla, práctica y fácil de implantar por un equipo multiprofesional. Se deben adaptar al contexto de cada hospital tras realizar un análisis juicioso del riesgo-beneficio de la demora quirúrgica, del tipo de analgesia y de la técnica anestésica óptima, de la estrategia de manejo de los antitrombóticos (incluyendo la tromboprofilaxis venosa), de la optimización de la hemostasia y la hemoglobina y de los recursos disponibles.
En la mayoría de los pacientes tratados con antitrombóticos se considera óptima la realización de BNP compresible y anestesia general. No obstante, si la anestesia neuroaxial puede mejorar la morbimortalidad de un paciente particular, podría justificarse su realización con unas condiciones hemostáticas diferentes a las de la cirugía programada (material suplementario 6-8). Esta decisión debe basarse en un balance de riesgos y beneficios, debe ser una decisión multidisciplinar y compartida con el paciente o su cuidador y debe reflejarse en la historia clínica.
En la tromboprofilaxis perioperatoria se sugiere valorar el cambio de paradigma recientemente propuesto37,41. Por un lado, el efecto residual de los AVK y ACOD parece suficiente para la tromboprofilaxis preoperatoria si la cirugía se realiza en las primeras 48h, permite obviar la HBPM preoperatoria y aumenta la seguridad de la cirugía precoz y de las técnicas regionales. Además, en los pacientes anticoagulados con ACOD, su uso postoperatorio iniciándolos a dosis de tromboprofilaxis venosa permite obviar la HBPM y ha mostrado ser una buena práctica. Por otro lado, el AAS puede reducir la agregación y activación plaquetaria, y la actividad de la protrombina y del fibrinógeno, a la vez que parece favorecer la fibrinólisis40,48. El AAS combinado con la deambulación precoz se ha mostrado eficaz para la tromboprofilaxis venosa en la FOC, puede asociar menos sangrado que otras combinaciones de antiagregantes con HBPM, es más cómoda para el paciente y más económica para el sistema de salud37,40,41, no obstante, la evidencia sobre la eficacia de la HBPM para la tromboprofilaxis en la FOC es mucho mayor que con el AAS. Por otra parte, una vez cumplido el periodo de tromboprofilaxis con AAS 100mg/12h se deberá mantener el AAS 100mg/24h, en ningún caso se debe interrumpir definitivamente la antiagregación en quienes la necesitan.
El material suplementario 1-8 sintetiza la evidencia disponible en el manejo de los pacientes tratados con antitrombóticos y con FOC y la justificación de las recomendaciones. No obstante, la principal limitación de las recomendaciones es que son débiles porque la mayoría se basan en estudios observacionales; las recomendaciones fuertes se apoyan en estudios aleatorizados con muestras pequeñas de pacientes o en estudios observacionales con control de sesgos, por tanto, persisten incertidumbres que se deberán revisar y modificar ante nuevas evidencias. Estas recomendaciones no eximen a los profesionales de analizar las circunstancias particulares de cada paciente para establecer las indicaciones más adecuadas en cada caso y contexto. Además, se deben realizar estudios de seguimiento de los cambios propuestos y actualizar los protocolos con las nuevas evidencias.
ConclusionesEn el manejo de los pacientes tratados con antitrombóticos que sufren una FOC se debe proporcionar una analgesia multimodal que incluya un BNP compresible desde el ingreso del paciente, realizar la cirugía dentro de las 48h siguientes al ingreso bajo BNP y anestesia general o neuroaxial adaptadas a las condiciones hemostáticas, realizar todas las medidas dirigidas a preservar la sangre del paciente desde el ingreso (optimizar la hemoglobina y la hemostasia, prevenir la hemorragia y transfundir los concentrados de hematíes de uno en uno solo cuando sea estrictamente necesario), reiniciar su régimen antitrombótico tan pronto como sea posible con la hemorragia controlada y las condiciones hemostáticas recuperadas y, por último, realizar la tromboprofilaxis venosa combinando la movilización precoz (sentar al paciente en el preoperatorio y el primer día postoperatorio e iniciar la deambulación al día siguiente de la cirugía) con los fármacos que mejor se adapten a las comorbilidades y tratamiento antitrombótico crónico del paciente. Estas recomendaciones buscan mejorar el bienestar, la recuperación funcional y la vuelta al domicilio habitual de los pacientes, además de disminuir la variabilidad en el manejo perioperatorio y reducir la ocupación de camas hospitalarias de los pacientes con FOC.
AutoríaC. Cassinello contribuyó a la elaboración de preguntas PICO y coordinación de la redacción del artículo. Todos los autores contribuyeron a la redacción, revisión crítica, edición, revisión y presentación final del manuscrito.
Todos los autores garantizan que las preguntas se han investigado en profundidad para obtener las mejores prácticas de las que derivan todas las recomendaciones. Además, se consideraron los comentarios y sugerencias del comité de expertos multidisciplinar en la elaboración final del documento.
AvalesEl artículo está avalado por la Sociedad Española de Anestesia y Reanimación, Sección de Hemostasia (SEDAR), por la Sociedad Española de Fracturas Osteoporóticas (SEFRAOS), por el Registro Nacional de Fractura de Cadera (RNFC), por la Sociedad Española de Geriatría y Gerontología (SEGG) y por la Sociedad Española de Medicina Interna (SEMI).
FinanciaciónEl manuscrito no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Especialmente agradecemos la colaboración de la ingeniera industrial Macarena Cassinello en el cálculo del efecto residual de clopidogrel, ticagrelor y prasugrel y de los xabanes a las 24 y 48horas de la última dosis; la excelente revisión y aportaciones del equipo de expertos multidisciplinar y el apoyo del vicepresidente segundo de la SEDAR, Dr. César Aldecoa, y de los vicepresidentes de la Sección de Hemostasia, Dra. Misericordia Basora y Dra. M.ª José Colomina.
Rafael Bielza. Servicio de Geriatría, Hospital Universitario Infanta Sofía. Madrid, España.
Mª Carmen Cervera. Servicio de Geriatría, Hospital Clínico Universitario de Valladolid. Valladolid, España.
Patricia Cordohuran. Servicio de Geriatría, Hospital Universitario La Paz. Madrid, España.
Leonor Cuadra. Servicio de Geriatría, Consorci Sanitari de Terrassa. Terrassa, España.
Gregorio Jiménez. Servicio de Geriatría, Hospital Universitario Príncipe de Asturias. Alcalá de Henares, Madrid, España
Angélica Muñoz. Servicio de Geriatría, Complejo Asistencial de Segovia. Segovia, España
Teresa Pareja. Servicio de Geriatría, Hospital Universitario Guadalajara. Guadalajara, España.
Pilar Sáez-López. Servicio de Geriatría, Hospital Universitario Fundación Alcorcón. Madrid, España.
Ana Granados. Servicio de Medicina Interna. Hospital Parc Taulí. Sabadell, España
Enrique Hueso. Servicio de Medicina Interna, Hospital Universitario Miguel Servet. Zaragoza, España
Patxi Huici. Servicio de Medicina Interna, Hospital Universitario Miguel Servet. Zaragoza, España.
Jesús Lasso. Servicio de Medicina Interna, Hospital Universitario Miguel Servet. Zaragoza, España.
Olga Madridiano. Servicio de Medicina Interna, Hospital Universitario Infanta Sofía. Madrid, España.
Eduardo Montero. Coordinador del GT Asistencia Compartida y Medicina Consultiva de la Sociedad Española de Medicina Interna.
Laura Pérez. Servicio de Medicina Interna, Hospital Ramón y Cajal. Madrid, España.
José Manuel Rodríguez. Servicio de Medicina Interna, Hospital Universitario de Cruces. Bilbao, España.
David Rubal. Servicio de Medicina Interna, Hospital Universitario Lucus Augusti. Lugo, España.
Christian Velardo Andrés. Servicio de Medicina Interna, Hospital Virgen del Puerto. Plasencia, España.
José Ramón Caeiro. Servicio de Traumatología, Complejo Hospitalario Universitario de Santiago. Santiago de Compostela, España.
Javier Escalera. Servicio de Traumatología, Hospital Universitario Infanta Sofía. Madrid, España.
Íñigo Etxebarría. Servicio de Traumatología, Hospital Alto Deba. Guipúzcoa, España.
Ricardo Larrainzar. Servicio de Traumatología, Hospital Universitario Infanta Leonor. Madrid, España.
Néstor López. Servicio de Traumatología, Hospital Universitario Infanta Sofía. Madrid, España.
Cristina Ojeda. Servicio de Traumatología, Hospital Universitario 12 de Octubre. Madrid, España.
Adrián Roche. Servicio de Traumatología, Hospital Universitario Miguel Servet. Zaragoza, España.
José Antonio García Erce. Banco de Sangre y Tejidos, Servicio Navarro de Salud. Navarra, España.
Regina Herráez. Servicio de Hematología, Hospital Universitario Infanta Sofía. Madrid, España.
Pilar Llamas. Servicio de Hematología, Hospital Fundación Jiménez Diaz. Madrid, España.
Juan Vázquez. Servicio de Hematología. Hospital Universitario Infanta Sofía. Madrid, España.
Eduardo Bustamante. Servicio de Urgencias, Hospital Universitario Miguel Servet. Zaragoza, España.
Mariam Javierre. Servicio de Urgencias, Hospital Universitario Miguel Servet. Zaragoza, España.
César Aldecoa. Servicio de Anestesiología, Hospital Río Hortega de Valladolid. Valladolid, España.
Rafael Anaya. Servicio de Anestesiología, Hospital General Universitario Gregorio Marañón. Madrid, España.
Misericordia Basora. Servicio de Anestesiología, Hospital Clinic. Barcelona, España.
Elvira Bisbe. Servicio de Anestesiología, Hospital del Mar. Barcelona, España.
Fernando Cassinello. Servicio de Anestesiología, Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife. Tenerife, España.
M.a José Colomina. Servicio de anestesiología, Hospital de Bellvitge. Barcelona, España.
Josefina Cubes. Servicio de Anestesiología, Complejo Hospitalario Universitario de Santiago. Santiago de Compostela, España.
José de Andrés. Servicio de Anestesiología, Hospital General Universitario de Valencia. Valencia, España.
Agustín Diaz. Servicio de Anestesiología, Hospital Universitario de Salamanca. Salamanca, España.
Ana Díez. Servicio de Anestesiología, Hospital General de Segovia. Segovia, España.
Lourdes Durán. Anestesióloga experta en hemostasia y técnicas de preservación de la sangre. Madrid, España.
Roxana Gutiérrez. Servicio de Anestesiología, Hospital Universitario Infanta Sofía. Madrid, España.
Pilar Herranz. Servicio de Anestesiología, Hospital Universitario Miguel Servet. Zaragoza, España.
Marta Eugenia Infantes. Servicio de Anestesiología, Hospital Universitario Miguel Servet. Zaragoza, España.
Lourdes Muñoz. Servicio de Anestesiología, Hospital Universitario Guadalajara. Guadalajara, España.
Antonio Pérez Ferrer. Servicio de Anestesiología, Hospital Universitario Infanta Sofía. San Sebastián de los Reyes, Madrid, España.
Mireia Rodríguez. Servicio de Anestesiología, Hospital Sant Pau. Barcelona, España.
Ana Ruiz. Servicio de Anestesiología, Hospital Clinic. Barcelona, España.
Luis Miguel Torres. Anestesiólogo experto en hemostasia y anestesia regional. Cádiz, España.
M.a José Martínez Zapata. Centro Cochrane Iberoamericano-Servicio de Epidemiologia Clínica, Hospital Sant Pau. Barcelona, España.
“Se relacionan los nombres y filiaciones del grupo multidisciplinar en el anexo 1”.
Factores de riesgo adicionales de TVP: descarga tras la cirugía, antecedentes de TVP o embolia pulmonar, obesidad, insuficiencia cardiaca congestiva, hipoalbuminemia, trombosis los últimos 3 meses, cáncer activo o síndrome de hipercoagulabilidad.