El propéptido aminoterminal del procolágeno tipo I (P1NP) es un marcador de formación ósea que se altera en afecciones óseas tales como la osteoporosis. El objetivo de este estudio es ver la utilidad del marcador en el diagnóstico de la osteoporosis en una población de pacientes sometidos a un trasplante renal (TR).
Material y métodosNoventa pacientes sometidos a un TR (60 varones, 30 mujeres) con una edad media±desviación estándar (DE) de 55±15 años. Se determinó en suero P1NP, creatinina, paratirina (PTH) y vitamina D, en situación pretrasplante, a los 3 meses y al año. Se estimó el filtrado glomerular con la fórmula MDRD abreviado y se registró la terapia inmunosupresora. Se realizó una densitometría ósea a los 3 meses del trasplante. Según los criterios de la Organización Mundial de la Salud se clasificó la muestra en población con masa ósea baja (T-score<−1 DE) y población normal (T-score⩾−1 DE).
ResultadosNo se observó correlación entre la concentración de P1NP y la función renal. Un 64% de los pacientes presentaron una masa ósea baja. El paciente con densidad mineral ósea disminuida presentaba unos valores de P1NP en situación pretrasplante mayores, respecto a los pacientes con masa ósea normal. El análisis de regresión logística puso de manifiesto que P1NP (p=0,028; odds ratio=10,755) podría ser un marcador de masa ósea baja independiente de la edad, el sexo, la dosis de glucocorticoides y la PTH (covariables en el estudio).
ConclusionesEl P1NP es un buen marcador para estimar el estado óseo en el paciente renal. El valor de P1NP en situación pre-trasplante sería indicativo de un mayor riesgo de presentar una masa ósea disminuida.
Type I procollagen N-terminal propeptide (P1NP) is a marker of bone formation which is altered in bone diseases such as osteoporosis. The objective of this study was to evaluate the use of this marker in the diagnosis of osteoporosis in patients who undergo a renal transplant.
Material and methodsNinety RT (renal transplant) patients (60 men, 30 women) with a mean age of 55±15 years were evaluated. Serum P1NP, creatinine, parathyroid hormone (PTH), and vitamin D were measured at baseline and at 3 months and 1 year after transplantation. The glomerular filtration rate was estimated using the Modification of Diet in Renal Disease (MDRD) formula and immunosuppression therapy was recorded. A bone densitometry scan was performed 3 months after transplant. The patients were classified,according to WHO guidelines, into two populations: a group with low bone mass (T-score<−1SD) and a normal group (T-score⩾−1SD).
ResultsNo correlation was observed between P1NP conentrations and kidney function. A low bone mass was seen in 64% of the RT patients. Patients in the group with low bone mass had higher pretransplant levels of P1NP compared to those in the normal group. The logistic regression analysis showed that P1NP (P=.028; OR=10.755) could be a marker of low bone mass, regardless of age, sex, glucosteroid dose and PTH (covariables in the study).
ConclusionsP1NP is a good marker for estimating bone status in renal transplanted patients. Pretransplant P1NP values could be indicative of a higher risk of having a decreased bone mass.
La osteoporosis es una de las complicaciones más prevalentes en el paciente renal, cuya manifestación favorece una elevada morbilidad1–4. El tratamiento sustitutivo renal, la vida sedentaria, los inmunosupresores5,6 y el hiperparatiroidismo7, entre otros, favorecen la alteración ósea, afectando principalmente al hueso trabecular de la columna lumbar y al fémur proximal8,9. En este estudio se ha decidido utilizar la densitometría ósea basándose en los criterios establecidos por la Organización Mundial de la Salud (OMS) para las mujeres y los criterios de la International Society for Clinical Densitometry (ISCD) en caso de varones, como prueba para la clasificación de la masa ósea, atendiendo que es el método de elección para el estudio de la enfermedad osteoporótica. La densitometría permite una medida estática de la densidad mineral ósea (DMO)10. El uso de los marcadores bioquímicos es útil para evaluar el proceso del remodelado óseo, lo que refleja la actividad funcional de las células óseas encargadas del proceso, los osteoblastos y los osteoclastos11. En la literatura médica podemos encontrar muchos estudios que relacionan marcadores de formación ósea, como la fosfatasa alcalina ósea (FAO) o la osteocalcina (OC), así como marcadores de resorción como el telopéptido aminoterminal del colágeno tipo I (NTX) y la desoxipiridolina (DPD), con la disminución de la densidad ósea12. Uno de los problemas principales de estos marcadores es que tienen una eliminación renal, a excepción de la FAO que debido a su elevado peso molecular, no se elimina por esta vía11. Los resultados de estos marcadores pueden verse falsamente elevados en el paciente sometido a trasplante renal debido a la disminución del filtrado glomerular, sobre todo en la fase pretrasplante12,13. Por ello, nos planteamos el estudio de un nuevo marcador de formación ósea, el propéptido aminoterminal del colágeno tipo I (P1NP), que presenta un aclaramiento mayoritariamente hepático, que se ve alterado en enfermedades hepáticas como la cirrosis14,15.
El P1NP es una proteína circulante liberada por los osteoblastos durante el proceso de síntesis del colágeno tipo I, predominante en la matriz ósea. La molécula de colágeno se sintetiza en el interior de los osteoblastos en forma de su precursor, el procolágeno tipo I, que cuando es liberado al exterior se escinde en sus extremos amino (P1NP) y carboxiterminal (PCNP). La cantidad de colágeno sintetizada es proporcional a las concentraciones de P1NP y PCNP circulantes en plasma. Hay estudios que demuestran que para el estudio de la osteoporosis, el P1NP tiene una mayor sensibilidad que el PCNP16.
El objetivo de nuestro estudio es determinar la utilidad clínica del P1NP como marcador de la evolución de la masa ósea en una población de pacientes sometidos a trasplante renal, así como analizar la relación entre el P1NP y otros parámetros bioquímicos y situaciones clínicas presentes en el paciente renal.
Material y métodosPoblaciónPara el estudio se analizó una población de 90 individuos (60 varones, 30 mujeres) con una edad media±desviación estándar (DE) de 55±15 años, sometidos a un trasplante renal en el Hospital Germans Trias i Pujol, durante el período de marzo de 2004 a marzo de 2007. Un 17,6% de la población presentaba diabetes mellitus antes del trasplante. En relación con los inmunosupresores cabe destacar que un 100% de la población recibió prednisona. La dosis de prednisona establecida fue de 500mg de metilprednisona el día de la intervención quirúrgica, 125mg el primer día postrasplante y 20mg a partir del segundo día con disminución progresiva de la dosis, hasta los 6 meses, donde se instaura la dosis de 5mg para todos los pacientes. Respecto a los anticalcineurínicos, a los 3 meses del trasplante, un 26% se trataron con ciclosporina y el 74% restante con tacrolimus.
Se utilizó un grupo control de 111 individuos sanos (61 varones, 50 mujeres), con una edad media±DE de 43±22 años, sin enfermedad ósea conocida, procedentes de banco de sangre.
Parámetros bioquímicosPropeptido aminoterminal del colágeno tipo IEl estudio del P1NP se realizó mediante un inmunoensayo de electroquimioluminiscencia automatizado, en el analizador Modular Analytics E170, de Roche Diagnostics, con un intervalo de medición de 5–1.200ng/ml y coeficiente de variación (CV) del 3,8%. Se determinó en el momento del pretrasplante (basal), a los 3 meses y al año de la intervención, para el grupo de trasplante renal. Para el grupo control, sólo se realizó una determinación.
Función renalSe analizaron las concentraciones de creatinina en suero en el analizador Modular Analitics DP, de Roche Diagnostics, método picrato alcalino cinético.
Se estimó el filtrado glomerular mediante la ecuación abreviada MDRD (modification of diet in renal disease) (MDRD-4), que requiere valores séricos de creatinina (μmol/l), edad (años), sexo y raza:
FG estimado (ml/min/1,73m2)=186×(creatinina/88,4)−1,154×(edad)−0,203×(0,742 si mujer)×(1,210 si raza negra).
ParatirinaSe analizó la concentración de PTH en suero en cada tiempo del estudio, basal, 3 meses y al año de la intervención, en el analizador Modular Analytics E170, de Roche Diagnostics, mediante un inmunoensayo de electroquimioluminiscencia no competitivo de fase sólida. La linealidad de la técnica corresponde al intervalo de 1,2 a 5.000pg/ml y el coeficiente de variación del 2,5%.
25-hidroxivitamina DSe determinaron valores de 25-hidroxivitamina D, forma predominante de vitamina D en circulación sanguínea en cada uno de los 3 tiempos del estudio, mediante un método de radioinmunoensayo de la firma comercial DIASORIN. La linealidad de la técnica corresponde al intervalo de 4–100ng/ml y coeficiente de variación del 4,4%.
DensitometríaEl estudio de la densidad mineral ósea se realizó mediante la densitometría a los 3 meses del trasplante renal. Se determinó el valor de la DMO en la cadera lumbar, la columna total y el cuello de fémur, mediante un densitómetro Lunar Prodigy (General Electric). Se clasificó la población en hueso normal o patológico en función del valor de T, parámetro que refleja el riesgo de fractura y que permite segmentar la población en pacientes normales con valores de T⩾−1 DE, pacientes osteopénicos con valores de T entre −1 a −2,5 DE y osteoporosis con valores de T⩽−2,5 DE, según el criterio establecido por la OMS17 y los criterios de la ISCD.
En nuestro estudio se agrupa la población según los valores de T en 2 grupos: población pacientes con osteoporosis y/u osteopenia (OP), y población (ON) con estado óseo normal (ON).
EstadísticaEl análisis estadístico se realizó utilizando el programa SPSS versión 14.0 para sistema Windows. La prueba de Kolmogorov-Smirnov mostró que las variables no seguían una distribución normal, por lo que se utilizaron pruebas no paramétricas para el análisis de los resultados. Se expresan el valor de las variables mediante la mediana y el percentil 25–75. Para la toma de decisiones se fijó un nivel de significación de 0,05.
Se estableció un modelo de regresión logística para analizar la presencia de osteoporosis y/o osteopenia en la población de pacientes trasplantados renales. El objetivo de este modelo fue el de caracterizar la probabilidad de presentar esta enfermedad en función de un conjunto de características de los pacientes: edad, sexo, dosis de glucocorticoides, concentración de PTH, y el indicador de valores elevados para el marcador P1NP (percentil 75, P1NP75).
Debido a que el tamaño muestral de la población de pacientes trasplantados renales no era homogénea (un 17,6% de diabéticos), en el análisis de regresión logística se tuvo en cuenta solamente la población no diabética.
El estudio fue aprobado por el comité ético local y todos los pacientes firmaron el consentimiento informado para su participación.
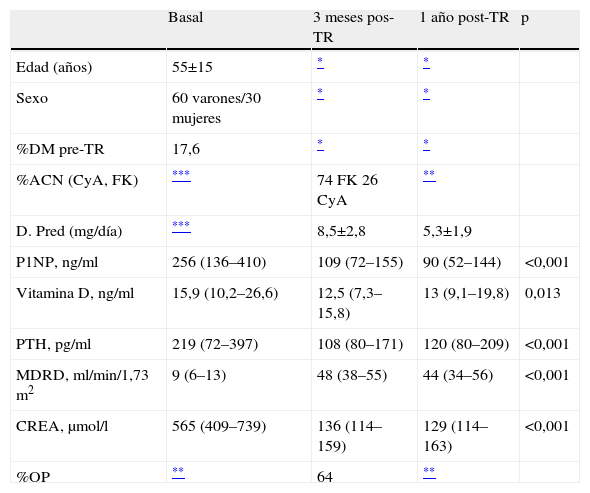
ResultadosCaracterísticas poblaciónLas características clínicas y los marcadores bioquímicos de la población de pacientes renales se expresan en la tabla 1.
Características clínicas y bioquímicas de la población de estudio
| Basal | 3 meses pos-TR | 1 año post-TR | p | |
| Edad (años) | 55±15 | * | * | |
| Sexo | 60 varones/30 mujeres | * | * | |
| %DM pre-TR | 17,6 | * | * | |
| %ACN (CyA, FK) | *** | 74 FK 26 CyA | ** | |
| D. Pred (mg/día) | *** | 8,5±2,8 | 5,3±1,9 | |
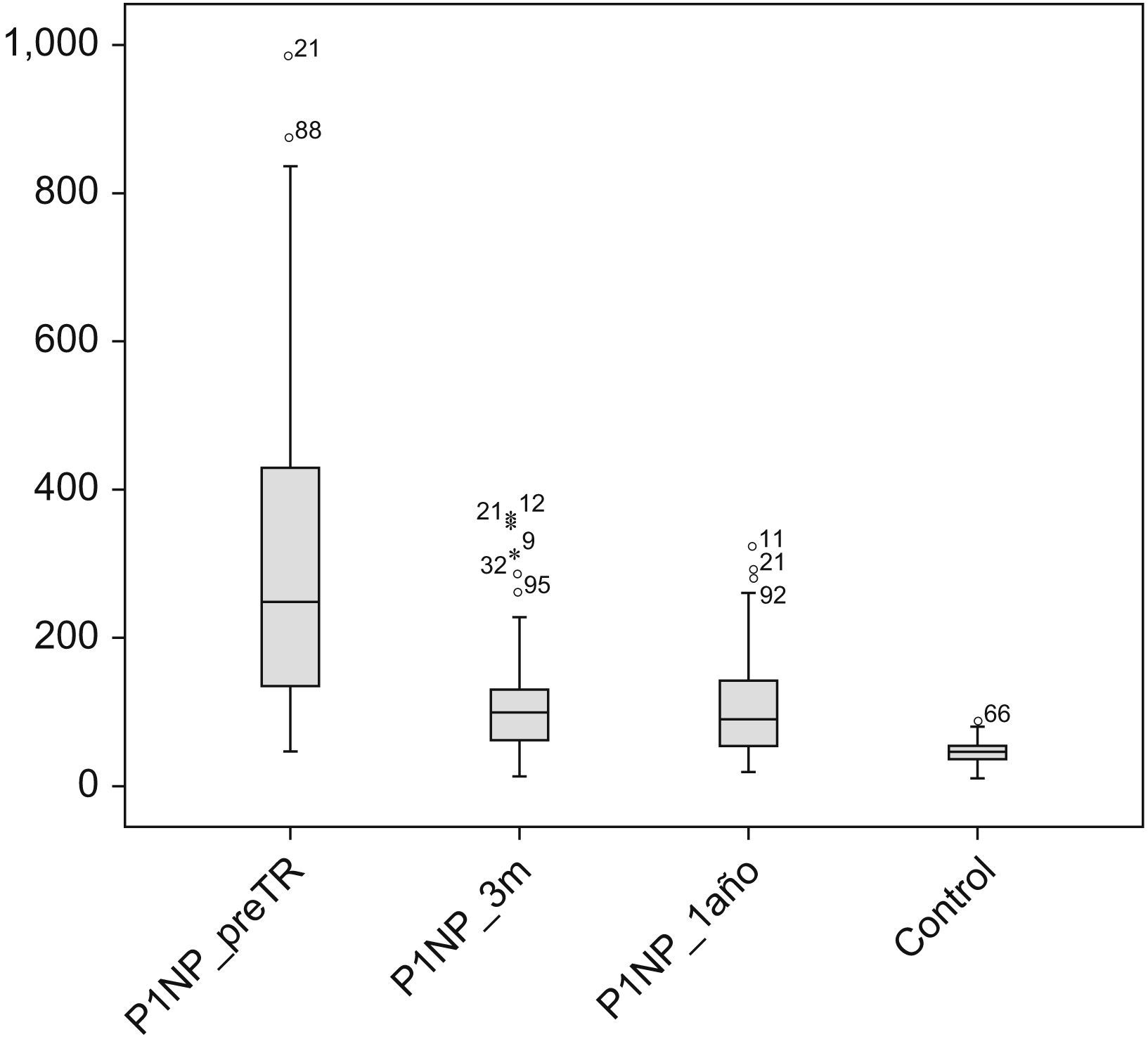
| P1NP, ng/ml | 256 (136–410) | 109 (72–155) | 90 (52–144) | <0,001 |
| Vitamina D, ng/ml | 15,9 (10,2–26,6) | 12,5 (7,3–15,8) | 13 (9,1–19,8) | 0,013 |
| PTH, pg/ml | 219 (72–397) | 108 (80–171) | 120 (80–209) | <0,001 |
| MDRD, ml/min/1,73m2 | 9 (6–13) | 48 (38–55) | 44 (34–56) | <0,001 |
| CREA, μmol/l | 565 (409–739) | 136 (114–159) | 129 (114–163) | <0,001 |
| %OP | ** | 64 | ** |
%DM: porcentaje de diabéticos en situación pretrasplante; ACN: anticalcineurínicos; CyA: ciclosporina A; CREA: creatinina; D. Pred: dosis de prednisona; FK: tacrolimus; MDRD: ecuación para estimar el filtrado glomerular; OP: hueso alterado: población osteoporótica y/o osteopénica; P1NP: propéptido aminoterminal del colágeno tipo I; Post-TR: postrasplante renal; Pre-TR: pretrasplante renal; PTH: paratirina; vitamina D: 25-hidroxivitamina D.
P1NP, vitamina D, PTH, MDRD y CREA se expresan como su mediana (P25–P75).
p=prueba de Friedman.
La figura 1 muestra las concentraciones del P1NP en los distintos momentos del estudio (pretrasplante, 3 meses y 12 meses postrasplante renal), así como los valores de la población control. Como se puede observar las concentraciones de P1NP de la población renal son muy superiores en todos los tiempos estudiados a las del grupo control 43 (12–74)ng/ml.
Respecto a la edad, el P1NP no presenta diferencias significativas en la población de trasplante renal. Si que hay diferencias significativas en relación con el sexo; el colectivo de las mujeres es el que presenta los valores de P1NP más elevados (mujeres P1NP pretrasplante, 330ng/ml; varones P1NP pretrasplante, 225ng/ml; p=0,003). Cuando se analiza la presencia de la diabetes mellitus se observa que no hay diferencias estadísticamente significativas en los valores de P1NP.
P1NP y la función renalAl analizar la función renal observamos que no existe correlación en ningún tiempo del estudio entre P1NP y los parámetros de función renal analizados: valores de creatinina y la estimación del filtrado glomerular según la ecuación MDRD-4.
P1NP, PTH y 25-hidroxivitamina DEn relación con la PTH, hay correlación en todos los tiempos del estudio entre P1NP y PTH (P1NP basal y PTH basal: r=0,522; [p<0,0001]; P1NP 3 meses y PTH 3 meses: r=0,278 [p=0,015]; P1NP año y PTH año: r=0,482 [p<0,001]).
Hay una correlación negativa estadísticamente significativa entre el P1NP y los valores de vitamina D al año del trasplante (P1NP año y vitamina D año: r=−0,319 [p=0,029]).
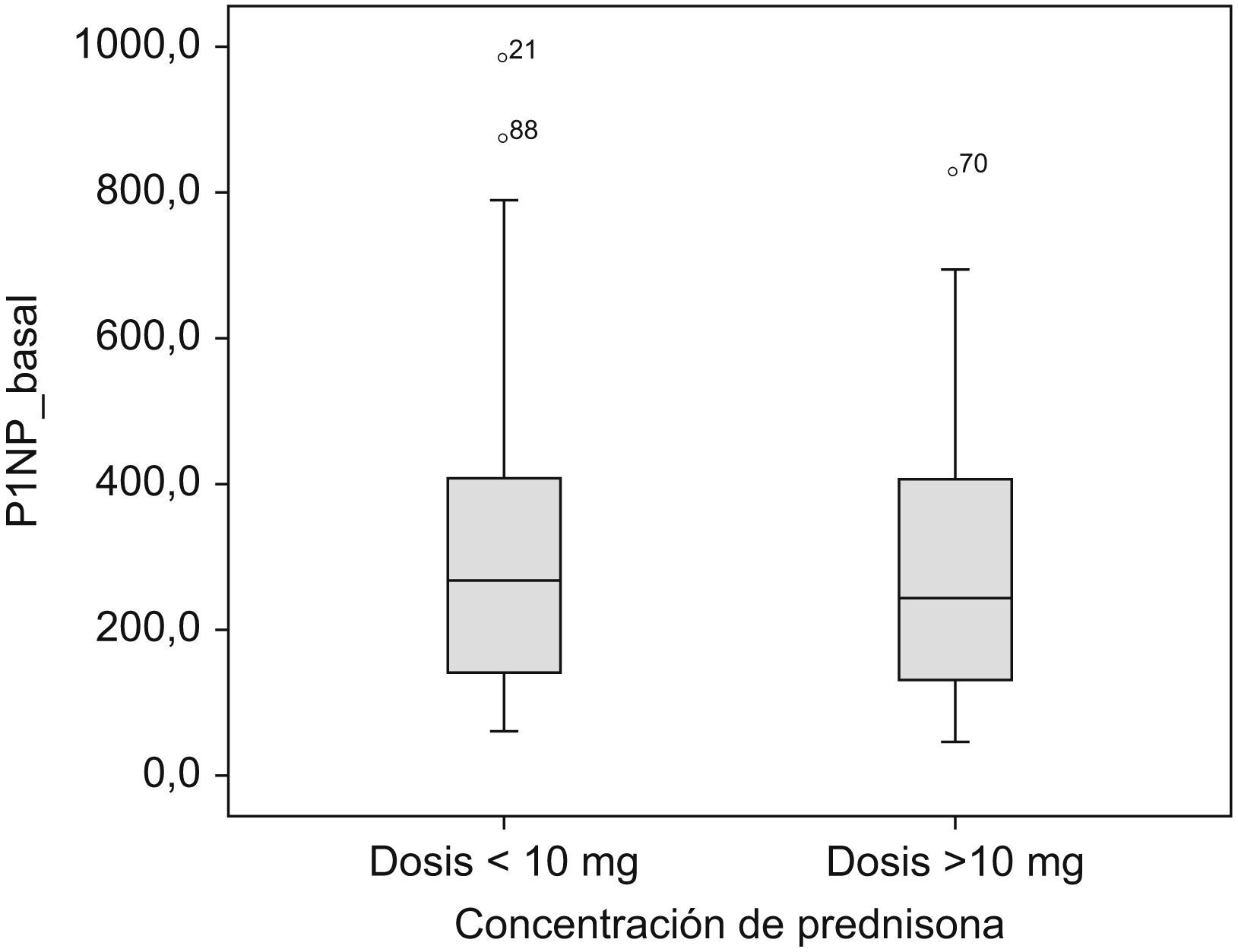
P1NP e inmunosupresoresEn relación con los anticalcineurínicos, no hay diferencias significativas en el uso de ciclosporina y tacrolimus en relación con el marcador P1NP, pero sí hay diferencias en relación con la dosis de prednisona utilizada. Como puede verse en la figura 2, los pacientes que a los 3 meses del trasplante reciben una dosis de prednisona diaria<10mg presentan unos valores de P1NP significativamente más elevados que los pacientes tratados con dosis superiores (concentración de P1NP en los pacientes con una dosis de prednisona<10mg/día=144ng/ml; concentración de P1NP en los pacientes con una dosis de prednisona ⩾10mg/día=109ng/ml; p=0,048).
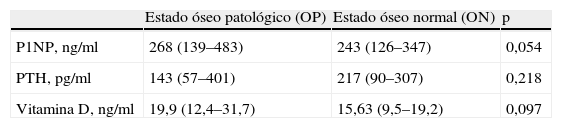
Estudio del huesoAl analizar los resultados de la densitometría ósea se observó que un 64% de los pacientes presentó una alteración de la densidad mineral ósea (osteoporosis y/o osteopenia) (OP). Teniendo en cuenta que la densitometría se realiza a los 3 meses postrasplante y que las alteraciones óseas son frecuentes en el paciente en tratamiento sustitutivo renal, probablemente el resultado de la densitometría refleja más el estado pretrasplante del hueso que las posibles modificaciones producidas en los primeros 3 meses postrasplante. El 36% restante no presenta enfermedad ósea (ON). Esto sugiere que las alteraciones óseas de los pacientes que presentan osteoporosis y/u osteopenia (OP) se correlacionan con unos valores de P1NP pretrasplante más elevados (pacientes OP, P1NP pretrasplante, 268 [139–483]ng/ml, pacientes ON, P1NP pretrasplante, 243 [126–347]ng/ml; p=0,054). En la tabla 2 se muestran los parámetros bioquímicos analizados en situación pretrasplante en relación con el estado óseo.
Parámetros bioquímicos en pretrasplante en relación al estado óseo
| Estado óseo patológico (OP) | Estado óseo normal (ON) | p | |
| P1NP, ng/ml | 268 (139–483) | 243 (126–347) | 0,054 |
| PTH, pg/ml | 143 (57–401) | 217 (90–307) | 0,218 |
| Vitamina D, ng/ml | 19,9 (12,4–31,7) | 15,63 (9,5–19,2) | 0,097 |
P1NP: propéptido aminoterminal del colágeno tipo I; PTH: hormona paratiroidea; vitamina D: 25-hidroxi vitamina D.
P1NP, PTH y vitamina D se expresan como mediana (P25–P75).
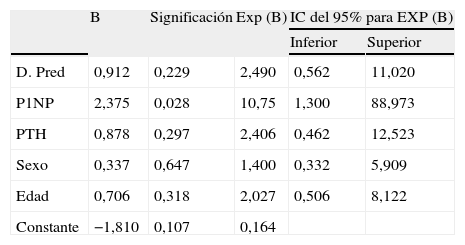
El análisis de regresión logística realizado para analizar el estado del hueso (osteoporosis y/u osteopenia) en la población sometida a trasplante renal se expone en la tabla 3. Como variable dependiente se escoge el indicador de paciente con la característica de si presenta osteoporosis y/u osteopenia y como covariables del estudio los siguientes indicadores: concentración de P1NP pretrasplante percentil 75 (P1NP=409ng/ml), dosis prednisona diaria ⩾10mg, edad >50 años, sexo masculino y concentración de PTH >250pg/ml, indicativa de hiperparatiroidismo20. A partir de este análisis se puede afirmar que la concentración sérica de P1NP pretrasplante es una variable predictiva independiente del estado del hueso en el paciente renal (OR=10,755; intervalo de confianza [IC] del 95%, 1,3–88,97; p=0,028). Los pacientes que presentan concentraciones de P1NP en pretrasplante superiores a 409ng/ml tienen 10 veces más riesgo de presentar enfermedad ósea que los pacientes con unas concentraciones de P1NP inferiores. Las otras covariables del estudio no presentan significación estadística, por lo que no son factores predictivos del estado óseo.
Análisis de regresión logística de los marcadores clínicos y bioquímicos en relación con el estado del hueso en el trasplante renal
| B | Significación | Exp (B) | IC del 95% para EXP (B) | ||
| Inferior | Superior | ||||
| D. Pred | 0,912 | 0,229 | 2,490 | 0,562 | 11,020 |
| P1NP | 2,375 | 0,028 | 10,75 | 1,300 | 88,973 |
| PTH | 0,878 | 0,297 | 2,406 | 0,462 | 12,523 |
| Sexo | 0,337 | 0,647 | 1,400 | 0,332 | 5,909 |
| Edad | 0,706 | 0,318 | 2,027 | 0,506 | 8,122 |
| Constante | −1,810 | 0,107 | 0,164 | ||
D. Pred: dosis de prednisona ⩾10mg; edad: >50 años; P1NP: P1NP percentil 75; PTH: PTH >250pg/ml; sexo: sexo masculino.
Los resultados obtenidos en nuestro estudio sugieren que el P1NP puede ser útil como marcador de osteoporosis y/u osteopenia en la población sometida a trasplante renal.
Uno de los problemas principales de los marcadores de remodelado óseo en este tipo de población es que la insuficiencia renal tiende a concentrarlos en la sangre, debido al mal funcionamiento del proceso de filtración que se establece. Esto repercute en que los valores no puedan ser del todo fiables, y pueden darse concentraciones falseadas por acumulación12,13. La ventaja de P1NP es que entre un 20 y un 30% se elimina por vía renal, y el 70–80% restante, por vía hepática14; por tanto, valores elevados serían más significativos del estado óseo del paciente y no de la insuficiencia renal preexistente. En nuestro estudio no hemos encontrado correlación en ninguno de los tiempos analizados entre P1NP, valores de creatinina y filtrado glomerular estimado mediante la fórmula MDRD abreviada. Este hecho nos ha llevado a pensar que posiblemente estemos ante una nueva herramienta de ayuda en el diagnóstico de los procesos osteoporóticos y/u osteopénicos que presentan la mayoría de los pacientes renales.
Se ha comprobado que el P1NP no presenta correlación significativa con la edad, pero sí respecto al sexo; las mujeres presentan concentraciones más elevadas de P1NP. En nuestro estudio las mujeres abarcan un rango de edades de 45 a 65 años y la mayoría se encuentran en menopausia. Este hecho agrava el estado del hueso, ya que buena parte de la disminución de la masa ósea se debe al descenso de estrógenos que se instaura durante la menopausia. Nosotros no hemos evaluado el efecto estrogénico en el marcador; otros estudios han demostrado que las mujeres con valores bajos de estrógenos presentan mayor disminución de masa ósea5.
Probablemente otro de los factores que favorece que los pacientes presenten concentraciones elevadas de P1NP en situación pretrasplante es el hecho que éstos están sometidos a un proceso de diálisis. Es bien conocido que la diálisis favorece un conjunto de complicaciones clínicas y metabólicas que provocan una agresión para el hueso. Se sabe que la diálisis genera una aceleración del proceso oxidativo en el organismo repercutiendo también en el hueso; asimismo, la duración del proceso dializador es fundamental en el deterioro inicial del hueso4. Durante el estudio del paciente renal en diálisis, los marcadores óseos utilizados con mayor frecuencia han sido OC y FAO. Varios trabajos demuestran una mayor sensibilidad de FAO como marcador de presencia de enfermedad metabólica del hueso (hueso adinámico) y P1NP como mejor marcador predictivo de variaciones en la DMO del paciente dializado12,13. Los valores elevados de P1NP en el paciente renal también se han relacionado con el hiperparatiroidismo secundario a la insuficiencia renal. Éste provoca una falta de absorción de calcio, agravada por los valores disminuidos de vitamina D, además de un aumento de absorción de los fosfatos, el conjunto provoca un estímulo secretor de la glándula paratiroidea para intentar contrarrestar el efecto, que acaba provocando valores elevados de PTH18,19, lo que favorece un aumento de la resorción ósea8,20,21. En nuestro estudio los pacientes que presentan unos niveles de P1NP más elevados se correlacionan con valores elevados de PTH y bajas concentraciones de vitamina D. Esto sugiere la relación de este marcador con el remodelado óseo. Se recomienda una suplementación de vitamina D en aquellos pacientes que presenten concentraciones<30ng/ml para reducir así las concentraciones de PTH22,23.
A pesar de que los efectos sobre el remodelado óseo de la medicación inmunosupresora con tacrolimus (FK) o ciclosporina (CyA) es controvertida, estudios recientes no encuentran diferencias en el estado óseo de los pacientes en relación con el fármaco24. Los anticalcineurínicos se unen a la molécula diana calcineurina, inhibiendo así su actividad fosfatasa y por tanto la activación de la inmunidad humoral. Su mecanismo de acción no interfiere en el hueso y por lo tanto el uso de estos fármacos no puede ser considerado un factor principal en la disminución de la masa ósea. Incluso se ha postulado la posibilidad de que el tacrolimus (FK) pueda tener un efecto protector en el hueso sobre los efectos negativos que genera la falta de estrógenos y el hiperparatiroidismo8,24.
Otro hecho aditivo a la pérdida de masa ósea es la dosis de glucocorticoides administrada en el post-trasplante renal. Hay datos en la literatura médica que demuestran que tratamientos de larga duración con dosis elevadas de prednisona inducen a la osteoporosis porque inhiben la proliferación de las células osteoblásticas8,19. En el postrasplante la dosis acumulada y la dosificación establecida se relacionan con una mayor pérdida de masa ósea20,25–27. En nuestro estudio se analizan las dosis de prednisona a los 3 meses de la intervención. En este intervalo de tiempo se observa que a dosis mayores de glucocorticoides (dosis ⩾10mg), los valores de P1NP disminuyen. Esto sugiere que en estos pacientes se produce una disminución de la formación ósea probablemente por la acción que ejercen los glucocorticoides.
En resumen, el estudio pone de manifiesto como el P1NP en pretrasplante podría ser útil como marcador de osteoporosis y/o osteopenia independiente de la edad, el sexo, la dosis de glucocorticoides y las concentraciones de PTH. Observamos que los pacientes con valores de P1NP superiores al percentil 75 (409ng/ml) tienen hasta 10 veces mayor riesgo de presentar una enfermedad ósea. Esto podría deberse, en primer lugar al aumento del remodelado óseo pretrasplante, como indican los valores más elevados de P1NP y PTH, y en segundo lugar a la disminución de la formación ósea a los 3 meses, ya que los pacientes con dosis mayores de glucocorticoides presentan una disminución de P1NP. Por tanto, la concentración de P1NP en pretrasplante podría ser de utilidad para detectar aquellos pacientes con una mayor pérdida de masa ósea. El P1NP podría utilizarse como marcador basal para instaurar un tratamiento farmacológico concomitante al trasplante renal.
Comunicación premiada en el I Congreso Nacional del Laboratorio Clínico celebrado en Sevilla del 17 al 20 de octubre de 2007.