Los glucómetros, dispositivos médicos que permiten la medida de la concentración de glucosa en sangre capilar, han supuesto desde su introducción en los inicios de los años 70 un cambio revolucionario en el control de la diabetes. La posibilidad de obtener resultados en un espacio de tiempo muy corto, tanto por parte del propio paciente como del personal sanitario, así como la creciente fiabilidad de estos dispositivos, han posibilitado que su uso se haya generalizado y que actualmente no sea posible imaginar el control y seguimiento de esta enfermedad sin la utilización de los glucómetros.
Desde la introducción en el año 19621 de las primeras tiras reactivas para la medición de la concentración de glucosa en sangre hasta la actualidad, la tecnología de las tiras reactivas y de los propios glucómetros ha evolucionado de manera muy significativa, permitiendo mejorar tanto su fiabilidad analítica como su facilidad de uso o practicabilidad.
Sin embargo, a pesar de las mejoras introducidas en estos dispositivos, siguen existiendo cuestiones pendientes de resolver, como las discrepancias entre los resultados de glucosa obtenidos con los glucómetros y los procedimientos de los analizadores convencionales que se utilizan en los laboratorios o las diferencias entre los resultados que proporcionan los diferentes glucómetros que hay en el mercado y que utilizan diversas metodologías y tecnologías.
No existe un consenso general sobre los requisitos de calidad analítica que deben cumplir los glucómetros. Diferentes sociedades científicas han propuesto distintos objetivos para la exactitud y la precisión de los resultados que proporcionan estos equipos. Por ejemplo, la Sociedad Española de Diabetes sugiere que es necesario exigir a todos los glucómetros unos requisitos mínimos, que son los que marca la norma ISO 15197:20132,3.
En este sentido, aunque existen razones evidentes para la utilización de los glucómetros, es importante conocer las limitaciones preanalíticas y analíticas que pueden afectar a la fiabilidad de los resultados. Dichas limitaciones se han de tener en cuenta al valorar los resultados obtenidos con estos dispositivos y también la necesidad de conocer en profundidad cuál es la calidad de las prestaciones analíticas (fiabilidad técnica) que proporciona cada glucómetro en particular.
Los glucómetros deben validarse antes de su uso para establecer y conocer cuál es su inexactitud, imprecisión y veracidad. En el caso de los glucómetros de uso hospitalario, es especialmente importante saber si los resultados obtenidos con los mismos son comparables con los de los procedimientos de uso más frecuente en los analizadores de bioquímica del laboratorio clínico. Es decir, debe estudiarse si existen diferencias significativas entre los resultados obtenidos con ambos tipos de procedimientos de medida. Una vez se haya seleccionado un dispositivo en particular, es muy importante comunicar a los usuarios, tanto internos como externos, cuáles son sus características, su fiabilidad analítica, sus limitaciones y las posibles causas que pueden generar errores en los resultados, intentando minimizar de esta manera su efecto4,5.
La metodología más habitual para estudiar y conocer la fiabilidad de cualquier procedimiento de medida consiste en validar la exactitud, la veracidad y la precisión del mismo. En este sentido, cabe considerar que poco más del 50% (18 de 34) de los glucómetros disponibles en el mercado en 20126 no cumplían con los requisitos recogidos en la norma ISO 15197:20133.
Objeto y campo de aplicaciónEl objeto de este documento es revisar las diferentes recomendaciones existentes para validar la fiabilidad, imprecisión, inexactitud, veracidad y practicabilidad de los glucómetros.
El campo de aplicación se refiere a todos los glucómetros utilizados en los distintos ámbitos asistenciales, incluyendo aquellos de uso personal.
Estudio de la fiabilidad analíticaTodo proceso de medida está sujeto a una cierta variabilidad debida a las fluctuaciones o cambios que sufre dicho proceso tanto en la fase premetrológica como en la metrológica. En la fase metrológica esta variabilidad está ocasionada por la existencia del error de medida. La concordancia entre el resultado de una medición y el valor verdadero se denomina exactitud de medida. El resultado de una medición se puede desglosar en un intervalo de valores que contiene el valor verdadero de dicha medida y que se conoce como incertidumbre de medida. Estos errores de medida pueden ser de tipo sistemático o aleatorio. Por tanto, para conocer la exactitud de medida de un procedimiento se deberían estimar la precisión y la veracidad del mismo.
La precisión de medida es la concordancia entre los resultados de medida independientes obtenidos en un mismo espécimen en unas condiciones determinadas. Es un concepto cualitativo y se cuantifica mediante la imprecisión, que es la desviación típica o el coeficiente de variación de los resultados de un conjunto de mediciones repetidas en unas determinadas condiciones. Estas condiciones pueden ser de repetibilidad, de reproducibilidad o intermedias6. Las condiciones de repetibilidad incluyen un mismo sistema de medida, procedimiento de medida, usuario del sistema analítico y en un corto intervalo de tiempo, sin calibraciones entre las mediciones ni cambios de lotes de reactivos. Las condiciones de reproducibilidad corresponden a condiciones de medida diferentes, incluyendo ubicación y usuario del sistema analítico, y las condiciones intermedias comprenden el mismo procedimiento de medida y mediciones repetidas en una misma muestra durante un período de tiempo prolongado, pero incluyen otras condiciones que pueden variar, tales como nuevas calibraciones, lotes de calibradores, lotes de reactivos y usuarios del sistema analítico.
La veracidad de medida es la concordancia entre la medida obtenida a partir de un amplio número de resultados de la medición de una magnitud particular y su valor verdadero. El estudio de la veracidad se cuantifica mediante la estimación del sesgo o error sistemático del procedimiento de medida.
El concepto de error sistemático hace referencia al valor verdadero, pero este es generalmente imposible de conocer. Por este motivo, la mayoría de las ocasiones los estudios de error sistemático se realizan con un valor convencionalmente verdadero. Para ello es frecuente tomar como referencia los resultados de un procedimiento de medida del que ya conocemos sus prestaciones analíticas7,8.
Estudio de la precisión en glucómetrosAunque los últimos dispositivos que se han desarrollado en este campo han mejorado de forma sustancial su imprecisión, en general la imprecisión analítica de los glucómetros es mayor que la de los procedimientos para medir glucosa incorporados en los analizadores convencionales de laboratorio, principalmente en los valores extremos del intervalo de medida, lo cual es especialmente crítico en situaciones de hipo e hiperglucemia clínicas. En algunos casos, su imprecisión está por encima del coeficiente de variación máximo (5%) que recomienda la American Diabetes Association (ADA) para la medida de la concentración de glucosa9-11.
La evaluación de la imprecisión en los glucómetros debe realizarse en condiciones de repetibilidad usando, dentro de la misma serie, tiras reactivas de un mismo lote y, al menos, 2 materiales de control con concentraciones de glucosa distintas (idealmente una alta y otra baja), pues la desviación típica correspondiente a la imprecisión puede ser diferente según las concentraciones de glucosa. Las series (número de mediciones repetidas en la misma muestra) han de ser como mínimo de 10 mediciones y deben informarse la media, la desviación típica y el coeficiente de variación para cada una de las muestras evaluadas. Además, es recomendable repetir el estudio de la imprecisión en concentraciones intermedias con diferentes lotes de tiras reactivas (al menos 2) y en condiciones de reproducibilidad con diversas unidades del mismo modelo de glucómetro (al menos 2). En este caso, las series también han de ser como mínimo de 10 mediciones. De esta manera, se puede comprobar que no existen diferencias en la imprecisión atribuibles al lector o al lote. Este protocolo de estudio está basado en la experiencia de los autores, que a su vez se deriva de las recomendaciones de sociedades científicas7.
Los requisitos de calidad analítica para el estudio de la imprecisión son muy diferentes según la sociedad científica o entidad que los proponga. En la norma ISO 15197:2013 se propone realizarlo en condiciones de reproducibilidad con un mínimo de 10 glucómetros, 3 lotes de tiras y 5 materiales de concentración de glucosa diferentes, efectuando 10 determinaciones para cada una de las combinaciones de medidores, lotes y materiales de concentración que pueden definirse.
Estudio de la exactitudRevisión de criterios aplicables a la evaluación de la exactitudLa International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) recomienda que los resultados de la medición de glucosa en sangre obtenidos con los glucómetros se expresen de manera equivalente a la concentración de glucosa en plasma12. De esta manera, se pretende conseguir que los glucómetros presenten resultados comparables con respecto a los que se obtienen con los procedimientos de medida de la concentración de glucosa habituales en el laboratorio, por lo que diremos que los glucómetros están calibrados (referenciados) respecto a la concentración de glucosa en plasma (o suero).
Paralelamente a los avances tecnológicos que han mejorado las prestaciones analíticas de los glucómetros, se han propuesto diversos requisitos de calidad para la veracidad. Estos requisitos son distintos según el organismo que los promueve y pueden ser diferentes si el glucómetro es para uso profesional (centros sanitarios) o para uso personal (pacientes).
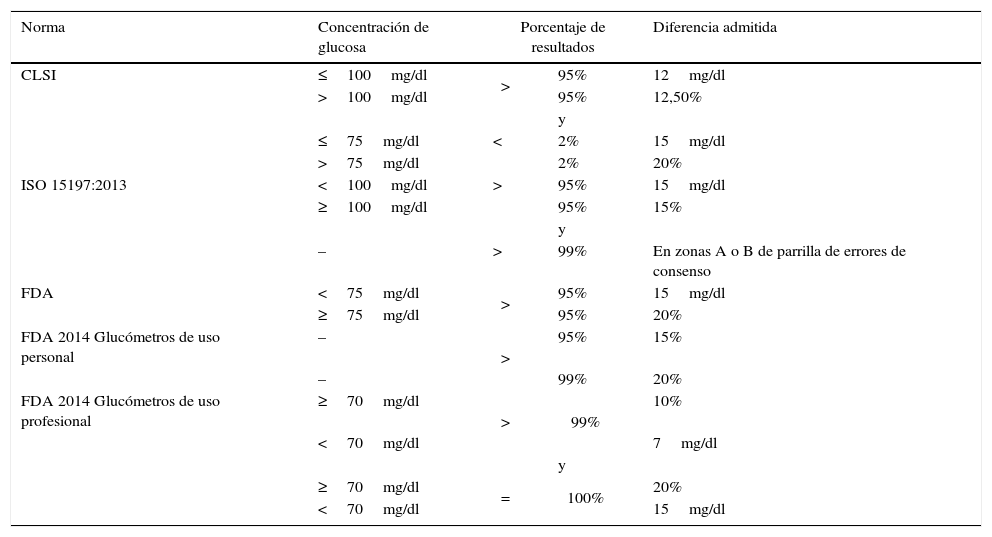
El Clinical and Laboratory Standards Institute (CLSI) publicó su primer documento con requisitos para los glucómetros en el año 1994. Desde entonces, ha publicado diversas revisiones, siendo la última la Point-of-care blood glucose testing in acute and chronic care facilities que se publicó en el año 2013, con la referencia POCT 12-A34. En dicha revisión especifica que el 95% de los resultados de las muestras analizadas con los glucómetros deben diferir, respecto a la determinación en el laboratorio, menos de un 12,5% si la concentración de glucosa medida en el laboratorio es mayor que 5,5mmol/l (100mg/dl), o menos de 0,66mmol/l (12mg/dl) cuando la glucosa medida en el laboratorio es menor o igual que 5,5mmol/l (100mg/dl). Adicionalmente, establece que menos del 2% de los resultados tengan diferencias mayores del 20% cuando la concentración de glucosa es superior a 4,125mmol/l (75mg/dl) o que menos del 2% tengan diferencias mayores de 0,825mmol/l (15mg/dl) cuando la concentración de glucosa es inferior a 4,125mmol/l (75mg/dl). Es decir, en sus criterios, y a diferencia de la mayoría de sociedades y organismos, el CLSI no solo establece un porcentaje mínimo de valores que se encuentren dentro de los límites establecidos, sino que, además, limita el porcentaje de resultados que pueden superar unas diferencias concretas.
Uno de los requisitos más conocidos y utilizados para establecer la veracidad de los glucómetros es el propuesto por el Comité Técnico 212 de la International Organization for Standardization (ISO) dedicado a Clinical Laboratory Testing and In Vitro Diagnostic Test Systems, que publicó en 2003 la primera versión de la norma ISO 15197 Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus específica para glucómetros. En esta primera versión, se establecía que el 95% de los valores obtenidos con los glucómetros debían mostrar diferencias, respecto al analizador de referencia, menores del 20% cuando las concentraciones del analizador de referencia eran mayores o iguales que 4,125mmol/l (75mg/dl) o diferencias menores a 0,825mmol/l (15mg/dl) cuando la concentración de glucosa era menor que 4,125mmol/l (75mg/dl). En mayo de 2013 se publicó una nueva versión de esta norma ISO 15197:20133 en la que los requisitos para la veracidad se definieron de manera más exigente. Así, el 95% de los resultados no pueden exceder de una diferencia del 15% para concentraciones de glucosa mayores o iguales que 5,5mmol/l (100mg/dl) ni de una diferencia mayor que 0,825mmol/l (15mg/dl) para concentraciones de glucosa menores de 5,5mmol/l (100mg/dl). Además, el 99% de los resultados deben encontrarse en las zonas A o B de la parrilla de errores de consenso (ver apartado específico). Los estándares de la norma ISO son de aplicación por parte de los fabricantes y específicamente para glucómetros de uso personal (no profesional).
La United States Food and Drug Administration (FDA) es otro de los organismos que ha establecido requisitos de calidad para validar la veracidad de los glucómetros. Tradicionalmente, coincidiendo con los criterios de la norma ISO 15197:2003, la FDA no definía requisitos de calidad diferentes para los glucómetros de uso profesional o de uso personal, y señalaba que el 95% de los resultados debían presentar diferencias menores del 20% para concentraciones superiores a 4,125mmol/l (75mg/dl) y menores de 0,825mmol/l (15mg/dl) para las concentraciones menores que 4,125mmol/l (75mg/dl). Sin embargo, en enero de 2014 la FDA publicó 2 documentos provisionales13,14 para su discusión por la comunidad científica, en los que definía por primera vez requisitos diferentes que los fabricantes debían cumplir, para glucómetros de uso personal y de uso profesional. En concreto, para los glucómetros de uso personal la FDA define un requisito doble, ya que el 95% de los resultados deben tener una diferencia con el analizador de referencia menor del 15% y el 99% menor del 20%. Para los glucómetros de uso profesional, los requisitos son mucho más estrictos. Así la FDA establece que, por una parte, el 99% de los valores tengan una diferencia inferior al 10% para concentraciones de glucosa mayores o iguales que 3,85mmol/l (70mg/dl) y una diferencia inferior a 0,385mmol/l (7mg/dl) para concentraciones menores de 3,85mmol/l (70mg/dl). Por otra parte, establece que el 100% de los valores tengan una diferencia inferior al 20% para concentraciones de glucosa mayores o iguales a 3,85mmol/l (70mg/dl), mientras que para concentraciones menores de 3,85mmol/l (70mg/dl) el 100% de los resultados han de tener diferencias inferiores a 0,825mmol/l (15mg/dl).
Un resumen de las diferentes especificaciones para la evaluación de veracidad queda recogido en la tabla 1.
Criterios de inexactitud en glucómetros con respecto a analizadores de laboratorio
| Norma | Concentración de glucosa | Porcentaje de resultados | Diferencia admitida | |
|---|---|---|---|---|
| CLSI | ≤100mg/dl | > | 95% | 12mg/dl |
| >100mg/dl | 95% | 12,50% | ||
| y | ||||
| ≤75mg/dl | < | 2% | 15mg/dl | |
| >75mg/dl | 2% | 20% | ||
| ISO 15197:2013 | <100mg/dl | > | 95% | 15mg/dl |
| ≥100mg/dl | 95% | 15% | ||
| y | ||||
| – | > | 99% | En zonas A o B de parrilla de errores de consenso | |
| FDA | <75mg/dl | > | 95% | 15mg/dl |
| ≥75mg/dl | 95% | 20% | ||
| FDA 2014 Glucómetros de uso personal | – | > | 95% | 15% |
| – | 99% | 20% | ||
| FDA 2014 Glucómetros de uso profesional | ≥70mg/dl | > | 99% | 10% |
| <70mg/dl | 7mg/dl | |||
| y | ||||
| ≥70mg/dl | = | 100% | 20% | |
| <70mg/dl | 15mg/dl | |||
Para una mejor comprensión de lo anteriormente expuesto, es preciso comentar las diferentes atribuciones que tienen la FDA y el Clinical Laboratory Improvement Amendments (CLIA). La FDA regula a los fabricantes de instrumentos y pruebas diagnósticas, mientras que el CLIA es una regulación promovida por el Centers for Medicare and Medical Services (CMS) que aplica en los Estados Unidos (EE.UU.) sobre toda la actividad de laboratorio clínico realizada en muestras de origen humano. Sin embargo, sus políticas interactúan de manera inevitable, pues la FDA es, por ejemplo, quien decide qué instrumentos reciben la categoría de exento (waived) y pueden, en consecuencia, ser utilizados de manera generalizada. Actualmente, todos los glucómetros son considerados por la FDA dentro de la categoría de exentos, ya que son presentados para su aprobación como equipos de uso personal. Por este motivo, la inmensa mayoría de los glucómetros que se utilizan en los centros hospitalarios no han sido aprobados por la FDA para este uso (actualmente, solo hay un glucómetro aprobado con este fin). El hecho de que se estén usando a nivel hospitalario glucómetros aprobados por la FDA para uso personal, es decir, un uso diferente al de su aprobación, provoca que, automáticamente, pasen a considerarse dentro de la categoría de alta complejidad del CLIA. Por este motivo, requieren estrictos controles de calidad, personal adecuadamente formado y capacitado y que el laboratorio tenga que validar el procedimiento.
Por todo ello, la publicación de estos 2 documentos, aún en fase de borrador (junio 2016), ha suscitado un intenso debate y polémica en EE.UU. A pesar de establecer criterios cada vez más estrictos, se siguen planteando cuestiones que es necesario resolver. A modo de ejemplo, y tomando como referencia la norma ISO 15197:2013, si partimos de una concentración de glucosa de 3,575mmol/l (65mg/dl) se considerarían aceptables, según estos criterios, los resultados obtenidos con el glucómetro comprendidos entre 2,75mmol/l (50mg/dl) y 4,4mmol/l (80mg/dl). Se aceptaría además que en el 5% de los casos las diferencias fueran superiores a ±0,825mmol/l (15mg/dl), lo que haría difícil valorar de manera precisa las posibles situaciones de hipoglucemia. En el caso de una concentración de glucosa de 8,25mmol/l (150mg/dl), la norma ISO admite como correctos resultados del glucómetro de entre 7,04mmol/l (128mg/dl) y 9,515mmol/l (173mg/dl) y aceptará diferencias aún mayores en el 5% de los casos. En ambas situaciones, hay una circunstancia añadida que es necesario tener muy en cuenta, y es que, si bien es cierto que monitorizando periódicamente la imprecisión y la exactitud puede alcanzarse una idea certera de las prestaciones del glucómetro en uso, siempre existe riesgo de que ni los pacientes ni los profesionales sanitarios sepan cuáles, de entre los resultados obtenidos con el glucómetro, están en el 5% de resultados que podrían no cumplir con la norma ISO. Por ello es necesario insistir en que, ante cualquier resultado obtenido con el glucómetro que genere dudas y que no se corresponda con la situación clínica del paciente, se proceda a remitir muestra al laboratorio.
Por este motivo, reafirmamos la necesidad de comprobar en el laboratorio, siempre que sea posible, cualquier resultado obtenido con un glucómetro que no se corresponda con el estado de salud o con la situación clínica del paciente.
Todos estos métodos evalúan la prestación de los glucómetros considerando los resultados individualmente.
Representaciones gráficas de la exactitud clínica de los resultadosUno de los sistemas que más se está utilizando para comprobar la concordancia de resultados entre los glucómetros y los analizadores del laboratorio, conjuntamente con la norma ISO específica, es el de las representaciones gráficas que permiten comparar al mismo tiempo los resultados y la valoración de las repercusiones clínicas de las posibles diferencias. En estas gráficas, que se mostrarán posteriormente, se van situando los puntos de intersección que se generan al cruzar los resultados obtenidos con el analizador de referencia del laboratorio (eje x) y los del glucómetro en evaluación (eje y).
Estos sistemas pretenden:
- -
Distinguir los errores críticos de aquellos menos importantes y sin repercusiones.
- -
Identificar el resultado erróneo que implica una decisión terapéutica incorrecta y un riesgo potencial para el paciente.
- -
Identificar los dispositivos que no deberían utilizarse para la toma de decisiones en tiempo real.
- -
Clasificar los resultados en zonas que permitan distinguir, de forma intuitiva y progresiva, la importancia clínica de las diferencias.
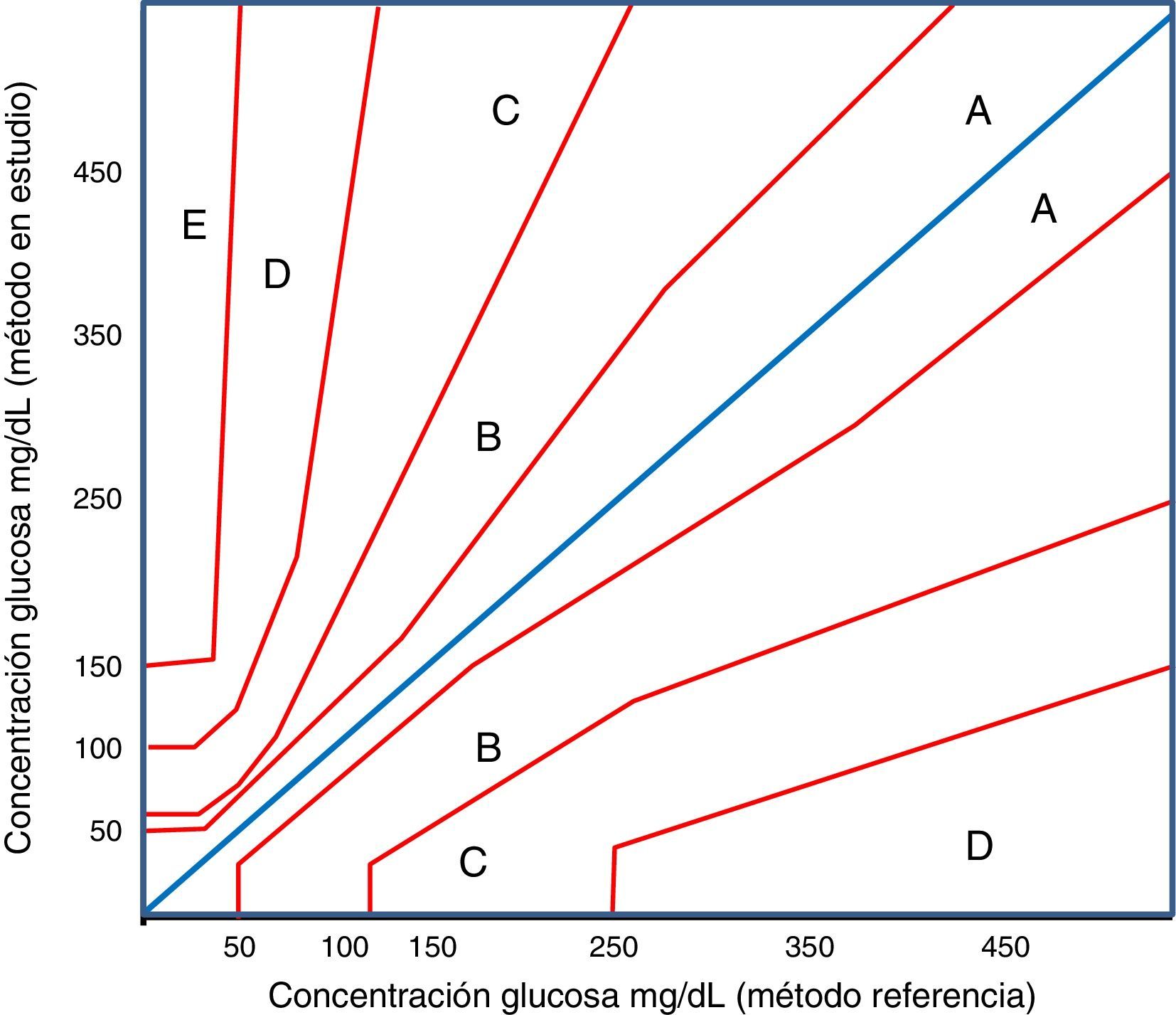
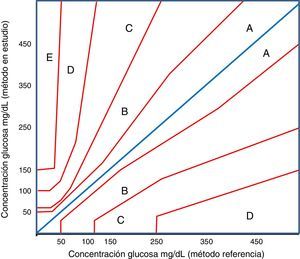
Los primeros diagramas de errores para el estudio de la exactitud clínica de los glucómetros fueron publicados por Clarke et al. (1987)15. En la propuesta de Clarke se presentan 5 categorías de riesgo. Los puntos situados en las zonas A y B se consideran, respectivamente, clínicamente exactos o que no conducen a tratamientos erróneos. Los puntos situados en las zonas C, D y E se consideran que originan errores en la definición de acciones terapéuticas o errores en el tratamiento (tabla 2).
Comparación del significado clínico de cada una de las zonas de error de los métodos de análisis gráfico de la exactitud clínica de Clarke y Parkes
| Zona | Clarke | Parkes |
|---|---|---|
| A | Los resultados son clínicamente exactos. Los valores están dentro de un margen de ±20% respecto al método de referencia | Sin cambio. Sin efecto o sin acción clínica |
| B | Los resultados difieren >±20% respecto al método de referencia, pero no provocan un cambio en la terapia del paciente ni se establecen tratamientos con efectos adversos | Generan cambios o acciones clínicas con poco o ningún efecto en la evolución clínica del paciente |
| C | Los resultados originan tratamientos y acciones clínicas innecesarias | Las decisiones tomadas pueden alterar las acciones clínicas de manera significativa |
| D | Los resultados originan situaciones en las que no se detectan adecuadamente situaciones de hipo o hiperglucemia | Alteración de las acciones clínicas, con riesgo médico significativo |
| E | Los resultados suponen tratamientos erróneos. Son resultados clínicamente opuestos a los del método de referencia | Alteración de las acciones clínicas con posibles consecuencias y riesgo serio para la salud |
Posteriormente, Parkes et al.16 definieron un nuevo método para el diseño e interpretación de los diagramas de error, en el que utilizaron premisas basadas en el consenso alcanzado con 100 endocrinólogos. Por esta razón se conoce como parrilla de errores de Parkes o, también, como parrilla de errores de consenso (consensus error grid). Este sistema de análisis también estudia la exactitud clínica utilizando 5 zonas, valorando para diferentes magnitudes de error si el consenso de los endocrinólogos establecería pautas terapéuticas diferentes. Presenta diferencias significativas respecto al modelo previamente definido; la más importante es que en el modelo de consenso las zonas de riesgo se disponen contiguamente (fig. 1).
En la tabla 2 se muestra una comparación del significado clínico de cada una de las zonas de error de los 2 métodos de análisis gráfico de la exactitud clínica.
Sin embargo, este tipo de representaciones gráficas también tienen sus limitaciones. La exactitud clínica del dispositivo en evaluación se mide habitualmente por el porcentaje de puntos incluidos en las zonas A y B, y este porcentaje puede ser alto incluso para glucómetros muy inexactos. En un esfuerzo por disponer de nuevas herramientas que permitan monitorizar las prestaciones clínicas de los glucómetros, la Diabetes Technology Society presentó, en el transcurso de las 74.a Sesiones Científicas de la Asociación Americana de Diabetes, un nuevo diseño de parrilla para la vigilancia de errores (surveillance error grid)17. En su elaboración, se entrevistó a 206 clínicos para conocer cómo reaccionarían frente a las posibles inexactitudes del glucómetro y cómo afectarían estas al cuidado del paciente. En este nuevo formato, los resultados se muestran en una matriz continua de colores con 15 zonas con diferentes grados de riesgo clínico (diferenciando hipo e hiperglucemia), lo que permite una mayor precisión en la cuantificación del riesgo clínico derivado de la inexactitud de los glucómetros. Es de esperar que este nuevo formato se vaya consolidando progresivamente como opción de referencia, pues en su diseño se han tenido en cuenta tanto los cambios tecnológicos de los últimos años como el riesgo clínico que suponen los posibles errores de exactitud de los glucómetros.
Estudio de la veracidadOtra forma de evaluar la concordancia entre los resultados de un glucómetro concreto y el analizador de bioquímica empleado en el laboratorio clínico de referencia es utilizando algunas de las pruebas estadísticas diseñadas para estudiar la comparación de procedimientos analíticos. Entre estas, la más recomendable es la regresión lineal no paramétrica de Passing-Bablok, que consiste en una regresión lineal sin supuestos especiales respecto a la distribución de la muestra ni de sus errores de medida18. Con esta regresión deben medirse, tanto por el método en estudio —glucómetro— como por el analizador de bioquímica de referencia, un mínimo de 100 muestras que deben ser representativas de todo el intervalo analítico de la magnitud en cuestión, la glucosa, en este caso. Como resultado de la aplicación de este método estadístico de comparación de procedimientos analíticos, obtendremos la ecuación de una recta y el intervalo de confianza al 95% tanto para la pendiente como para la ordenada en el origen. Si el primer intervalo incluye el valor «1» y el segundo intervalo el valor «0», podremos afirmar que los resultados de ambos métodos son intercambiables. En el caso de que el intervalo de la pendiente no incluya el valor «1», se interpreta que existe un error sistemático de tipo proporcional, y si el intervalo de la ordenada en el origen no incluye el valor «0» se está ante un error sistemático de tipo constante.
Influencia del hematocritoEl hematocrito es una de las principales fuentes de error en la medición de la concentración de glucosa en los glucómetros3,19. La manera en cómo el hematocrito afecta a los resultados depende en buena parte del principio de medida concreto que utiliza cada uno de los dispositivos. Este hecho aconseja la evaluación de error que puede estar asociado a diferentes hematocritos en distintos grupos de población, incluyendo algunos grupos especiales como es el caso de los neonatos3.
La cantidad de agua que contiene la muestra varía en función del hematocrito de la misma, al tiempo que la glucosa se encuentra en equilibrio en la porción acuosa de la sangre. Al aumentar el hematocrito, se transfiere menos plasma a la zona de reacción de la tira reactiva, con lo que el volumen de reacción es menor y se obtienen unos resultados en la concentración falsamente disminuidos a los que corresponderían si la relación células/plasma fuera normal. En el caso contrario, si el hematocrito es muy bajo, una mayor cantidad de plasma alcanza la zona de reacción y la concentración de glucosa daría resultados falsamente elevados.
Por tanto, enfermedades y situaciones clínicas o fisiológicas (neonatos, p. ej.) en las que aumenta el valor del hematocrito del paciente, como la policitemia o la sangre de los recién nacidos, pueden presentar, en algunos sistemas de medida, resultados infravalorados de la concentración de glucosa que es necesario tener en cuenta. Por otra parte, pacientes con anemia o hemorragias pueden presentar un valor de hematocrito menor y una sobreestimación del valor de la concentración de glucosa. Con la finalidad de minimizar el efecto del hematocrito sobre la medición de la concentración de glucosa se ha propuesto la corrección de su efecto mediante el ajuste de una fórmula matemática incorporada directamente en los cálculos que realizan la mayoría de dispositivos19.
Las diferencias entre estas diversas funciones de corrección son una fuente de variabilidad entre los diversos modelos de glucómetros, que pueden mostrar distintos niveles de interferencia por el efecto del hematocrito en la medida de la concentración de glucosa en una misma muestra. Como intervalos de hematocrito aceptables, la FDA propone para los glucómetros de uso personal valores de entre el 20 al 60%, y para los glucómetros de uso hospitalario el rango es del 10 al 65%.
Por todo lo expuesto, se recomienda que antes de utilizar un nuevo modelo de glucómetro se incluya en la evaluación de las prestaciones analíticas del mismo, independientemente de la descripción de las características técnicas del dispositivo que proporcione el fabricante, un estudio de cómo diferentes valores de hematocrito pueden afectar a la calidad de los resultados y seleccionar, en consecuencia, aquellos dispositivos que se vean menos afectados. Para evaluar la influencia del hematocrito puede utilizarse el protocolo de estudio sugerido en la norma ISO 15197:20133.
A pesar de esta afirmación, cabe destacar que no es sencillo realizar una evaluación técnica de la influencia del hematocrito en los glucómetros, pues se requiere una considerable manipulación de las muestras, lo que hace totalmente necesaria la participación e implicación del laboratorio en la misma. También se tiene que valorar la dificultad de realizar estas validaciones sobre grupos especiales como los neonatos, dada la dificultad en la recogida y el volumen de muestra.
PracticabilidadJuntamente con la fiabilidad analítica de los glucómetros también es necesario valorar, de manera igualmente rigurosa, otro aspecto que tiene una importante incidencia tanto en el uso adecuado del dispositivo como en la calidad final de los resultados: la practicabilidad.
La practicabilidad es una condición de cualquier dispositivo que agrupa un conjunto de cualidades que aporten información sobre las características de uso de un analizador concreto en unas determinadas condiciones de trabajo. En otros términos, podríamos definir la practicabilidad como el grado en el que un analizador (dispositivo) concreto se adecúa a las necesidades particulares de cada situación en la que es utilizado.
En este sentido, un mismo glucómetro puede tener mejor o peor practicabilidad según el uso que de él se haga (hospitalario, domiciliario, consulta médica) o según la persona (profesional sanitario, paciente, diferentes niveles culturales) que lo utilice. Igualmente, también una misma cualidad, como podría ser por ejemplo el tamaño de la tira reactiva, puede tener diferentes valoraciones de practicabilidad según el entorno de uso del glucómetro o la persona que lo vaya a emplear.
La practicabilidad es una condición que día a día está tomando más protagonismo como factor decisivo en el momento de seleccionar cualquier analizador de laboratorio. De hecho, cuanto más similares son las prestaciones técnicas de los diferentes equipos de laboratorio disponibles en el mercado, más relevancia adquiere la practicabilidad como criterio básico para elegir la opción tecnológica que mejor se adapte a las necesidades de cada centro o usuario.
Esta consideración genérica es especialmente relevante cuando hablamos de los glucómetros, pues son, muy probablemente, los dispositivos médicos más ampliamente utilizados y difundidos. Su uso es generalizado y los utilizan diariamente desde profesionales sanitarios, con una amplia experiencia, hasta un inmenso colectivo de pacientes, que incluye personas de todas las edades, niveles culturales y condiciones sociales.
Entre los criterios que es necesario valorar cuando evaluemos la practicabilidad de un glucómetro cabría incluir:
- -
Dimensiones y peso del dispositivo.
- -
Solidez.
- -
Dimensiones de la pantalla de visualización (incluidos el tamaño de las letras y los números).
- -
Dimensiones de la tira reactiva.
- -
Duración de la batería.
- -
Volumen de muestra necesario.
- -
Tiempo de medida.
- -
Facilidad de uso.
- -
Facilidad de mantenimiento (especialmente limpieza).
- -
Avisos en pantalla (por ejemplo: la dosificación de muestra insuficiente).
- -
Almacenamiento (memoria) de resultados.
- -
Funciones de cálculo integradas en el propio glucómetro.
- -
Opciones de conectividad.
- -
Aplicaciones informáticas para la gestión de resultados.
- -
Presentación de las tiras reactivas (bote, blíster).
- -
Necesidad o no de codificación y calibración.
- -
Sistema de expulsión de la tira reactiva.
Al final, la elección del glucómetro que se recomendará a cada paciente, dando por supuesta y comprobada su adecuada calidad técnica, debería realizarla un profesional sanitario teniendo en cuenta que el dispositivo se adapte de la mejor manera posible a las características y necesidades particulares de cada paciente.
La FDA también ha sugerido y publicado criterios de practicabilidad para los glucómetros20.
Consideraciones sobre los glucómetros de uso hospitalarioLos glucómetros son dispositivos médicos ampliamente utilizados en los hospitales y en ellos se realizan la que se podría considerar como una de las pruebas bioquímicas más frecuentes: la medida de la concentración de glucosa en sangre capilar (o venosa). Sin embargo, en la gran mayoría de los casos, los profesionales del laboratorio clínico no participan en los procesos de selección de los glucómetros, siendo esta una realidad que es necesario mejorar, pues la elección de los glucómetros para uso hospitalario debería realizarse teniendo en cuenta tanto los aspectos económicos como los técnicos y de practicabilidad.
Cuando se convoca un concurso para la compra de estos equipos, deberían definirse claramente cuáles serán los criterios a valorar (económicos, técnicos, practicabilidad, formación, etc.) y la ponderación que cada uno de ellos tendrá en la valoración final. La definición de los criterios técnicos que se tendrán en cuenta, como los expuestos en este documento, y su valoración debería ser tarea de los profesionales del laboratorio clínico del centro, que deberían ser los responsables de que se garantice el cumplimiento de las especificaciones de calidad. Respecto a las características vinculadas a la practicabilidad, tanto en su definición como en su valoración, deberían ser responsabilidad del personal de atención clínica del paciente, tanto médico como de enfermería.
En realidad, este planteamiento multidisciplinar supone que cada colectivo aporte su conocimiento y experiencia en la selección de los glucómetros para los centros hospitalarios. Esto permitiría que el proceso fuese mucho más fiable, asegurando que el glucómetro seleccionado presenta las características técnicas y de practicabilidad más adecuadas para cada centro.
En el momento de elegir los dispositivos de uso hospitalario, se debería valorar también la posibilidad de que alguno de los equipos pueda conectarse con los sistemas de información del hospital a través de soluciones informáticas propias o de terceros. Estos programas de gestión de glucómetros permiten administrar los usuarios que los utilizan, enviar resultados al sistema informático del hospital, gestionar lotes de control de calidad y de tiras reactivas, etc. Permiten también obtener la trazabilidad de las muestras analizadas, quedando registrado quién ha realizado la medición, bajo qué parámetros de calibración y control de calidad. También en esta área, los profesionales del laboratorio deberían ser quienes se encargasen de supervisar estos programas para garantizar su adecuado funcionamiento.
En un entorno como el actual, en el que los aspectos meramente económicos pueden estar condicionando las decisiones en el momento de seleccionar los dispositivos médicos, es importante asegurar que el precio no es el único factor, ni el más determinante, que se valora en el proceso de selección. En este sentido es importante definir que para los criterios técnicos se valorará un mínimo de puntuación que, en caso de no alcanzarse, supusiera la exclusión del dispositivo presentado y que, en consecuencia, significara que la correspondiente oferta económica ya no llegara ni a valorarse. Como ejemplo, se puede dejar especificado en el pliego de condiciones técnicas del concurso que si el glucómetro no cumple con los límites de aceptación de los criterios de calidad basados en la norma ISO 15197:2013 quedará excluido.
Con este tipo de actuaciones, nos aseguramos que un dispositivo con deficientes prestaciones técnicas, incluso por debajo de las recomendaciones y normativas, pueda, solo por precio, ser la opción ganadora de un concurso público.
Recomendaciones- 1.
Dado el uso generalizado, bajo coste relativo y su facilidad de uso, los glucómetros no han estado sometidos a los mismos procesos de evaluación técnica ni de control de calidad que se aplican a otros dispositivos médicos. Sin embargo, debido a los potenciales eventos adversos que pudieran ocasionarse derivados de la utilización de un glucómetro con una baja fiabilidad analítica, se recomienda que los profesionales sanitarios conozcan la calidad de las prestaciones de los glucómetros utilizados.
- 2.
Es responsabilidad del laboratorio establecer los criterios para determinar la fiabilidad analítica de los glucómetros evaluando la imprecisión, veracidad e inexactitud, los cuales deberán estar basados en los propuestos por diferentes organismos y sociedades científicas (FDA, CLSI, ISO o similar). Por su mayor difusión y utilidad, se recomienda seguir los criterios definidos en la norma ISO 15197:20133. En concreto, para el estudio de la exactitud, recomendamos utilizar una versión simplificada de la metodología de evaluación que propone esta norma, de manera que sea más asequible para su realización en cualquier tipo de laboratorio. Las condiciones quedarían de la siguiente manera:
- -
100 muestras de sangre venosa (en lugar de capilar);
- -
realizar el estudio con 2 lotes diferentes de tiras reactivas;
- -
un tercio de las muestras con concentraciones de glucosa menores de 4,125mmol/l (75mg/dl), un tercio con concentraciones de glucosa de entre 4,125mmol/l (75mg/dl) y 8,250mmol/l (150mg/dl), y un tercio con concentraciones de glucosa mayores de 8,250mmol/l (150mg/dl);
- -
controlando que el tiempo entre la medición de la concentración de glucosa en el glucómetro y la medición en el analizador del laboratorio sea menor de 15min.
- 3.
Ante cualquier proceso de selección de tiras reactivas o glucómetros, dentro del proceso de validación técnica se recomienda hacer un estudio de veracidad comparándolo con los resultados obtenidos con el procedimiento del laboratorio clínico. Para ello es el laboratorio el responsable de diseñar el protocolo de validación, especificar los requisitos de calidad analítica y cualquier otro estudio necesario para comprobar las características de funcionamiento de cada uno de los glucómetros, así como emitir un informe de la validación.
- 4.
La valoración de la practicabilidad y aplicabilidad al control de la glucemia y su tratamiento corresponderá al personal de enfermería y al personal médico de atención a las personas con diabetes.
- -
Manel Mata Cases; Fernando Gómez Peralta; Fernando Alvarez Guisasola; Javier Escalada San Martín; Sara Artola Menéndez; Edelmiro Menéndez Torre; Juan Girbés Borrás; Juan Carlos Ferrer García; Itxaso Rico Echevarría; Patxi Ezcurra Loiola; Carlos Ortega Millán; Javier Lafita Tejedor; Jose Antonio Fornos; Mercedes Galindo Rubio.
Composición de la Comisión de Pruebas de Laboratorio en el Lugar de Asistencia (POCT) de la Sociedad Española de Bioquímica Clínica y Patología Molecular disponible en el anexo 2.
) de la Sociedad Española de Bioquímica Clínica y Patología MolecularRicardo Alonso Díaz; José Luis Bedini; Maria Luisa Hortas Nieto; Francisco Javier Lirón Hernández; Vicente Monzó Inglés; Xavier Navarro Segarra; José Angel Noval Padillo; Paloma Oliver Sáez; María Ortiz Espejo; Manuel Otero Santiago; Fernando Rodríguez Cantalejo; Olaia Rodríguez; Catalina Sánchez Mora.
Francesca Canalías Reverter; Sara Esteve Poblador; F. Javier Gella Tomás; Bernardino González de la Presa; Rosa M. López Martínez; Inmaculada Pérez de Algaba Fuentes; Raúl F. Rigo Bonnin.
Virtudes Álvarez Funes; Carme Biosca Adzet; Beatriz Boned Juliani; Fernando Cava Valenciano; Zoraida Corte Arboleya; Jorge Díaz-Garzón Marco; Pilar Fernández Calle; Pilar Fernández Fernández; José Vicente García Lario; Elisabet González Lao; Juana Minchinela Girona; Carmen Perich Alsina; Carmen Ricós Aguilá; Margarita Simón Palmada.
Composición del Grupo de Consensos y Guías Clínicas de la Sociedad Española de Diabetes disponible en el anexo 1.
Este documento tiene la conformidad de AEBM-ML y AEFA como Recomendación profesional en el ámbito del Laboratorio Clínico.
Composición de la Comisión de Pruebas de Laboratorio en el Lugar de Asistencia (POCT) de la Sociedad Española de Bioquímica Clínica y Patología Molecular disponible en el anexo 2.
Composición de la Comisión de Metrología y Sistemas Analíticos de la Sociedad Española de Bioquímica Clínica y Patología Molecular disponible en el anexo 3.
Composición de la Comisión de Calidad Analítica de la Sociedad Española de Bioquímica Clínica y Patología Molecular disponible en el anexo 4.