La neumonía adquirida en la comunidad (NAC) sigue siendo un problema sanitario importante. Para establecer su gravedad existen una serie de escalas de severidad, pero tienen sus limitaciones. Se han propuesto diferentes biomarcadores que podrían resultar de ayuda.
ObjetivoEvaluar el valor pronóstico de proteína C reactiva (PCR), procalcitonina (PCT) y proadrenomedulina (PADM) para predecir mala evolución intrahospitalaria en NAC.
Material y métodosSe incluyeron todos los pacientes diagnosticados de NAC que quedaron ingresados durante un periodo de 13 meses. Se congeló a −80°C suero y plasma EDTA obtenidos en el Servicio de Urgencias del Hospital para la determinación de los biomarcadores. Se dividió a los pacientes en dos grupos: los que evolucionaron favorablemente y los que tuvieron mala evolución. Los datos clínicos de los pacientes fueron recopilados por revisión de la historia clínica.
ResultadosLas diferencias de las medianas de los tres biomarcadores para los dos grupos adquirieron significación estadística. Las áreas bajo la curva de las curvas ROC correspondientes fueron: 0,67 para PCT, 0,62 para PCR y 0,74 para PADM. Los puntos de corte seleccionados con sus respectivos datos de sensibilidad y especificidad fueron: para PCT 0,5 ng/mL (S: 0,67/E: 0,61), para PCR 150mg/L (S: 0,67/E: 0,47) y para PADM 1,2 nmol/L (S: 0,80/E: 0,53).
ConclusionesLos resultados sugieren un posible valor pronóstico de estos biomarcadores en relación con la evolución intrahospitalaria que presentarán los pacientes con NAC, destacando entre ellos la PADM.
Community-acquired pneumonia (CAP) continues to be a major health problem. There are several scoring systems to predict its severity, but they have limitations. Different biomarkers have been proposed to be of assistance.
ObjectiveTo evaluate C reactive protein (CRP), procalcitonin (PCT) and proadrenomedullin (PADM) as prognostic factors to predict the outcome in CAP.
Material and methodsAll patients diagnosed with CAP and admitted to hospital during a period of 13 months were included in our study. Serum and EDTA plasma samples from the Emergency Unit were collected and frozen at -80°C for biomarkers determination. Patients were divided into two groups: those who developed favorably and those with an unfavorable outcome. Clinical data for these patients were collected by reviewing their medical records.
ResultsThe median values between both groups were found to be statistically significantly different for all three biomarkers. Areas under the ROC curve for each biomarker were: 0.67 for PCT, 0.62 for CRP and 0.74 for PADM. Selected cut-off for each biomarker with their corresponding sensitivity and specificity values were: 0.5 ng/mL (Se: 0.67/Sp: 0.61) for PCT, 150mg/L (Se: 0.67/Sp: 0.47) for CRP and 1.2 nmol/L (Se: 0.8/Sp: 0.53) for PADM.
ConclusionsThe results indicate that these biomarkers could help in predicting the outcome of patients with CAP during hospitalization, with PADM being a potentially better predictor.
La neumonía adquirida en la comunidad (NAC) es una enfermedad grave. Las cifras de incidencia anual de la NAC en adultos varían según los diferentes países entre 5-11 casos/1.000 habitantes, y también el porcentaje de pacientes ingresados, que se ha calculado en 6, 22 y 63% según el país1–5. Esto se debe a que no es fácil calcular la incidencia exacta de una enfermedad que puede cursar de forma leve y ser diagnosticada y tratada en medicina primaria, o cursar de forma grave y requerir hospitalización incluso en el Servicio de Cuidados Intensivos. En un estudio a nivel estatal en España se calculó una incidencia de 1,6 casos/1.000 adultos/año, de los cuales el 61,4% requirió ingreso2.
Existen y se utilizan en la clínica diaria diferentes escalas que estratifican a los pacientes con NAC según su gravedad (PSI, CURB-65, SCAP, SMART-COP, …)6–9, empleadas en la toma de decisión en cuanto a ingreso o tratamiento ambulatorio del paciente. Sin embargo todas ellas tienen sus ventajas y sus limitaciones10,11.
Durante los últimos años se han propuesto distintos parámetros como biomarcadores que ayuden a establecer el pronóstico de procesos agudos.
La proteína C reactiva (PCR) es un reactante de fase aguda producida por el hígado, que se eleva cuando existe un proceso inflamatorio en el organismo, es decir, su elevación es muy inespecífica. Aun así ha sido estudiada para el diagnóstico y monitorización de diversos procesos inflamatorios, y se ha establecido cierta relación con la gravedad de la NAC12–15, relacionándose su disminución con la supervivencia de pacientes con neumonía asociada a ventilador16. Kofoed et al17, estudiando diversos biomarcadores para el diagnóstico de infecciones bacterianas adquiridas en la comunidad, obtienen mejores resultados para PCR que para la procalcitonina (PCT) (biomarcador, a priori, más específico).
La PCT es la pro-proteína precursora de la calcitonina, secretada por las células C de tiroides. En condiciones normales la PCT se fragmenta intracelularmente siendo la proteína procesada la que se libera a sangre, por lo que no se detectan niveles medibles de PCT en el organismo. Pero en diferentes situaciones infecciosas e inflamatorias, los niveles circulantes de PCT se elevan hasta miles de veces, principalmente por su producción en tejido no tiroideo. Esta elevación es mayor en infecciones bacterianas18. Ha sido referido como un marcador sensible de gravedad de la infección bacteriana y sepsis, así como predictor de gravedad19 y guía para ajustar el tratamiento antibiótico en pacientes con NAC12,20–22.
La proadrenomedulina (PADM) es el biomarcador más novedoso en estudio. Es la pro-proteína precursora de la adrenomedulina, proteína de la familia de los genes de la calcitonina que se expresa en presencia de una infección. Se la ha relacionado como marcador pronóstico en pacientes con sepsis, y como marcador útil en la estratificación de riesgo de pacientes con NAC23. Incluso mejora los resultados de PCR y PCT en estos pacientes24.
Aunque existen estudios que relacionan la presencia y evolución de estos biomarcadores inflamatorios con la evolución clínica de ciertos procesos infecciosos (entre ellos la neumonía), su utilidad para el diagnóstico y pronóstico de la NAC está por confirmar.
ObjetivoEvaluar la capacidad de las concentraciones en sangre de distintos biomarcadores (PCR, proadrenomedulina y procalcitonina), obtenidos en el Servicio de Urgencias previos al ingreso, para predecir la mala evolución intrahospitalaria de pacientes ingresados por NAC.
Material y métodosProcedimientoEstudio observacional prospectivo. Se incluyeron de forma consecutiva todos los pacientes adultos (≥ 18 años) que acudieron al Servicio de Urgencias del Hospital Galdakao-Usansolo y que fueron ingresados con diagnóstico confirmado de NAC durante 13 meses (1 de julio 2008-31 de julio 2009). Se consideró como neumonía todo infiltrado pulmonar en la radiografía de tórax, que no se conociese como antiguo y que presentó síntomas indicativos de neumonía, tales como tos, disnea, fiebre y/o dolor pleural. Todos fueron revisados por el Servicio de Neumología.
Criterios de mala evolución intrahospitalaria: muerte intrahospitalaria, shock, necesidad de ventilación mecánica (invasiva o no) o duración de la estancia hospitalaria superior a 5 días (media de estancia hospitalaria por neumonía en nuestro hospital).Se excluyeron del estudio los pacientes inmunodeprimidos (aquellos pacientes transplantados de víscera sólida, esplenectomizados, tratados con corticosteroides durante más de 30 días, tratados con otros agentes inmunosupresores o que causen neutropenia con < 1 × 109 neutrófilos/L o infectados por el virus de la inmunodeficiencia humana) y los pacientes hospitalizados en los 14 días previos.
La cohorte total de pacientes obtenida fue de 250. La concentración de PCR se midió con el resto de los parámetros del protocolo de sospecha de neumonía del Servicio de Urgencias. El suero restante y el plasma EDTA (obtenido tras centrifugación de sangre total) se congelaron en alícuotas a −80°C para su posterior análisis. Los biomarcadores se analizaron en series de 100 muestras, de forma ciega, e identificadas únicamente por el número de petición sin conocer los datos clínicos evolutivos del paciente.
Todos los participantes (o sus familiares en caso de pacientes que no presentaron el grado de consciencia necesario) firmaron un consentimiento informado tras haber sido informados por los investigadores de los objetivos, riesgos y beneficios potenciales del estudio. El proyecto cuenta con la aprobación del Comité de Ética e Investigación Clínica del Hospital.
Instrumentación analíticaLa PCR y la PCT se analizaron en suero en un Cobas 6000 de Roche Diagnostics®. La PCR se cuantificó por inmunoturbidimetría con una sensibilidad analítica de 1mg/L. La PCT se midió por electroquimioluminiscencia con una sensibilidad analítica de 0,02 ng/mL. Por otra parte, la PADM se analizó en plasma EDTA por inmunoensayo tipo sándwich mediante tecnología TRACE (time-resolved amplified cryptate emission) en un Kriptor de Brahms AG®, con una sensibilidad analítica del 0,05 nmol/L. Las técnicas analíticas utilizadas no presentan interferencias significativas hasta 500mg/dL de hemoglobina y 60mg/dL de bilirrubina para PCR, 900mg/dL de hemoglobina y 25mg/dL de bilirrubina para PCT y 500mg/dL de hemoglobina y 40mg/dL de bilirrubina para PADM.
Análisis estadísticoLos tres biomarcadores se presentan como mediana (Q1, Q3: rango intercuartílico) debido a que su distribución no fue normal. Las comparaciones de los valores de los analitos entre pacientes de evolución favorable vs. pacientes de mala evolución se realizaron con la prueba de la mediana. La significación estadística se estableció para un valor de p<0,05.
Se calculó la edad media de los pacientes y su desviación típica, comparándose los dos grupos de evolución mediante el t test. La distribución por sexos de los pacientes se presenta como porcentaje, y se comparó mediante la prueba de la mediana.
La capacidad de discriminación de cada biomarcador se examinó mediante curvas ROC (Receiver Operating Characteristic). Para los puntos de corte sugeridos se presentan los valores de sensibilidad, especificidad, valor pronóstico positivo (VPP), valor pronóstico negativo (VPN) y odds ratio (OR) con sus respectivos 95% intervalos de confianza (95% IC). Todos los análisis fueron realizados con el software PASW Statistics 18.
ResultadosDe los 495 pacientes diagnosticados de NAC, 245 fueron dados de alta y tratados ambulatoriamente. Se estudiaron los 250 pacientes (171 hombres/79 mujeres) que quedaron ingresados en el hospital desde julio 2008 a julio 2009. Se dividieron en dos grupos según la evolución intrahospitalaria. De todos ellos, 167 evolucionaron favorablemente y 83 presentaron mala evolución por alguno de los motivos: 20 murieron durante el ingreso, 17 presentaron shock, 5 necesitaron ventilación y 64 pacientes permanecieron hospitalizados más de 5 días (algunos pacientes tuvieron más de una razón para considerarlos de mala evolución: 1 evolucionó a shock y murió; 5 estuvieron ingresados más de 5 días y murieron; 5 evolucionaron a shock y su estancia duró más de 5 días; 1 evolucionó a shock, necesitó ventilación y murió; 1 evolucionó a shock, precisó ventilación y su ingreso se alargó más de 5 días; 1 necesitó ventilación, su ingreso se prolongó más de 5 días y murió; 2 pacientes cumplieron los 4 criterios de mala evolución).
La media de edad de los pacientes es de 70,8 años para los pacientes de evolución favorable y 71,8 para los pacientes de mala evolución. En cuanto al porcentaje de hombres en cada grupo, suponen el 70,7% en los pacientes que evolucionan favorablemente y el 63,9% de los pacientes con mala evolución. Ninguna de las dos variables adquirió significación estadística, por lo que podemos considerarlos grupos homogéneos en cuanto a edad y sexo.
Por diferentes motivos, no se han podido obtener todos los biomarcadores de todos los pacientes. Las causas más frecuentes han sido la muestra insuficiente o la muestra no recibida. Un resultado de PADM no se pudo obtener por interferencia de la hemoglobina. De los 250 pacientes el total de muestras analizadas ha sido de 219 PCT, 247 PCR y 229 PADM.
Las medianas obtenidas para cada biomarcador fueron: PCT de 0,30 ng/mL para el grupo de evolución favorable, y 1,44 ng/mL para el grupo de mala evolución (p=0,001); la PCR de los que evolucionaron favorablemente fue de 157mg/L, y 231mg/L la de los de mala evolución (p=0,013); la PADM en evolución favorable fue de 1,18 nmol/L, mientras que la del grupo de mala evolución, 1,92 nmol/L (p<0,0001) (tabla 1).
Edad, sexo, PCT, PCR y PADM para toda la muestra y en los dos grupos de evolución.
| Toda la muestra (n=250) | Evolución Favorable (n=167) | Mala Evolución (n=83) | Significación | |
| Edad (años) | 71,1 (17,0) | 70,8 (17,0) | 71,8 (17,0) | t=−0,429 |
| p=0,668 | ||||
| Sexo | ||||
| H | 171 (68,4) | 118 (70,7) | 53 (63,9) | χ12=1,2 |
| M | 79 (31,6) | 49 (29,3) | 30 (36,1) | p=0,276 |
| PCT (ng/mL) | 0,43 (0,14-2,75) | 0,30 (0,09-1,73) | 1,44 (0,25-5,12) | χ12=11,5 |
| [150] | [69] | p=0,001 | ||
| PCR (mg/L) | 181 (77-298) | 157 (52-265) | 231 (119-388) | χ12=6,1 |
| [165] | [82] | p=0,013 | ||
| PADM (nmol/L) | 1,35 (0,93-2,05) | 1,18 (0,85-1,69) | 1,92 (1,32-3,06) | χ12=24,7 |
| [154] | [75] | p<0,0001 | ||
La edad se presenta como media (desviación típica), y el sexo como número de casos (%). Los valores de los tres biomarcadores son mediana (rango intercuartílico). En el caso de datos perdidos el número de datos válidos aparece entre corchetes.
t: t-test; χ12: chi-cuadrado con un grado de libertad.
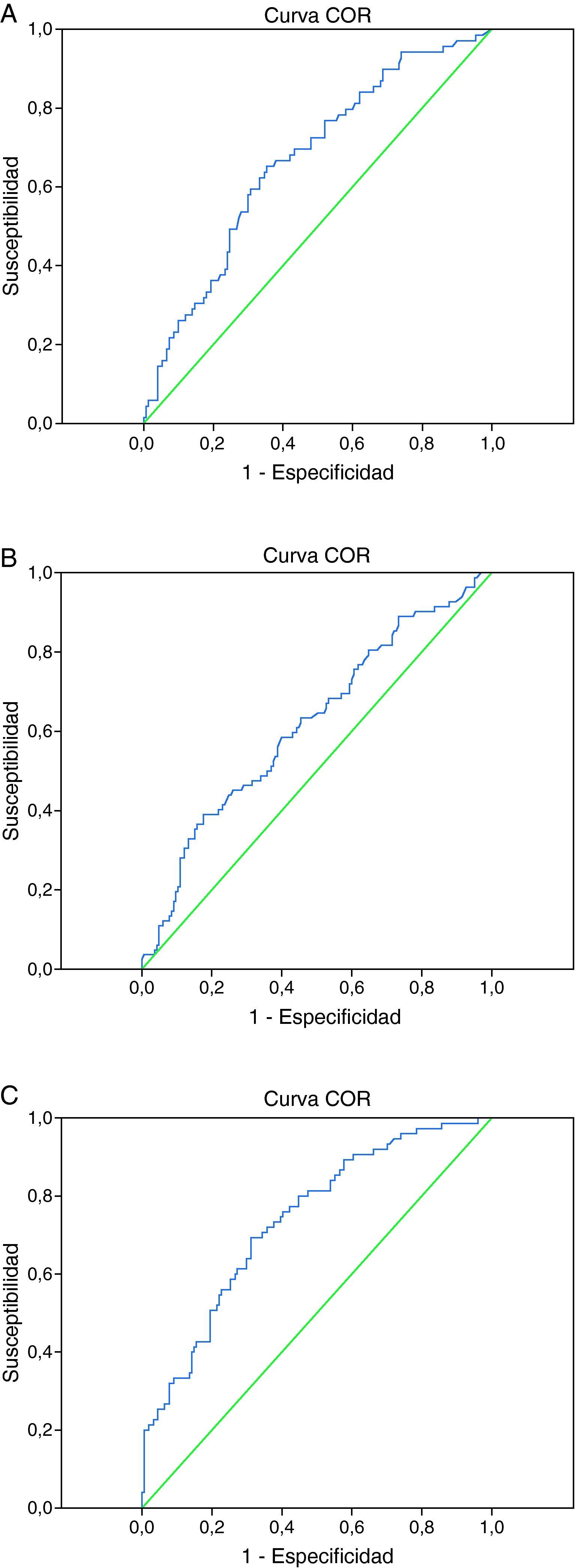
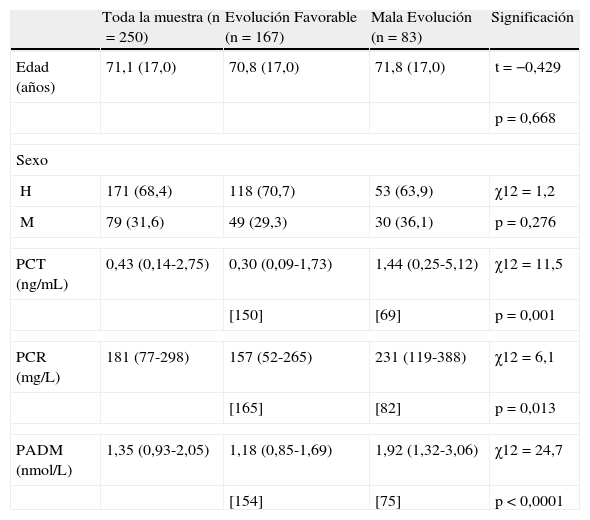
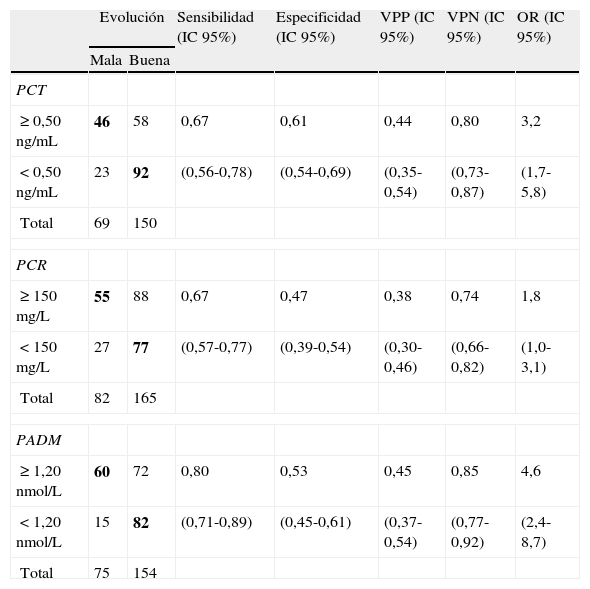
Se calcularon las curvas ROC correspondientes a cada biomarcador (fig. 1).
Para la PCT, el área bajo la curva fue de 0,67 (IC 95%: 0,59-0,74). Esta estimación se obtuvo con datos de 69 pacientes de mala evolución y 150 de evolución favorable.
Para la PCR, el área bajo la curva fue de 0,62 (IC 95%: 0,54-0,69). En este caso la estimación fue basada en 82 sujetos de mala evolución y 165 de evolución favorable.
Finalmente para la PADM, el área bajo la curva fue de 0,74 (IC 95%: 0,67-0,81), según los datos de 75 sujetos de mala evolución y 154 de evolución favorable.
Según los resultados de las curvas ROC, se sugieren tres puntos de corte, uno para cada biomarcador. A continuación se presentan los valores de sensibilidad, especificidad, VPP, VPN y OR con sus respectivos 95% IC para cada punto de corte.
Para la PCT se eligió un punto de corte de 0,50 ng/mL, obteniéndose una sensibilidad de 0,67 (IC 95%: 0,56-0,78), una especificidad de 0,61 (IC 95%: 0,54-0,69), un VPP de 0,44 (IC 95%: 0,35-0,54) y un VPN de 0,80 (IC 95%: 0,73-0,87) con un OR de 3,2 (IC 95%: 1,7-5,8).
Para la PCR el punto de corte de 150mg/L resultó en una sensibilidad de 0,67 (IC 95%: 0,57-0,77), una especificidad de 0,47 (IC 95%: 0,39-0,54), un VPP de 0,38 (IC 95%: 0,30-0,46) y un VPN de 0,74 (IC 95%: 0,66-0,82) con un OR correspondiente de 1,8 (IC 95%: 1,0-3,1).
Para la PADM un punto de corte de 1,2 nmoL/L obtuvo una sensibilidad del 0,80 (IC 95%: 0,71-0,89), una especificidad del 0,53 (IC 95%: 0,45-0,61), un VPP de 0,45 (IC 95%: 0,37-0,54) y un VPN de 0,85 (IC 95%: 0,77-0,92). Su OR fue de 4,6 (IC 95%: 2,4-8,7).
Estos datos, junto con las tablas de contingencia correspondientes a cada punto de corte, se presentan en la tabla 2.
Tablas de contingencia y valores de sensibilidad, especificidad, VPP, VPN y OR con sus respectivos intervalos de confianza del 95% (95% IC) para los puntos de corte seleccionados para PCT, PCR y PADM.
| Evolución | Sensibilidad (IC 95%) | Especificidad (IC 95%) | VPP (IC 95%) | VPN (IC 95%) | OR (IC 95%) | ||
| Mala | Buena | ||||||
| PCT | |||||||
| ≥ 0,50ng/mL | 46 | 58 | 0,67 | 0,61 | 0,44 | 0,80 | 3,2 |
| < 0,50ng/mL | 23 | 92 | (0,56-0,78) | (0,54-0,69) | (0,35-0,54) | (0,73-0,87) | (1,7-5,8) |
| Total | 69 | 150 | |||||
| PCR | |||||||
| ≥ 150mg/L | 55 | 88 | 0,67 | 0,47 | 0,38 | 0,74 | 1,8 |
| < 150mg/L | 27 | 77 | (0,57-0,77) | (0,39-0,54) | (0,30-0,46) | (0,66-0,82) | (1,0-3,1) |
| Total | 82 | 165 | |||||
| PADM | |||||||
| ≥ 1,20nmol/L | 60 | 72 | 0,80 | 0,53 | 0,45 | 0,85 | 4,6 |
| < 1,20nmol/L | 15 | 82 | (0,71-0,89) | (0,45-0,61) | (0,37-0,54) | (0,77-0,92) | (2,4-8,7) |
| Total | 75 | 154 | |||||
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En negrita se resalta el número de casos en los que coinciden el biomarcador y el tipo de evolución.
Aunque la medicina avanza a pasos agigantados y se descubren día a día nuevos tratamientos y curas para distintas enfermedades, la neumonía adquirida en la comunidad sigue siendo uno de los problemas sanitarios más importantes tanto por su incidencia global, como por las graves consecuencias en algunos enfermos.
En la actualidad se está estudiando el valor de diversos biomarcadores en el diagnóstico, pronóstico y seguimiento de la NAC con notables diferencias entre los distintos grupos25,26.
Nuestros resultados sugieren un posible valor pronóstico de PCR, PCT y PADM en relación con la evolución intrahospitalaria que presentarán los pacientes ingresados diagnosticados de NAC, aportando información a priori a los clínicos de cara a intensificar el seguimiento en aquellos con niveles más altos.
La PADM destaca y se muestra como el biomarcador con mayor capacidad para discriminar entre los pacientes con mala evolución y los de evolución favorable. El área bajo la curva de la PADM ha sido el mayor de todos, y el punto de corte sugerido ha alcanzado una alta sensibilidad (0,80), aunque su especificidad ha sido relativamente baja (0,53). Los pacientes con una PADM superior a 1,2 nmoL/L parecen tener mayor probabilidad de mala evolución intrahospitalaria que aquellos con un valor más bajo, con un OR de 4,6. Salvo la especificidad de la PCT, el resto de los valores diagnósticos de PCR y PCT sugieren una menor capacidad discriminatoria de estos biomarcadores.
La PADM ha sido analizada en diversos estudios como predictora de mal pronóstico en infecciones respiratorias y NAC, y los resultados han sido prometedores23,27. Ambos estudios tienen la ventaja de ser multicéntricos y con gran número de pacientes respecto del nuestro.
En cuanto a la PCT, aunque en un análisis preliminar con 81 pacientes no llegaba a adquirir significación estadística, al aumentar la cohorte sí que la ha alcanzado. En un estudio multicéntrico con una cohorte de más de 1.600 pacientes20, se observó que la PCT tenía valor pronóstico, relacionándose niveles altos de PCT con mayor probabilidad de muerte a los 30 días, y los niveles bajos con menos días de ingreso y mejor pronóstico a 30 días. En algunos estudios se ha postulado un punto de corte 0,25μg/L por debajo del cual sería poco probable una NAC grave22. Este dato concuerda perfectamente con los datos que hemos obtenido tal y como se puede ver en la tabla 1. De todas formas, las utilidades principales de la PCT como biomarcador son, por un lado, la de distinguir entre la etiología de la infección (vírica o bacteriana)21,25, y por otro, en el seguimiento de la eficacia del tratamiento26, ninguna de ellas estudiadas en el presente estudio.
Respecto a la PCR los resultados son parecidos a los obtenidos para la PCT. A pesar de ser un reactante de fase aguda, no específico, tiene valor pronóstico de mala evolución intrahospitalaria. Chalmers et al28 también encontraron valor pronóstico para la PCR, y su conclusión principal fue que los pacientes con una PCR<100mg/L tenían riesgo menor de mala evolución, datos que hemos podido corroborar.
Con la intención de dar una explicación a las diferencias en las publicaciones respecto de la PCR, Cabezas et al han publicado recientemente que la edad puede influir en su producción29. Esto no se ha tenido en cuenta en ninguno de los estudios mencionados, y tampoco en el nuestro.
Los VPNs obtenidos para nuestros puntos de corte de los tres biomarcadores nos indican que diferencian bien qué pacientes tienen menos probabilidades de evolucionar desfavorablemente, con lo que ayudarían en la práctica clínica a diferenciar los pacientes ingresados que no necesitan un seguimiento tan exhaustivo.
Lo que diferencia nuestro estudio del resto es que los datos son referidos únicamente al mal pronóstico intrahospitalario, y no se han encontrado datos para comparar al respecto. Los estudios mencionados tienen en cuenta el mal pronóstico a plazos más largos, la mayoría 30 días.
Una limitación que tener en cuenta es que es un estudio unicéntrico. A pesar de ser una desventaja en muchos aspectos, también ha permitido utilizar criterios concretos ya estudiados y adaptados a nuestra población, como la estancia intrahospitalaria media de 5 días, más baja de lo habitual en pacientes con NAC.
Nuestros resultados son novedosos y prometedores porque tienen en cuenta el riesgo de mal pronóstico intrahospitalario, a muy corto plazo, destacando sobre todo la PADM. Los niveles de biomarcadores podrían resultar de ayuda al clínico en urgencias a la hora de decidir qué pacientes necesitan un seguimiento más exhaustivo. Para ello convendría confirmar estos resultados en futuros estudios, y realizar estudios prospectivos teniendo en cuenta los biomarcadores en la estratificación de riesgo de los pacientes con NAC para comprobar su utilidad real.
FinanciaciónEste estudio ha recibido la ayuda del Áccesit Beca Brahms de la Fundación José Luis Castaño 2008. Los reactivos necesarios para las determinaciones de PCT y PADM fueron donados sin cargo por Roche Diagnostics® y Brahms AG® respectivamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009.