El objetivo del estudio es realizar un análisis retrospectivo de los componentes monoclonales nuevos detectados durante los años 2004, 2005 y 2006 en el Laboratorio del Carmen, dependiente del Servicio de Análisis Clínicos del Hospital Universitario Son Dureta.
Material y métodosEl material son los datos obtenidos de los pacientes a los que se realiza un proteinograma en el Laboratorio del Carmen durante los años 2004–2006. Se realizó un estudio epidemiológico de tasa de incidencia de componentes monoclonales (CM) en Baleares, su distribución, edad y sexo de los pacientes. También se registraron los isotipos de CM, así como determinados parámetros analíticos como proteínas, hemoglobina, albúmina, creatinina, concentración de inmunoglobulinas. Se clasificaron los diagnósticos de los pacientes en función del tipo de patología más frecuente asociado al CM.
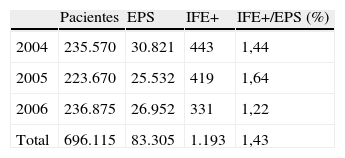
ResultadosDurante estos años, se atendieron en el laboratorio del Carmen 696.115 pacientes pertenecientes al Área Sanitaria de Mallorca, realizándose 83.305 electroforesis de proteínas séricas (11,96%), de los cuales solo el 1,43% obtuvo un resultado de inmunofijación electroforética positivo.
La tasa de incidencia global es de 70,98 casos nuevos/100.000 habitantes/año. En el 62,8% de los pacientes con presencia de CM no consta ningún diagnóstico.
The aim of this study is to carry out a retrospective analysis of monoclonal gammopathies detected during the period of 2004, 2005 and 2006 in the “El Carmen” laboratory, which is part of the Clinical Laboratory of Son Dureta Hospital. We studied the most important aspects related to these patients and the study of the monoclonal gammopathies detected.
Material and methodsAn epidemiological study was carried out on all the data, in order to find the incidence of monoclonal gammopathies, as well as its distribution, and the age and sex of the patients. We also studied the immunochemical types of the monoclonal components, as well as some analytical parameters. The patient diagnosis was classified according to the most common pathology associated to the monoclonal component.
ResultsDuring these years, 696,115 patients belonging to the Healthy Area of Mallorca were seen in the “El Carmen” laboratory and 83,305 (11.96%) serum protein electrophoreses were performed.
Only 1.43% had a positive result with electrophoretic immunofixation. The overall incidence was 70.98 new cases/100,000 inhabitants/year. The majority of patients (62.8%) with a monoclonal component had no diagnosis.
Las gammapatías monoclonales (GM) expresan el producto de la proliferación de un clono de células plasmáticas escapado al control normal de la homeostasis inmunoglobulínica. Estas células producen inmunoglobulinas (Ig) normales o sus fragmentos, cuyo aumento en sangre se detecta por la aparición de una banda homogénea en el trazado electroforético (componente monoclonal [CM])1. Sin lugar a dudas, el mayor interés clínico de las GM estriba en dos hechos: a) la posibilidad de encontrar bajo un común denominador, el CM, patologías tan dispares como una neoplasia o una infección, cuyo abordaje clínico-terapéutico difieren radicalmente; b) la diferente evolución de una GM, que puede mantenerse de forma estable a lo largo de los años, o bien corresponder a la fase inicial preclínica de un mieloma múltiple (MM), o una macroglobulinemia de Waldenstrom2.
La GM más frecuente es la denominada GM de significado incierto (GMSI) caracterizada por una concentración de la proteína monoclonal<30g/l, un porcentaje de células plasmáticas en médula ósea<10% y carencia de sintomatología clínica3,4. La prevalencia de la GMSI es de un 3%, en la población mayor de 50 años, y aumenta con la edad alcanzando una tasa de 10% en población mayor de 85 años5.
Actualmente, se considera que la GMSI constituye una etapa premaligna del MM6. En los trabajos realizados en población española7, la probabilidad de que una GMSI evolucione a gammapatía maligna (GMM) era de un 8,5% a los 5 años y de un 19,2% a los 10 años; Kyle et al8,9, en estudios con mayor número de pacientes y mayor número de años de seguimiento, concluían que el riesgo de progresión a gammapatía maligna era del 10%, a los 10 años; del 21%, a los 20 años, y del 26%, a los 25 años, siendo la patología que con más frecuencia se desarrollaba el MM. Por su parte el MM, aproximadamente el 1,1% de todos los tipos de cánceres y entre el 10–15% de los de tipo hematológico, posee el índice de mortalidad más elevado de todos los cánceres4. Así, si consideramos que el MM es una enfermedad grave con una media de supervivencia desde el diagnóstico de 33 meses, según reflejó Kyle10, podemos afirmar que la detección, tipificación y el seguimiento de los pacientes con GM es de gran importancia.
Debido a que no existen parámetros que permitan predecir la transformación de una GMSI a gammapatía maligna, solo el control clínico-biológico periódico nos permitirá valorar la evolución de los pacientes y si tenemos en cuenta que la detección y monitorización del CM precisa de métodos electroforéticos, el laboratorio está en una situación privilegiada para obtener la información de la incidencia, distribución y evolución de los pacientes con GM y, por ello, debe tener una actitud activa en el estudio de las GM.
No es fácil conocer la frecuencia de GM en una zona geográfica, por la dispersión existente para su detección entre los diversos servicios clínicos relacionados con esta patología: Hematología, Geriatría, Laboratorio Clínico, Medicina Interna, Atención Primaria, etc.
El Laboratorio del Carmen realiza los proteinogramas procedentes de la red de asistencia primaria correspondiente a 120 centros de salud y unidades básicas y, también, los proteinogramas procedentes del Hospital Universitario Son Dureta.
El objetivo del trabajo es realizar un estudio retrospectivo de los CM nuevos detectados durante los años 2004, 2005 y 2006 en el Laboratorio del Carmen revisando los aspectos más relevantes en relación a estos pacientes y el estudio de GM detectadas.
Material y métodosPoblación estudiadaLa población a estudio la constituyen los 560.202 habitantes que tienen como referencia al Laboratorio del Carmen, dependiente del Hospital Universitario Son Dureta (Palma de Mallorca).
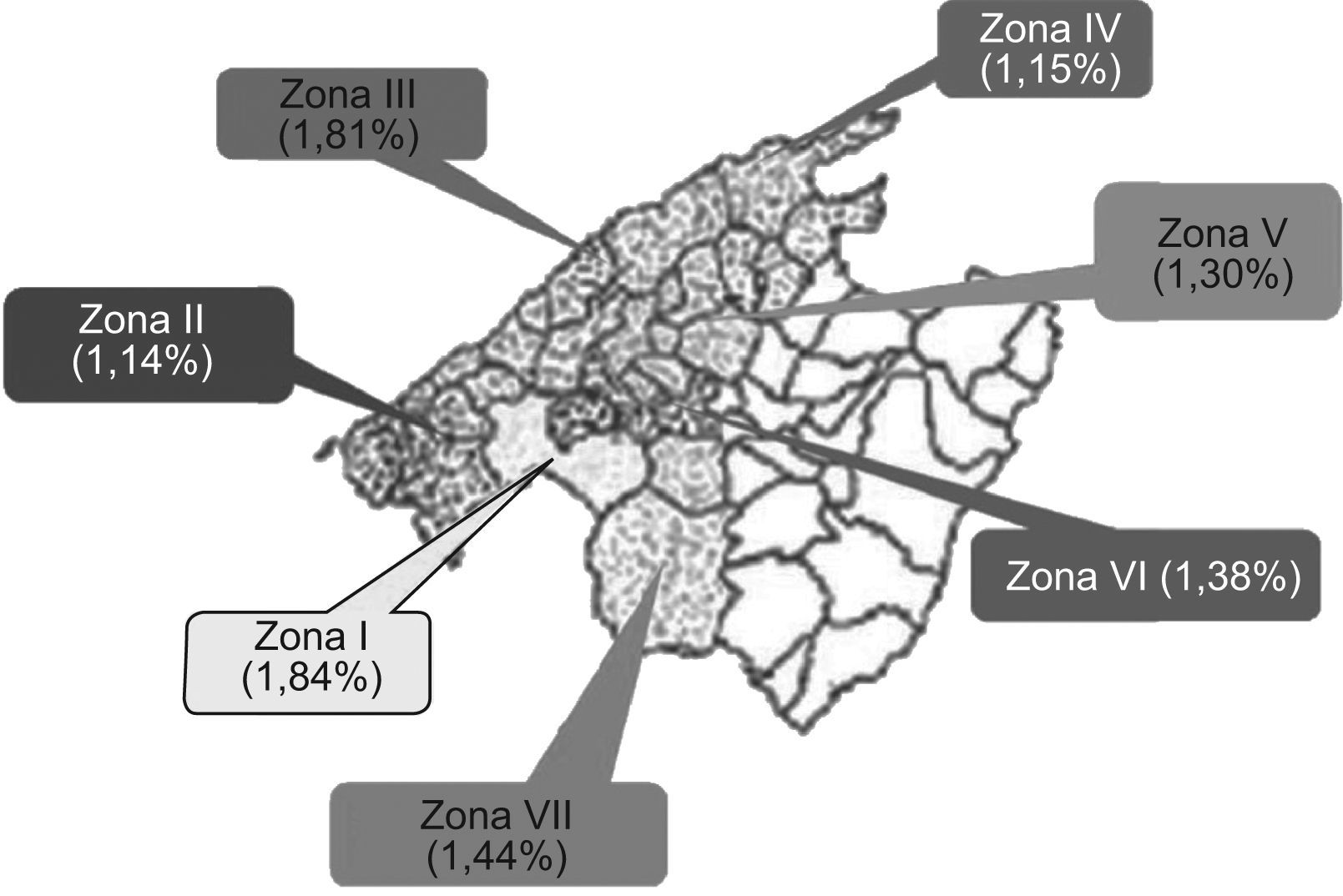
En función de las áreas de salud establecidas por el Instituto Balear de la Salud se ha realizado una división en 7 áreas geográficas. Si consideramos la población atendida, podemos definir siete zonas. Zona I: Palma (incluye Hospital Universitario Son Dureta), que atiende a una población de 346.720 habitantes. Zona II (oeste): con una población de 49.560 habitantes. Zona III (norte I): 24.692 habitantes. Zona IV (norte II): 40.691 habitantes. Zona V (Raiger): 39.230 habitantes. Zona VI (Pla): 30.691 habitantes. Zona VII (sur): una población de 28.618 habitantes.
Las peticiones analíticas tienen diversa procedencia: pacientes atendidos en los centros de salud de Atención Primaria, en Consultas Externas de Atención Especializada, o pacientes del Hospital Universitario Son Dureta.
Se recogieron, de forma retrospectiva, los datos de los 1.193 pacientes a los que se detectó y confirmó por primera vez un CM durante el periodo de 2004–06. La información incluida en una base de datos informatizada fue, el nombre del paciente, sexo, año de nacimiento, número de centro de salud y/o unidad básica de salud y/o Hospital Son Dureta, la fecha de detección del CM, tipo de CM, concentración de las Ig G, Ig A, Ig M, diagnóstico concentración de hemoglobina, proteína total, albúmina y creatinina.
Solo se reflejó en la base de datos los CM nuevos, no se incluyen las visitas repetidas de los pacientes.
Obtención de muestrasSe extrajeron 20cc de sangre venosa, obtenida en sistema de vacío sin aditivo. Posteriormente, se dejó coagular a temperatura ambiente y se centrifugó a 3.000rpm durante 10min, para obtener el suero en el que se realizaron las determinaciones. No se procesaron muestras de plasma para evitar la presencia de fibrinógeno que presenta movilidad electroforética similar a la de algunas Ig.
Métodos analíticosLa concentración de proteína total en suero se cuantificó mediante el método de Biuret, la albúmina por método colorimétrico con verde de bromocresol, y creatinina por método de Jaffé cinético. Todas las determinaciones bioquímicas se realizaron en el analizador Advia 2.400 (Bayer Diagnostics). La hemoglobina se cuantificó por el método de la cianmetahemoglobina en el analizador ADVIA 120 (Bayer Diagnostics).
La electroforesis de las proteínas séricas (EPS) se realizó mediante electroforesis capilar, utilizando el analizador Paragon CZE 2.000 (Beckman-Coulter Instruments). La cuantificación de las Ig G, A y M se llevó a cabo en el nefelómetro Immage, mediante inmunonefelometría cinética siguiendo las instrucciones del fabricante y utilizando los reactivos suministrados por (Beckman-Coulter Instruments). La identificación del CM se realizó por inmunofijación sobre gel de agarosa (Helena).
Métodos estadísticosSe ha utilizado el método epidemiológico descriptivo, usando como marcador la tasa de incidencia de los nuevos CM detectados en el laboratorio durante los años 2004–2006.
En el análisis estadístico, se realizó el test de Kolmogorov-Smirnov y la prueba T de Student para comparar los parámetros entre los grupos diagnósticos MM y GMSI.
Todos los análisis estadísticos fueron llevados a cabo con el programa SPSS para Windows (Versión 11.0), y se consideró que existía significación estadística cuando p<0,05.
ResultadosEn los años 2004, 2005 y 2006 se atendieron a 696.115 pacientes, el 52,6% eran hombres y el 47,4% mujeres, con una edad media de 69 años.
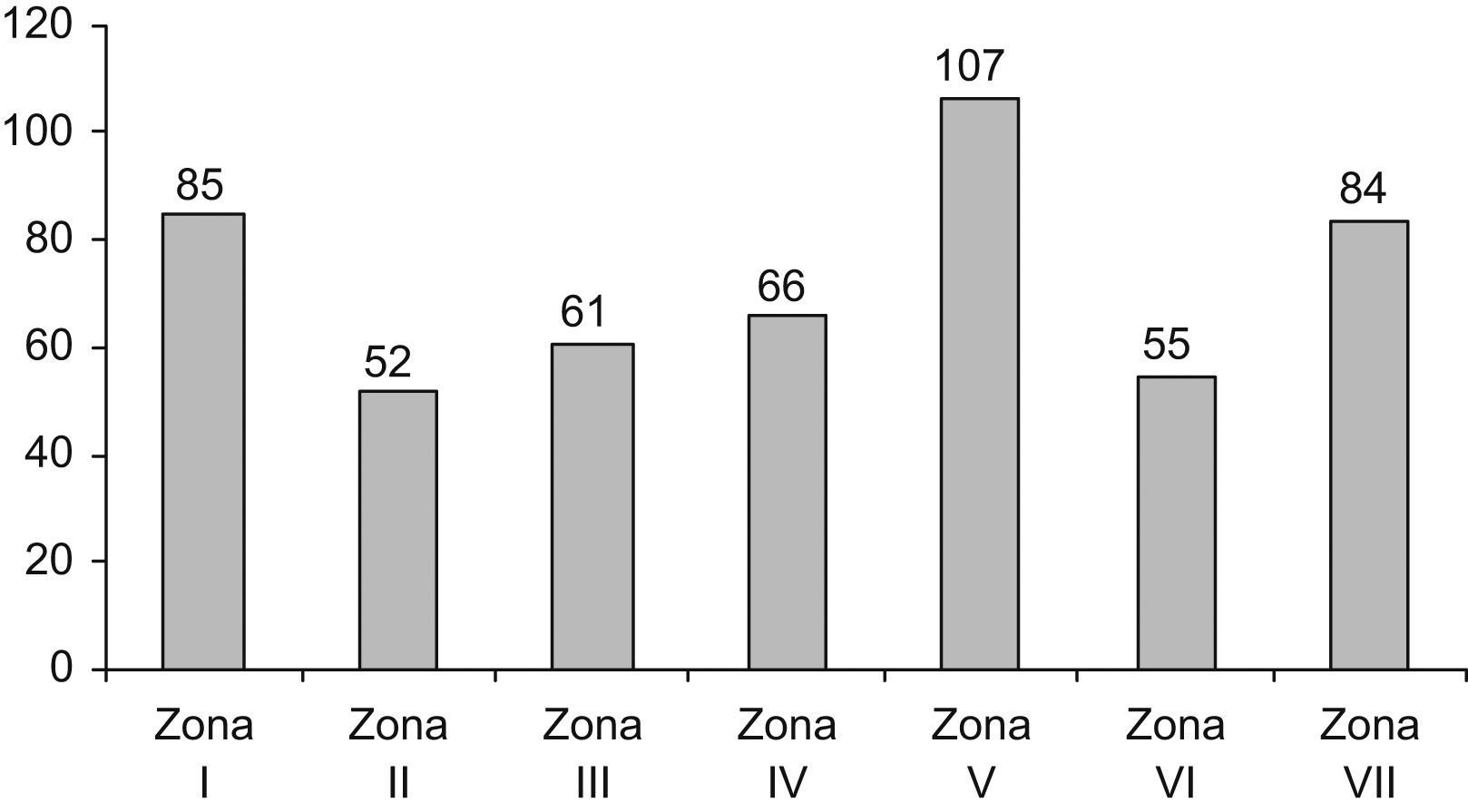
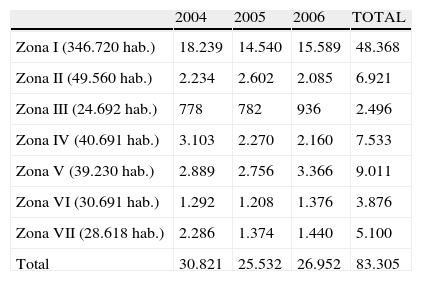
Los proteinogramas realizados en función de las distintas zonas geográficas quedan reflejados en la tabla 1.
Número de proteinogramas realizados por zonas geográficas y años
| 2004 | 2005 | 2006 | TOTAL | |
| Zona I (346.720 hab.) | 18.239 | 14.540 | 15.589 | 48.368 |
| Zona II (49.560 hab.) | 2.234 | 2.602 | 2.085 | 6.921 |
| Zona III (24.692 hab.) | 778 | 782 | 936 | 2.496 |
| Zona IV (40.691 hab.) | 3.103 | 2.270 | 2.160 | 7.533 |
| Zona V (39.230 hab.) | 2.889 | 2.756 | 3.366 | 9.011 |
| Zona VI (30.691 hab.) | 1.292 | 1.208 | 1.376 | 3.876 |
| Zona VII (28.618 hab.) | 2.286 | 1.374 | 1.440 | 5.100 |
| Total | 30.821 | 25.532 | 26.952 | 83.305 |
En total, se realizaron 83.305 EPS, lo que significa que se solicitó una EPS al 11,96% de los 696.115 pacientes.
Se tipificaron por inmunofijación 1.193CM, por lo que la frecuencia de los CM nuevos detectados en los 83.305 EPS fue de 1,43% (tabla 2).
Los resultados en función de las diferentes áreas geográficas divididas quedan reflejado en la figura1.
La tasa de incidencia global para la población dependiente del Laboratorio del Carmen, 560.202 habitantes es de 70,98 casos nuevos/100.000 habitantes/año. La incidencia en las 7 áreas queda reflejada en la figura 2.
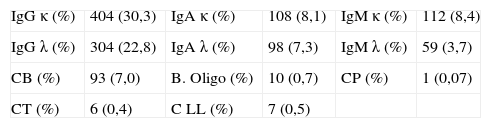
La tipificación por inmunofijación de los CM detectados queda reflejada en la tabla 3.
Distribución de isotipos de paraproteínas detectadas por inmunofijación
| IgG κ (%) | 404 (30,3) | IgA κ (%) | 108 (8,1) | IgM κ (%) | 112 (8,4) |
| IgG λ (%) | 304 (22,8) | IgA λ (%) | 98 (7,3) | IgM λ (%) | 59 (3,7) |
| CB (%) | 93 (7,0) | B. Oligo (%) | 10 (0,7) | CP (%) | 1 (0,07) |
| CT (%) | 6 (0,4) | C LL (%) | 7 (0,5) |
B. Oligo: bandas oligoclonales; CB: componente biclonal; CLL: cadenas ligeras libres; CP: cadenas pesadas; CT: componente triclonal.
En referencia a la cuantificación de Ig los resultados de imprecisión intraserie/interserie son inferiores al 5,6% para todas las concentraciones de Ig11.
Si consideramos el valor de referencia de las Ig G: 700–1.600mg/dl; Ig A: 70–400mg/dl, e Ig M: 40–230mg/dl, el resultado de las Ig en función del tipo de CM queda reflejado en la tabla 4.
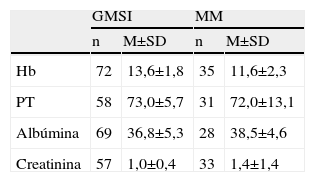
Se realiza el estudio de los parámetros analíticos, hemoglobina, albúmina, proteínas totales y creatinina, en los 2 grupos diagnósticos de MM y GMSI. Al comparar las medias para los grupos MM y GMSI, no se encontraron diferencias estadísticamente significativas para ninguno de los parámetros estudiados (p<0,05), excepto para la hemoglobina. (tabla 5).
Resultados de parámetros analíticos
| GMSI | MM | |||
| n | M±SD | n | M±SD | |
| Hb | 72 | 13,6±1,8 | 35 | 11,6±2,3 |
| PT | 58 | 73,0±5,7 | 31 | 72,0±13,1 |
| Albúmina | 69 | 36,8±5,3 | 28 | 38,5±4,6 |
| Creatinina | 57 | 1,0±0,4 | 33 | 1,4±1,4 |
Hb: hemoglobina; GMSI: gammapatía monoclonal de significado incierto; M: media; MM: mieloma múltiple; PT: proteína total; SD: desviación estandar.
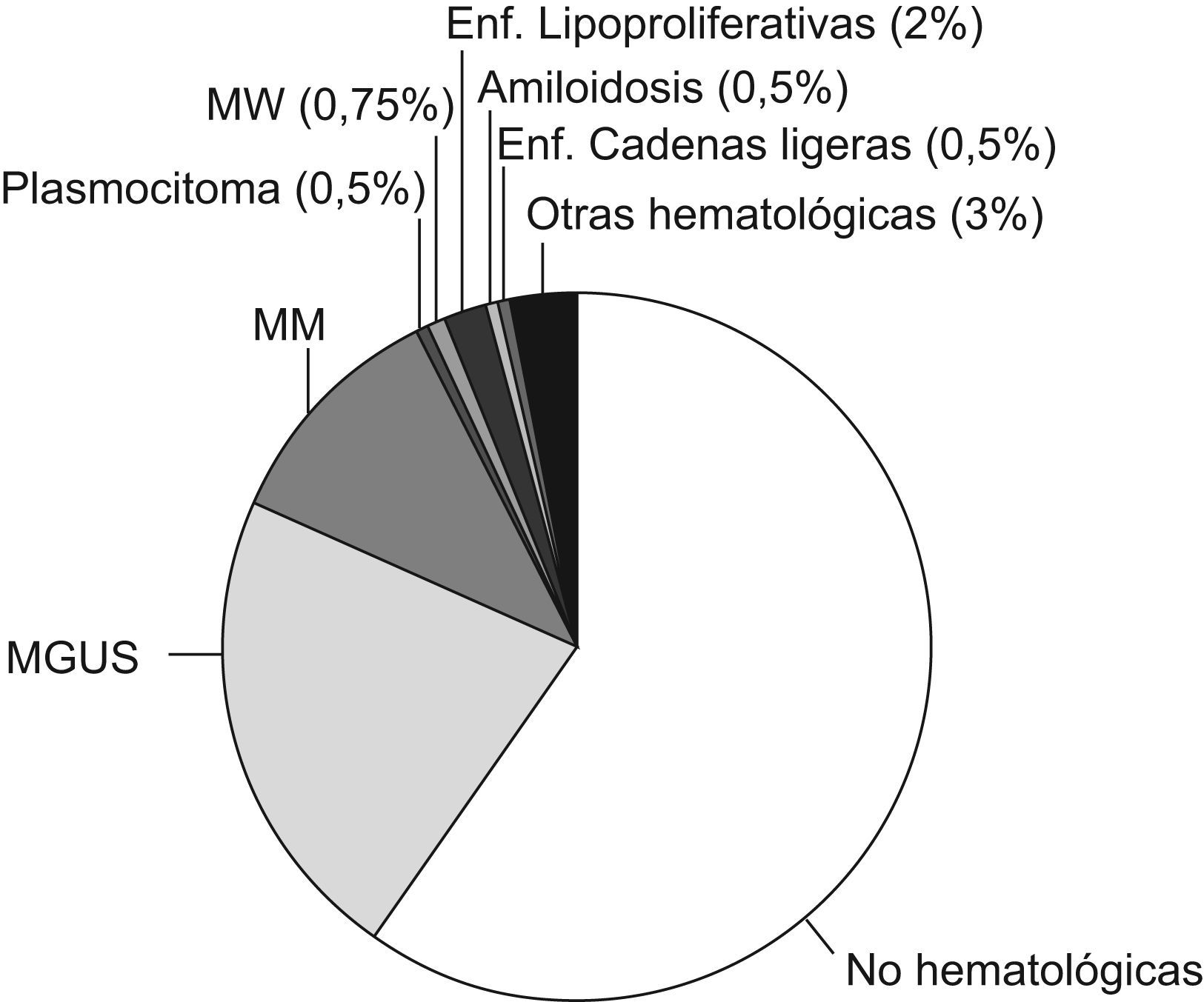
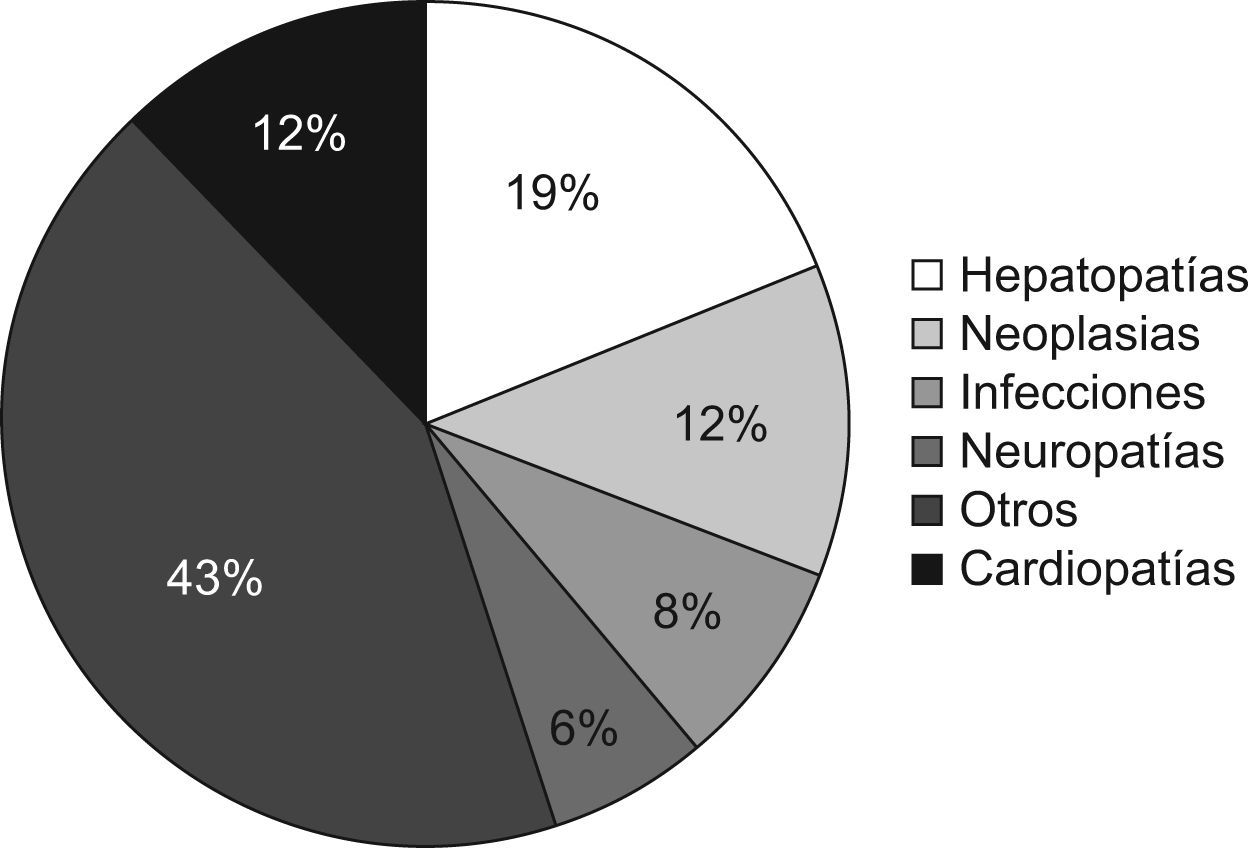
En el 62,8% de los pacientes con presencia de CM no consta ningún diagnóstico. En el resto de pacientes, el diagnóstico de los pacientes se ha clasificado en función de las enfermedades que con mayor frecuencia están relacionadas con la presencia de un CM. Los resultados quedan reflejados en la figura 3. Si establecemos una diferenciación entre aquellos pacientes con diagnóstico de carácter no hematológico y los clasificamos según las patologías que con mayor frecuencia presentan CM, los resultados quedan reflejados en la figura 4.
DiscusiónEl diseño experimental posiblemente no es el método más adecuado para un estudio epidemiológico, porque la selección de pacientes no se ha realizado al azar y, por tanto, está condicionado por la frecuencia con que los clínicos solicitan proteinogramas. De todas maneras, las muestras pueden dar una idea aproximada del Área Sanitaria de Mallorca, porque tienen tan diversa procedencia como revisiones rutinarias solicitadas en el centro de salud por el médico de cabecera a pacientes sin ninguna clínica, pacientes de Consultas Externas, Urgencias o pacientes ingresados en el Hospital Universitario Son Dureta.
El análisis de los 1.193 pacientes con presencia de CM nos permite valorar que es un grupo heterogéneo con edades entre 18–107 años en el que predominan los mayores de 40 años siendo la edad media del grupo estudiado de 69 años.
La frecuencia de detección de gammapatías ha aumentado en la práctica, debido a la generalización de los estudios electroforéticos y a la utilización de sistemas de separación proteica cada vez más sensibles, precisos y fiables2. Hasta el año 1999, el Laboratorio del Carmen realizaba la electroforesis de proteínas sobre soporte de acetato de celulosa y se realizó un trabajo similar al actual obteniendo una tasa de detección de CM de 26,00 casos nuevos/100.000 habitantes/año12. En el trabajo desarrollado actualmente, la tasa de detección de CM es de 70,98 casos nuevos/100.000 habitantes/año. Este incremento tan importante se debe principalmente al mayor número de EPS realizadas y a la mejor resolución aportada por la electroforesis capilar.
La tasa de incidencia global obtenida por nuestro laboratorio 70,98 casos nuevos/100.000 habitantes/año es muy similar a la obtenida por Maiz et al13, que hallan una incidencia de 67,8/100.000 habitantes/año. Sin embargo, son datos muy superiores a los obtenidos por Giraldo et al en Zaragoza2 con una incidencia de 36/100.000 habitantes/año, o Bergon et al14 en Madrid, con una incidencia de 10,1/100.000 habitantes/año. Posiblemente, la similitud de datos obtenidos con Maiz et al es debida a que la selección del tipo de pacientes es muy similar, al igual que el elevado número de proteinogramas realizados 93.880 EPS, en el trabajo de Maiz et al, y 83.305 EPS, en el nuestro. El porcentaje de inmunofijaciones positivas con respecto al número de proteinogramas realizados es de 1,43%. La conclusión que podemos obtener de este dato es el elevado número de proteinogramas realizados sin una significación clínica relevante. La explicación está muy relacionada con la población seleccionada, lo que ha provocado una reacción por parte del laboratorio que mediante una campaña de concienciación a los médicos de atención primaria ha recomendado la solicitud del proteinograma solo en los casos de sospecha de GM. Esta acción ha provocado un descenso importante del número de proteinogramas solicitados en la actualidad de forma que (a falta de una valoración más profunda), podemos afirmar que el porcentaje de inmunofijación electroforética positivo obtenidos frente a los EPS solicitados en estos momentos, es muy superior al que publicamos en el trabajo actual.
La tasa de incidencia según la zona geográfica es similar en todas ellas a excepción de las zonas I, V y VII. La zona I presenta la mayor población asignada y por tanto mayor n.° de proteinogramas realizados lo que podría explicar la elevada tasa de detección. Sin embargo para las zonas V y VII con una población asignada similar al resto de zonas (desde II-VII) la tasa de detección es superior, lo que exige un estudio del tipo de población adscrita a estas zonas. Si tenemos en cuenta que la incidencia es superior en raza negra, población de mayor edad y sexo varón15 podemos determinar que teniendo en cuenta que la tasa de varones y edad media es muy similar en todas las zonas, estos 2 factores no podrían explicar esta incidencia superior para las zonas V y VII. Por ello, podríamos pensar que una tasa de inmigración superior en esta zona podría explicar la elevada incidencia. Actualmente, Atención Primaria en Baleares no tiene adscrita un número de historia clínica y, por tanto, un estudio de características demográficas es complejo por lo que la justificación de las diferentes tasas de incidencia serán objeto de un estudio posterior.
La distribución de CM detectados coincide con la publicada por trabajos de otros autores2,4,13 donde el CM más frecuente es el de Ig G kappa seguido de Ig A e Ig M.
Los resultados obtenidos sobre la concentración de Ig en función del CM detectado, implican que ante la sospecha de un CM de tipo Ig A o CM de IgM, la concentración elevada de esa Ig A o Ig M (en ausencia de otras situaciones clínicas de carácter inflamatorio/infeccioso) permite sospechar la posible presencia de ese CM, ya que en el 86% de CM de tipo IgA la concentración de esta Ig está por encima de los valores de referencia, al igual que ocurre con los CM de tipo IgM en los que el valor de IgM está elevada en el 85% de los casos. Sin embargo, el valor de IgG no es un dato discriminante ante la sospecha de un CM IgG ya que solo en el 28,7% de los casos, la IgG está por encima del rango de referencia. Al estudiar conjuntamente en un CM el aumento de la Ig implicada y el descenso de las otras dos como signo de mayor invasión medular y pero pronóstico, es en el CM tipo Ig A en el que existe en un 48% de los casos un aumento de la concentración de Ig A conjuntamente con una disminución de la Ig G y /o Ig M.
Si observamos que en el 62,8% de los pacientes que presentaban un CM no existe un diagnóstico, podemos afirmar que el hallazgo de este CM fue fortuito y la falta de manifestaciones clínicas relacionadas con GM no llevó a estudios posteriores. Actualmente, no existe un protocolo consensuado entre Atención Primaria y Atención Especializada a diferencia de otras comunidades16, por lo que en muchas ocasiones a estos pacientes no se les realiza un estudio diagnóstico completo posterior.
En los pacientes que presentaban un diagnóstico relacionado con la presencia del CM, el grupo mayoritario, era el de GMSI y, en segundo lugar, el grupo de pacientes con diagnostico de MM, resultados similares a los publicados en la bibliografía general sobre CM. Sin embargo, contrariamente a lo observado en otros estudios, al analizar nuestros valores para albúmina, proteína y creatinina, no encontramos diferencias estadísticamente significativas. Una posible explicación a este hecho podría ser que nuestros datos corresponden al momento del diagnóstico de MM y GMSI. Sin embargo, en otros estudios similares, los autores realizan un seguimiento evolutivo a largo plazo de los pacientes estudiados, razón por la cual aparecen diferencias estadísticamente significativas entre ambos grupos (MM y GMSI) para los distintos parámetros estudiados. En nuestro caso, el único parámetro donde encontramos diferencias significativas, es la hemoglobina, pero esto podría ser debido a la diferencia de valores de ésta entre el sexo masculino y femenino.
A pesar de que se han introducido nuevos tipos de tratamiento, el MM es una enfermedad incurable y, dado que la concentración de la Ig monoclonal está relacionada directamente con la masa del clon de células que la produce (con excepción del mieloma no secretor), el CM constituye un marcador bioquímico esencial tanto en el momento del diagnóstico del MM17,18, como en la monitorización y en la evaluación de la respuesta al tratamiento4. Así, es muy importante que el laboratorio disponga de un fichero para registrar los datos evolutivos del paciente19, siendo fundamental reflejar en la ficha del paciente la cuantificación del CM realizada por densitometría siempre que el tipo de CM lo permita15, de forma que la concentración del CM adquiere el significado de marcador tumoral para el seguimiento de estos pacientes.
Del resto de pacientes cuyo CM se asoció a un diagnóstico sin relación con patología hematológica, el grupo mayoritario lo constituían los pacientes que presentaban una hepatopatía, neoplasia o cardiopatía, al igual que el trabajo publicado por Giraldo et al2, confirmando la detección de estos CM de forma fortuita, que posiblemente tendrán un carácter transitorio, dato a evaluar con el seguimiento posterior de estos pacientes.
ConclusiónLa detección y monitorización del CM precisa de métodos electroforéticos, lo que sitúa al laboratorio en una situación privilegiada para obtener la información de la incidencia, distribución y evolución de los pacientes con GM y debe provocar una actitud activa en el estudio de las GM.
Parece existir una mayor incidencia de CM en la isla de Mallorca que en otras zonas de la geografía española, lo que podría hacer pensar en la posible existencia de factores de riesgo que provoquen esta elevada casuística. La tasa de incidencia superior en las zonas V y VII precisa de estudios posteriores que permitan explicar este hecho.
La petición del proteinograma en población general no tiene justificación, por lo que es imprescindible que el laboratorio adopte medidas para racionalizar la solicitud de proteinogramas al laboratorio (estas medidas ya se han tomado y ha descendido considerablemente el número de proteinogramas solicitados).
Es imprescindible elaborar un protocolo de estudio de CM entre Atención Primaria, Atención Especializada y los servicios de Análisis Clínicos e Inmunología.
Los resultados obtenidos en cuanto al diagnóstico de los pacientes son similares a los publicados por otros autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.