La púrpura de Henoch-Schönlein en el adulto es un reto diagnóstico. Su baja incidencia y su sintomatología poco específica configuran un cuadro clínico que puede pasar desapercibido en diversas ocasiones o solaparse bajo el peso de diferentes sospechas diagnósticas. La púrpura de Henoch-Schönlein no es un cuadro de espectro único. Se considera un grupo de enfermedades de manifestación heterogénea con un eje patogénico común dado por el hallazgo de inflamación de la pared en vasos de pequeño calibre mediada por complejos inmunes. Este es el caso de un paciente de 70años quien cursa con un cuadro compatible con púrpura de Henoch-Schönlein, de inicio tardío, caracterizada por su difícil manejo y constantes recaídas. a pesar del uso cuidadoso de las pautas terapéuticas establecidas por los consensos actuales. En este paciente se documentó, de forma concomitante, una infección por citomegalovirus que al recibir tratamiento permitió el control adecuado de síntomas. Adicionalmente, este paciente presentaba una linfocitopenia que parecía ser secundaria a la infección viral.
Henoch-Schönlein purpura in the adult is a diagnostic challenge. Its low incidence and its unspecific symptomatology in this age group, establish a clinical chart that can be ignored on several occasions. Henoch-Schönlein purpura is considered a group of diseases of heterogeneous manifestation with a common pathogenic axis: the finding of inflammation of the wall of the small calibre vessels, mediated by immune complexes. The case is presented of a 70-year-old patient with a difficult to treat Henoch-Schönlein purpura, with constant relapses despite the use of the therapeutic guidelines established in the current guidelines. In this patient, a concomitant cytomegalovirus infection was documented that, after receiving treatment, allowed adequate control of symptoms. Additionally, this patient also had a lymphocytopenia that was secondary to cytomegalovirus.
La púrpura de Henoch-Schönlein (PHS) es una vasculitis sistémica mediada por inmunocomplejos (IgA) que afecta los vasos de pequeño calibre de la piel, los glomérulos y el sistema digestivo1. La mayor parte de los casos aparecen en la infancia, con una incidencia aproximada de 3,26/100.000 habitantes1. El pronóstico en este grupo etario suele ser benigno2. En contraste, la presentación del anciano es infrecuente y corresponde a menos del 10% de los casos3. Las series de casos parecen indicar que los adultos suelen responder de forma favorable al tratamiento convencional: un tratamiento que puede resultar controvertido debido a la ausencia de ensayos clínicos controlados que lo soporten con evidencia concreta4. Presento el caso de un hombre de 70años con diagnóstico de PHS, con múltiples recaídas a pesar de tratamiento corticoide a altas dosis en asociación con protocolos de citostáticos. Así mismo, el paciente cursaba con infección por citomegalovirus, que en el presente contexto pareciera contribuir a la perpetuación de los fenómenos de autoinmunidad activa o mimetizar síntomas que se relacionaron a refractariedad del cuadro. Existen 4casos reportados en la literatura que han relacionado el citomegalovirus con la PHS. Estos 4casos reportan pacientes que debutan con alteraciones renales y hallazgos compatibles con PHS. Una vez se instauró el tratamiento de la vasculitis, los pacientes presentaron episodios de sangrado intestinal con estudios histopatológicos compatibles con infección por citomegalovirus. La diferencia cardinal con nuestro caso es la documentación de una linfocitopenia en probable relación con la infección viral.
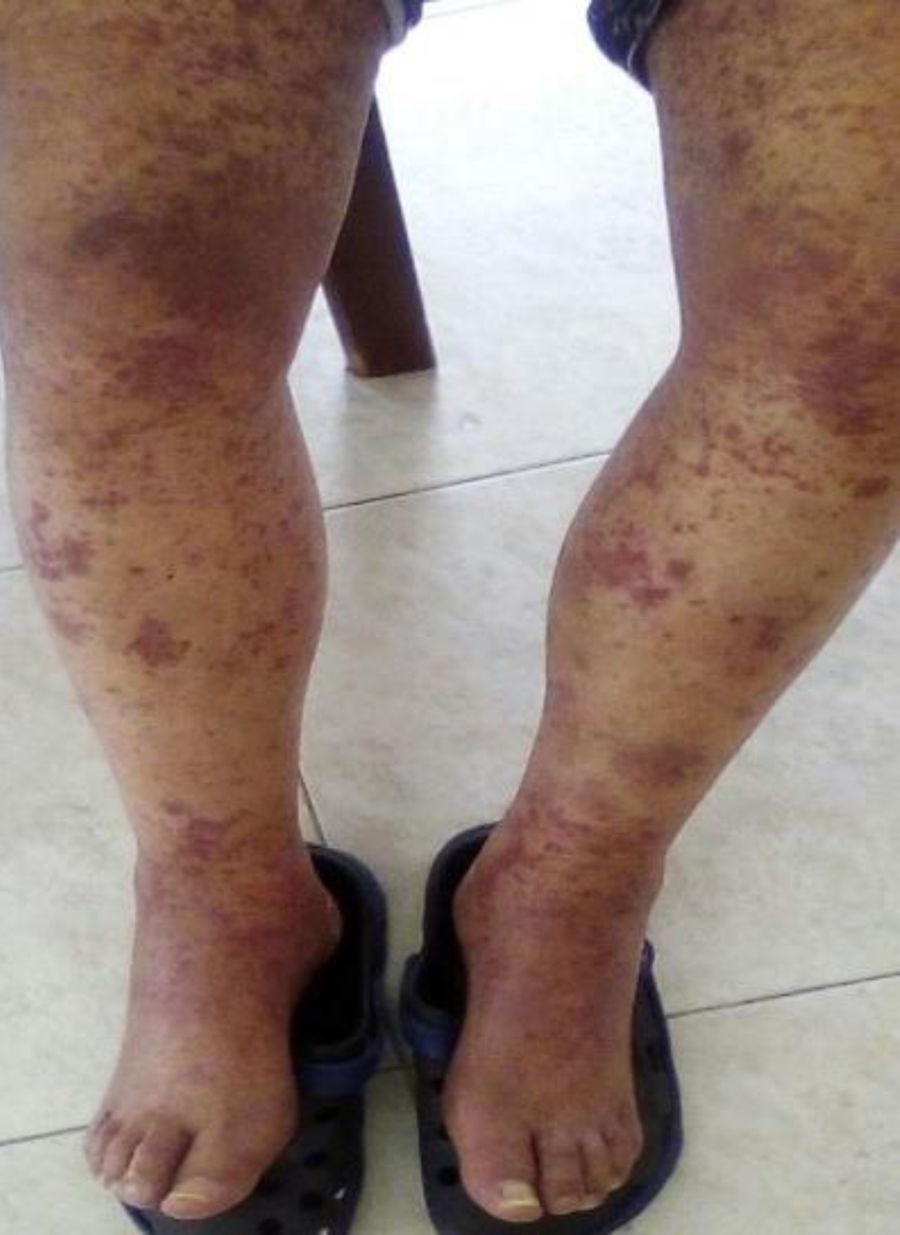
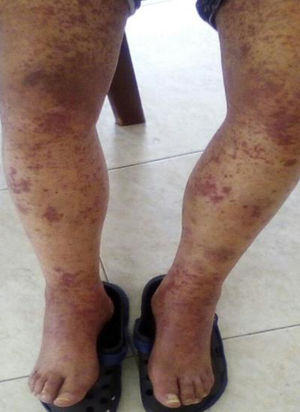
Caso clínicoPaciente masculino de 70 años, con ocupación de vendedor, sin antecedentes médicos de relevancia, quien ingresa remitido de otra institución por cuadro clínico de 15días de evolución consistente en lesiones purpúricas pruriginosas generalizadas, asociadas a alteración de la función renal. Al examen físico se evidenciaban máculas confluentes y placas purpúricas en miembros inferiores. Se inician pulsos con altas dosis de esteroide con sospecha diagnóstica de vasculitis ANCA positivo. El paciente había presentado varios cuadros de las mismas características durante los últimos 8años, de presentación episódica y periodos intercríticos asintomáticos, con una respuesta inicial adecuada a los esteroides y con diagnóstico por biopsia de piel de vasculitis leucocitoclástica. Adicionalmente, el paciente había cursado en diversas oportunidades con dolor abdominal intenso de etiología no dilucidada. Al culminar la administración de esteroide la función renal se recuperó en su totalidad. Se inició estudio solicitando perfil inmunológico y biopsia renal, con reporte de proliferación mesangial con depósitos de IgA. Se diagnosticó PHS del anciano.
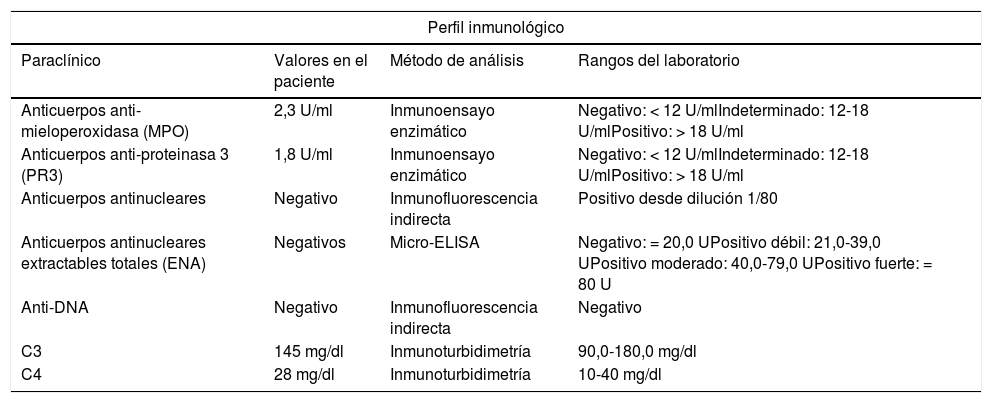
El paciente reingresó meses después por cuadro similar al previamente descrito (fig. 1). Se amplían estudios para descartar causas neoplásicas, entre ellas mieloma múltiple, los cuales son negativos. Perfil para autoinmunidad negativo (tabla 1). Se evidenció PTH muy elevada, por lo cual se realiza gammagrafía, la que reporta un adenoma paratiroideo el cual se resecó. Se inicia ciclofosfamida a dosis de 750mg (de aplicación mensual, por 6meses). Con la primera dosis de citostático el paciente resuelve su sintomatología, por lo cual se da egreso para continuar el esquema de forma ambulatoria.
Perfil inmunológico del paciente
| Perfil inmunológico | |||
|---|---|---|---|
| Paraclínico | Valores en el paciente | Método de análisis | Rangos del laboratorio |
| Anticuerpos anti-mieloperoxidasa (MPO) | 2,3 U/ml | Inmunoensayo enzimático | Negativo: < 12 U/mlIndeterminado: 12-18 U/mlPositivo: > 18 U/ml |
| Anticuerpos anti-proteinasa 3 (PR3) | 1,8 U/ml | Inmunoensayo enzimático | Negativo: < 12 U/mlIndeterminado: 12-18 U/mlPositivo: > 18 U/ml |
| Anticuerpos antinucleares | Negativo | Inmunofluorescencia indirecta | Positivo desde dilución 1/80 |
| Anticuerpos antinucleares extractables totales (ENA) | Negativos | Micro-ELISA | Negativo: = 20,0 UPositivo débil: 21,0-39,0 UPositivo moderado: 40,0-79,0 UPositivo fuerte: = 80 U |
| Anti-DNA | Negativo | Inmunofluorescencia indirecta | Negativo |
| C3 | 145 mg/dl | Inmunoturbidimetría | 90,0-180,0 mg/dl |
| C4 | 28 mg/dl | Inmunoturbidimetría | 10-40 mg/dl |
Dos meses después el paciente reingresa por reaparición de lesiones purpúricas palpables generalizadas asociadas con anasarca. Se iniciaron pulsos de esteroide a altas dosis, con lo cual resolvió el cuadro de forma absoluta y rápida. Reingresó tras pocas semanas con nueva recaída cutánea en el contexto de hemorragia digestiva alta, secundaria a gastritis con control endoscópico exitoso. Al resolver la hemorragia digestiva se administraron pulsos de esteroide. Para este momento había recibido varios esquemas de ciclofosfamida. Se dejó manejo crónico con esteroide a altas dosis y azatioprina.
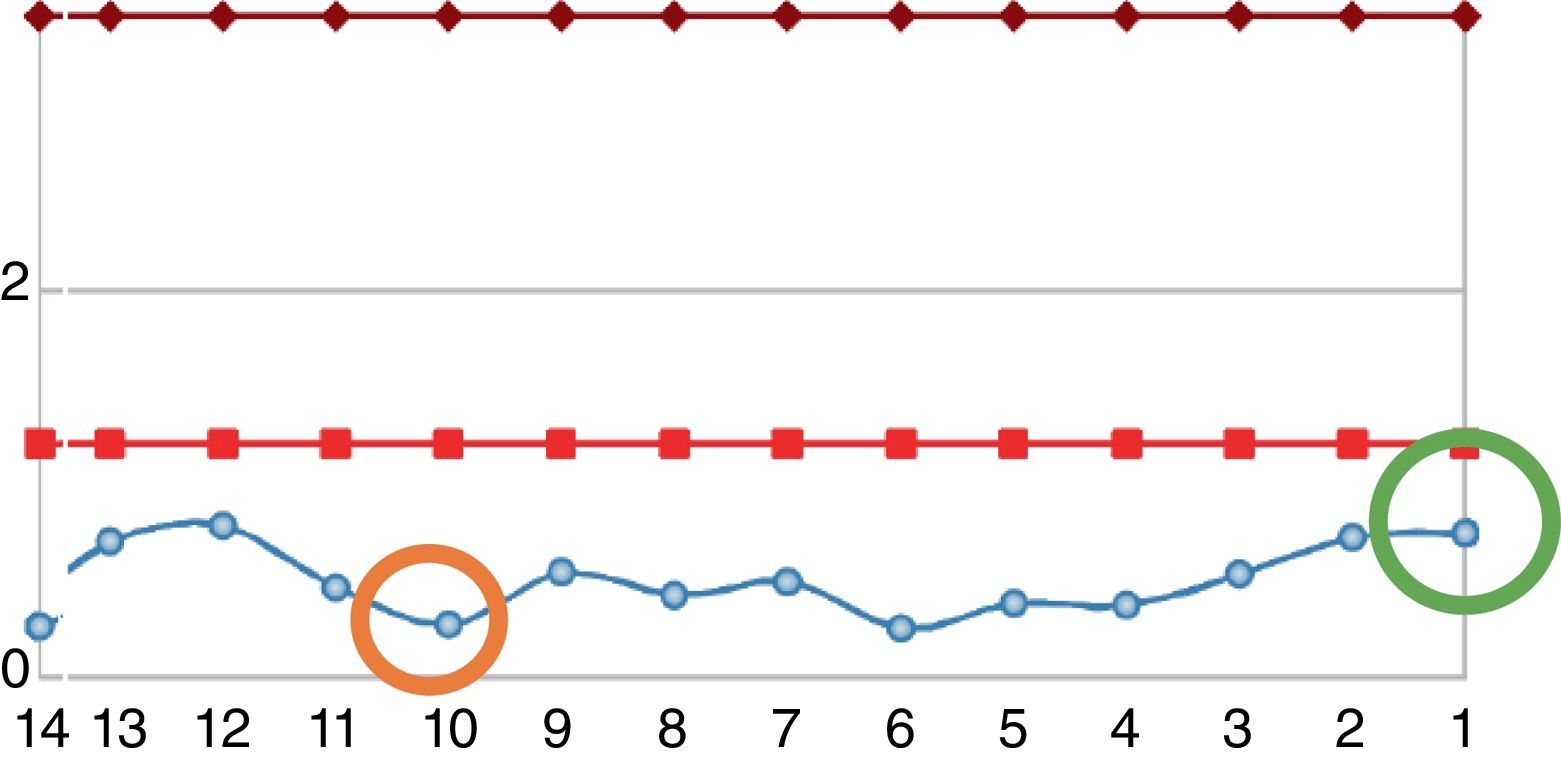
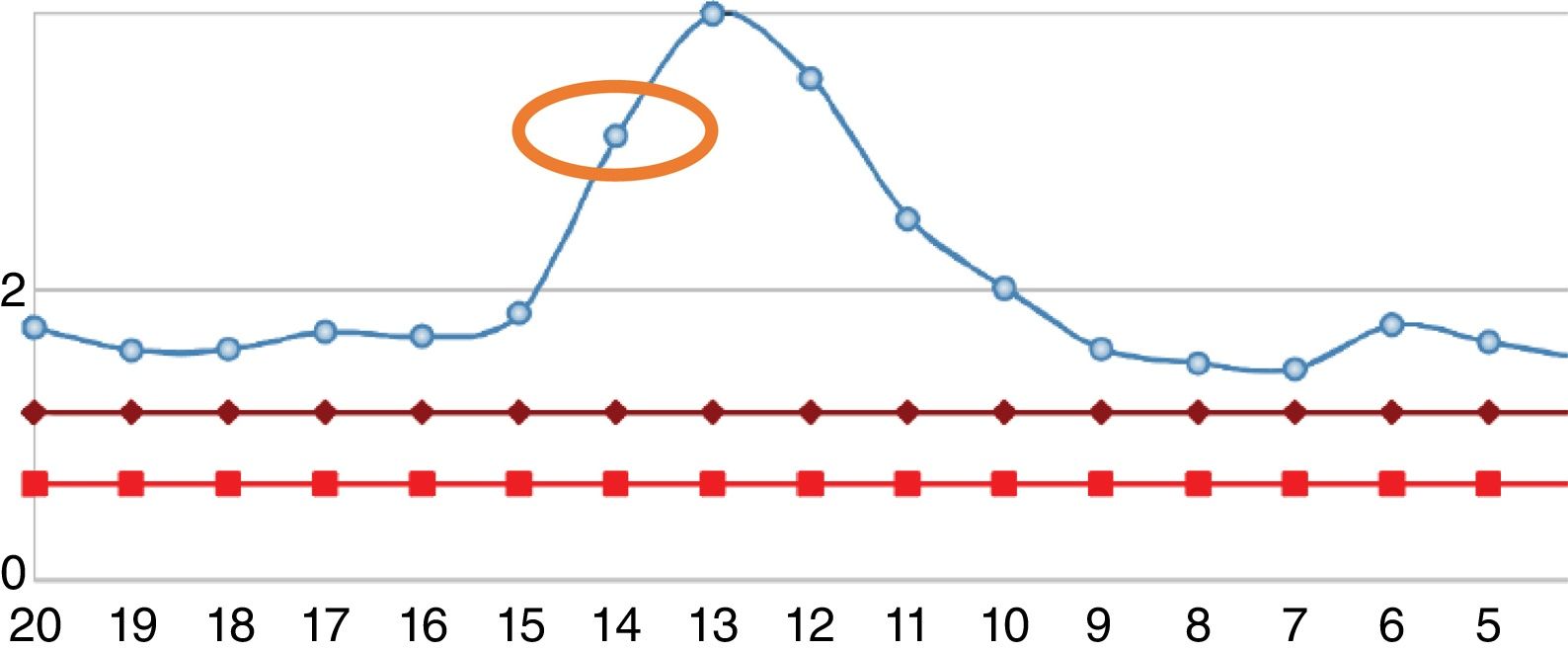
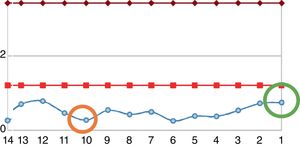
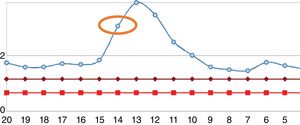
Reingresó tras un año por cuadro de 6meses de evolución consistente en nueva aparición de lesiones purpúricas intermitentes, asociado con edema de miembros inferiores y deterioro de la clase funcional. Al ingreso se documentó aumento de azoados. Se tomó adicionalmente hemograma, con el único hallazgo de linfocitopenia (que en primera instancia no se consideró relevante), reactantes de fase aguda elevados y radiografía de tórax con escasos derrames pleurales bilaterales (tabla 2). Se inician nuevamente bolos de esteroide endovenoso a razón de 1g de metilprednisolona cada día por 3dosis. Se complementaron estudios con uroanálisis que mostraba sedimento activo dado por proteinuria y hematuria, ecografía renal que no documentaba cambios de nefropatía crónica y recolección de proteínas en 24h que se encontraban en rango nefrótico. Se determinó lesión renal aguda por probable glomerulonefritis rápidamente progresiva. Reumatología consideró que ante múltiples recaídas y refractariedad de patología autoinmune se beneficiaba de inicio de rituximab e iniciaron estudios de enfermedades infecciosas. ELISA para VIH, perfil de virus hepatotropos y prueba de tuberculina negativas. Durante la hospitalización presentó rectorragia abundante con anemización secundaria. Este evento derivó en choque hipovolémico. Se realizó tomografía de abdomen, que evidenció megacolon. Fue llevado a laparotomía exploratoria y colectomía total para control de sangrado. Durante el posoperatorio llamaba la atención el empeoramiento progresivo de la linfocitopenia. Dado este hallazgo, se solicitó recuento de CD4. Se pidió, adicionalmente, reacción en cadena de polimerasa para citomegalovirus y revisión histológica de la muestra de patología de colectomía previamente realizada. El recuento de CD4 reportó linfocitos totales de 72. La reacción en cadena de polimerasa para citomegalovirus fue positiva, por lo cual se solicitó carga viral, la cual fue de 1.143. Se inició terapia antiviral con ganciclovir. La biopsia reportó edema de la pared del colon, zonas de hemorragia y presencia de células gigantes con inclusiones intracelulares. Se descartó compromiso oftálmico por citomegalovirus. Tras culminar el esquema antiviral, el paciente presentó ascenso progresivo en el recuento de linfocitos (fig. 2). Los azoados iniciaron un lento descenso (fig. 3). Tras un año del último episodio el paciente no ha vuelto a presentar recaídas y continúa el manejo con esteroide a bajas dosis con adecuado control de la enfermedad.
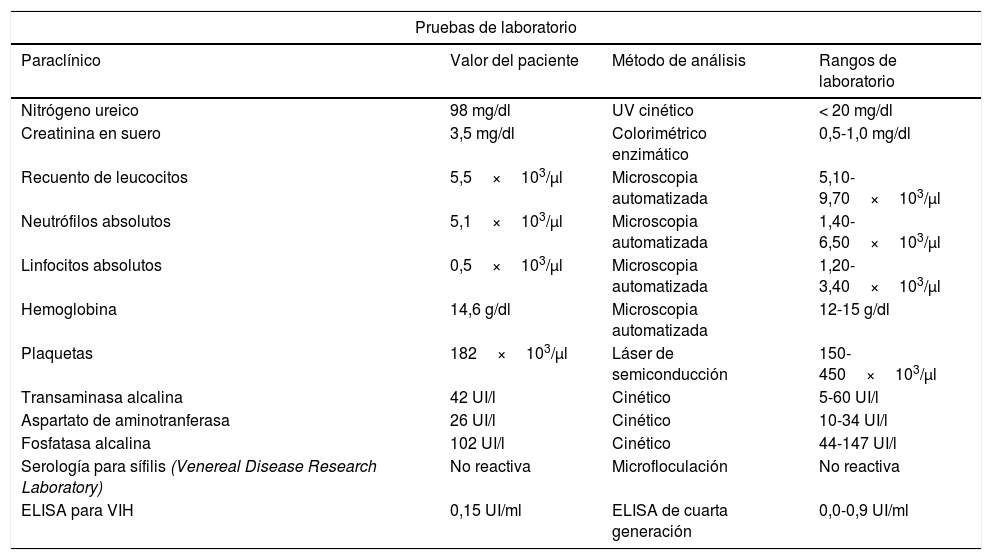
Paraclínicos del paciente al ingreso de la última hospitalización
| Pruebas de laboratorio | |||
|---|---|---|---|
| Paraclínico | Valor del paciente | Método de análisis | Rangos de laboratorio |
| Nitrógeno ureico | 98 mg/dl | UV cinético | < 20 mg/dl |
| Creatinina en suero | 3,5 mg/dl | Colorimétrico enzimático | 0,5-1,0 mg/dl |
| Recuento de leucocitos | 5,5×103/µl | Microscopia automatizada | 5,10-9,70×103/µl |
| Neutrófilos absolutos | 5,1×103/µl | Microscopia automatizada | 1,40-6,50×103/µl |
| Linfocitos absolutos | 0,5×103/µl | Microscopia automatizada | 1,20-3,40×103/µl |
| Hemoglobina | 14,6 g/dl | Microscopia automatizada | 12-15 g/dl |
| Plaquetas | 182×103/µl | Láser de semiconducción | 150-450×103/µl |
| Transaminasa alcalina | 42 UI/l | Cinético | 5-60 UI/l |
| Aspartato de aminotranferasa | 26 UI/l | Cinético | 10-34 UI/l |
| Fosfatasa alcalina | 102 UI/l | Cinético | 44-147 UI/l |
| Serología para sífilis (Venereal Disease Research Laboratory) | No reactiva | Microfloculación | No reactiva |
| ELISA para VIH | 0,15 UI/ml | ELISA de cuarta generación | 0,0-0,9 UI/ml |
Evolución del recuento de leucocitos del paciente. Entre las líneas rojas se encuentra el rango de la normalidad. La línea azul corresponde a los valores del paciente. El círculo naranja corresponde al nivel a la fecha en que el paciente requirió colectomía. El círculo verde corresponde al nivel de linfocitos al momento del egreso.
No existen en la literatura grandes consensos acerca de la PHS en el paciente anciano. Es notoria su baja incidencia y el importante subdiagnóstico. Por tal razón, el abordaje y el manejo de la patología se basan, en esencia, en consensos de expertos y series internacionales sumados a la experticia del clínico. La etiología de la PHS es desconocida5. Del mismo modo que en gran parte de las enfermedades autoinmunes, la genética y los factores ambientales parecen desempeñar un rol fundamental en el desarrollo de la misma6. Se han relacionado diversos factores en la aparición de esta condición: las infecciones (llama la atención la predominancia del estreptococo como microorganismo de mayor asociación), los fármacos y algunos tumores7.
Existe diversidad de alteraciones patológicas que explican la heterogeneidad en la presentación clínica, si bien los puntos comunes suelen ser: lesiones vasculíticas en piel, dolor abdominal y nefropatía8. El hallazgo en piel es la manifestación más frecuente. Difiere de las formas infantiles por su apariencia macro y microscópica; en el anciano predominan las formas hemorrágicas y necróticas que inician habitualmente como pápulas y placas purpúricas simétricas, de diversos tamaños y distribución9,10. La afectación renal parece ser el escenario que determina el pronóstico de la enfermedad3. En las formas infantiles la afección glomerular no es común, contrariamente al anciano, donde su prevalencia oscila del 50 al 80% y constituye un campo dinámico que evoluciona y puede alcanzar estadios de magnitud importante11. Aproximadamente la mitad de los pacientes presenta compromiso gastrointestinal. Comúnmente, el dolor abdominal es producto de la isquemia de la pared intestinal12. La literatura describe que en la biopsia renal el hallazgo de mayor frecuencia es la glomerulonefritis proliferativa focal y segmentaria asociada, en ocasiones, a la formación de semilunas13,14.
Por varias décadas, otra de las grandes dificultades en la PHS del anciano fue el establecimiento de criterios diagnósticos fiables que no se basaran en la edad como el supuesto cardinal. En los últimos años la Sociedad Europea de Reumatología Pediátrica y la Liga Europea contra el Reumatismo (EULAR/PReS) propusieron nuevos criterios, substrayendo la edad como eje principal para dar lugar a la posibilidad de englobar cualquier grupo etario en el diagnóstico12,15.
Existe una relación clara y frecuente entre autoinmunidad y neoplasias. Se ha descrito la coexistencia de la PHS con tumores malignos, más frecuentemente sólidos, como carcinoma de pulmón próstata, mama y estómago16. Esta asociación obliga en el paciente anciano con PHS a descartar la presencia de una lesión que dé lugar a síndromes paraneoplásicos17.
El tratamiento en la PHS del adulto tiene como principal medida el control clínico en búsqueda de la resolución de síntomas agudos18. La función renal constituye el estamento vertical que rige las modificaciones terapéuticas. Desafortunadamente, las pautas de tratamiento no han sido evaluadas de forma concreta en adultos y la mayoría de los estudios se han realizado en poblaciones pediátricas. Como previamente comentamos, no existe una pauta de tratamiento masivamente aceptada que cuente con el soporte de estudios pormenorizados19. Las series de casos revisadas para el presente reporte sugieren la administración de esteroide oral a altas dosis con beneficios potenciales importantes para el control de síntomas cutáneos y abdominales y la reducción del riesgo de falla renal a corto plazo14,20. Otros inmunosupresores usados en el caso de PHS con manifestaciones severas o refractarios a la administración de esteroides no cuentan con importante evidencia en adultos y la mayoría de los estudios se han llevado a cabo en población infantil19. Parece existir evidencia de que si bien los esteroides son efectivos para la resolución de los síntomas, a largo plazo esta terapia no confiere una reducción en la recurrencia de la nefritis21,22. La evidencia que respalde un tratamiento efectivo para evitar complicaciones renales y mitigar la morbilidad es limitada. Un estudio retrospectivo que comparó la terapia combinada entre esteroide y ciclofosfamida en comparación con solo esteroide no demostró ningún tipo de beneficio en el manejo conjunto23. La evidencia del rituximab en el control de la enfermedad se describe en algunos reportes de caso. La experiencia con fármacos biológicos está pobremente documentada. Fenoglio et al.21 presentan una serie de casos de 5pacientes con baja respuesta a tratamientos con esteroide y otros citostáticos que responden de forma efectiva al tratamiento con anti-CD20 y obtienen obteniendo el control de la nefritis y la resolución sintomática completa.
Tras la retinitis, la colitis por citomegalovirus es la segunda entidad más común en los pacientes inmunodeprimidos que tienen infección diseminada por este patógeno24. En pacientes con inmunodeficiencias la colitis suele ser secundaria a la reactivación del virus24. En las muestras histopatológicas se caracteriza por inclusiones intranucleares basófilas e inclusiones citoplasmáticas25. Una de las complicaciones de mayor severidad de esta entidad es el megacolon tóxico, una entidad de marcada morbimortalidad que requiere manejo quirúrgico de urgencia25,26.
En nuestro paciente es difícil determinar el origen de la linfocitopenia. Los fármacos utilizados en el control de su enfermedad autoinmune pueden predisponer a la depleción de CD4. No obstante, parecen existir casos de infecciones por retrovirus (distintos al virus de la inmunodeficiencia humana) que pueden desencadenar linfocitopenias que se recuperan una vez la infección aguda se ha resuelto o con la instauración de tratamiento antiviral27. Díaz et al.27 publicaron 6 reportes de caso de pacientes con deficiencias severas en CD4, que cursaban con infecciones por citomegalovirus y Epstein-Barr, que recuperaron su estado inmunológico una vez se instauró terapia antirretroviral con ganciclovir.
Un estudio multicéntrico hecho en Japón por el grupo del doctor Takizawa28 parece establecer que en pacientes con enfermedades autoinmunes la linfocitopenia puede ser factor de alto riesgo para infección por citomegalovirus. El recuento de linfocitos en el momento del diagnóstico se asoció significativamente con el hallazgo de infección por citomegalovirus (p=0,009), sin relacionarse con los niveles en títulos de anticuerpos o la magnitud de la carga viral28. Otro estudio, realizado en el Peking University People's Hospital, encuentra que entre 263 pacientes con enfermedades autoinmunes, 62 cursan con infecciones por citomegalovirus, y los hallazgos relacionan la reducción de CD4 como factor de riesgo para el desarrollo de este escenario clínico. En este estudio parece demostrarse una coincidencia entre la linfocitopenia y la infección por citomegalovirus en pacientes reumatológicos29. Existen algunos reportes de caso de colitis por citomegalovirus en pacientes con linfocitopenias severas idiopáticas en quienes mejoró el estado inmunológico del paciente en cuanto resolvió la infección viral, sin que los autores concluyan relaciones entre la terapia antirretroviral y la recuperación inmunológica21.
Existen reportes que asocian la infección por citomegalovirus como complicación en algunas entidades como el lupus eritematoso sistémico (LES). El citomegalovirus se ha relacionado con escenarios de mimetismo en enfermedades como el LES30. La infección por citomegalovirus puede simular brotes de actividad lúpica, y se han reportado casos en que el compromiso por el virus a nivel gastrointestinal y pulmonar se confunde con manifestaciones específicas de órgano por actividad inmunológica31. Así mismo, existen reportes que describen casos de pacientes que tras infecciones por citomegalovirus desarrollan LES32-34. Hallamos en la literatura 4reportes de caso que relacionan PHS con infección por citomegalovirus. D’Alessandro et al.35 describen el caso de una niña de 3años, no inmunocomprometida, que desarrolla un cuadro compatible con PHS. Por medio de estudio anatomopatológico se determinó vasculitis necrotizante y cuerpos de inclusión por citomegalovirus35. Nguyen et al.36 reportaron en 1997 el caso de un paciente que cursaba con PHS y desarrolló hematoquecia. El estudio anatomopatológico de este individuo reveló segmentos intestinales que presentaban alteraciones atribuibles a vasculitis e infección concomitante con citomegalovirus. Este caso comparte varias características con el que presentamos: un paciente que cursa con falla renal que se atribuye a PHS que desarrolla sangrado digestivo bajo y con una muestra histológica compatible con colitis por citomegalovirus y cambios secundarios a vasculitis atribuibles a su enfermedad autoinmune. El tercer caso fue reportado en Japón y describe un paciente masculino de 55años que ingresó por artralgias, melenas y edema en miembros inferiores. Se documenta una hiperazoemia asociada a hematuria y proteinuria masiva. Se realiza diagnóstico histológico compatible con PHS, por lo cual se inicia manejo esteroide. Una vez la clínica de vasculitis empieza a resolverse, el paciente presenta hemorragia de vías digestivas que desencadena su fallecimiento. En la autopsia se evidencian lesiones hemorrágicas ulcerosas compatibles con colitis por citomegalovirus37. El último caso, y el más reciente, fue reportado en Corea y documenta una paciente con carcinoma pulmonar de células pequeñas que desarrolla clínica de PHS concomitante a duodenitis por citomegalovirus38. Estos 4casos se diferencian del presentado en este reporte por el estado inmunológico de los pacientes. Estos pacientes contaban con recuentos adecuados de linfocitos CD4, por lo cual el uso de terapia antirretroviral podría resultar controvertido38.
Un tratamiento eficaz para los casos de enfermedades autoinmunes que cursan con infecciones por citomegalovirus concomitantes debería tener como objetivo detener la actividad inmunológica y negativizar la carga viral sin que estos dos factores entren en contradicción o resulten antagónicos el uno del otro. Lograr el control de la infección y modular la vasculitis en un mismo accionar terapéutico constituiría un ideal de tratamiento y facilitaría el accionar clínico al disminuir las tasas de reacciones adversas, las interacciones medicamentosas y facilitando la administración de fármacos. Una propuesta interesante es la leflunomida. Existen reportes de caso de pacientes que cursan con infecciones por citomegalovirus resistente a las terapias convencionales en quienes se logra el control de la infección y la negativización de la carga viral a través de la terapia con leflunomida39. Así mismo, un estudio del año 2014 hecho por Zhang et al.40 demostró que en pacientes con enfermedad renal secundaria a PHS que cursaban con proteinuria en rango nefrótico el uso de leflunomida en asociación con esteroides (en comparación al uso únicamente de esteroides) mejoró de forma significativa la tasa de filtración glomerular y disminuyó la excreción de proteínas por la orina. A pesar de ser un estudio único en el mundo y con muy poca cantidad de participantes, parece lograr establecer un nuevo campo terapéutico en la PHS.
ConclusiónEn este caso, el control de la enfermedad autoinmune se logró hasta que se instauró tratamiento efectivo contra la infección viral. El paciente no ha vuelto a presentar periodos de recaídas y el control de síntomas ha sido adecuado tras la terapia con antirretroviral. Se obtuvo remisión de la enfermedad y la función renal se estabilizó con adecuada respuesta a los tratamientos que comúnmente se usan en la PHS. Este reporte parece respaldar el hecho de que existen escenarios de linfocitopenia, que se considera idiopática, que pueden ser secundarias a otros tipos de virus distintos al de inmunodeficiencia humana. Adicionalmente, si se analiza este caso en relación con los 4reportes de PHS asociada a infección por citomegalovirus, podemos concluir que manifestaciones secundarias al citomegalovirus pueden resultar como complicación de las terapias inmunosupresoras que se usan en las enfermedades autoinmunes. La infección por citomegalovirus se da en escenarios clínicos donde existe un factor predisponente relevante. La infección oportunista complicará el curso de la enfermedad y provocará que su abordaje se revista de una mayor complejidad. No obstante, no ofrecer la terapia inmunosupresora adecuada en una vasculitis sistémica puede resultar en desenlaces de alto impacto y morbilidad. En este sentido, es necesario proponer una terapia capaz de modular la actividad de la vasculitis sistémica con el fin de detener las afecciones potencialmente mortales y lograr, en un mismo accionar, el control de la infección oportunista o, a lo sumo, no complicarla. En ocasiones la infección puede resultar un factor de confusión y un obstáculo para la instauración precoz de las terapias necesarias que permitan el control de la actividad vasculítica. Esto genera un retraso en el tratamiento que puede repercutir en el pronóstico de la condición y significar mayor morbilidad o una causa de mortalidad. En este sentido, alcanzar un tratamiento con la capacidad de detener el curso de la enfermedad autoinmune y tratar la infección oportunista en una misma determinación terapéutica, sin que la mejoría de uno signifique el empeoramiento del otro, puede dar lugar a escenarios de mayor eficacia en la práctica clínica que garanticen mejores resultados.
Igualmente concluimos que en el paciente con vasculitis que esté recibiendo tratamiento inmunosupresor y debute con hemorragia de vías digestivas bajas se debe tener en cuenta la colitis por citomegalovirus como un diagnóstico diferencial. Si estamos frente a una PHS que cursa con sangrado digestivo, la etiología más probable es la actividad de la enfermedad por sí misma o reacciones adversas a algunos medicamentos inmunosupresores, si bien aunque una vez descartadas las causas comunes, el citomegalovirus debe tomar relevancia en las consideraciones diagnósticas.
FinanciaciónNo hubo fuentes de financiación para el presente artículo.
Conflicto de interesesNo declaro conflicto de intereses para la realización del presente artículo.