El lupus eritematoso sistémico es una enfermedad autoinmune, multisistémica y crónica, de etiología desconocida, en la cual la frecuencia de alteraciones en la densidad mineral ósea varía entre 25-74%; si bien su diagnóstico no está estandarizado.
ObjetivoDescribir las alteraciones densitométricas en pacientes con lupus eritematoso sistémico, así como las características clínicas y demográficas en 2 centros de referencia del noroccidente colombiano.
Materiales y métodosEstudio transversal realizado entre enero de 2013 y diciembre de 2014. Variables incluidas: demográficas, estado de menopausia, consumo de tabaco y alcohol, autoanticuerpos, compromiso orgánico, medicamentos e índices de actividad y cronicidad (SLEDAI, SLICC). Alteraciones densitométricas definidas según la Organización Mundial de la Salud.
Análisis estadísticoFrecuencias absolutas y relativas para variables cualitativas; mediana con rango intercuartílico (RIQ) para variables cuantitativas.
ResultadosDe 302 pacientes evaluados, 65 cumplieron criterios de elegibilidad. Treinta y uno por ciento de las pacientes premenopáusicas tenían baja masa ósea para la edad; un 50% de las mujeres posmenopáusicas tenían osteoporosis y un 27% baja masa ósea. Número de pacientes con alteraciones densitométricas según factores asociados: fracturas 4, consumo de alcohol 2, fumadores activos 3, anticuerpos anti-Ro 8, afección neurológica 7, falla renal crónica 4. Uso de prednisolona: 53,8%; mediana de dosis diaria: 10mg (RIQ 5-52). Medianas de SLEDAI y SLICC: 0 (RIQ= 0-4) y 0,5 (RIQ=0-1,75), respectivamente.
ConclusionesSe encontraron pocas densitometrías óseas en pacientes con lupus; la frecuencia de las alteraciones minerales óseas fue independiente del estado de menopausia. La mediana de dosis de prednisolona fue alta, en sujetos en remisión y sin daño orgánico.
Systemic lupus erythematosus is a chronic, autoimmune, multisystem disease of unknown aetiology, and in which the frequency of alterations in bone mineral density varies between 25% and 74%, although its diagnosis is not standardised.
ObjectiveTo describe the densitometric changes in systemic lupus erythematosus patients, as well as the clinical and demographic characteristics from two reference centres north-western Colombia.
Materials and methodsA cross-sectional study was conducted between January 2013 and December 2014. The data collected included the demographic variables, menopausal status, use of tobacco and alcohol, autoantibodies, organ involvement, medications, as well as the activity and chronicity indices (SLEDAI, SLICC). Densitometric changes were defined according to World Health Organisation criteria.
Statistical analysesAbsolute and relative frequencies were calculated for qualitative variables, and medians with interquartile range (IQR) for quantitative variables.
ResultsOf the total 302 patients evaluated, 65 met eligibility criteria. Thirty-one percent of premenopausal patients had low bone mass for age was observed in 31% of pre-menopausal women, with 50% of post-menopausal women showing osteoporosis, and 27% low bone mass. The number of patients with densitometric alterations according to associated factors was, fractures 4, alcohol consumption 2, active smokers 3, anti-Ro antibodies 8, neurological involvement 7, and chronic renal failure 4. Prednisone was used in 53.8%, with a median daily dose of 10mg (IQR 5-52). The median SLEDAI and SLICC was 0 (IQR=0-4) and 0.5 (IQR=0-1.75), respectively.
ConclusionsFew bone densitometry results were found in patients with systemic lupus erythematosus. The frequency of mineral bone disorders was independent of menopausal status. The median dose of prednisone was high in subjects in remission, and without organ damage.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune, multisistémica y crónica, de etiología desconocida. Su curso clínico se caracteriza por periodos recurrentes de exacerbación y remisión, lo que genera daño, no solo por la actividad de la enfermedad, sino también por el daño orgánico acumulado1. Una de las manifestaciones de este daño orgánico es la disminución de la densidad mineral ósea (DMO), la cual se manifiesta bien sea como baja masa ósea (BMO) u osteoporosis en el subgrupo de pacientes menopaúsicas o como baja masa ósea para la edad (BMO-PE) en personas premenopáusicas2. La incidencia de estas alteraciones de la DMO varía entre los diferentes estudios, dependiendo de la metodología utilizada para su diagnóstico, ubicándose entre 25-74% para BMO y entre 1,4-68% para osteoporosis3; entre 6- 42% de estos pacientes se fracturan, siendo esta la consecuencia final de la disminución de la DMO, acarreando una importante morbimortalidad4.
La etiología de estas alteraciones en la DMO es multifactorial y abarca desde factores de riesgo tradicionales (como el consumo de tabaco y alcohol), pasando por aspectos metabólicos (deficiencia de vitamina D, hiperhomocisteinemia), hasta los derivados específicamente de la enfermedad, como el perfil de anticuerpos (presencia de anti-Ro y ausencia de anti-Sm), el número de reactivaciones y el daño crónico acumulado3. También deben considerarse los efectos deletéreos de los medicamentos usados para el control de la enfermedad, como ciclofosfamida con su disfunción gonadal y especialmente los esteroides, por su efecto apoptótico sobre el osteoblasto con aumento de los osteoclastos, siendo este último un factor de riesgo reconocido para osteoporosis aun en población no lúpica3,5.
En el ámbito regional existe un vacío de conocimiento en este tópico, pues los estudios que abordan este tema son pocos6–8 y los métodos utilizados para el diagnóstico de las alteraciones de la DMO han sido variables, no siempre utilizando la densitometría ósea (DO), la cual es el estándar de referencia para la evaluación de dichas alteraciones2 utilizándose, en ocasiones, la evidencia de fractura a través de los rayos X como marcador de alteración de la DMO9, siendo difícil determinar la magnitud de este problema en nuestra población.
El objetivo de este trabajo fue describir las alteraciones en la DMO de pacientes con LES, así como sus características clínicas y demográficas en 2 centros de referencia del noroccidente colombiano.
MetodologíaSe realizó un estudio transversal, en pacientes atendidos en consulta externa y hospitalización de 2 hospitales de alto nivel de complejidad entre enero de 2013 y diciembre de 2014. Se seleccionaron pacientes mayores de 18 años con diagnóstico de LES, según criterios del Colegio Americano de Reumatología modificados de 199710 y con disponibilidad de DO. Se excluyeron pacientes con otras enfermedades sistémicas como: artritis reumatoide, vasculitis, cáncer, enfermedad renal crónica distinta a nefropatía lúpica; enfermedades óseas metabólicas o diagnóstico de osteoporosis o BMO previo al diagnóstico de LES.
En el momento de realización de la DO se recolectaron las siguientes variables: sexo, edad, presencia de menopausia, consumo de alcohol (ingesta de 3 o más porciones diarias) o tabaco (cualquier consumo activo de cigarrillo al momento de inclusión en el estudio), antecedente personal o familiar de fractura por osteoporosis, anti-DNA, complemento sérico, anticuerpos contra antígenos nucleares extractables (Ro, La, Sm, RNP), presencia del fenómeno de Raynaud y de nefropatía lúpica, uso de esteroides, dosis promedio, tipo de esteroide utilizado, uso de pulsos de metilprednisolona, utilización de antimaláricos, actividad de la enfermedad determinada por el índice SLEDAI11, así como cuantificación del daño orgánico a través del índice SLICC12.
La información se recolectó a partir de las historias clínicas y se consignó en un formulario previamente diseñado. Antes de iniciar la ejecución de este estudio, los investigadores realizaron una discusión sobre el protocolo, estandarizaron el proceso de recolección de la información y se realizó una prueba piloto con 5 historias clínicas que permitió ajustar este proceso. La DMO se evaluó por DO y se clasificó de la siguiente manera: para pacientes mayores de 50 años o posmenopáusicas se utilizó el T-score así: normal entre 0 y –0,99; BMO entre –1,0 y –2,49, y osteoporosis valores iguales o más negativos que –2,513, y en sujetos menores de 50 años o premenopáusicas, se utilizó el Z-score, así: normal entre 0 y –1,99 y BMO-PE valores iguales o menores a –2,014.
A partir de la información recolectada se diseñó una hoja de cálculo en Microsoft Excel 2010 (Microsoft Computer Software. Redmond, Washington, EE. UU.), utilizando campos validados para restringir el ingreso de información y disminuir los errores de digitación. Además, el manejo de esta estuvo a cargo de un solo investigador para disminuir los errores por manipulación múltiple y antes de procesar la información se evaluaron la calidad y la consistencia de la misma.
Para el análisis estadístico se utilizaron frecuencias absolutas y relativas para las variables cualitativas y media con desviación estándar o mediana con rango intercuartílico (RIQ) para aquellas variables cuantitativas, dependiendo de la distribución de los datos. Los análisis estadísticos se llevaron a cabo en el paquete IBM SPSS 20.0. (IBM Corp. in Armonk, NY, EE. UU.).
Consideraciones éticasAl ser una revisión de historias clínicas, esta investigación es considerada sin riesgo según la resolución 008430 de 1993, del Ministerio de Salud de Colombia. El estudio contó con la aprobación de los comités de Ética de las instituciones participantes y solo se obtuvo de las historias clínicas la información necesaria para cumplir con los objetivos de esta investigación.
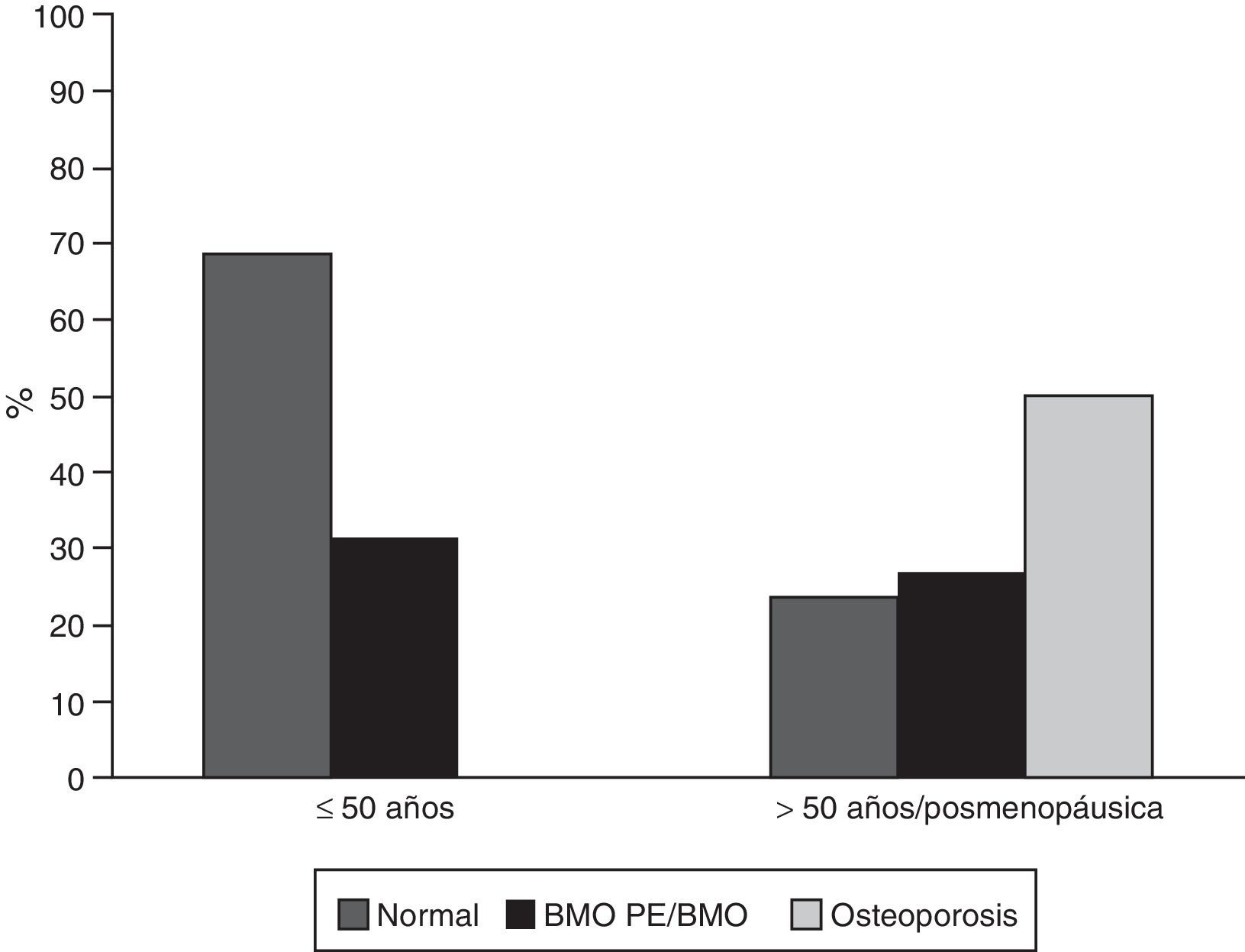
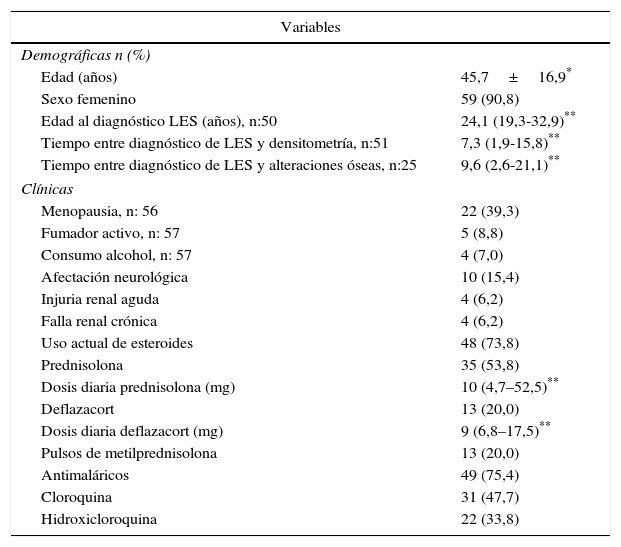
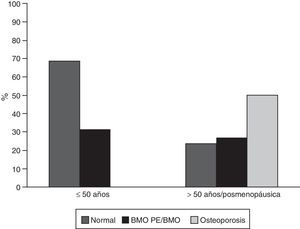
ResultadosCaracterísticas generalesDe los 302 pacientes evaluados durante el periodo de estudio, 65 (21,52%) cumplieron los criterios de elegibilidad; de estos, 59 (90,8%) eran mujeres, con una edad promedio de 45,7 años (desviación estándar: 16,9). De los 6 hombres de esta cohorte, 4 eran menores a 50 años y de estos solo uno fue clasificado con BMO-PE, los 2 restantes eran mayores de 50 años y tenían osteoporosis. Treinta y cinco sujetos (53,8%) eran pacientes menores a 50 años de edad o premenopáusicas; en este grupo 11 (31%) fueron clasificados con BMO-PE, en mayores de 50 años o pacientes menopáusicas, 15 individuos (50%) fueron diagnosticados con osteoporosis y 8 (27%) con BMO (fig. 1). Seis de 59 (10,2%) individuos tenían antecedentes personales de fracturas, de los cuales 4 tenían osteoporosis y 2 BMO-PE.
Con respecto a los factores de riesgo tradicionales, se encontró que 4 de 57 pacientes (7%) consumían alcohol, 2 de estos eran mayores de 50 años o posmenopáusicas y presentaron osteoporosis; 5 (8,8%) eran fumadores activos, de los cuales 2 eran hombres y presentaron BMO-PE y osteoporosis, según sus grupos de edad correspondientes, la totalidad de las características de los pacientes pueden observarse en la tabla 1.
Características demográficas y clínicas de los pacientes con LES
| Variables | |
|---|---|
| Demográficas n (%) | |
| Edad (años) | 45,7±16,9* |
| Sexo femenino | 59 (90,8) |
| Edad al diagnóstico LES (años), n:50 | 24,1 (19,3-32,9)** |
| Tiempo entre diagnóstico de LES y densitometría, n:51 | 7,3 (1,9-15,8)** |
| Tiempo entre diagnóstico de LES y alteraciones óseas, n:25 | 9,6 (2,6-21,1)** |
| Clínicas | |
| Menopausia, n: 56 | 22 (39,3) |
| Fumador activo, n: 57 | 5 (8,8) |
| Consumo alcohol, n: 57 | 4 (7,0) |
| Afectación neurológica | 10 (15,4) |
| Injuria renal aguda | 4 (6,2) |
| Falla renal crónica | 4 (6,2) |
| Uso actual de esteroides | 48 (73,8) |
| Prednisolona | 35 (53,8) |
| Dosis diaria prednisolona (mg) | 10 (4,7–52,5)** |
| Deflazacort | 13 (20,0) |
| Dosis diaria deflazacort (mg) | 9 (6,8–17,5)** |
| Pulsos de metilprednisolona | 13 (20,0) |
| Antimaláricos | 49 (75,4) |
| Cloroquina | 31 (47,7) |
| Hidroxicloroquina | 22 (33,8) |
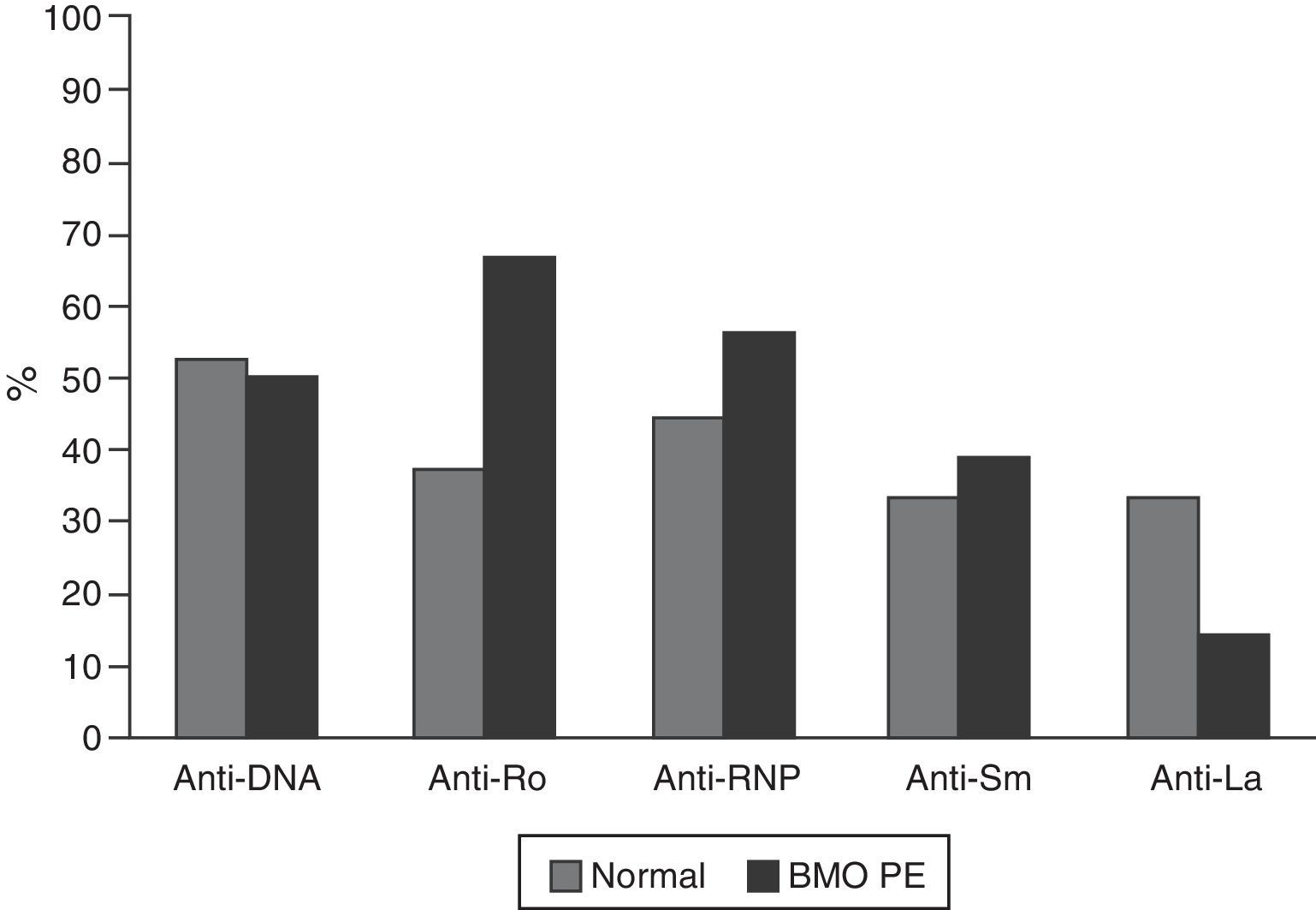
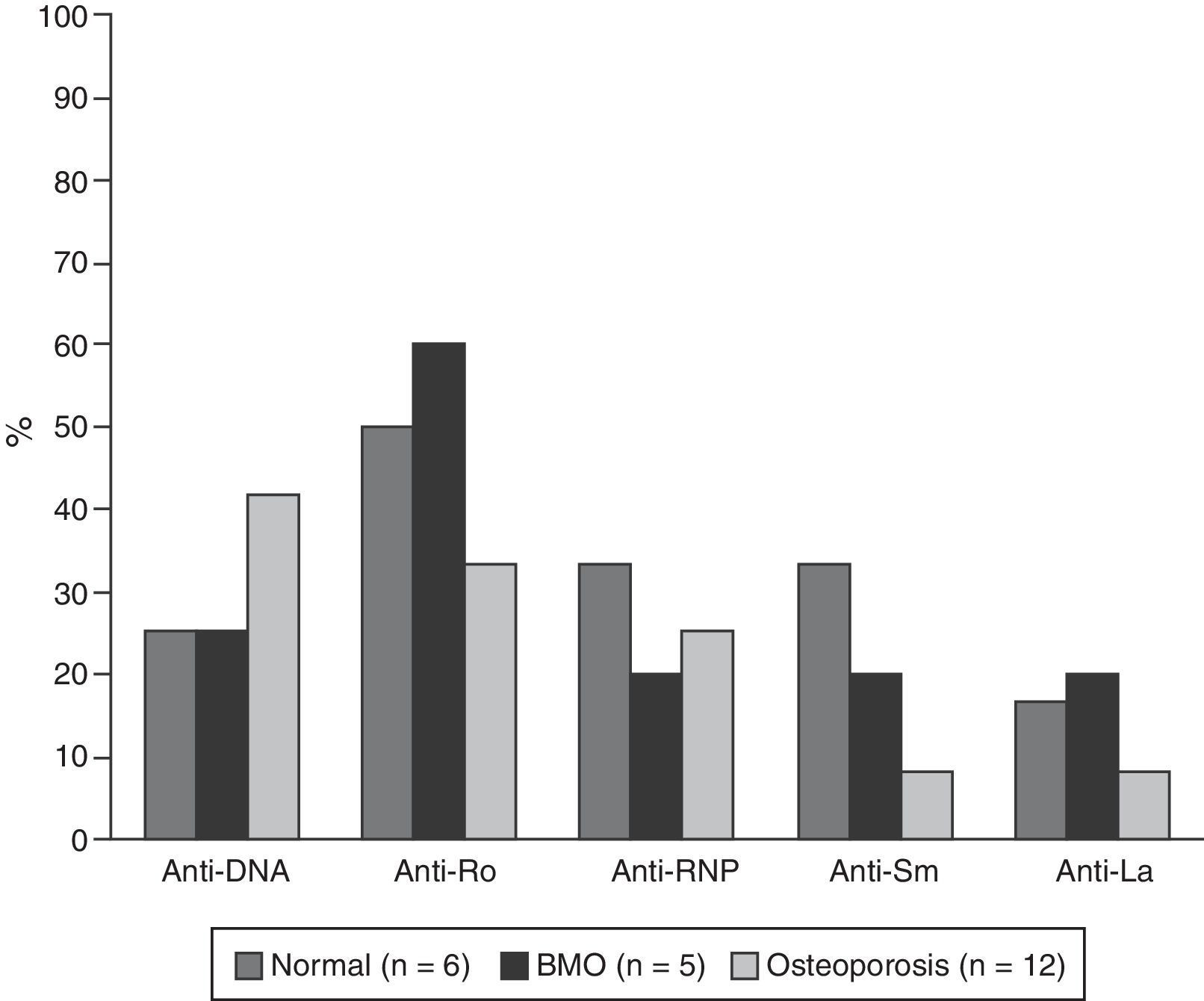
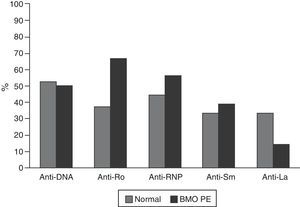
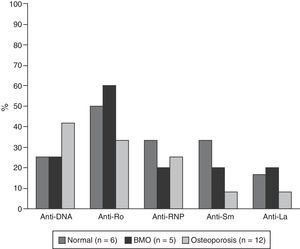
Las características serológicas de los pacientes según los grupos etarios se describen en las figuras 2 y 3. A 46 sujetos se les determinó la presencia de anticuerpos anti-Ro y anti-La; 12 (26%) individuos presentaron solo anticuerpos anti-Ro y de estos 8 presentaron alteraciones en su DO; 3 eran menores de 50 años con BMO PE y 5 eran del grupo de mayores de 50 años o posmenopáusicas (2 con BMO y 3 con osteoporosis). Además, 8 pacientes presentaron ambos tipos de anticuerpos; de estos, 3 tenían BMO PE, 1 BMO y otra osteoporosis. Ningún paciente presentó solo anticuerpos anti-La.
La hipocomplementemia C3 se presentó en 18/40 (45%) pacientes, 14 casos en menores de 50 años; presentándose en 10/17 (58,8%) y 4/7 (42,9%) de los pacientes con densitometría normal y con BMO-PE, respectivamente. Cuatro casos ocurrieron en el grupo de mayores de 50 años o posmenopáusicas, incluyendo 2 pacientes con BMO y un paciente con osteoporosis. Con respecto a los niveles de C4, 9/41 (22%) presentaron hipocomplementemia; 8 pacientes del grupo de menores de 50, de los cuales 5/18 (27,8%) estaban en el rango de normalidad y 3/7 (42,9%) presentaban BMO-PE. En el grupo de mayores de 50 años o posmenopáusicas solo se presentó un caso y se ubicó en el rango de BMO-PE.
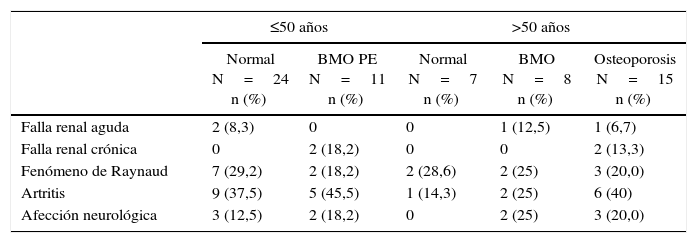
Manifestaciones y complicaciones clínicasEn cuanto a los índices de actividad y cronicidad de la enfermedad, la mediana del SLEDAI (n=59) fue 0 (RIQ= 0-4) y la mediana del SLICC (n=64) fue 0,5 (RIQ=0-1,75). Las manifestaciones clínicas más frecuentes fueron artritis y fenómeno de Raynaud en 23 (35,4%) y 16 (24,6%) pacientes, respectivamente; seguidas de la afección neurológica observada en 10 (15,4%) casos (2 pacientes con BMO PE, 2 con BMO y 3 con osteoporosis). La falla renal crónica se observó en 4 pacientes (6,2%), 2 de los cuales tenían BMO-PE y 2 osteoporosis. Estas manifestaciones, de acuerdo con la descripción por subgrupos, se muestran en la tabla 2.
Complicaciones clínicas asociadas a alteraciones de la masa ósea en pacientes con LES
| ≤50 años | >50 años | ||||
|---|---|---|---|---|---|
| Normal N=24 n (%) | BMO PE N=11 n (%) | Normal N=7 n (%) | BMO N=8 n (%) | Osteoporosis N=15 n (%) | |
| Falla renal aguda | 2 (8,3) | 0 | 0 | 1 (12,5) | 1 (6,7) |
| Falla renal crónica | 0 | 2 (18,2) | 0 | 0 | 2 (13,3) |
| Fenómeno de Raynaud | 7 (29,2) | 2 (18,2) | 2 (28,6) | 2 (25) | 3 (20,0) |
| Artritis | 9 (37,5) | 5 (45,5) | 1 (14,3) | 2 (25) | 6 (40) |
| Afección neurológica | 3 (12,5) | 2 (18,2) | 0 | 2 (25) | 3 (20,0) |
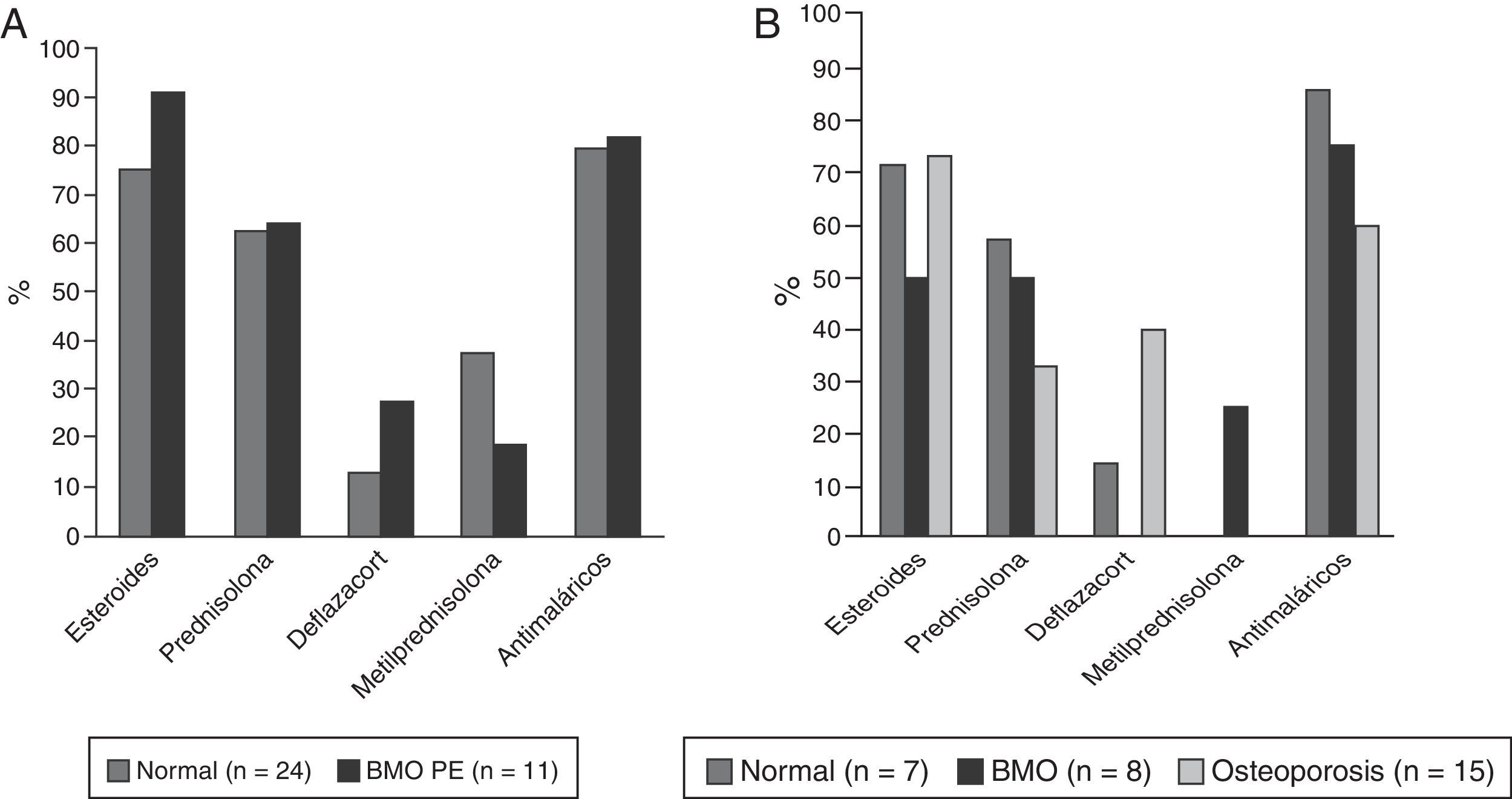
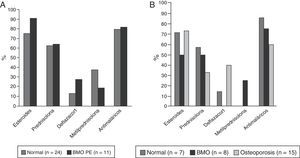
Cuarenta y ocho pacientes (73,8%) utilizaron glucocorticoides; 35 (53,8%) tomaban prednisolona con una mediana de dosis diaria de 10mg (RIQ 5-52) y 49 (75,4%) recibieron algún tipo de antimalárico, de los cuales el más usado fue cloroquina en 31 (63,2%). La descripción del tratamiento según grupos de edad se muestra en la figura 4.
DiscusiónEn el presente estudio se encontraron varios hallazgos de interés: el primero es derivado de su carácter retrospectivo, que permite evaluar la práctica clínica usual, específicamente el uso de la DMO para la tamización de las alteraciones de la masa ósea en pacientes con LES. Si bien existen publicadas indicaciones precisas para la realización de DO en individuos con esta enfermedad, como lo son el uso de glucocorticoides (uso por más de 3 meses a dosis mayores de 7,5mg día), la edad (mujeres mayores de 65 años u hombres mayores de 70 años) y la presencia de factores de riesgo adicionales para osteoporosis3,15–17, en el presente estudio solo un 21,5% de las historias evaluadas tenía registro de DXA. Esto si bien es una limitación por los pocos datos disponibles para el análisis, revela la necesidad de reforzar la búsqueda de estas alteraciones por parte de médicos reumatólogos y no reumatólogos, y aportar así información importante y relevante al conocimiento local.
Con respecto a las alteraciones en la DMO, se encontró una importante frecuencia tanto de BMO-PE como de BMO/osteoporosis en sus grupos de edades respectivos. Este resultado es difícil de comparar, puesto que los estudios previamente publicados han utilizado el T score menor a -2,5 como diagnóstico en pacientes de todas las edades. Esto es susceptible a debate, pues en población sana los criterios de clasificación varían según el grupo etario2. Otra forma de aproximarse a este problema es asumir las alteraciones en la DMO como derivadas, principalmente, del uso de esteroides, pero aun así la determinación de iniciar terapia con bisfosfonatos depende predominantemente de la dosis y de la duración de la terapia con esteroides; las guías que recomiendan la medición de la masa ósea la utilizan como parte del puntaje FRAX para calcular el riesgo de fractura15. Adicionalmente, el FRAX está diseñado para utilizar una edad mínima de 45 años y evalúa de forma dicotómica el uso de esteroides, siendo difícil ajustar el efecto según la dosis y si bien se dispone de algunas estrategias para corregir este hecho, estas se basan en recomendación de expertos5. Finalmente, el efecto sobre la DMO en LES es multifactorial, por lo que esta aproximación solo estaría viendo un aspecto único de este problema.
En el presente estudio se encontraron frecuencias de BMO-PE, osteoporosis y BMO de 31, 50 y 31%, respectivamente. Estos valores son similares a los reportados por Mok et al.18, quienes evaluaron 34 pacientes con edad promedio de 52,9 años y encontraron una frecuencia de osteoporosis en columna lumbar de 48% y de BMO de 33%. Jacobs et al.19, compararon 126 pacientes con edad promedio de 39 años y con 18% de pacientes menopáusicas, encontrando un 39,7% de BMO y 6,3% de osteoporosis, para un total de 46% de alteraciones en la DMO. Es importante recalcar que los resultados no son directamente comparables por la metodología usada en el presente estudio; no obstante, nuestro valor de BMO-PE y los resultados de Jacobs son similares (31 vs. 46%) reiterando la importancia del tamizaje de este tipo de complicaciones osteomusculares en este grupo de pacientes.
La menopausia se ha descrito claramente como factor de riesgo independiente para desarrollar alteraciones de la masa ósea3,20; no obstante, en estos pacientes no es el único factor que condiciona el aparecimiento de dichas alteraciones, lo que de alguna manera se evidencia en este estudio, pues en el grupo de pacientes menores a 50 años de edad o premenopáusicas, 31% presentó BMO-PE. Sin embargo, más del 90% de las mujeres premenopáusicas, que consumían esteroides, tenía BMO-PE y, en las pacientes posmenopáusicas, el 73% tenía osteoporosis. En este subgrupo de pacientes el efecto de los esteroides es independiente de la menopausia, como lo demostraron Zhu et al.21, quienes incluyeron 75 mujeres premenopáusicas y 44 pacientes posmenopáusicas; encontrando que la densidad ósea volumétrica se redujo a 2,66% a los 2 años del uso de glucocorticoides, hallazgo independiente del estado de menopausia. Tang et al.22, encontraron una disminución de la DMO, por área y volumétrica de 5,3 y 5,7%, respectivamente, después de un año de ingesta de prednisolona, en dosis promedio de 5mg diarios.
Con respecto a los factores de riesgo tradicionales en relación con la disminución de la DMO y LES, nuestros datos son semejantes a los encontrados por otros autores6,18,23,24. Sin embargo, algunos estudios han encontrado una frecuencia mayor de consumo de tabaco (22%)24 y alcohol (33,8%), específicamente en población afroamericana25. Estas variaciones pueden explicarse por 2 factores: el primero es que al basarse nuestro estudio en la revisión de historias clínicas, pudiera existir un subregistro importante de estas variables y el segundo son las variaciones socioculturales en diferentes poblaciones, especialmente en el aspecto del tabaquismo.
Al analizar las manifestaciones derivadas de la enfermedad, todos los pacientes de este estudio con falla renal crónica presentaban osteoporosis o BMO-PE. Este resultado es esperable, pues en estos sujetos se ha descrito la presencia de otros factores independientes para el desarrollo de osteoporosis, como hiperparatiroidismo secundario, déficit de vitamina D y alteraciones en la absorción del calcio3; hasta donde se sabe, no hay otros estudios que evalúen específicamente la tríada osteoporosis, falla renal y lupus. De la misma forma, 7 de los 10 pacientes con afección neurológica por LES presentaban alguna alteración de la masa ósea. Una de las posibles explicaciones para este hallazgo es la presencia de inmovilización prolongada secundaria a este compromiso orgánico; en estas condiciones se ha demostrado, en humanos, un aumento de la reabsorción ósea y, en animales, una alteración de la regulación de los osteoclastos26; no obstante, el lupus neuropsiquiátrico se considera una manifestación grave de la enfermedad que requiere inmunosupresión agresiva con dosis elevadas de esteroides por tiempo prolongado, por lo que podría ser simplemente un marcador de actividad de la enfermedad.
Otro resultado relevante del presente estudio fue la mayor frecuencia de anticuerpos anti-Ro en pacientes con BMO; este hallazgo coincide con lo reportado por Mok et al., quienes sugieren que, en estos pacientes, la especial restricción a la exposición solar para evitar recaídas de la enfermedad podría asociarse a una menor absorción de vitamina D y esto contribuiría a la presencia de BMO, teniendo en cuenta la presencia de anticuerpos anti-Ro se asocia con manifestaciones fotosensibles del LES18.
En lo referente al aspecto farmacológico, nuestros pacientes recibían antimaláricos en una alta proporción (75,4%) factor que ha sido descrito como protector de la DMO19. Si se analiza el uso de esteroides para el tratamiento del LES, en nuestro estudio es de 73%; al respecto un estudio español, multicéntrico, que incluyó a 3.658 pacientes lúpicos, encontró que su uso en cualquier momento de la enfermedad o al ingreso de esta cohorte estuvo entre 52,4 y 84,6%, respectivamente27. No obstante, nuestra mediana de dosis de prednisolona fue de 10mg, por encima de la descrita en otros estudios Bultink: 7mg, Mok: 4mg; Jacobs: 6,5 mg18,19,24, siendo una dosis elevada teniendo en cuenta que nuestros pacientes tenían una mediana del SLEDAI de 0, reflejando remisión de la enfermedad. Este hallazgo obliga a considerar la importancia de propender por ajustar la dosis de esteroides en cada evaluación del paciente, siempre que la situación lo permita, para evitar la exposición innecesaria e injustificada de los pacientes a estos fármacos. Finalmente, en los pacientes con alteraciones de la DMO, se encontró un mayor uso de deflazacort, el cual posiblemente fuese instaurado como medida reactiva ante los hallazgos densitométricos por su mejor perfil de seguridad ósea, no obstante, al ser un estudio de corte transversal, establecer la temporalidad entre la alteración en la DMO y el uso de este medicamento es imposible y esta afirmación es de tipo especulativo.
El presente estudio tiene varias limitaciones, la mayoría inherentes a su diseño, pues al basarse en recolección de historias clínicas, presenta una alta probabilidad de subregistro de la información. También se reconoce que, por la misma metodología del trabajo, no se evaluaron otros aspectos que, según la literatura, pueden influir en la presencia de osteoporosis en pacientes con LES, como el índice de masa corporal y los niveles séricos de vitamina D, entre otros24. Finalmente, al ser un estudio transversal descriptivo, su alcance se limita a la descripción de las variables encontradas en los pacientes con alteraciones en la DMO y puede generar hipótesis sobre los posibles factores involucrados en el desarrollo de las alteraciones densitométricas, pero no demuestra asociación de ningún tipo.
ConclusiónEn una cohorte de pacientes del noroccidente colombiano con LES, hay una alta frecuencia de alteraciones en la DMO; fue llamativa la poca frecuencia de solicitud de esta ayuda diagnóstica como parte del control clínico de estos individuos y el bajo porcentaje de factores tradicionales relacionados, excepto el consumo de glucocorticoides.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.