Los trastornos del movimiento pueden definirse como síndromes neurológicos en los que puede haber un exceso o enlentecimiento de movimientos automáticos o voluntarios sin relación con debilidad o espasticidad. Tanto la enfermedad de Parkinson (EP) como la de Huntington (EH) son condiciones paradigmáticas de estos trastornos. La alta prevalencia de síntomas psiquiátricos comórbidos, como depresión, ansiedad, síntomas obsesivo-compulsivos, alucinaciones, delirios, impulsividad, trastornos del sueño, apatía y deterioro cognoscitivo, obliga a abordar estas enfermedades como entidades neuropsiquiátricas. En el presente artículo, se realiza una revisión de los aspectos neuroanatómicos (estructurales y funcionales), neuropsicológicos y psicopatológicos de la EP y la EH. Se hace especial énfasis en el papel de los circuitos frontosubcorticales no motores para la comprensión del espectro clínico de ambas entidades, sin excluir la influencia de aspectos genéticos, psicológicos y psicosociales. Por último, se realiza una breve revisión sobre los principales abordajes psicofarmacológicos en cada entidad
Movement disorders can be defined as neurological syndromes presenting with excessive or diminished automatic or voluntary movements not related to weakness or spasticity. Both Parkinson's disease (PD) and Huntington's disease (HD) are well-known examples of these syndromes. The high prevalence of comorbid psychiatric symptoms like depression, anxiety, obsessive-compulsive symptoms, hallucinations, delusions, impulsivity, sleep disorders, apathy and cognitive impairment mean that these conditions must be regarded as neuropsychiatric diseases. In this article, we review neuroanatomical (structural and functional), psychopathological and neuropsychological aspects of PD and HD. The role of fronto-subcortical loops in non-motor functions is particularly emphasised in order to understand the clinical spectrum of both diseases, together with the influence of genetic, psychological and psychosocial aspects. A brief description of the main psychopharmacological approaches for both diseases is also included
Los trastornos del movimiento pueden definirse como síndromes neurológicos en los que puede haber un exceso o enlentecimiento de movimientos automáticos o voluntarios sin relación con debilidad o espasticidad. Las estructuras que componen los ganglios basales (GB) históricamente han estado ligadas a funciones relacionadas con el control del movimiento; no obstante, conforme ha avanzado la comprensión de los circuitos cerebrales y su relación con la emergencia de síntomas psiquiátricos, el paradigma motor ha mudado hacia una integración con las funciones cognitivas, afectivas y conductuales.
Los síntomas no motores que generan la EP y la EH, afecciones paradigmáticas de los GB, son tan importantes e incapacitantes como los motores. Este cambio en la manera de abordar la disfunción de los GB ha reforzado el planteamiento de las enfermedades psiquiátricas como una disfunción de circuitos, que complementa y contrasta la visión clásica de alteraciones en los sistemas de neurotransmisores1.
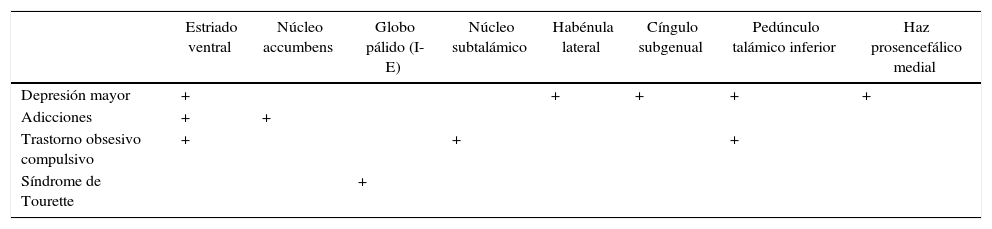
Otro aspecto fundamental que ha puesto en evidencia la indiscutible contribución de los GB a la regulación afectiva y conductual es la reciente aparición de la estimulación cerebral profunda (ECP)2. La ECP se utiliza como opción terapéutica para la EP y estimula el núcleo subtalámico o el pálido interno. Con dicha estimulación (principalmente del pálido interno), los pacientes muestran una gran mejoría tanto de los síntomas motores como de los afectivos, lo que confirma el papel de los GB en este tipo de funciones no motoras. Actualmente se utilizan diversas estructuras diana para estimulación cerebral en trastornos psiquiátricos (tabla 1)3.
Estructuras susceptibles de neuroestimulación en trastornos psiquiátricos
| Estriado ventral | Núcleo accumbens | Globo pálido (I-E) | Núcleo subtalámico | Habénula lateral | Cíngulo subgenual | Pedúnculo talámico inferior | Haz prosencefálico medial | |
|---|---|---|---|---|---|---|---|---|
| Depresión mayor | + | + | + | + | + | |||
| Adicciones | + | + | ||||||
| Trastorno obsesivo compulsivo | + | + | + | |||||
| Síndrome de Tourette | + |
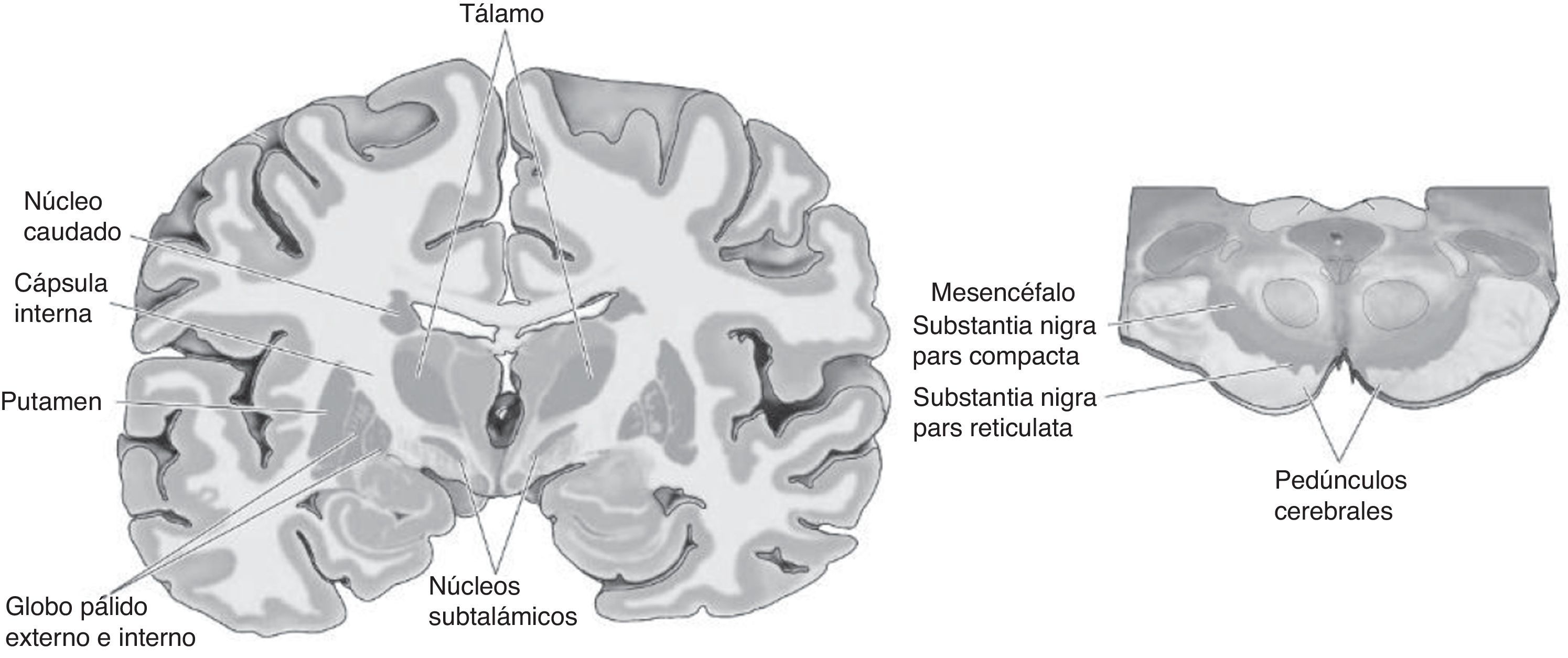
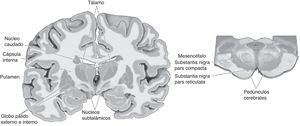
El término GB hace referencia a un grupo de núcleos funcionalmente diversos y localizados en lo profundo de la corteza cerebral. Este conjunto de núcleos tiene como funciones importantes el control motor, incluida la selección adecuada de patrones de movimiento acordes con los requisitos del entorno, la regulación afectiva y la generación de estados de recompensa4. Las estructuras que conforman los GB (fig. 1) integran una red compleja de circuitos involucrados en las funciones mencionadas.
Los componentes de estos circuitos han generado debate acerca de qué estructuras se considera GB. Hay consenso sobre los componentes principales que incluyen el núcleo caudado, el putamen, el núcleo accumbens (en conjunto conocidos como cuerpo estriado) y el globo pálido5. La cabeza del caudado y el núcleo accumbens, ambas conocidas como estriado ventral, son estructuras ligadas a circuitos límbicos y sistemas de recompensa6. El núcleo celular de la sustancia negra, con sus porciones compacta y reticular, también está incluido entre los GB por el aporte de dopamina, neurotransmisor fundamental para el correcto funcionamiento de estas estructuras.
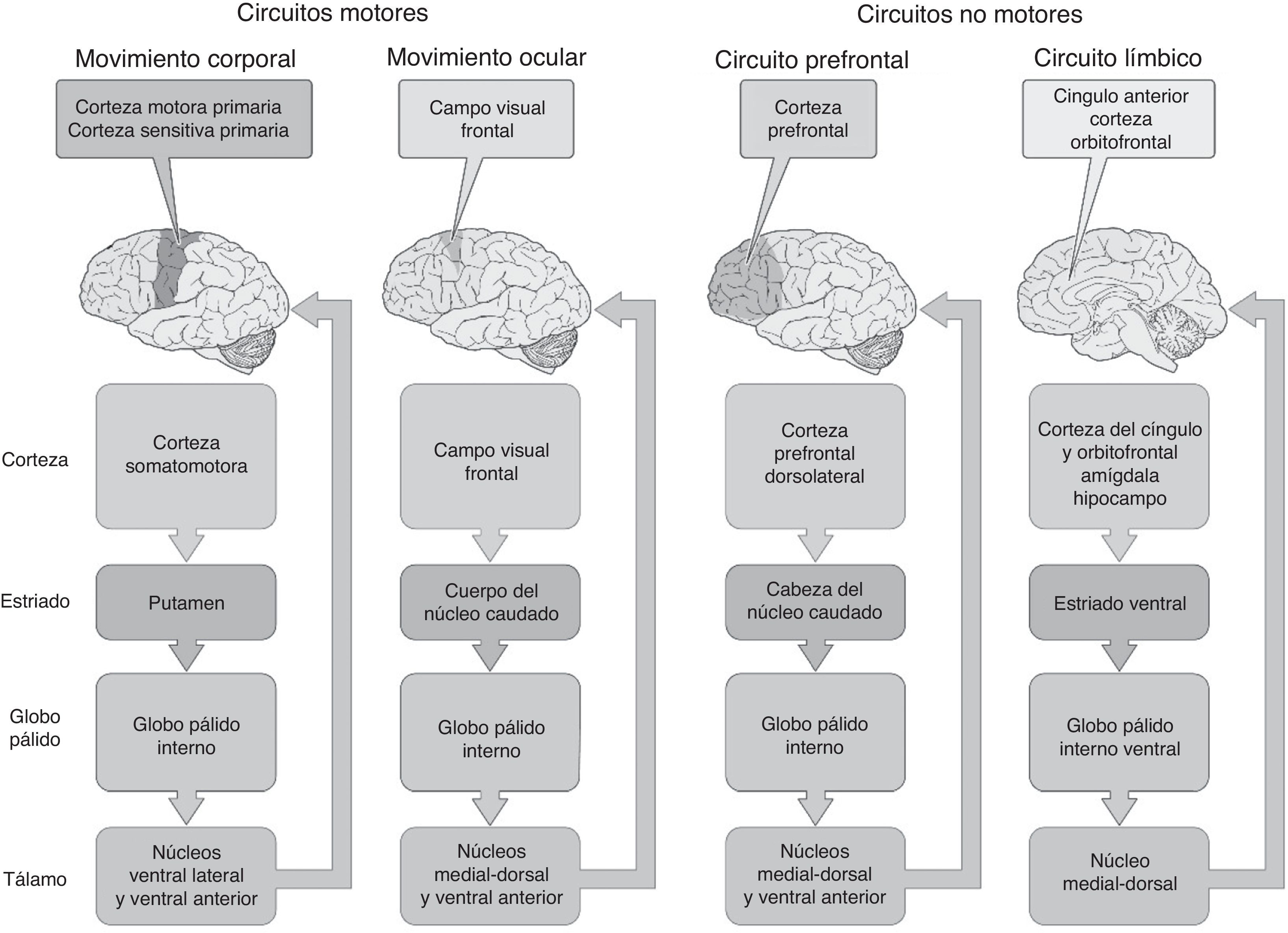
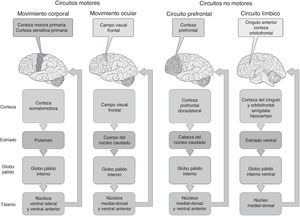
En cuanto a la conectividad de los GB, se considera el estriado como la principal vía de entrada al sistema, localización donde convergen conexiones de la sustancia negra, la amígdala y la corteza cerebral. El tálamo es la principal vía de salida. Aunque dicha estructura no pertenece filogenéticamente a los componentes de los GB, desde el punto de vista funcional está íntimamente relacionada con los circuitos mencionados. Para comprender mejor el patrón de conectividad, conviene segregarlo en circuitos motores y circuitos no motores (fig. 2).
Cada uno de estos circuitos recibe múltiples entradas corticales y estriatales que progresivamente se integran en los GB para intervenir en la regulación del control motor, los movimientos oculares sacádicos, la memoria de trabajo y la regulación afectiva. Dichos circuitos se proyectan a áreas específicas de la corteza que a su vez están interconectadas para generar su función5.
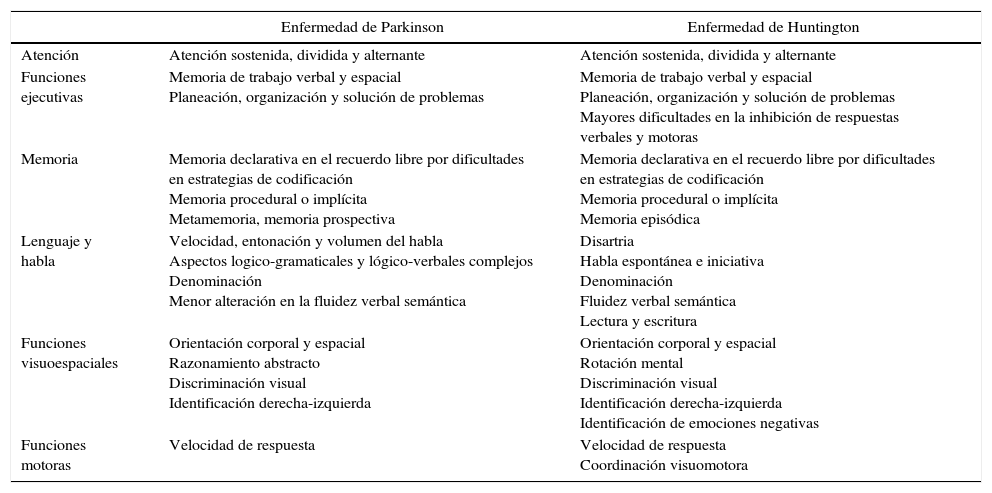
Perfil neuropsicológico de los trastornos del movimientoLos sujetos con EP y EH, típicamente expresan un perfil «subcortical», manifestado clínicamente por deterioro de la atención, la visuopercepción y las funciones ejecutivas7-9. A continuación se describen las alteraciones en cada uno de los dominios cognitivos comúnmente afectados en la EP y la EH (tabla 2).
Funciones cognitivas alteradas en trastornos del movimiento como la enfermedad de Parkinson y la enfermedad de Huntington
| Enfermedad de Parkinson | Enfermedad de Huntington | |
|---|---|---|
| Atención | Atención sostenida, dividida y alternante | Atención sostenida, dividida y alternante |
| Funciones ejecutivas | Memoria de trabajo verbal y espacial Planeación, organización y solución de problemas | Memoria de trabajo verbal y espacial Planeación, organización y solución de problemas Mayores dificultades en la inhibición de respuestas verbales y motoras |
| Memoria | Memoria declarativa en el recuerdo libre por dificultades en estrategias de codificación Memoria procedural o implícita Metamemoria, memoria prospectiva | Memoria declarativa en el recuerdo libre por dificultades en estrategias de codificación Memoria procedural o implícita Memoria episódica |
| Lenguaje y habla | Velocidad, entonación y volumen del habla Aspectos logico-gramaticales y lógico-verbales complejos Denominación Menor alteración en la fluidez verbal semántica | Disartria Habla espontánea e iniciativa Denominación Fluidez verbal semántica Lectura y escritura |
| Funciones visuoespaciales | Orientación corporal y espacial Razonamiento abstracto Discriminación visual Identificación derecha-izquierda | Orientación corporal y espacial Rotación mental Discriminación visual Identificación derecha-izquierda Identificación de emociones negativas |
| Funciones motoras | Velocidad de respuesta | Velocidad de respuesta Coordinación visuomotora |
Tanto en la EP como en la EH, frecuentemente se encuentran insuficiencias en sistemas atencionales, desde los más básicos como el mantenimiento de la atención hasta aspectos más complejos como la atención dividida y alternante7,8,10,11. Igualmente, se han relacionado dificultades en la memoria de trabajo tanto verbal como espacial. Estos déficit atencionales complejos y de memoria de trabajo están relacionados con dificultades para inhibir respuestas y estímulos irrelevantes del medio y para cambiar fácilmente de set, por lo que se comete un mayor número de errores en tareas clásicas de inhibición, como el Stroop test7. El síndrome disejecutivo los puede llevar a errores en la toma de decisiones, pobre capacidad de juicio, automonitorización, planeación y solución de problemas12.
Además, se han reportado dificultades en la velocidad de respuesta, que a su vez pueden explicarse por la falta de iniciativa y espontaneidad11.
A diferencia de los pacientes con EP, aquellos con EH han mostrado mayores errores perseverativos en tareas ejecutivas10.
MemoriaLas alteraciones de la memoria no declarativa, principalmente en la realización de hábitos o el aprendizaje por condicionamiento clásico, se han descrito ampliamente tanto en EP como en EH. Otra alteración común son los errores en la memoria anterógrada, donde la principal dificultad se da en la codificación de la información y no en el almacenamiento. Estas dificultades pueden explicarse por una falla ejecutiva más que por un defecto de la memoria como tal7,10,11.
En cuanto a la memoria episódica, está alterada en la EH desde las etapas iniciales de la enfermedad. Al contrario que en la EP, en la que la información remota episódica suele estar conservada. Se podría decir que, en la EP sin demencia, las alteraciones de la memoria se explican por la disfunción frontal en el aprendizaje asociativo, la metamemoria, el ordenamiento temporal de acontecimientos y aspectos de la memoria prospectiva7,10.
Lenguaje y hablaLas alteraciones del habla y más probablemente la disartria son evidentes en estadios iniciales de la EH. Además, se muestran dificultades de lectura y escritura, con omisiones, perseveraciones y sustituciones, las cuales están en relación con los movimientos coreiformes y la disfunción frontal. Asimismo muestran dificultades en la comprensión verbal compleja y la denominación por confrontación visual, con altos errores perceptuales, y al contrario que lo esperado en disfunciones de tipo subcortical, se ha visto primeramente afectada la fluidez verbal de tipo semántico8.
En la EP predominan las alteraciones en la velocidad, la prosodia y el volumen del habla. Se dan alteraciones lógico-gramaticales y lógico-verbales complejas y, al igual que en la EH, dificultad en la fluidez verbal semántica, pero relacionada con disminución de la velocidad de procesamiento y dificultad para cambiar de set. La denominación y la fluidez verbal semántica y fonológica se encuentran mejor preservadas que en la EH7,11.
Habilidades visuoespacialesEn la EP se han documentado alteraciones en la orientación corporal y espacial, al aparecer fallas en tareas de razonamiento abstracto, discriminación visual y confusión derecha-izquierda. Estas alteraciones, más que a los déficit motores propios, se deben a una dificultad ejecutiva en la capacidad para cambiar de set mental7,11.
En la EH, se encuentran alteraciones en tareas de trazado de rutas, dificultades en la rotación mental y, en comparación con otras enfermedades degenerativas, expresan una percepción más afectada de las emociones en los rostros, principalmente en la identificación de emociones negativas como el asco7,8.
Trastornos neuropsiquiátricos en la enfermedad de ParkinsonLa alta prevalencia de alteraciones psiquiátricas en la EP indica que se trata de una condición neuropsiquiátrica. Aunque los síntomas psicopatológicos de la EP pueden ser variables (tabla 3) y difícilmente delimitables, a continuación se revisan algunos.
Síntomas motores y no motores de la enfermedad de Parkinson
| Síntomas motores | Síntomas no motores (psiquiátricos) |
|---|---|
| Bradicinesia Rigidez en rueda dentada Inestabilidad postural Cambios en la marcha Temblor en reposo | Deterioro cognoscitivo Psicosis Depresión Ansiedad Trastorno del control de impulsos Apatía Trastornos del sueño |
Aproximadamente el 80% de los pacientes con EP sufrirán deterioro cognoscitivo con el paso de los años13. La demencia en la EP (DEP) y la demencia por cuerpos de Lewy (DCL) comparten el mismo proceso neurodegenerativo derivado de los depósitos anormales de alfa-sinucleína. La diferencia fundamental se basa en la instauración de los síntomas motores con respecto a los cognitivos. En la DEP los síntomas motores preceden al deterioro cognoscitivo y en la DCL la situación es la contraria.
Los inhibidores de la acetilcolinesterasa son los medicamentos de elección, ya que no solo tienen efectos positivo en la función cognitiva, sino que también mejoran los síntomas afectivos y conductuales y la funcionalidad cotidiana14. La rivastigmina es la más estudiada y se recomienda ampliamente15. Una segunda opción podría ser el donepezilo, que aunque solo se ha estudiado en grupos pequeños, ha revelado efectos discretos en la cognición sin empeoramiento de los síntomas motores16,17. En un metanálisis reciente, se comparó la eficacia de los inhibidores de la acetilcolinesterasa con la memantina en sujetos con DEP y DCL; se encontró mejoría en la impresión general en ambos grupos, pero sin beneficio cognitivo para el grupo de memantina18.
DepresiónLa depresión en la EP ocurre en aproximadamente el 35% de los casos19. Puede estar presente desde el diagnóstico de la EP o aparecer en fases prodrómicas20.
Existen múltiples mecanismos etiológicos involucrados en la depresión en la EP, pero lo más probable es la convergencia de factores genéticos, biológicos y psicosociales. Los depósitos anormales de alfa-sinucleína generan daños neuronales progresivos que afectan a núcleos monoaminérgicos del rafe medial (productores de serotonina), el locus coeruleus (productor de noradrenalina) y el área tegmental ventral (productora de dopamina), estructuras fundamentales para la regulación emocional21. El daño de los circuitos frontosubcorticales límbicos objetivado con estudios de neuroimagen funcional también es clave para la instauración de síntomas depresivos22.
Desde el punto de vista psicosocial, las dificultades para movilizarse, la baja autoestima, el uso de estrategias de afrontamiento desadaptativas y la escasa red de apoyo son factores precipitantes de un evento depresivo.
Los inhibidores selectivos de la recaptación de serotonina (ISRS) suelen utilizarse con alta frecuencia para tratar la depresión en la EP; sin embargo, los estudios clínicos controlados, las revisiones sistemáticas y algunos metanálisis no han evidenciado mayor eficacia al compararlos con placebo23,24. El uso de antidepresivos tricíclicos como la nortriptilina y la desipramina ha mostrado mejor evidencia25, aunque se debe tener en cuenta los efectos adversos anticolinérgicos. Igualmente, antidepresivos duales como la venlafaxina y la atomoxetina han mostrado mayor eficacia que los ISRS26. El bupropión también parece ser una buena estrategia terapéutica para pacientes con depresión asociada a EP27.
El uso de agonistas dopaminérgicos para tratar la EP podría contribuir, en algunos casos, a la mejoría de los síntomas depresivos. Este parece ser el caso del pramipexol, con el que se ha demostrado una reducción importante de síntomas tanto motores como depresivos28. Por el contrario, la levodopa/carbidopa no parece tener mayor efecto en la depresión en la EP.
Por último, el uso de terapia electroconvulsiva (TEC) y de estimulación magnética transcraneal (EMT) muestra resultados variables; la EMT es la que menores efectos adversos cognitivos genera29,30.
PsicosisEn 2007 se realizó el consenso internacional para establecer los criterios de psicosis en la EP31. Los síntomas «positivos» involucran alucinaciones de personas, animales u objetos indefinidos que pasan por el campo visual periférico (alucinaciones de paso), percepción de objetos distorsionados (ilusiones), pareidolias y experiencias perceptuales en las que se da una sensación de «presencia»32. Estas se viven como si la presencia de una sombra o una nube hubiera abandonado la habitación (palinparousia)33. Habitualmente el sujeto tiene crítica de la anormalidad de los fenómenos perceptuales, por lo cual se los ha denominado alucinaciones «menores». Con el paso de los años, pueden aparecer otros síntomas «mayores», como ideas delirantes y alucinaciones olfatorias, auditivas o táctiles.
La prevalencia de fenómenos «menores» es cercana al 42% en estadios tempranos de la enfermedad34 y la de «mayores» alcanza hasta un 60% en fases avanzadas35.
Las alucinaciones de presencia parecen estar relacionadas con disfunción en los mecanismos de control ocular ubicados en el tallo cerebral y con deterioro de las vías dorsales que viajan por el lóbulo parietal (surco intraparietal)32. Las alucinaciones complejas y multimodales se asocian con cambios cognitivos y afectivos y revelan alteraciones en estructuras corticales de vías ventrales occipitotemporales36. La pérdida del insight y las alteraciones conductuales están relacionadas con disfunción orbitofrontal. Aunque la dopamina suele estar relacionada con síntomas psicóticos en muchas enfermedades psiquiátricas, no parce que este sea el caso de la psicosis en la EP, en la que predomina un estado hipodopaminérgico. Se ha debatido el vínculo entre agonistas dopaminérgicos y la presencia de alucinaciones. Si bien dosis elevadas incrementan el riesgo de alucinaciones35, la mayoría de los estudios concluyen que su relación es débil, ya que tampoco se ha demostrado que el uso intravenoso de levodopa precipite síntomas psicóticos37. La pérdida de los núcleos colinérgicos en el tallo cerebral y el exceso de influencia serotoninérgica en regiones orbitofrontales, temporales ventrales y de la corteza motora parecen estar relacionados con los síntomas psicóticos. De hecho, los tratamientos más recientes para la psicosis en EP son los agonistas inversos de los receptores 5HT2A, como la pimavanserina.
En cuanto al tratamiento, se recomienda revisar las dosis de agonistas dopa y, si se encuentran muy elevadas o hay mezcla de varios, se propone disminuir la dosis vigilando riesgo/beneficio con los síntomas motores. Para los pacientes sin deterioro cognoscitivo, los fármacos con mejor evidencia son clozapina38,39 y pimavanserina, que ha mostrado mejoría importante en un amplio estudio clínico, a doble ciego y controlado con placebo40. En pacientes con deterioro cognoscitivo y alucinaciones visuales, la rivastigmina reduce significativamente la puntuación del inventario neuropsiquiátrico32. Aunque inicialmente se recomendaba el uso de quetiapina, múltiples estudios no han logrado reproducir su eficacia en EP32. Igual ha pasado con la olanzapina, que además empeora los síntomas motores41.
Trastorno del control de impulsosEl término trastorno del control de impulsos (TCI) agrupa una serie de conductas complejas caracterizadas por la dificultad para resistir el impulso de realizar un acto que es nocivo para el sujeto o para otros42. Se ha calculado una prevalencia del 6% en pacientes sin medicación dopaminérgica y del 17% con medicación43. A continuación se mencionan las características clínicas fundamentales del TCI:
- •
Juego patológico (JP): se define como la incapacidad para resistir el impulso de jugar (casino, máquinas tragamonedas, bingo, lotería, etc.) a pesar de las consecuencias negativas para su vida personal, profesional o familiar que conlleva.
- •
Conductas hipersexuales (CH): el sujeto experimenta un incremento de la libido respecto a su nivel premórbido. Las CH los pueden llevar a gastar mucho dinero, tiempo y energía en actividades sexuales desbordando su control voluntario. Pueden aparecer conductas parafílicas como exhibicionismo o voyerismo auditivo (uso excesivo de llamadas a líneas calientes)44. También encuentros constantes con prostitutas, compras desmesuradas en sex-shops, masturbación compulsiva, obsesión por la pornografía y/o travestismo. En algunos casos, pueden sobrepasarse los límites socialmente aceptados y cometerse conductas incestuosas, pedófilas45 o zoofílicas46.
- •
Compras compulsivas: se trata de una preocupación desadaptativa por realizar impulsivamente grandes compras. Los sujetos gastan más dinero del presupuestado, compran objetos innecesarios o dedican largos periodos al consumo en establecimientos comerciales. Se trata de una conducta incontrolable que genera problemas financieros y estrés a los familiares47.
- •
Alimentación compulsiva: se produce un drástico incremento de la ingesta alimentaria, principalmente de hidratos de carboo, dulces y/o comida salada. Las porciones de las comidas son exageradas y se incrementa el consumo entre comidas o incluso en horas de la noche. Esto, por supuesto, lleva a un aumento del índice de masa corporal. Tanto la alimentación compulsiva como las compras compulsivas son más frecuentes en las mujeres42.
- •
Punding: la preocupación y la fascinación por rituales aparentemente sin sentido de manera estereotipada (p. ej., organización y reordenación de objetos).
- •
Hobbismo: una preocupación prolongada por aficiones o actividades (p. ej., trabajar sin cesar en proyectos o pasatiempos, «adicción» al computador).
- •
Pasearse: caminar o conducir sin rumbo definido o inútilmente.
Los circuitos córtico-meso-límbicos y el estriado ventral, regulados por la dopamina, median respuestas de recompensa y placer, como ya se mencionó44. Algunos estudios han documentado hipofunción de estas estructuras, probablemente por sobrestimulación medicamentosa dopaminérgica. La recurrencia de conductas placenteras/impulsivas parece tener como finalidad la activación conductual de estos circuitos48.
El tratamiento consiste en la psicoeducación del paciente y sus familiares para generar una mejor comprensión del fenómeno y disminuir la ansiedad asociada con las conductas anormales. El consumo responsable de los agonistas dopaminérgicos, la reducción de las dosis, el cambio a otro agonista y la interrupción del tratamiento pueden ser estrategias efectivas para el control de síntomas49. En un estudio observacional, se demostró que la interrupción o la reducción significativa del medicamento disminuía de manera importante las conductas impulsivas50. Si esta estrategia no es efectiva, se puede hacer uso de antipsicóticos atípicos como la clozapina51 o la quetiapina, aunque con menor grado de evidencia. El uso de ISRS no ha mostrado mayor eficacia44. En algunos casos podría adicionarse litio o ácido valproico52 y/o terapia cognitivo-conductual.
Trastornos neuropsiquiátricos en la enfermedad de HuntingtonAdemás de los síntomas motores, la EH se acompaña típicamente de cambios neuropsiquiátricos como depresión, manía, psicosis, trastorno obsesivo compulsivo, síndrome disejecutivo, apatía e irritabilidad. A continuación se revisan brevemente algunos de ellos.
DepresiónLa prevalencia de síntomas depresivos en el transcurso de la EH es del 30 al 40%, y se alcanza un riesgo de suicidio de hasta 46 veces el de la población general53. La mayoría de los pacientes con EH sufren síntomas depresivos subsindrómicos, reacciones adaptativas con ánimo triste en relación con el diagnóstico de la enfermedad y apatía, los cuales hay que diferenciar de un episodio depresivo como tal. Los síntomas depresivos suelen preceder varios años a la enfermedad neurológica54.
Los estudios por neuroimagen funcional han documentado hipometabolismo orbitofrontal en sujetos que cursan un episodio depresivo en la EH55. Los aspectos reactivos y psicosociales también son importantes para la instauración del episodio depresivo. El hecho de tener que lidiar con una enfermedad que no tiene cura, progresiva y que genera extrañeza para la sociedad, carga en los cuidadores y deterioro funcional incapacitante pone en riesgo la estabilidad mental de cualquiera que la padezca.
El tratamiento de primera línea suelen ser los ISRS, aunque solo existen algunos reportes de caso sobre su eficacia56. Otro estudio con venlafaxina XR mostró que, tras administrarla a 26 sujetos con EH durante 4 semanas a una dosis promedio de 150 mg/día, se redujeron significativamente los síntomas depresivos57.
Manía e irritabilidadLa prevalencia de síndromes maniformes en la EH varía entre un 5 y un 10%54. Los pacientes pueden tener exaltación afectiva, irritabilidad, impulsividad, grandiosidad, incremento de la libido, disminución de la necesidad de sueño y, en casos graves, síntomas psicóticos. Es importante mencionar que la EH se acompaña típicamente de cambios de personalidad como desinhibición, inestabilidad afectiva, agresividad, puerilidad e irritabilidad58. Por esta razón, los síntomas maniformes no necesariamente deben interpretarse en contexto de un trastorno afectivo bipolar. Para el tratamiento se recomienda el uso de divalproato de sodio o carbamazepina59, ya que con el carbonato de litio se ha obtenido pobre respuesta y mayor riesgo de toxicidad por deshidratación. El uso de antipsicóticos está en controversia, pero pueden ser de utilidad.
Síntomas obsesivos compulsivosUn importante número de pacientes con EH sufren síntomas obsesivos compulsivos (SOC), sin cumplir necesariamente los criterios de trastorno obsesivo compulsivo según el DSM-V. Los síntomas pueden expresarse en fases preclínicas o de manera importante en las fases avanzadas de la enfermedad60. Inflexibilidad, perseveraciones y preocupaciones idiosincrásicas son frecuentes en la EH61. Las iteraciones verbales y las conductas repetitivas generalmente corresponden a disfunción ejecutiva, más que a compulsiones como tales.
Las enfermedades que afectan a los GB y, por lo tanto, alteran los circuitos frontosubcorticales (principalmente orbitofrontales) tienen mayor prevalencia de SOC62. Se han descrito casos en corea de Sydenham, infartos en el caudado, síndrome de Gilles de la Tourette y neuroacantosis, entre otras63.
Los ISRS y la clomipramina se mantienen como las terapias de elección para el SOC en EH, en combinación con terapia cognitivo conductual54.
Trastornos psicóticosLos síntomas de esquizoides en la EH tienen una prevalencia del 3 al 6%64. Los principales factores de riesgo son el inicio temprano de la EH y los antecedentes familiares de psicosis59.
Los síntomas más frecuentes son: ideas delirantes paranoides mal estructuradas, agresividad, irritabilidad y mal control de impulsos. Las alucinaciones son relativamente infrecuentes y suponen solo el 2% de los casos. Otros síntomas que podrían ser interpretados como negativos son apatía y aplanamiento afectivo. De manera infrecuente, se han descrito casos de delirios erotomaniacos, delirio de parasitosis, síndromes de Cotard y alucinaciones auditivas54.
Algunos reportes de caso han mostrado la eficacia del tratamiento de la psicosis en la EH con risperidona65,66. Otros reportes han utilizado otros antipsicóticos atípicos, como aripiprazol y quetiapina, y han obtenido buenos resultados67,68.
Trastornos neurocognoscitivosEl deterioro cognoscitivo es una característica invariable de la EH que se presenta tempranamente en el curso de la enfermedad. Incluso es probable que las alteraciones cognitivas aparezcan durante la fase prodrómica, décadas antes de los síntomas motores69. Como ya se ha mencionado, típicamente expresan un patrón subcortical, y el síndrome disejecutivo cognitivo y conductual es el aspecto más relevante54,59.
Hay poca evidencia para el uso de inhibidores de acetilcolinesterasa en la demencia asociada a EH70,71.
DiscusiónEl término trastornos del movimiento se aplica a un grupo amplio y heterogéneo de enfermedades que cursan con alteraciones en la voluntariedad del movimiento, ya sea por exceso o por defecto. Tanto la EP como la EH son condiciones paradigmáticas de estos trastornos.
Como se ha revisado, los GB están conformados por circuitos frontosubcorticales motores y no motores (figura 2). De estos, destacan los circuitos prefrontales dorsolaterales, orbitofrontales y frontomediales, los cuales están dedicados a regular funciones ejecutivas, conducta social y estados motivacionales72. Dado que estos circuitos son cerrados, cualquier daño en algún punto del recorrido puede alterar su funcionamiento y generar síntomas. En la EP, el deterioro progresivo de la sustancia negra y, por lo tanto, del funcionamiento dopaminérgico altera prácticamente todos los circuitos frontosubcorticales. Para la EH, el deterioro del caudado interrumpe la continuidad de los mismos circuitos, pero con expresiones clínicas diferentes. Como se ha visto, los GB tienen un papel fundamental en la regulación afectiva, cognitiva y conductual de manera que, ante daños estructurales o funcionales, es esperable encontrar altas prevalencias de síntomas depresivos, psicóticos y cognoscitivos, SOC y dificultades para el control de impulsos. Los síntomas afectivos en la EP tienen el agravante de que además los generan daños en los núcleos serotoninérgicos, noradrenérgicos y dopaminérgicos del tallo cerebral21, que pueden objetivarse mediante resonancia magnética cerebral (hiperintensidades mesencefálicas), concentraciones disminuidas de metabolitos en el líquido cefalorraquídeo y por ultrasonografía (hipoecogenicidad mesencefálica en los núcleos del rafe)73. Es por esto que el peso biológico en la fisiopatología de la depresión en la EP es relevante y se debe abordar con antidepresivos que eleven varios sistemas de neurotransmisores, como los duales o los tricíclicos. En el caso de la EH, la depresión parece estar más relacionada con el daño de circuitos límbicos (orbitofrontales y frontomediales) que por afección directa del sistema monoaminérgico55.
Tanto en la EP como en la EH, la disfunción de los circuitos prefrontales dorsolaterales explicarían el enlentecimiento psicomotor, las perseveraciones, el concretismo en el pensamiento, las dificultades para planear, organizar información, resolver problemas complejos, activar memorias remotas, la flexibilidad mental y la generación de programas motores74.
La alta prevalencia de apatía de autoactivación en la EH y la EP tiene un correlato neuroanatómico claro con daños en estructuras frontomediales como el cíngulo anterior75 que revelan afección de los circuitos frontosubcorticales límbicos.
La disfunción de los circuitos prefrontales orbitofrontales sería la causa de los cambios de personalidad, más notorios en la EH que en la EP76. Esta disfunción también se puede manifestar con un espectro de síntomas que abarcan desde SOC hasta síntomas psicóticos32.
En la EP, el circuito orbitofrontal medial y del cíngulo anterior, ambos con conexiones con el estriado ventral, están involucrados en el TCI. La hipofunción dopaminérgica de estas estructuras es similar al documentado en sujetos con adicciones77, quienes buscan reactivar los circuitos del placer consumiendo estimulantes. En la EP se realizan conductas impulsivas que generan recompensa y placer. Se plantea que los TCI podrían ser formas de dependencia conductual no asociadas con el uso de sustancias psicoactivas, pero exacerbadas por el uso de agonistas dopaminérgicos.
ConclusionesEl espectro de síntomas neuropsiquiátricos que se presentan en los trastornos del movimiento es amplio, y comprenderlo requiere conocimientos sólidos en áreas interdisciplinarias como neurología, neuropsicología y psiquiatría.
Tanto la EP como la EH deben abordarse como entidades neuropsiquiátricas en las cuales la integración de síntomas motores y no motores se han de entender bajo la luz de la neuroanatomía funcional de los GB y como expresiones semiológicas de daños en los circuitos frontosubcorticales. Aunque ambas entidades comparten disfunción de ese sistema, las diferencias en la localización del daño anatómico y las particularidades genéticas, biológicas, psicológicas y psicosociales favorecen diversas expresiones clínicas en cada sujeto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.