Determinar los exámenes paraclínicos relacionados con riesgo metabólico, que se les deben practicar a los pacientes adultos con diagnóstico de esquizofrenia. Ayudar al clínico en la toma de decisiones sobre las estrategias de evaluación diagnóstica complementarias basadas en el adulto con diagnóstico de esquizofrenia.
MétodoSe elaboró una guía de práctica clínica bajo los lineamientos de la Guía Metodológica del Ministerio de Salud y Protección Social para identificar, sintetizar, evaluar la evidencia y formular recomendaciones respecto al manejo y seguimiento de los pacientes adultos con diagnóstico de esquizofrenia. Se adoptó y actualizó la evidencia de la guía NICE 82, que contestaba la pregunta acá planteada. Se presentó la evidencia y su graduación al grupo desarrollador de la guía (GDG) para la formulación de las recomendaciones siguiendo la metodología propuesta por el abordaje GRADE.
ResultadosEl riesgo de mortalidad general en esquizofrenia es mayor que en la población general excluyendo el suicidio. Los resultados relacionados con la mortalidad asociada a antipsicóticos muestran resultados contradictorios. Los desenlaces metabólicos mostraron una mayor incidencia y asociación con la esquizofrenia y el tratamiento con antipsicóticos (APS). El diagnóstico de dislipidemia en los hombres con esquizofrenia parece ser menor que en la población general. Sin embargo, los cambios en el peso, en los niveles de glicemia, colesterol HDL y triglicéridos están influidos por el uso de antipsicóticos y en general hay un mayor riesgo de desarrollar diabetes mellitus en las personas adultas con esquizofrenia.
ConclusiónCon base en la evidencia encontrada se justificó la formulación de un plan de evaluación de variables fisiológicas y paraclínicas, tanto antes como durante el manejo con AP del adulto con diagnóstico de esquizofrenia. Se consideró que la calidad general de la evidencia es baja teniendo en cuenta que la mayoría de los reportes provienen de estudios de observaciones que tienen riesgo de sesgo y algunos diseños tienen limitaciones metodológicas.
To determine the laboratory tests, related to metabolic risk that should be practiced to adult patients diagnosed with schizophrenia. To assist the clinician decision-making process about complementary diagnostic evaluation strategies in adult diagnosed with schizophrenia.
MethodsA clinical practice guideline was elaborated under the parameters of the Methodological Guide of the Ministerio de Salud y Protección Social to identify, synthesize and evaluate the evidence and make recommendations about the treatment and follow-up of adult patients with schizophrenia. The evidence of NICE guide 82 was adopted and updated. The evidence was presented to the Guideline Developing Group and recommendations, employing the GRADE system, were produced.
ResultsThe risk of overall mortality in schizophrenia is higher than in the general population excluding suicide. Results related with mortality associated to antipsychotics showed contradictory results. Metabolic outcomes showed a higher incidence and association with schizophrenia and treatment with antipsychotics (AP). The diagnosis of dyslipidemia in men with schizophrenia appears to be lower in comparison with the general population. However, changes in weight, blood sugar levels, HDL cholesterol and triglycerides are influenced by the use of antipsychotics in general there is a higher risk of developing diabetes mellitus in adults with schizophrenia.
ConclusionBased on the evidence found a plan was formulated for the evaluation of physiological and paraclinical variables during and before the management with AP in adult diagnosed with schizophrenia. The overall quality of evidence is low considering that most of the reports come from observational studies that have risk of bias and some designs have methodological limitations.
La farmacoterapia se considera la piedra angular en el tratamiento de la esquizofrenia y su implementación racional puede influir en el control de varios de los síntomas de esta enfermedad y mejorar la integración psicosocial de los individuos afectados1,2. Sin embargo, los tratamientos psicofarmacológicos no son inocuos, pueden tener efectos en múltiples sistemas o procesos, como el hematológico3–6, los metabólicos7,8 y el cardiovascular9,10, entre otros.
Varios grupos de investigadores han propuesto protocolos y recomendaciones de seguimiento clínico y paraclínico en el marco del tratamiento de la esquizofrenia; estos se han desarrollado con consensos formales o informales en el marco de los servicios de salud de sus países de origen, el tipo de práctica clínica y las necesidades específicas de sus grupos poblacionales3,11–19 para mejorar la práctica clínica.
En consecuencia, se formuló la siguiente pregunta para el desarrollo de las recomendaciones sobre la evaluación y el seguimiento metabólico del paciente con diagnóstico de esquizofrenia: ¿Cuáles son los exámenes paraclínicos que se les deben practicar a los pacientes con diagnóstico de esquizofrenia al inicio del tratamiento farmacológico y durante el seguimiento del tratamiento?
MetodologíaPara la realización de la GPC se utilizaron los pasos propuestos en el documento Guía Metodológica para la elaboración de Guías de Práctica Clínica en el Sistema General de Seguridad Social en Salud colombiano. La metodología detallada de la elaboración de la guía se encuentra en el documento completo disponible la página web del Ministerio de Salud y Protección Social (http://www.minsalud.gov.co)20. Para el desarrollo de las recomendaciones basadas en la evidencia sobre la evaluación y el seguimiento metabólico de los pacientes con diagnóstico de esquizofrenia se elaboró un protocolo de revisión sistemática de la literatura que se detalla a continuación.
Búsqueda y selección de la literaturaSe realizó un proceso general de búsqueda de guías de práctica clínica sobre la evaluación y el tratamiento del adulto con diagnóstico de esquizofrenia. El proceso incluyó una búsqueda exhaustiva en diferentes fuentes de guías, una tamización y una evaluación de calidad. Para el desarrollo de la guía completa se tomó como base la guía NICE 8221. Para esta pregunta clínica se realizó una búsqueda de novo y se realizó una selección pareada de los títulos para apreciar críticamente. La fecha de la última búsqueda fue en Agosto de 2013.
Se condujo una búsqueda sistemática de la literatura en PubMed, EMBASE, BVS y Cochrane para identificar estudios que reportaran la incidencia de los desenlaces críticos (Diabetes e hiperglicemia, síndrome metabólico, sobrepeso, dislipidemia) en pacientes adultos con diagnóstico de esquizofrenia, que identificó las publicaciones relevantes hasta agosto de 2013. Se incluyeron revisiones sistemáticas y metaanálisis, ensayos clínicos y estudios de cohortes, en español, inglés y francés. Se excluyeron estudios post-hoc, reportes de caso, series de casos, casos y controles, corte transversal, revisiones narrativas no sistemáticas y cartas al editor. También fueron excluidos aquellos con pacientes con demencia, reportes de conjunto de pacientes con diferentes diagnósticos psiquiátricos (salvo trastorno esquizoafectivo, esquizofreniforme o bipolar) que no tuviesen un análisis de subgrupos, de mujeres embarazadas, de pacientes con diagnóstico de esquizofrenia de inicio muy tardío (mayores de 65) y artículos que trataran específicamente sobre esquizofrenia y consumo de sustancias. Una vez preseleccionados los estudios, se escogieron para apreciar aquellos que aportaran información para la frecuencia de toma de paraclínicos y estuvieran relacionados con los medicamentos evaluados en la elaboración de la guía y se excluyeron aquellos que solo incluyeran comparaciones de medicamentos cabeza a cabeza.
Evaluación y selección de estudios individualesUna vez seleccionados los estudios relevantes, teniendo en cuenta los criterios de inclusión descritos anteriormente, cada documento fue sometido a una evaluación de su calidad. Dicha evaluación fue realizada por dos evaluadores de manera independiente, y los desacuerdos fueron resueltos por consenso o por un tercer revisor.
Evaluación de la calidad de la evidencia y formulación de recomendacionesUna vez se seleccionaron los artículos que deberían ser incluidos para basar la formulación de las recomendaciones, se dio paso a la síntesis de la información y a la consolidación del cuerpo de la evidencia disponible para cada uno de los desenlaces considerados como críticos por el grupo desarrollador (GDG).
La evidencia fue presentada en una reunión al GDG, en conjunto con un borrador de las recomendaciones. Las cuales fueron definidas y graduadas en fortaleza a partir de las siguientes consideraciones: calidad de la evidencia, balance entre beneficios y riesgos, consumo de recursos y valores y preferencias de los pacientes (el grupo contaba con delegados de Asociación Colombiana de Personas con Esquizofrenia y sus Familiares). En caso de no contar con evidencia se establecieron las recomendaciones y su fortaleza por consenso.
Para facilitar la lectura del artículo e interpretación de las recomendaciones, se utilizarán las siguientes convenciones:
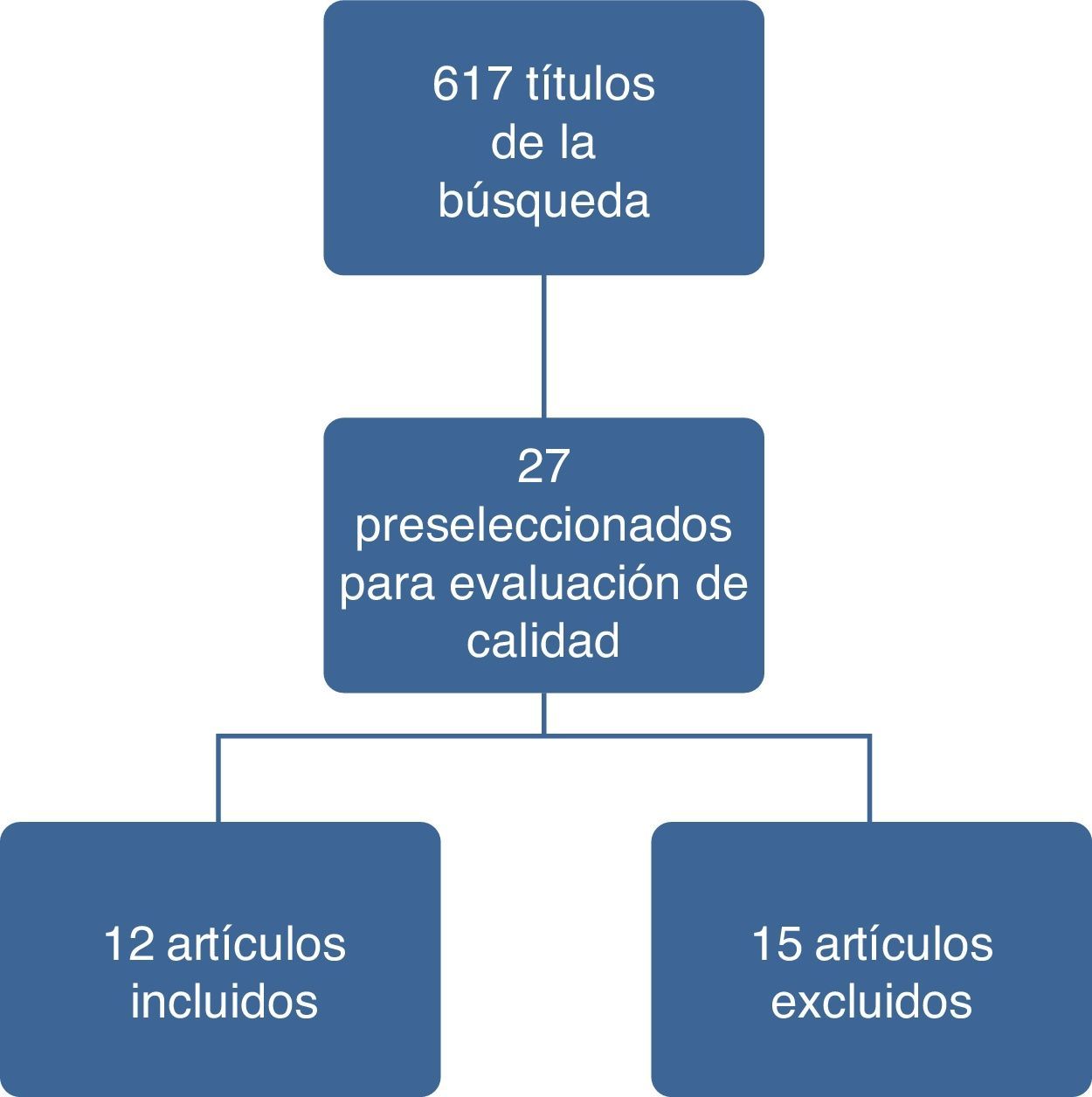
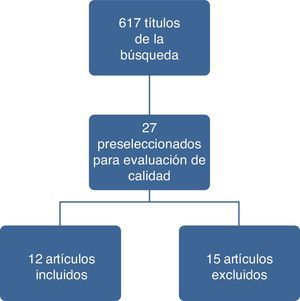
ResultadosEn la figura 1 se ilustran los resultados del proceso de búsqueda y selección de los estudios para actualizar el cuerpo de la evidencia que sirvió de base para la formulación de recomendaciones. El detalle de los artículos incluidos y excluidos puede ser consultado en el documento completo de la guía en la página del Ministerio de Salud y Protección Social (gpc.minsalud.gov.co)22.
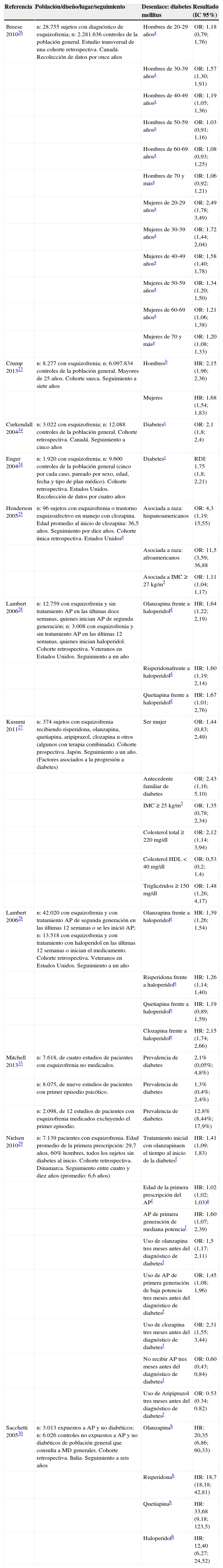
Descripción de los hallazgos y calidad de la evidenciaDiabetes mellitus e hiperglicemiaSe incluyeron diez estudios que reportaron la evaluación de la diabetes en pacientes con esquizofrenia23–32 y un metaanálisis que reportó la prevalencia de diabetes en estudios observacionales33. En este último se compararon tres grupos poblacionales: sujetos con esquizofrenia no medicados, sujetos con primer episodio psicótico y pacientes con diagnóstico de esquizofrenia que no estuvieran en primer episodio. La prevalencia fue significativamente más alta en el último grupo al compararla con los dos primeros (frente a no medicados chi2 38,3; p < 0,000 y frente a primer episodio chi2 92,9; p < 0,000)33. La asociación entre diabetes mellitus con el diagnóstico de esquizofrenia cuando se comparan los pacientes con la enfermedad mental y la población general fue evaluada en cuatro estudios23,24,26,34. Se encontró una asociación significativa entre esquizofrenia y diabetes en el reporte de Curkendall y colaboradores34. En el estudio de Crump y colaboradores23 se encontró un mayor riesgo de tener un diagnóstico de diabetes posterior al diagnóstico de esquizofrenia tanto en hombres como en mujeres. En el estudio de Enger y colaboradores24 reportaron un mayor riesgo de incidencia de diabetes que en el grupo de control.
En cuanto a la asociación del uso de AP en pacientes con esquizofrenia y desarrollo de diabetes mellitus, Lambert y colaboradores28 hallaron que los pacientes que iniciaron tratamiento antipsicótico de segunda generación por primera vez y aquellos a los que se les recetó olanzapina, risperidona, quetiapina o clozapina tienen mayor riesgo de presentar diabetes en comparación con los que tomaron haloperidol. Nielsen y colaboradores29 también hallaron que las variables asociadas con el aumento de la incidencia de diabetes dentro de los tres meses de su desarrollo fueron el uso de olanzapina, AP de primera generación de baja potencia o clozapina (tabla 1).
Resumen de la evidencia de diabetes mellitus en pacientes con esquizofrenia
| Referencia | Población/diseño/lugar/seguimiento | Desenlace: diabetes mellitus | Resultado (IC 95%) |
|---|---|---|---|
| Breese 201026 | n: 28.755 sujetos con diagnóstico de esquizofrenia; n: 2.281.636 controles de la población general. Estudio transversal de una cohorte retrospectiva. Canadá. Recolección de datos por once años | Hombres de 20-29 añosa | OR: 1,18 (0,79; 1,76) |
| Hombres de 30-39 añosa | OR: 1,57 (1,30; 1,91) | ||
| Hombres de 40-49 añosa | OR: 1,19 (1,05; 1,36) | ||
| Hombres de 50-59 añosa | OR: 1,03 (0,91; 1,16) | ||
| Hombres de 60-69 añosa | OR: 1,08 (0,93; 1,25) | ||
| Hombres de 70 y mása | OR: 1,06 (0,92; 1,21) | ||
| Mujeres de 20-29 añosa | OR: 2,49 (1,78; 3,49) | ||
| Mujeres de 30-39 añosa | OR: 1,72 (1,44; 2,04) | ||
| Mujeres de 40-49 añosa | OR: 1,58 (1,40; 1,78) | ||
| Mujeres de 50-59 añosa | OR: 1,34 (1,20; 1,50) | ||
| Mujeres de 60-69 añosa | OR: 1,21 (1,06; 1,38) | ||
| Mujeres de 70 y mása | OR: 1,20 (1,08; 1,33) | ||
| Crump 201323 | n: 8.277 con esquizofrenia; n: 6.097.834 controles de la población general. Mayores de 25 años. Cohorte sueca. Seguimiento a siete años | Hombresb | HR: 2,15 (1,96; 2,36) |
| Mujeres | HR: 1,68 (1,54; 1,83) | ||
| Curkendall 200434 | n: 3.022 con esquizofrenia; n: 12.088 controles de la población general. Cohorte retrospectiva. Canadá. Seguimiento a cinco años | Diabetesc | OR: 2,1 (1,8; 2,4) |
| Enger 200424 | n: 1.920 con esquizofrenia; n: 9.600 controles de la población general (cinco por cada caso, pareado por sexo, edad, fecha y tipo de plan médico). Cohorte retrospectiva. Estados Unidos. Recolección de datos por cuatro años | Diabetesc | RDI: 1,75 (1,8; 2,21) |
| Henderson 200525 | n: 96 sujetos con esquizofrenia o trastorno esquizoafectivo en manejo con clozapina. Edad promedio al inicio de clozapina: 36,5 años. Seguimiento por diez años. Cohorte única retrospectiva. Estados Unidose | Asociada a raza: hispanoamericanos | OR: 4,3 (1,19; 15,55) |
| Asociada a raza: afroamericanos | OR: 11,5 (3,59; 36,88 | ||
| Asociada a IMC ≥ 27 kg/m2 | OR: 1,11 (1,04; 1,17) | ||
| Lambert 200628 | n: 12.759 con esquizofrenia y sin tratamiento AP en las últimas doce semanas, quienes inician AP de segunda generación; n: 3.008 con esquizofrenia y sin tratamiento AP en las últimas 12 semanas, quienes inician haloperidol. Cohorte retrospectiva. Veteranos en Estados Unidos. Seguimiento a un año | Olanzapina frente a haloperidold | HR: 1,64 (1,22; 2,19) |
| Risperidonafrente a haloperidold | HR: 1,60 (1,19; 2,14) | ||
| Quetiapina frente a haloperidold | HR: 1,67 (1,01; 2,76) | ||
| Kusumi 201127 | n: 374 sujetos con esquizofrenia recibiendo risperidona, olanzapina, quetiapina, aripiprazol, clozapina u otros (algunos con terapia combinada). Cohorte prospectiva. Japón. Seguimiento a un año.(Factores asociados a la progresión a diabetes) | Ser mujer | OR: 1,44 (0,83; 2,49) |
| Antecedente familiar de diabetes | OR: 2,43 (1,16; 5,10) | ||
| IMC ≥ 25 kg/m2 | OR: 1,35 (0,78; 2,34) | ||
| Colesterol total ≥ 220 mg/dl | OR: 2,12 (1,14; 3,94) | ||
| Colesterol HDL<40 mg/dl | OR: 0,53 (0,2; 1,4) | ||
| Triglicéridos ≥ 150 mg/dl | OR: 1,48 (1,26; 4,17) | ||
| Lambert 200628 | n: 42.020 con esquizofrenia y con tratamiento AP de segunda generación en las últimas 12 semanas o se les inició AP; n: 13.518 con esquizofrenia y con tratamiento con haloperidol en las últimas 12 semanas o inician el medicamento. Cohorte retrospectiva. Veteranos en Estados Unidos. Seguimiento a un año | Olanzapina frente a haloperidole | HR: 1,39 (1,26; 1,54) |
| Risperidona frente a haloperidole | HR: 1,26 (1,14; 1,40) | ||
| Quetiapina frente a haloperidole | HR: 1,19 (0,89; 1,59) | ||
| Clozapina frente a haloperidole | HR: 2,15 (1,74; 2,66) | ||
| Mitchell 201333 | n: 7.618, de cuatro estudios de pacientes con esquizofrenia no medicados. | Prevalencia de diabetes | 2,1% (0,05%; 4,8%) |
| n: 8.075, de nueve estudios de pacientes con primer episodio psicótico. | Prevalencia de diabetes | 1,3% (0,4%; 2,4%) | |
| n: 2.098, de 12 estudios de pacientes con esquizofrenia medicados excluyendo el primer episodio. | Prevalencia de diabetes | 12.8% (8,44%; 17,9%) | |
| Nielsen 201029 | n: 7.139 pacientes con esquizofrenia. Edad promedio de la primera prescripción: 29,7 años, 60% hombres, todos los sujetos sin diabetes al inicio. Cohorte retrospectiva. Dinamarca. Seguimiento entre cuatro y diez años (promedio: 6,6 años) | Tratamiento inicial con olanzapinaen el tiempo al inicio de la diabetesf | HR: 1,41 (1,09; 1,83) |
| Edad de la primera prescripción del APf | HR: 1,02 (1,02; 1,03)g | ||
| AP de primera generación de mediana potenciaf | HR: 1,60 (1,07; 2,39) | ||
| Uso de olanzapina tres meses antes del diagnóstico de diabetesf | OR: 1,5 (1,17; 2,11) | ||
| Uso de AP de primera generación de baja potencia tres meses antes del diagnóstico de diabetesf | OR: 1,45 (1,08; 1,96) | ||
| Uso de clozapina tres meses antes del diagnóstico de diabetesf | OR: 2,31 (1,55; 3,44) | ||
| No recibir AP tres meses antes del diagnóstico de diabetesf | OR: 0,60 (0,43; 0,84) | ||
| Uso de Aripiprazol tres meses antes del diagnóstico de diabetesf | OR: 0.53 (0.34; 0.82) | ||
| Sacchetti 200530 | n: 3.013 expuestos a AP y no diabéticos; n: 6.026 controles no expuestos a AP y no diabéticos de población general que consulta a MD generales. Cohorte retrospectiva. Italia. Seguimiento a seis años | Olanzapinah | HR: 20,35 (6,86; 60,33) |
| Risperidonah | HR: 18,7 (18,18; 42,81) | ||
| Quetiapinah | HR: 33,68 (9,18; 123,5) | ||
| Haloperidolh | HR: 12,40 (6,27; 24,52) |
Abreviaturas: IC: intervalo de confianza, HR: Hazard Ratio, OR: Odds ratio (razón de suertes).
Ajustado por estatus socioeconómico y visitas al MD general e interacciones de las variables (no presentadas en la publicación).
Ajustado por sexo, edad, uso medicación antipsicótica, para diabetes, antihipertensivos, año y porcentaje de medicación antipsicótica reclamada.
Ajustado por: sexo, edad, raza, estado civil y toma de medicamentos potencialmente inductores de diabetes.
Hiperglicemia se considera un valor superior a 100mg/dl de glucosa en sangre en ayunas de acuerdo con los criterios de síndrome metabólico (ver apéndice). Mitchell y colaboradores33 estimaron la prevalencia de hiperglicemia mediante el metaanálisis de estudios observacionales en tres grupos poblacionales: sujetos con esquizofrenia no medicados, sujetos con primer episodio psicótico y pacientes con diagnóstico de esquizofrenia que no estuvieran en primer episodio. La prevalencia fue significativamente más alta en el grupo de pacientes tratados frente a los sujetos en primer episodio (chi2 156,2; p < 0,0001)33 (tabla 2).
Resumen de la evidencia de prevalencia de hiperglicemia en pacientes con esquizofrenia
| Referencia | Población/diseño/lugar/seguimiento | Resultado (IC 95%) |
|---|---|---|
| Mitchell 201333 | n: 390, de tres estudios de pacientes con esquizofrenia no medicados | 6,4% (2,2%; 12,7%) |
| n: 788, de siete estudios de pacientes con primer episodio psicótico | 8,7% (5,2%; 12,9%) | |
| n: 6.798, de 26 estudios de pacientes con esquizofrenia medicados excluyendo el primer episodio | 27,8% (23,0%; 32,9%) |
Abreviaturas: IC: intervalo de confianza.
El síndrome metabólico es un concepto clínico que se desarrolló para identificar pacientes que tienen mayor riesgo de enfermedades cardiovasculares de origen ateroesclerótico (el doble) y de desarrollar diabetes mellitus tipo II (hasta cinco veces más)35.
Koponen y colaboradores36 hicieron una evaluación de los criterios diagnósticos según la IDF y el NCEP -ATP-A III en 31 pacientes con esquizofrenia de 100 personas con el diagnóstico que eran ubicables, aceptaron participar y tomaron su muestra. Estos sujetos provienen de una cohorte del norte de Finlandia seguida desde el nacimiento, en 1966, hasta los 31 años. Los resultados sobre las características operativas indican la sensibilidad y especificidad para el diagnóstico de síndrome metabólico teniendo en cuenta el criterio de obesidad central más alguno de los otros criterios.
En el reporte de Mitchell y colaboradores33 estimaron la prevalencia de síndrome metabólico (por cualquiera de los criterios empleados para su diagnóstico, véase apéndice) con el metaanálisis de estudios observacionales en tres grupos poblacionales –sujetos con esquizofrenia no medicados, sujetos con primer episodio psicótico y pacientes con diagnóstico de esquizofrenia que no estuvieran en primer episodio– y compararon los resultados entre ellos. La prevalencia fue significativamente más alta en el último grupo al compararla con los dos primeros (frente a no medicados chi2 195,7; p<0,0001 y frente a primer episodio chi2 303,6; p<0,0001), pero no hubo diferencias entre los sujetos con esquizofrenia no medicados y los que estaban en un primer episodio33 (tabla 3).
Resumen de la evidencia sobre prevalencia de síndrome metabólico en pacientes con esquizofrenia
| Referencia | Población/diseño/lugar/seguimiento | Resultado (IC 95%) |
|---|---|---|
| Koponen 201036 | n: 31 sujetos con esquizofrenia. Cohorte, Finlandia. Seguidos hasta los 31 años | 29% (IDF) 29% (ATP-A-III) |
| Mitchell 201333 | n: 702, de once estudios de pacientes con esquizofrenia no medicados | 9,8% (5,3%; 15,6%) |
| n: 1.106, de catorce estudios de pacientes con primer episodio psicótico | 9,9% (6,1%; 14,5%) | |
| n: 24.892, de 78 estudios de pacientes con esquizofrenia medicados excluyendo el primer episodio | 35,3% (32,8%; 37,8%) |
Abreviaturas: IC: intervalo de confianza.
Se incluyeron tres artículos que reportaron la evaluación de sobrepeso en pacientes con diagnóstico de esquizofrenia33,37,38; también se consideró la evidencia presentada en el protocolo de recomendación 2a de los resultados de las comparaciones que reportaron sobrepeso. De la evidencia incluida en el protocolo de recomendaciones para el tratamiento con AP en la fase aguda de la esquizofrenia, la obesidad fue reportada solo para la comparación entre haloperidol y olanzapina, con un mayor riesgo para la olanzapina y con un gran tamaño del efecto (RR: 0,35 IC 95% [0,21; 0,58])39,40.
En el análisis retrospectivo de Wirshing y colaboradores37 durante un seguimiento a seis años de individuos con esquizofrenia, la máxima ganancia de peso ajustada se dio entre la semana quince (para risperidona) y 24 (para clozapina) del tratamiento con AP. Los máximos porcentajes de ganancia de peso ajustados los obtuvieron la olanzapina y la clozapina. Mitchell y colaboradores33 estimaron la prevalencia de obesidadb mediante el metaanálisis de estudios observacionales en tres grupos poblacionales: sujetos con esquizofrenia no medicados, sujetos con primer episodio psicótico y pacientes con diagnóstico de esquizofrenia que no estuvieran en primer episodio. La prevalencia fue significativamente más alta en el último grupo al compararla con los dos primeros (frente a no medicados chi2 217,1; p<0,0001 y frente a primer episodio chi2 714,9; p<0,0001). También encontraron un diferencia significativa entre los pacientes de primer episodio y los no medicados (chi2 7,2; p=0,0072)33 (tabla 4).
Resumen de la evidencia de sobrepeso en pacientes con esquizofrenia
| Referencia | Población/diseño/lugar/seguimiento | Desenlace | Resultado |
|---|---|---|---|
| Wirshing 199937Análisis retrospectivoEstados Unidos | n: 92 hombres con diagnóstico de esquizofrenia que recibieron cinco AP diferentes: clozapina, olanzapina, haloperidol, risperidona y sertindol. Seguimiento durante seis años para el manejo de control de peso. | Tiempo a la máxima ganancia de peso con Clozapina (promedio±ES)a | 24,9±3,1 semanas |
| Tiempo a la máxima ganancia de peso con Olanzapina (promedio±ES)a | 21,2±4,1 semanas | ||
| Tiempo a la máxima ganancia de peso con Risperidona (promedio±ES)a | 15,0±2,3 semanas | ||
| Tiempo ajustado a la máxima ganancia de peso con Haloperidol (promedio±ES)a | 18,5±2,1 semanas | ||
| Máximo porcentaje en ganancia de peso con Clozapina (promedio±ES)a | 8,8±1,1 | ||
| Máximo porcentaje en ganancia de peso con Olanzapina (promedio±ES)a | 8,8±1,3 | ||
| Máximo porcentaje en ganancia de peso con Risperidona (promedio±ES)a | 6,4±0,8 | ||
| Máximo porcentaje en ganancia de peso con Haloperidol (promedio±ES)a | 4,4±0,8 | ||
| Mitchell 201333 | n: 837, de 10 estudios de pacientes con esquizofrenia no medicados | Prevalencia de obesidad (IC 95%) | 26,6% (15,9%; 38,9%) |
| n: 2.127, de 17 estudios de pacientes con primer episodio psicótico | Prevalencia de obesidad (IC 95%) | 22,0% (15,6%; 29,1%) | |
| n: 17.474, de 58 estudios de pacientes con esquizofrenia medicados excluyendo el primer episodio | Prevalencia de obesidad (IC 95%) | 52,7% (48,9%; 56,5%) |
Abreviaturas: IC: intervalo de confianza.
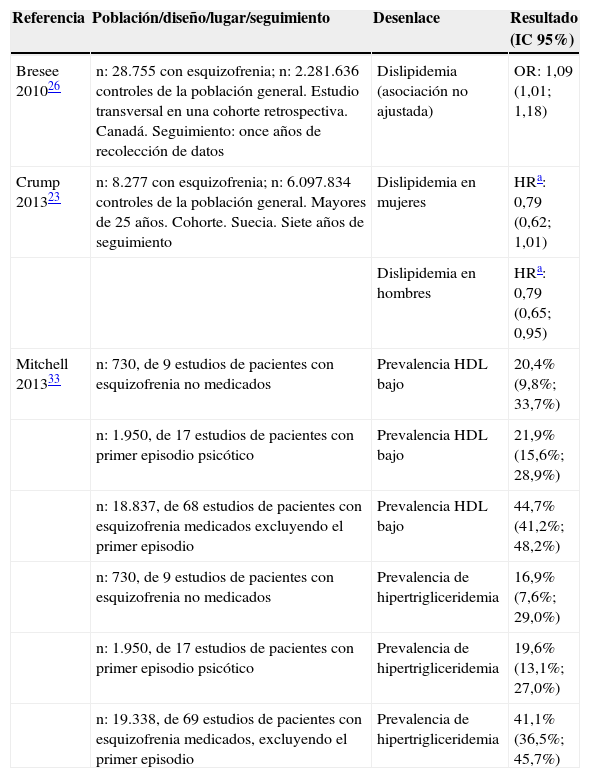
Se incluyeron tres artículos sobre la evaluación de dislipidemia en pacientes con diagnóstico de esquizofrenia23,26,33. Bresee y colaboradores26 encontraron una asociación débil de la dislipidemia con la esquizofrenia. Mitchell y colaboradores33 estimaron la prevalencia de HDL bajo e hipertrigliceridemia (≥150mg/dl) mediante el metaanálisis de estudios observacionales en tres grupos poblacionales: sujetos con esquizofrenia no medicados, sujetos con primer episodio psicótico y pacientes con diagnóstico de esquizofrenia que no estuvieran en su primer episodio. La prevalencia de ambos desenlaces fue significativamente más alta en el grupo de pacientes que no estaban en primer episodio y recibían mediación al compararlos con los pacientes no medicados (HDL bajo chi2 168,4; p<0,0001 e hipertrigliceridemia chi2 172,0; p<0,0001). De igual forma, la prevalencia de las mismas variables fue significativamente más alta en el grupo de pacientes que no estaban en primer episodio y recibían mediación al compararlos con los pacientes en primer episodio (HDL bajo chi2 375,8; p<0,0001 e hipertrigliceridemia chi2 344,1; p<0,0001) (tabla 5).
Resumen de la evidencia de dislipidemia en pacientes con esquizofrenia
| Referencia | Población/diseño/lugar/seguimiento | Desenlace | Resultado (IC 95%) |
|---|---|---|---|
| Bresee 201026 | n: 28.755 con esquizofrenia; n: 2.281.636 controles de la población general. Estudio transversal en una cohorte retrospectiva. Canadá. Seguimiento: once años de recolección de datos | Dislipidemia (asociación no ajustada) | OR: 1,09 (1,01; 1,18) |
| Crump 201323 | n: 8.277 con esquizofrenia; n: 6.097.834 controles de la población general. Mayores de 25 años. Cohorte. Suecia. Siete años de seguimiento | Dislipidemia en mujeres | HRa: 0,79 (0,62; 1,01) |
| Dislipidemia en hombres | HRa: 0,79 (0,65; 0,95) | ||
| Mitchell 201333 | n: 730, de 9 estudios de pacientes con esquizofrenia no medicados | Prevalencia HDL bajo | 20,4% (9,8%; 33,7%) |
| n: 1.950, de 17 estudios de pacientes con primer episodio psicótico | Prevalencia HDL bajo | 21,9% (15,6%; 28,9%) | |
| n: 18.837, de 68 estudios de pacientes con esquizofrenia medicados excluyendo el primer episodio | Prevalencia HDL bajo | 44,7% (41,2%; 48,2%) | |
| n: 730, de 9 estudios de pacientes con esquizofrenia no medicados | Prevalencia de hipertrigliceridemia | 16,9% (7,6%; 29,0%) | |
| n: 1.950, de 17 estudios de pacientes con primer episodio psicótico | Prevalencia de hipertrigliceridemia | 19,6% (13,1%; 27,0%) | |
| n: 19.338, de 69 estudios de pacientes con esquizofrenia medicados, excluyendo el primer episodio | Prevalencia de hipertrigliceridemia | 41,1% (36,5%; 45,7%) |
Abreviaturas: IC: intervalo de confianza, HR: Hazard Ratio, OR: Odds ratio (razón de suertes).
Con base en la evidencia encontrada sobre: mortalidad, desenlaces metabólicos y los riesgos establecidos se justificó la formulación de un plan de evaluación de variables fisiológicas tanto antes como durante el manejo con AP del adulto con diagnóstico de esquizofrenia. Se considera que la calidad general de la evidencia es baja teniendo en cuenta que la mayoría de los reportes provienen de estudios de observaciones que tienen riesgo de sesgo y algunos diseños tienen limitaciones metodológicas.
RecomendacionesEl GDG formuló las siguientes recomendaciones
Recomendación 1. Todo paciente adulto con diagnóstico de esquizofrenia requiere una evaluación clínica antes de iniciar el tratamiento farmacológico que incluya como mínimo las pruebas enumeradas en la tabla 6. ↑↑
Variables fisiológicas o estudios paraclínicos que deben realizarse en el adulto con diagnóstico de esquizofrenia
| Estudio | Periodicidad |
|---|---|
| Perímetro abdominal | Al inicio del tratamientoPrimer año cada tres mesesDel segundo en adelante dos veces al año |
| Glicemia en ayunas | Al inicio del tratamientoA los tres meses si hay cambio en el tratamientoCada seis meses para pacientes jóvenes menores de 45 añosAnual para mayores de 45 años |
| Perfil lipídico (colesterol total, LDL, HDL y triglicéridos) | Al inicio del tratamientoCada seis meses para AP atípicosControl anual para otros AP |
Recomendación 2. Los pacientes adultos con diagnóstico de esquizofrenia que reciben tratamiento con antipsicóticos (AP) deben ser evaluados con los estudios enumerados en la tabla 6 y en la periodicidad establecida. ↑↑
Punto de buena práctica 1. De acuerdo con la clínica del paciente adulto con diagnóstico de esquizofrenia, el MD puede solicitar otros estudios paraclínicos. √
Conflictos de interésLa declaración de intereses y evaluación de los mismos se presenta en el anexo 3 de la guía completa que se puede consultar en la página web (gpc.minsalud.gov.co). Los autores no declararon conflictos de interés relacionados con el tópico de artículo.
Al Ministerio de Salud y Protección Social y al Departamento Administrativo de Ciencia, Tecnología e Innovación (COLCIENCIAS), por la financiación para el desarrollo de la guía mediante Contrato 467 de 2012 suscrito con la Pontificia Universidad Javeriana.
Al personal de soporte administrativo para el desarrollo de la guía.
Dirección y coordinación
Carlos Gómez Restrepo (Líder), Adriana Patricia Bohórquez Peñaranda (Coordinadora)
Equipo Metodológico
Jenny García Valencia, Ana María De la Hoz Bradford, Álvaro Enrique Arenas Borrero
Asistentes de investigación
Mauricio José Avila Guerra, Nathalie Tamayo Martínez, Maria Luisa Arenas González, Carolina Vélez Fernández, Sergio Mario Castro Díaz.
Equipo Temático
Luis Eduardo Jaramillo, Gabriel Fernando Oviedo Lugo, Angela Vélez Traslaviña,
Luisa Fernanda Ahunca
Equipo de Evaluación Económica
Hoover Quitian, Jair Arciniegas, Natalia Castaño
Equipo de Implementación
Natalia Sánchez Díaz, Andrés Duarte Osorio
Expertos de la Fuerza de Tarea Ampliada
Ana Lindy Moreno López, Edwin Yair Oliveros Ariza, Maribel Pinilla Alarcón
Usuarios
Gloria Nieto de Cano, Marisol Gómez, Gloria Pinto Moreno
Equipo de soporte administrativo
Carlos Gómez Restrepo, Jenny Severiche Báez, Marisol Machetá Rico
Equipo de coordinación metodológica y editorial
Ana María De la Hoz Bradford, Carlos Gómez Restrepo
Equipo de comunicaciones
Mauricio Ocampo Flórez, Pedro Mejía Salazar, Carlos Prieto Acevedo
Marisol Machetá Rico, Jenny Severiche Báez, Paola Andrea Velasco Escobar
Equipo de coordinación general alianza CINETS
Carlos Gómez Restrepo, Rodrigo Pardo Turriago, Luz Helena Lugo Agudelo
Otros Colaboradores
Dr. Carlos Alberto Palacio Acosta, Dr. Alexander Pinzón, Dr. Omar Felipe Umaña
La Guía de práctica clínica para el diagnóstico, tratamiento e inicio de la rehabilitación psicosocial de los adultos con esquizofrenia completa fue desarrollada por el grupo que aparece en el anexo de este artículo. Este artículo-resumen fue redactado por los integrantes del grupo que se mencionan bajo el título. La fuente principal del documento es la guía, aclaramos que algunos apartes fueron tomados textualmente del texto de la guía pues no requerían ajustes o modificaciones. Financiación: El desarrollo de la Guía de Atención Integral fuefinanciado por el Ministerio de Salud y Protección Social y por el Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias), mediante Contrato 467 de 2012 suscrito con la Pontificia Universidad Javeriana. Convocatoria 563 de 2012 de Colciencias (Conformación de un banco de proyectos para el desarrollo de Guías de Atención Integral (GAI) Basadas en Evidencia), fue elegido por el Consejo del Programa Nacional de Ciencia y Tecnología de la Salud, el proyecto fue liderado por la Pontificia Universidad Javeriana, en alianza con la Universidad de Antioquia y la Universidad Nacional de Colombia (Alianza CINETS).
En el protocolo de recomendaciones número 2 se presentan en detalle la búsqueda, la evidencia incluida y su calidad, así como una síntesis de las conclusiones de los hallazgos descritos en el protocolo 2.
Obesidad fue definida como una circunferencia abdominal de más de 102 cm en hombres y de más de 88 cm en mujeres según criterios ATP.