Las reflexiones que se hacen en este artículo se deben al incremento de esta enfermedad. Las consideraciones que se tienen de ella desde su diagnóstico inicial son mínimas y parece que, a medida que pasa el tiempo, aumenta su prevalencia en la comunidad. Las secuelas que el pie diabético produce son devastadoras desde el punto de vista de las complicaciones médicas para el paciente, la calidad de vida, los problemas sociales, laborales y el gran costo financiero que producen.
Por lo tanto, de acuerdo con estudios anteriores donde de manera separada se nos dieron a conocer los daños producidos por la diabetes en el pie y el desarrollo de su fisiopatología, se presenta esta revisión con el objetivo de llegar a lograr una presencia cada vez mayor en estamentos universitarios y organizaciones no gubernamentales para establecer programas de salud pública para el manejo de esta patología.
The reflections that are made in this paper respond to the increase of this disease in the community. The considerations about it from its initial diagnosis are minimal, and it seems that as time passes, increases its prevalence in the community. Sequels that diabetic foot produces are devastating for the patient from the standpoint of medical complications, quality of life, social behavior, work behavior and great financial costs when these complications occur.
Therefore, according to previous studies, we get to know the damage caused by diabetes in the foot, and the development of the pathophysiology of them. This review is presented with the aim of reaching a presence each increasing in university bodies and NGOs in order to promote the establishment of public health programs for the management of this condition.
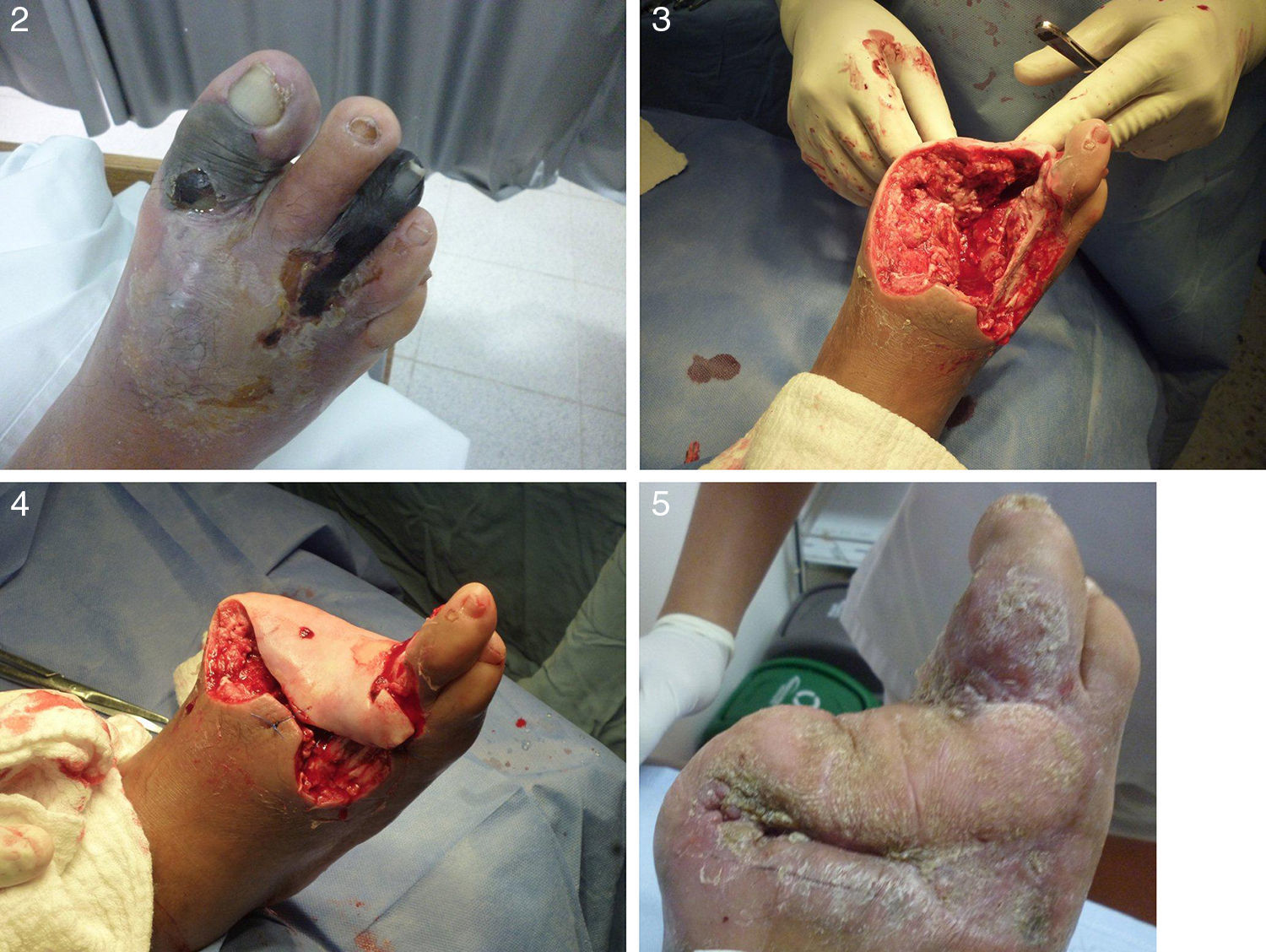
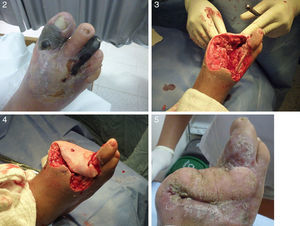
La diabetes es, en general, una enfermedad que tanto para los médicos generales como para los especialistas en diversas ramas médicas pasa hasta cierto punto inadvertida y tendemos a contemporizar demasiado con ella y con sus complicaciones debido a lo larvado de su curso. Sin embargo, a los ortopedistas nos llegan los pacientes diabéticos con complicaciones devastadoras, con tratamientos inadecuados y generalmente cuando el paciente ha desarrollado un pie diabético con úlceras intratables o de difícil manejo, que en la gran mayoría de casos terminan en amputación del miembro. Por lo tanto, es necesario llamar la atención sobre esta patología, que ha sido infravalorada médicamente. (figs. 1 y 2)
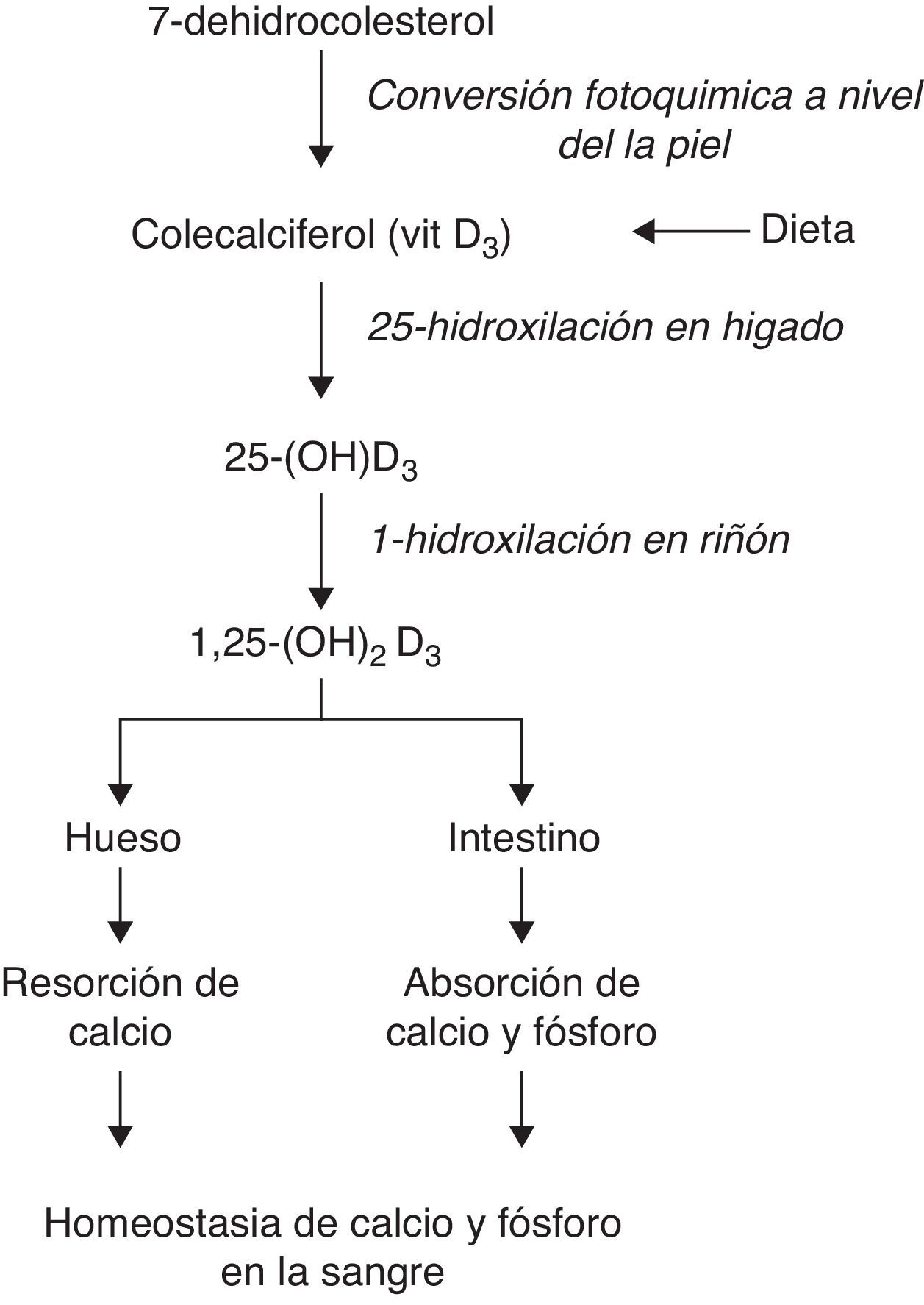
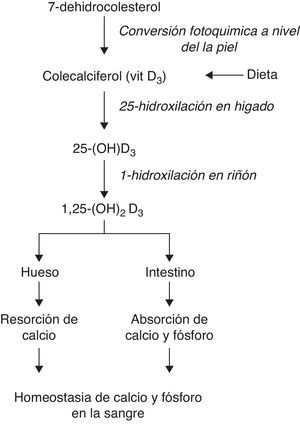
Metabolismo de la vitamina D y sus funciones biológicas clásicas34–46.
Desde el punto de vista epidemiológico revisamos algunos casos de prevalencia, modalidades diagnósticas y complicaciones asociadas en algunos países de Latinoamérica.
ArgentinaLa prevalencia de diabetes mellitus (DM) en Argentina es el 8% de la población adulta y el 50% no tiene diagnóstico. En el estudio multicentricéntrico PRAMUDIA se detectaron complicaciones crónicas en el 43,9% de los pacientes con DM de tipo 1, en el 51,8% de aquéllos con DM de tipo 2 y en el 69% de los que tenían DM de tipo 2 tratados con insulina. Se halló polineuropatía diabética en el 34,7% de la población y las personas con DM de tipo 2 con tratamiento con insulina fueron las más afectadas (48%). Se detectó incluso en DM de tipo 2 con 1 año de diagnóstico. La macro y microangiopatía, la dislipidemia y la hipertensión arterial serían complementarias al componente metabólico en la patogenia de la polineuropatía diabética (PND).
BrasilLa prevalencia de la DM en Brasil fue el 7,6% de la población adulta en el área urbana y el 11% en la población general. Una encuesta nacional determinó que el 58,2% padecía complicaciones en los pies. En el año 2005, la Sociedad de Diabetes de Brasil (SDB) concluyó que al 65% de los pacientes diabéticos no se les había realizado exploración de los pies.
Los datos epidemiológicos variables se deben a la falta de uniformidad del diagnóstico: el 30% en el hospital y el 10% en atención primaria tienen neuropatía diabética. En la década de 1980, la neuropatía diabética sensitiva (NDS) se diagnosticó en el 50,9% de los pacientes. Otros datos recientes, basados en la NDS, se encontraron con unas cifras del 29,3, el 45 y el 48%.
Según los criterios de la Asociación Latinoamericana de Diabetes (ALA, 2005), el 68,9% tenía ND y el 32,4% presentaba pie de Charcot mientras que al 60% con DM de tipo 1 se les diagnosticó neuropatía autonómica cardíaca y al 80%, ND.
ColombiaLa DM afecta a 1.200.000 personas. Se carece de datos epidemiológicos sobre la PND.
La constante es la ausencia de exploración y diagnóstico. Hay dificultad para disponer de monofilamentos de 10g de presión (Semmes Wenstein 5.07). Existe además el inconveniente de que los conocimientos sobre los mecanismos patogénicos de la PND son limitados.
ChileEn el país hay 700.000 diabéticos, de los cuales el 1% tiene DM de tipo 1 y no hay datos sobre tasa de ND. La diabetes es la primera causa de amputación y las hospitalizaciones por pie diabético duplican los días/cama (14,2) frente a otras complicaciones de la DM (6,7 días/cama).
Sólo el 63% de los pacientes con DM presentaba examen neurológico y el 36,6% corría un alto riesgo. En el área urbano-rural, el 37,9% tenía evaluación del pie y el 1,1% tenía lesiones en éste. En el año 2005, de los 13.816 pacientes con lesiones del pie por DM, el 13% requirió amputación.
MéxicoEn México, la DM ocupa el primer lugar en número de defunciones por año, con más de 60.000 muertes y 400.000 casos nuevos anuales. En el 2004, se registraron 65.662 egresos hospitalarios con DM, de los cuales 12.681 se debían a hospitalizaciones por pie diabético con 5.327 amputaciones. En 2008 se realizaron 6.223 amputaciones en instituciones sanitarias privadas. Los egresos hospitalarios por pie diabético se incrementaron el 10% entre 2004 y 2005. Las amputaciones por diabetes también aumentaron el 4% en el mismo período.
VenezuelaEn este país, la epidemiología de la PND en la población diabética no se ha estudiado. Hasta el 4,5% de los pacientes en el momento del diagnóstico de DM2 ya presenta signos y síntomas de neuropatía periférica sensorial (NPS). La ND es la principal responsable de amputaciones de los 30 a los 65 años: el 36,4% corresponde a pie diabético neuropático; el 15,6% a pie diabético ateroesclerótico, y el 48%, a pie diabético mixto, dependiendo de cuál de los dos predomine1.
En el año 2003 había 194 millones de diabéticos en todo el mundo y se espera que para el año 2025 sean 333 millones de personas, lo cual representa un incremento del 62% en la prevalencia de la enfermedad.
Historia natural de la diabetes en las extremidades inferioresExiste un trastorno de los pies provocado por el daño de las arterias periféricas que irrigan el pie y daño de los nervios periféricos e infecciones. Debido a la oclusión de las arterias que llevan sangre a los pies se produce gangrena.
El pie del paciente diabético es muy sensible a cualquier forma de traumatismo, y el talón y las prominencias óseas resultan especialmente vulnerables.
Los daños a los nervios periféricos de las extremidades provocan trastornos sensoriales, úlceras de la planta del pie y atrofias musculares.
En los pacientes diabéticos es frecuente que las lesiones propias del denominado pie diabético trascurran sin dolor, debido a lo cual se suele agravar la lesión antes que el paciente solicite ayuda especializada.
Para esto debemos considerar las neuropatías diabéticas (ND) y la polineuropatía diabética (PND) es la complicación de mayor prevalencia en la diabetes mellitus y uno de los principales determinantes del temido pie diabético (PD). Según análisis y estudios de la Organización Panamericana de la Salud (OPS), la prevalencia de ésta en Latinoamérica durante los próximos 15 años se incrementará en 64 millones de diabéticos (Guía de la PND Neurald, 2010).
¿Qué es la neuropatía?Es un síndrome neurológico que incluye todas las enfermedades inflamatorias y degenerativas que afectan el sistema nervioso periférico.
Los rasgos principales de presentación incluyen alteraciones motoras y sensitivas diseminadas de los nervios periféricos.
La polineuropatía se refiere a enfermedades primarias que comienzan en el parénquima nervioso y se inician por causas tóxicas, metabólicas o vasculares.
¿Cómo se produce el dolor neuropático?Se sabe que hay daño tisular actual o potencial, por lo que conceptualmente puede tratarse de un dolor nociceptivo y neuropático.
El dolor nociceptivo es una respuesta fisiológica experimentada secundaria a la activación normal de nociceptores (mecánico o térmico-químico).
El dolor neuropático es una respuesta a una lesión primaria o disfunción del sistema nervioso periférico o central y, por lo tanto, asociado a trastornos motores y sensitivos. Su localización puede ser superficial o profunda y a veces empeora con el movimiento. Este dolor puede ser espontáneo, es decir, estímulo-independiente o evocado, estímulo-dependiente o relacionado.
El dolor espontáneo es continuo, con sensaciones intermitentes y/o de tipo de descargas eléctricas, con frecuentes parestesias y disestesias. En el plano semiológico es muy sugerente porque la parestesia es una sensación anormal, espontánea o provocada, pero no desagradable y la disestesia es lo mismo, pero con un componente desagradable.
Se define la hiperalgesia como la respuesta dolorosa aumentada a un estímulo normalmente doloroso que se origina en las fibras aferentes C y A delta.
La alodinea es la sensación dolorosa provocada por un estímulo normalmente no doloroso y tiene relación con las fibras aferentes alfa y beta.
MecanismosSe deben considerar como multifactoriales porque pueden ser tanto centrales como periféricos sin que ninguno de ellas se encuentre en forma integral en la fisiopatología.
Los mecanismos periféricos son: sensibilización de nociceptores, generación de impulsos espontaneaos ectópicos en el axón, aumento de la sensibilidad mecánica y/o química del axón periférico.
Los del ámbito central son los mecanismos que llevan al defecto de liberación central de nociceptores y la sensibilización de neuronas del asta posterior.
Este dolor continuo se relaciona con la sensibilización del nociceptor periférico, con impulsos ectópicos de fibras C y la pérdida de la inhibición central.
La neuropatía diabética puede ser simétrica o asimétrica, así como mononeuropatía dolorosa o amiotrófica diabética (síndrome de Bruns-Garland), que es una neuropatía asimétrica proximal dolorosa de extremidades inferiores, con compromiso del plexo radicular.
Dolor neuropáticoCausas periféricas: lesiones traumáticas; causas metabólicas; carácter infeccioso; cáncer; por toxinas, alcohol o fármacos; causas vasculares, o nutricionales. Causas centrales: ictus; lesiones medulares; esclerosis múltiple, o tumores4. Otras causas. Pueden ser VIH, lepra, sarcoidosis, poliartritis o artritis reumatoidea. Se producen porque atacan la mielina y hay mala transmisión de las raíces dolorosas al cerebro, además de la ruptura de las terminaciones nerviosas. Deben tenerse en cuenta las deficiencias nutricionales (B12 y E) y las paraproteinemias.
Otro grupo lo forman: enfermedad de Charcot-Marie-Tooth, enfermedad de Dejerine-Sottas (neuropatía motora y sensitiva hereditaria [NMSH] de tipo III), ataxia de Friedreich o porfiria y enfermedad de Refsum (NMSH de tipo IV).
Tratamiento del dolor neuropáticoDeben realizarse los siguientes pasos:
- 1)
Eliminar medicamentos productores del dolor neuropático.
- 2)
Parece que el topiramato ayuda en la restauración de los nervios dañados.
- 3)
Con poca intensidad debe utilizarse amitriptilina o nortriptilina (antidepresivos que aumentan la transmisión nerviosa del cerebro).
- 4)
En casos graves, debe emplearse codeína o metadona, morfina o tramadol.
- 5)
Deben emplearse anticonvulsivantes, gabapentina (ya en desuso) y pregabalina.
- 6)
Deben utilizarse antidepresivos inhibidores de la recaptación de la serotonina, como paraxetina, venlafaxina o dulosetina.
- 7)
Pueden emplearse esteroides3.
- 8)
Actualmente se encuentra el ácido tióctico, que es un gran antioxidante, diferenciándose de los conocidos porque es soluble en agua y en la grasa, o sea, hidrosoluble y liposoluble. Con esta propiedad le permite ser absorbido fácilmente y transportado a través de las membranas de las células. Esta capacidad le permite brindar protección contra los radicales libres tanto dentro como fuera de la célula mientras que otros antioxidantes únicamente proveen esta protección fuera de la célula.
- 9)
Además, puesto que la vitamina D produce el estímulo de las células B, activa las endopeptidasas y así convierte la proinsulina en insulina. Por esta razón y muchas más debe tenerse en cuenta entre los tratamientos de la diabetes.
La hiperglucemia que afecta los microvasos sanguíneos sería el desencadenante primordial de la PND. Las alteraciones principales son: la reduplicación de la membrana basal, la oclusión vascular que altera la barrera entre las fibras nerviosas, los microvasos del endoneurio y del perineurio. El patrón histopatológico es el descenso en la densidad de las fibras de predominio sensitivas, con degeneración axonal, desmielización y remielinización.
El estrés oxidativo posee un papel central en la patogénesis de las complicaciones diabéticas, incluyendo la PND. La hiperglucemia sostenida produce anormalidades moleculares por el aumento en la oxidación de glucosa y lípidos, y de esta manera genera la formación de productos avanzados de la glicación (AGE) y estrés mitocondrial. De esta forma ocasiona un elevado estrés oxidativo que daña el endotelio y genera la disfunción vascular, lo que favorece las complicaciones diabéticas.
Las células endoteliales están limitadas para metabolizar la hiperglucemia en la DM, lo que aumenta la actividad del sistema enzimático en las cuatro vías metabólicas de que dispone la célula para metabolizarla. Por ello aumenta la vía de los polioles (aumento de sorbitol, fructosa y reducción del mioinositol) con elevación del estado osmótico intracelular, del estrés oxidativo y una reducida defensa endotelial. La glucosamina y el exceso de los prooxidantes de las mitocondrias lesionan las hélices del ADN, la transcripción genética y las proteínas circulantes que, al alterar la matriz extracelular, facilitan la patología vascular. El estrés oxidativo ocasionado por un exceso de los factores oxidantes sobre los antioxidantes provoca de esta forma todo el daño biológico oxidativo celular.
La hiperglucemia intracelular sobreactiva la proteincinasa C (PKC). Ésta modifica la expresión de los genes y sobreproduce sustancias proinflamatoria y protrombóticas en las células endoteliales, con lo que aumentan las moléculas de adhesión en el plasma. El elevado estado oxidativo altera la producción del óxido nítrico y éste modifica el tono vascular. De esta forma se alteran el flujo sanguíneo, la permeabilidad vascular y la angiogénesis, lo que ocasiona oclusión capilar y fibrinólisis.
Diagnóstico de la PNDEl diagnóstico de la PND será de exclusión, por lo que se deberá:
- 1.
Diagnosticar la DM o intolerancia a la glucosa: con prueba de tolerancia a la glucosa de 2 horas ≥ 200mg/dl para la DM o de 140 a 199mg/dl para la intolerancia a la glucosa.
- 2.
Diagnóstico de PND con cuestionarios validados: se recomienda la escala del TSS (total symptomatic score) para el diagnóstico inicial y evolutivo, según la intensidad/gravedad de los síntomas.
Para el diagnóstico se deben utilizar el monofilamento (sensibilidad a la presión con monofilamento de 10g), algodón, alfileres, diapasón (sensibilidad vibratoria en el primer metatarsiano [diapasón de 128Hz]) y martillo de reflejos (reflejo aquíleo); fuerza muscular del tibial anterior y peroneo (caminar de punta y talón).
Se aceptó para el diagnóstico de PND la clasificación de Dick y Thomas (tabla 2), y fue aceptado el uso del monofilamento para el diagnóstico. El diagnóstico de PND debe contar al menos con dos pruebas positivas sensitivas y/o motoras (monofilamento+sensibilidad vibratoria o parestesias o reflejos)2.
Los criterios para el diagnóstico de PND incluyen:
- 1)
Síntomas típicos: ardor, dolor punzante, calambres, adormecimiento, alodinia o hiperalgesia. Con frecuencia aumentan por la noche y mejoran con la actividad física.
- 2)
Signos de déficit neurológicos: disminución o abolición simétrica de la sensibilidad distal (táctil, térmica, vibratoria y dolorosa) de los reflejos tendinosos distales y de la muscular distal (presentación tardía).
- 3)
Alteración electrofisiológica (no indispensable en la práctica clínica). Sólo se emplea para las fibras nerviosas largas mielinizadas sensitivas y motoras o en neuropatía avanzada. Los métodos psicofísicos son las herramientas para diagnosticar el estado de las sensibilidades térmicas y algésica. Permiten la exploración de la neuropatía de fibras pequeñas.
- 4)
Se insiste en la revisión de los pies en todas las visitas y una exploración física completa (que incluya fondo de ojo) al menos una vez al año, y consulta al especialista en caso de mononeuropatía, neuropatía asimétrica, mononeuropatía craneana, amiotrofia, neuropatía autonómica o si el diagnóstico es incierto o poco concluyente, o si modifica su presentación clínica durante la evolución.
Deberá establecerse con patología inmunitarias (gammapatías o mieloma); endocrinometabólicas (urémica, amiloidosis o hipotiroidismo); infecciosas (herpética, tabes o lepra); nutricionales (deficiencia del complejo B o alcoholismo); hereditarias (síndrome de Pierre-Marie-Tooth); tóxicas (fármacos [isoniacida, hidralazina, nitrofurantoína, disulfiram o vincristina] o metales [plomo u oro]), e inflamatorias (síndromes paraneoplásicos o patologías reumatológicas).
Presentación clínica de la PNDLa PND puede presentarse como un proceso doloroso agudo o crónico y/o como un proceso indoloro (pueden sobreponerse entre sí) con resequedad cutánea, úlcera plantar, deformidades y amputaciones. La más común es la dolorosa crónica, con disestesias de predominio nocturno (sensación de hormigueo, ardor, dolor punzante, etc.) que pueden remitir espontáneamente. Existe una forma dolorosa aguda durante el descontrol metabólico, con hiperestesias difusas y pérdida de peso.
Tratamiento actual de la PNDPor lo mencionado anteriormente, sin duda la prevención es la mejor modalidad terapéutica para la PND. Llevar los niveles de glucemia a valores lo más cercano posible a lo normal (incluyendo los picos posprandiales) y el tratamiento de las comorbilidades (dislipidemia, hipertensión arterial, tabaquismo, etc.), aunado a un plan alimentario equilibrado y a una actividad física aeróbica regular deberán fundamentarse como una parte primordial del tratamiento, cuyo objetivo final será: eliminar o reducir los síntomas y los signos para prevenir, retrasar o impedir la progresión de la PND.
Bases fisiopatológicas para el tratamiento de la PNDEl estrés oxidativo es un factor determinante para la patogénesis de la PND, por lo que es prioritario el control de la hiperglucemia.
La fuerte asociación entre la hiperglucemia y el desarrollo y gravedad de la PND se evidencia por su prevalencia en los pacientes con pobre control glucémico. Las metas para el control glucémico recomendadas por la Asociación Latinoamericana de Diabetes (ALAD) son (los valores están en mg/dl):
Las metas para el control glucémico son: glucemia en ayunas (normal: menor de 100; adecuado: de 70 a 120, e inadecuado: mayor de 120 [a]); glucemia de 1 a 2 horas posprandial (normal: menor de 140; adecuado: de 70 a 140 [b], e inadecuado: mayor de 140 [b]), y HbA1c (%) (normal: menor de 6 [c]; adecuado: menor de 6,5 [d], e inadecuado: mayor de 7 [d]).
En adultos mayores debido al riesgo de hipoglucemia, se sugiere que las metas sean menos estrictas:
- (a)
Riesgo de hipoglucemia en adultos mayores. Las metas deben ser menos estrictas.
- (b)
Glucemia posprandial. Hay menor riesgo de hipoglucemia.
- (c)
La HbA1c normal según el método de referencia es del 6,14%.
- (d)
las asociaciones internacionales de diabetes coinciden en que se baje a menos del 7% y que un valor más alto obligue a actuar para iniciar o cambiar una terapia.
Se ha demostrado que el buen control glucémico retrasa la aparición y progresión de complicaciones causadas por la DM1. Hasta el 30% de los pacientes con DM1 desarrolla ND; el pobre control glucémico facilita la aparición del dolor.
En los pacientes con DM2, la corrección de la glucemia se asoció a la mejoría en la percepción sensitiva. El estudio Steno evidenció una reducción del desarrollo de PND en pacientes con DM2 tratados en forma intensificada con antihipertensivos, hipoglucemiantes orales, ácido acetilsalicílico, hipolipemiantes y antioxidantes3–10.
Deficiencia de vitamina D en relación con algunos factores de riesgo para el síndrome metabólicoAunque se conocen muy bien las consecuencias que tiene la deficiencia de vitamina D sobre el sistema óseo, investigaciones recientes sugieren que niveles disminuidos de esta vitamina producen efectos adversos en el sistema cardiovascular, lo que es más evidente en individuos con hipertensión y en aquéllos con niveles de vitamina D <15ng/ml9. De hecho, estudios prospectivos han encontrado que la hipovitaminosis D aumenta notablemente la disfunción miocárdica y el consecuente fallo cardíaco10, y la mortalidad cardiovascular en el paciente con hemodiálisis11.
El síndrome metabólico combina una serie de factores genéticos y asociados al estilo de vida que aumentan la predisposición a eventos cardiovasculares.
Entre éstos se encuentran la hiperglucemia, la hipertensión arterial, la dislipidemia y la obesidad abdominal, los cuales pudieran estar relacionados (directa o indirectamente) con la deficiencia de vitamina D.
Diabetes mellitusExiste evidencia que destaca el rol fundamental que desempeña la vitamina D en la secreción normal de insulina, incluyendo un efecto directo sobre los receptores de vitamina D (VDR) en las células beta y uno indirecto, mediado por la existencia de proteínas fijadoras de calcio dependientes de vitamina D en los tejidos pancreáticos12. De hecho, se ha reportado que pacientes con deficiencia de vitamina D y con limitada secreción de insulina muestran una mejora en la síntesis de esta última una vez que la vitamina es suplementada en la dieta5. Esto mismo es coherente con otras investigaciones que aseguran el efecto benéfico que tiene la 1,25-(OH)2D3 sobre la función celular beta en animales en experimentación13.
La influencia ejercida por la vitamina D sobre la secreción de insulina puede seguir varias vías. Esta vitamina estimula las células beta mediante un incremento en las concentraciones intracelulares de calcio a través de unos canales de voltaje no selectivos, lo que produce una activación de las endopeptidasas dependientes de calcio y provoca un desplazamiento que facilita la conversión de proinsulina a insulina5. El calcio no sólo es necesario para la biosíntesis de insulina, sino también para la glicólisis de las células beta, lo que es esencial en la señalización de la concentración de glucosa circulante. La vitamina D también ejerce efectos en la secreción de insulina por estimulación de su síntesis mediante la activación de proteínas en los islotes pancreáticos14–16.
En comparación con los estudios sobre disfunción de las células beta, la relación entre los niveles disminuidos de vitamina D y la sensibilidad a la insulina es bastante limitada. Una asociación positiva se reportó en un grupo de 34 hombres, incluyendo 7 individuos con diabetes; además, la suplementación con vitamina D reduce las concentraciones de ácidos grasos libres en suero, lo cual sugiere un incremento en la sensibilidad a la insulina. De acuerdo con esto se ha sugerido que la deficiencia de vitamina D puede conllevar al desarrollo de diabetes de tipo 217,18.
La diabetes de tipo 2 se caracteriza por la existencia de alteraciones en la secreción de insulina y defectos en su reconocimiento (resistencia), lo que trae consigo intolerancia a la glucosa y un aumento de su síntesis endógena. Recientemente, la hipovitaminosis D se ha señalado como factor de riesgo para la intolerancia a la glucosa, aunque se ha encontrado un aumento en la secreción de insulina y una mejora considerable en la tolerancia a la glucosa en pacientes que reciben tratamiento suplementado con vitamina D y se ha establecido, por lo tanto, una asociación inversa entre los niveles de vitamina D y el riesgo a desarrollar diabetes de tipo 2. La inflamación sistémica asociada con la diabetes de tipo 2, mediada por citocinas que provocan la apoptosis de las células beta, también puede ser modulada por los efectos de esta vitamina19–21.
Cabe destacar que la prevalencia de este tipo de diabetes es elevada en pacientes con obesidad, la cual se relaciona con la hipovitaminosis D, dado que la vitamina es eficientemente depositada en las fuentes de almacenamiento de grasa corporal donde no es completamente biodisponible7, pudiera coadyuvar a la disminución de los niveles séricos de 25(OH)D y traería consigo resistencia a la insulina. Aunque esta hipótesis sería una explicación del porqué los pacientes a la larga pudieran desarrollar diabetes de tipo 2, está lejos de ser comprendida en su totalidad.
La deficiencia de vitamina D es más común en pacientes con diabetes de tipo 2 que con diabetes de tipo 1. No obstante, su posible rol en la génesis de esta última se ha dilucidado con mayor profundidad. En la diabetes mellitus de tipo 1, la 1,25-(OH)2D3 tiene notables efectos antiinflamatorios e inmunomoduladores que podrían ser de utilidad en su tratamiento22.
En condiciones experimentales, la vitamina D inhibe la proliferación y la función citotóxica de los linfocitos T. Cuando se añade a cultivos de células mononucleares periféricas (PMBCS), el 1,25-(OH)2D3 disminuye la proliferación y la síntesis de inmunoglobulinas y de citocinas, que incluyen la interleucina 1 (IL-1), IL-2, IL-6, IL-12, el factor de necrosis tumoral alfa (TNF-α) y el interferón gamma (IFN-γ), lo que implica una regulación de la respuesta Th1. Sin embargo, la 1,25-(OH)2D3 también promueve la producción de IL-4, IL-5 e IL-10, con lo cual promueve la activación de la respuesta Th2. Gracias a este cambio de respuesta de las células T se protege a las células beta de la lesión pancreática orquestada por las citocinas de la respuesta Th1. El 1,25-(OH)2D3 tiene la capacidad de disminuir la actividad presentadora de antígenos de los macrófagos hacia los linfocitos mediante la reducción de la expresión de moléculas del complejo mayor de histocompatibilidad de tipo II (MCH-II) en la superficie celular. Además, también podría proteger frente al desencadenamiento de la diabetes de tipo 1, mediante el estímulo y reclutamiento de las células T reguladoras CD4+ y CD8+ en el sitio de la lesión pancreática. Todas estas acciones en conjunto tienen como objetivo disminuir la respuesta inflamatoria y la inmunidad mediada por células propias de esta enfermedad23–28.
Hipertensión arterialExiste evidencia, a partir de varios modelos animales, que la vitamina D es importante en el control de la presión sanguínea y la hipertensión arterial. Krause et al. reportaron que pacientes hipertensos expuestos a radiación ultravioleta B (UVB) más de 3 meses tuvieron más del 180% de incremento en las concentraciones de 25-OHD3 circulante y un descenso de 6 mmHg en sus presiones sanguíneas diastólicas y sistólicas, resultados similares a los esperados si los pacientes hubiesen recibido tratamiento farmacológico para la hipertensión. El mecanismo exacto por el cual la radiación UVB mejora la presión sanguínea en estos pacientes adultos aún no está muy bien dilucidada. Una hipótesis interesante es la propuesta por Li et al. y por Xiang et al., en que, basados en estudios experimentales, indican que 1,25-(OH)2D3 participa en la regulación del sistema renina-angiotensina por supresión directa de la expresión del gen. De hecho, la sobreexpresión de renina puede ser producida en ratones salvajes mediante inhibición farmacológica de la síntesis de vitamina D329–32.
Otra propuesta que se maneja involucra la posible influencia de la vitamina D sobre el tono vascular y la hemodinámica cardiovascular, pues se observa que la vitamina D causa cambios rápidos en los pacientes con hipertensión esencial, pero no en los controles, lo que incrementa la resistencia vascular. Estos resultados están soportados en ensayos experimentales, en que el 1,25-(OH)2D3 aumenta la sensibilidad de la resistencia arterial a la norepinefrina en ratas hipertensas, pero no en las normotensas, y rápidamente mejora la fuerza arterial generada por modulación de la concentración intracelular del calcio33.
Determinación del grado de riesgo en las lesiones del pie diabéticoEl interés básico en disponer de una clasificación clínica de los estadios en que cursa el pie diabético responde a la conveniencia de articular los protocolos terapéuticos adecuados a la necesidad de establecer su valor predictivo en cuanto a la cicatrización de la úlcera. La clasificación de Wagner (Meggitt/Wagner) valora 3 parámetros: la profundidad de la úlcera, el grado de infección y el grado de necrosis. Existen los siguientes grados:
- -
Grado 0: no hay lesión; pie de alto riesgo.
- -
Grado 1: úlcera superficial que compromete todo el espesor de la piel, pero no los tejidos subyacentes.
- -
Grado 2: úlcera profunda, que penetra hasta ligamentos y músculos, pero no compromete el hueso ni la formación de abscesos.
- -
Grado 3: úlcera profunda complicada con celulitis o formación de abscesos, casi siempre con osteomielitis.
- -
Grado 4: gangrena localizada.
- -
Grado 5: gangrena extensa que compromete todo el pie4,7–9.
- 1.
Factores anatómicos:
- a)
Localización (zona de la herida inicial):
- a)
Falángica. Herida primaria en dígitos con o sin extensión al resto del pie.
- b)
Metatarsal. Herida primaria con o sin extensión al resto del pie.
- c)
Tarsal. Herida primaria en el centro o retropié (talón) con o sin extensión a todo el pie.
- a)
- b)
Aspecto topográfico
- a)
Dorsal o plantar.
- b)
Lateral.
- c)
Dos o más aspectos.
- a)
- c)
Número de zonas afectadas:
- a)
Una.
- b)
Dos.
- c)
Todo el pie. Heridas múltiples.
- a)
- a)
- 2.
Factores agravantes:
- a)
Isquemia (perfusión)
- 0.
Sin isquemia. Sin signos y síntomas de enfermedad arterial periférica. Pulsos pedio y/o tibial posterior palpables; índice tobillo-brazo (ITB): 0,90-1,2; índice dedo-brazo (IDB): >0,75; presión en tobillo o presión en dedo: >80mmHg; oximetría transcutánea de O2 (PtcO2): >80mmHg; registro dóppler de la onda trifásica, o cualquier otro estudio que demuestre perfusión normal.
- 1.
Leve. Con/sin signos y síntomas de enfermedad arterial periférica o pulsos pedio y/o tibial posterior disminuidos (los pulsos pueden estar ausentes por causa no isquémica; p. ej., por edema); ITB: 0,7-0,89; IDB: 0,60-0,75; presión del tobillo: 70-80mmHg; presión dedo 55-80mmHg; PtcO2: 50-60mmHg; registro dóppler de la onda bifásico, o cualquier otro estudio que demuestre isquemia leve. 2. Moderada. Pulsos pedio y/o tibial posterior disminuidos o ausentes; ITB: 0,50-0,69; IDB: 0,30-0,59; presión del tobillo: 55-70mmHg; presión del dedo: 30-54mmHg; PtcO2: 30-49mmHg; registro dóppler de la onda monofásica, o cualquier otro estudio que demuestre isquemia moderada. 3. Grave o crítica. Clínicamente se trata de un pie isquémico; Pulso pedio y/o tibial posterior ausentes; ITB: <0,5; IDB: <0,30; presión del tobillo: <55mmHg; presión del dedo: <30mmHg; PtcO2: <30mmHg; registro dóppler de la onda aplanada, o cualquier otro estudio que demuestre una isquemia crítica.
Nota sobre la isquemia. El sistema de evaluación escalonada o las pruebas no invasivas subsecuentes pueden confirmar o descartar resultados diagnósticos iniciales positivos o negativos. La flexibilidad de esta puntuación permite recalificar en diversos momentos y niveles de atención. La sospecha de isquemia exige la confirmación de ésta por un angiólogo o cirujano vascular (con experiencia en pie diabético) que, de ser posible, corrija el problema con cirugía endovascular o by-pass.
- 0.
- b)
Infección
- 0.
Sin síntomas ni signos de infección.
- 1.
Leve. Eritema de 0,5-2cm, induración, calor, dolor y descarga purulenta.
- 2.
Moderada. Eritema >2cm, abscesos, necrosis, fascitis, osteomielitis y/o artritis.
- 3.
Grave. Respuesta inflamatoria sistémica y/o hiperglucemia o hipoglucemia grave o de difícil control secundaria a la sepsis.
- 0.
- c)
Edema
- 0.
Sin edema.
- 1.
Localizado a el área perilesional.
- 2.
Todo el pie unilateral.
- 3.
Bilateral secundario a enfermedad sistémica.
- 0.
- d)
Neuropatía
- 0.
Sin neuropatía.
- 1.
Inicial. Disminución de la sensibilidad con el monofilamento de SW de 10g en 2/3sitios y de la vibratoria con diapasón de 128Hz en el hallux. Atrapamiento nervioso sintomático 2. Avanzada. Ausencia de sensibilidad: monofilamento y vibratoria.
- 2.
Grave. Neuroosteoartropatia diabética (NOAD) o enfermedad de Charcot.
- 0.
- a)
- 3.
Factores de afección tisular de la herida:
- a)
Profundidad
- 1.
Superficial. Úlcera que afecta el espesor de la piel.
- 2.
Parcial. Toda la piel, fascias, tendones, músculos y probable afección ósea superficial, sin osteomielitis.
- 3.
Total. Afección de todos los planos que incluyen hueso y articulación.
- 1.
- b)
Área (cm2)
- 1.
Pequeña. Igual o menor de 10.
- 2.
Mediana. Entre 11 y 40.
- 3.
Grande. Mayor de 40.
- 1.
- c)
Fase de cicatrización:
- 1.
Epitelización.
- 2.
Granulación.
- 3.
Inflamación.
Esta clasificación nos lleva a hacer más tratamientos conservadores que demasiado agresivos, como las amputaciones, sin tratar de hacer valoraciones a fondo que nos lleven a ofrecer mejor calidad de vida.
- 1.
- a)
Los grados del tratamiento local según el grado de ulceración (escala de Wagner) son:
- -
Grado 0. El pie está en riego, no existe lesión, la actitud terapéutica es de índole preventiva.
- -
Grado 1. El procedimiento terapéutico va direccionado a disminuir la presión sobre el área con úlcera. Generalmente no se presenta una infección.
- -
Grado 2. La infección está presente, por lo que es necesario obtener muestras para cultivo y tratamiento con infectología. Debe realizarse un desbridamiento, curación tópica y utilizar antibióticos y coadyuvantes. Dentro de los coadyuvantes más efectivos, novedosos y de fácil aplicación se encuentran los productos a base de iones de plata.
- -
Grado 3. Se caracteriza por la existencia de una infección profunda, con formación de abscesos, a menudo de osteítis. La intervención quirúrgica es necesaria.
- -
Grado 4. Los pacientes afectados requieren hospitalización urgente y valoración del componente isquémico, que en esta fase suele estar sumamente afectado. En términos generales, se procede a cirugía de revascularización para evitar la amputación o conseguir que ésta se pueda realizar a un nivel lo más distal de la extremidad.
- -
Grado 5. Gangrena de todo el pie; amputación.
En las guías colombianas para la prevención, diagnóstico y tratamiento del pie diabético hay un tipo de manejo y proceso de cicatrización de la úlcera en que la Dra. Análida Elizabeth Pinilla R. hace un análisis de la magnitud del pie diabético y manifiesta que «el proceso de cicatrización o curación de la úlcera es la respuesta multicelular del organismo al daño tisular para la continuidad y función del tejido u órgano».
Ejemplo. Paciente con 2 años de diabetes, de profesión odontólogo, con hemoglobina glicosilada de 16, a quien se le hizo revascularización y tratamiento ortopédico para evitar amputación infracondílea porque ése era su pronóstico. Se le efectuó tratamiento por ortopedia y actualmente se encuentra deambulando normalmente y ejerciendo su profesión. Hemos podido bajar los niveles de amputación en el 55% y nos acercamos a estadísticas mundiales en este momento.
Cómo evitar las lesiones del pie diabéticoA los pacientes de riesgo (ancianos y aquellos que tienen mala circulación) se les recomienda los siguientes cuidados habituales de los pies:
- -
Cada día deben lavarse los pies (aunque no deben empaparlos) en agua caliente, cuya temperatura haya sido probada previamente con la mano. Se deben secar con meticulosidad y prestar una atención especial a los espacios interdigitales (entre los dedos).
- -
Las uñas de los pies deben cortarse con cuidado. Los pacientes con mala vista o manos temblorosas deben pedir a otras personas que se las corten. Las uñas no deben ser más cortas que el extremo del dedo.
- -
Los pies se deben inspeccionar con frecuencia y buscar detenidamente zonas resecas y fisuras en la piel, sobre todo alrededor de las uñas y en los espacios interdigitales. Deben espolvorearse con talco si la piel está húmeda o recubrirse con crema hidratante si la piel está seca. Las plantas deben ser inspeccionadas con un espejo o por otra persona. Debe tenerse un cuidado especial con los callos y las durezas, que debe ser tratadas por un podólogo. No se deben utilizar antisépticos potentes (yodo) ni callicidas.
- -
Si aparecen ampollas o infecciones, debe consultarse inmediatamente al médico.
- -
No deben utilizarse bolsas de agua caliente. Es preferible utilizar unos calcetines.
- -
Pueden emplearse mantas eléctricas, pero debe apagarse antes de meterse en la cama.
- -
Los zapatos se deben ajustar bien (sin apretar) y ser confortables, dejando espacio para que los dedos descansen en su posición natural.
- -
Los zapatos nuevos deben calzarse progresivamente, cada vez durante un tiempo más largo.
- -
Se deben utilizar calcetines de algodón o lana, mejor que de nilón. Deben ser de la talla adecuada y no tener zurcidos ni costuras que puedan producir presiones. Deben cambiarse a diario.
- -
Caminar con los pies descalzos es peligroso ya que una pequeña herida puede tardar mucho en curarse.
- -
Dejar de fumar. El tabaco es muy perjudicial para los diabéticos porque produce vasoconstricción.
- -
Otro aspecto de la prevención que merece cierta atención es el diseño de calzado a medida para los diabéticos con pies muy vulnerables. Estos zapatos debe estar diseñados para redistribuir las fuerzas que soporta el pie.
Se recomienda cuidar las lesiones ya existentes de la siguiente manera:
- -
Se debe proceder a un examen detallado de ambos pies, con una inspección cuidadosa de los talones y los espacios interdigitales.
- -
El estado de la circulación y la sensibilidad deben evaluarse con detalle.
- -
Deben tenerse en cuenta la temperatura y el color de la piel, la respuesta vascular a la elevación del miembro, es decir, si se producen cambios en el color según la postura de la extremidad o el cambio en la cantidad de pelo de la pierna.
- -
Una fotografía en color es útil para juzgar la progresión de la falta de riego.
El tratamiento del pie diabético se basa en:
- -
Protección contra el daño que se asocia a la pérdida de sensibilidad causada por lesión de los nervios periféricos.
- -
Tratamiento de la infección que pueda aparecer.
- -
Mejoría de la circulación al evitar el uso de calzado o prendas ajustadas.
- -
Control médico de la diabetes, es decir, comprobar que los niveles de glucosa se encuentran dentro de los límites permitidos8.
- 1.
De acuerdo con el criterio del médico hay que hospitalizar cuando consulta a urgencias o cuando se revisa en consulta externa y su patología lo amerita. Si es valorado por consulta externa, se harán todas las recomendaciones, como manejo en casa, alimentación y cuidados generales para su extremidad.
- 2.
Valoración del paciente diabético.
2.1. Valoración por medicina interna, por endocrinólogo o médico general entrenado y/o supervisado por el especialista.
2.2. Valoración por Cirugía Vascular.
2.3. Valoración por Ortopedia para que determine causas o daños que presente. Podología en caso de necesitarse para conocimiento del paciente y la familia el buen manejo del pie, quienes darán las indicaciones de acuerdo con los grados de riesgo determinados en la escala de Wagner (estados 0 y 1) o la de San Elián.
2.4. Terapia de enterostomía cuando se llega a los estados del 2 al 5 de Wagner, a solicitud de Ortopedia o Cirugía Vascular.
2.5. En las amputaciones debe tenerse en cuenta el concepto de Cirugía Vascular y, además, incluir las indicaciones del fisiatra.
- 3.
El ortopedista debe interconsultar a Cirugía Vascular para ver viabilidades en cuanto a revascularización se refiere.
En caso de poder llevar a cabo algún tratamiento de éstos, hay que efectuarlo lo más pronto posible, previa valoración de Medicina Interna, con los criterios establecidos (exámenes, valoración por nutricionista y Hb glicosilada entre otras).
En caso de requerir procedimiento por Cirugía Vascular, deben proceder de manera pronta y oportuna de acuerdo con los criterios médicos.
- 4.
Una vez valorado por Medicina Interna y Cirugía Vascular, el ortopedista, de acuerdo con su concepto, debe realizar el tratamiento más indicado y tratar de conservar la extremidad.
- 5.
En caso de resecciones parciales (dedos, antepié, etc.) debe colocarse al paciente en terapia aspirativa para lograr una rápida limpieza y granulación, de acuerdo con el manejo de terapia de enterostomía. Se puede llevar a cabo terapia húmeda si la terapia de enterostomía lo decide. (En caso de cierre o afrontamiento de las úlceras ya desbridadas, no se procederá a terapia aspirativa.)
- 6.
Si la zona afectada está limpia y granulada, debe efectuarse el cubrimiento del área expuesta con colgajos, injertos libres o cualquier otro sistema que sea favorable al caso y en ocasiones de acuerdo con el criterio de Cirugía Plástica.
- 7.
Valoraciones periódicas de los especialistas involucrados con el paciente para que éste continúe en un tratamiento adecuado y completo de acuerdo con los síntomas, como la polineuropatía (PND).
Además hay que tener en cuenta los niveles de vitamina B y 25-hidroxivitamina D3.
- 8.
En caso de ser un estado 0 según Wagner o con úlcera refractiva, se debe hacer valoración urgente por Ortopedia para revisar radiografías y ver compromiso. Con esto se determina si se lleva a cabo osteotomía correctiva para minimizar el efecto o se envía para plantillas o zapatos especiales.
- 9.
Se debe incluir al familiar del paciente con indicaciones de manejo en casa, en cuanto a: 9.1. Alimentación (pautas dadas por la nutricionista).
9.2. Manejo de la extremidad:
9.2.1. Evitar resequedades (humectarse).
9.2.2. Manejo de uñas. Evitar hongos.
9.2.3. Evitar humedad interdigital (polvos medicados), como neufungina.
9.3. La medicación, que debe ser precisa para el manejo de su hiperglucemia, como su neuropatía y vasculitis.
- 10.
Insistir sobre las visitas periódicas a su médico y/o equipo de trabajo.
Aclaración. Debemos tener en cuenta que un mal perforante plantar puede estar causado por tabes, mielodisplasia, amiloidosis hausen (lepra) o por una afectación de los nervios periféricos y no sólo por diabetes47–50.
Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o individuos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.