El propósito de la revisión fue extraer de la bibliografía recomendaciones para el manejo del miembro fantasma doloroso en niños amputados por cáncer, resumidas en una propuesta de un manejo integral.
El síndrome doloroso del miembro fantasma se presenta en el 48-80% de los amputados, ocasiona deterioro de la calidad de vida, incremento del costo de la atención sanitaria y dificulta su rehabilitación. La fisiopatología de esta entidad incluye la interacción de mecanismos periféricos y el procesamiento anormal de la información en el sistema nervioso central.
Su manejo requiere intervenciones enfocadas a la prevención y tratamiento temprano. Las opciones farmacológicas incluyen gabapentinoides, opioides y anti-NMDA (N-metil-D-aspartato). En conclusión, no hay consenso en cuanto a su manejo. Los puntos clave incluyen el control óptimo del dolor previo a la cirugía, el manejo multidisciplinario con clínica del dolor, salud mental, trabajo social y rehabilitación como modelo de atención del paciente amputado.
Nivel de evidencia clínicaNivel IV.
The purpose of this review was drawn from literature recommendations for the management of phantom limb pain in children having cancer-related amputation, summarized in a comprehensive approach.
The phantom limb pain syndrome occurs in 48 to 80% of amputees, causes deterioration of the quality of life, increased health care costs and hinders their rehabilitation. The pathophysiology of this clinical entity includes the interaction of peripheral mechanisms and abnormal processing of the information in the central nervous system.
Its management requires intervention strategies focused on prevention and early treatment. Pharmacological options include gabapentinoids, opioids and anti NMDA. In conclusion, there is no consensus on management. Key points include optimal pain control before surgery, managing multidisciplinary pain clinic, mental health, social work and rehabilitation as standard of care in amputees.
Evidence levelIV.
El síndrome doloroso del miembro fantasma hace referencia a la sensación de dolor que se percibe después de una amputación en la extremidad ausente. En el Instituto Nacional de Cancerología, la causa más frecuente de amputación en los niños corresponde al tratamiento de tumores malignos óseos, los cuales alcanzan una proporción del 12,7% de todos los tipos de cáncer en esta población, seguida de tumores de tejidos blandos, como el rabdomiosarcoma, que se presenta en el 6,9% de los casos1. En los niños, el síndrome doloroso del miembro fantasma se reporta en los estudios entre el 50 y el 80% de los casos2,3 y genera consecuencias negativas que incluyen el deterioro importante de la calidad de vida de los pacientes afectados4, incremento en el costo de la atención médica y dificultades en el proceso de rehabilitación protésica5,6.
En los siguientes apartados se presenta una revisión de la bibliografía, producto de la búsqueda en las bases de datos de la biblioteca Cochrane Library, Dare y PubMed/Embase, de las cuales se extrajeron recomendaciones para el manejo del síndrome doloroso del miembro fantasma en niños amputados por cáncer, resumidas en una propuesta de enfoque integral para la prevención y manejo de esta entidad, el cual será implementado en la clínica de oncología pediátrica del Instituto Nacional de Cancerología.
MetodologíaSe realizó una búsqueda en PubMed/Embase con los términos MeSH “phantom limb pain, neoplasm” en población pediátrica (menores de 18 años), con la selección de artículos de revisión, metaanálisis y guías clínicas, sin encontrar resultados, por lo cual se amplió la búsqueda con una estrategia de bola de nieve, lo cual permitió seleccionar artículos de revisión de síndrome doloroso del miembro fantasma de varias etiologías, que los autores clasificaron según criterios de relevancia, interés y utilidad clínica. Posteriormente se extrajeron conclusiones de las lecturas y se elaboraron los flujogramas que se adjuntan en los anexos.
EpidemiologíaEn la población pediátrica, la información de que se dispone es limitada. Un estudio realizado en Canadá en 1998 reportó dolor de miembro fantasma en niños amputados por traumatismo y accidentes en el 48,5% de los casos en comparación con el 3,7% de casos en niños amputados por defectos congénitos7. En otro estudio realizado en Estados Unidos en el año 2003 en niños amputados por lesiones por quemaduras se reportó la existencia de dolor de miembro fantasma en el 38-52% de los casos7,8.
Al revisar la bibliografía disponible sobre amputaciones en niños y adolescentes que padecen de cáncer encontramos tres artículos en los últimos 17 años, todos ellos con un limitado número de pacientes: dos publicados en el año 1995, el primero por Smith y Thompson que lo reportaron en el 48% de los casos y el de Krane y Heller, en el 90%. La diferencia podría explicarse por diferencias metodológicas, como el empleo de cuestionarios de autorreporte en el segundo estudio.
El último estudio disponible publicado en el presente año corresponde a la experiencia del St Jude Children's Research Hospital, que realizó un estudio retrospectivo desde el año 2000 hasta el año 2007 que incluyó a 30 pacientes, en el cual se reportó dolor del miembro fantasma en el 76% de los casos con disminución progresiva en el reporte del síntoma al año de seguimiento al cabo del cual lo reportó el 10% de los pacientes9.
Factores de riesgoSe han estudiado los factores de riesgo que permitan el desarrollo de estrategias preventivas. En cuanto a la causa de la amputación, se ha observado la mayor incidencia del síndrome en pacientes con enfermedades vasculares, diabetes, amputaciones traumáticas10 y la menor incidencia en pacientes con deformidades congénitas. De igual forma, se ha propuesto la mayor incidencia en pacientes con dolor previo mal controlado, con dolor intenso en el miembro residual y la utilización de prótesis11.
Se ha reportado menor riesgo en amputaciones de miembros superiores y mayor riesgo en personas que presentan sensación de miembro fantasma persistente12. En los niños se ha propuesto la menor prevalencia de los síntomas del miembro fantasma en el caso de amputaciones por defectos focales del desarrollo de extremidades13.
En un estudio publicado en el año 200214 presentaron un análisis multivariado de los factores de riesgo para el desarrollo del síndrome doloroso del miembro fantasma y encontraron que los principales indicadores de dolor fueron la amputación de miembros inferiores (OR: 5,6; p<0,001) y la amputación bilateral (OR: 8,2; p<0,001). Otro factor importante identificado en el análisis univariado correspondió al dolor en la extremidad residual (OR: 3,9; p<0,001).
Los factores de riesgo psicosociales están implicados en la cronificación del dolor, tienen impacto sobre la funcionalidad de la persona y sobre el desarrollo de trastornos emocionales, como depresión. Los principales factores de riesgo de este tipo incluyen distorsiones cognitivas, como la ideación catastrófica y mecanismos de defensa maladaptativos15.
No hay consenso en la bibliografía sobre los instrumentos adecuados para su valoración e intervención, pero se reconoce la relevancia y necesidad del concurso de servicios de salud mental en la intervención y apoyo a estos pacientes y sus familias.
FisiopatologíaPara el desarrollo del síndrome doloroso del miembro fantasma se implica la participación de factores periféricos y centrales; los periféricos incluyen la lesión de los nervios de las extremidades, la formación de neuromas16, la actividad eléctrica anormal causada por conexiones efápticas o ectópicas, la sobrerregulación de canales de sodio en las neuronas implicadas, entre otros17.
Los factores periféricos generan actividad eléctrica anormal sobre el ganglio de la raíz dorsal y sobre las neuronas del sistema nervioso central, que provoca el fenómeno de sensibilización central, que conduce a la activación de mecanismos moleculares de expresión de oncogenes y cambio en la expresión fenotípica de la neurona.
Estos cambios genéticos y moleculares conducen, a su vez, a la producción de péptidos involucrados en la neurotrasmisión del dolor y a cambios en la expresión de receptores en la membrana celular donde desempeñan un papel importante la sobreexpresión del receptor del neurotransmisor excitatorio de glutamato, el NMDA.
El efecto del aumento de la actividad excitatoria ocasionado por el incremento en la expresión de receptores de glutamato se amplifica por la disminución en la actividad del neurotrasmisor inhibitorio, ácido gammabutírico (GABA), lo cual se ocasiona por la apoptosis de las interneuronas inhibitorias productoras de este neurotransmisor.
En la fisiopatología del síndrome doloroso del miembro fantasma, a nivel supratentorial, están implicadas diversas estructuras anatómicas del tálamo y la corteza somatosensorial por medio de mecanismos de plasticidad cerebral maladaptativos18.
El proceso de plasticidad cerebral consiste en la respuesta biológica normal y adaptativa que sucede en el sistema nervioso central después de una lesión, por medio de la cual se producen cambios en la arquitectura del sistema somatosensorial. Los cambios maladaptativos en este proceso de reorganización después de una amputación pueden conducir al desarrollo de este síndrome doloroso crónico y la generación de una «memoria cortical del dolor»19. Los cambios plásticos se han documentado experimentalmente en estudios de imágenes funcionales20–22.
También se ha implicado la participación del sistema nervioso autónomo por medio de la sensibilización de las fibras simpáticas periféricas que generan circuitos neurales anormales a nivel espinal que cronifican el dolor. A favor de la participación del sistema nervioso simpático se encuentra la observación que los bloqueos farmacológicos de los ganglios de la cadena simpática disminuyen la sensación dolorosa fantasma23.
Otra teoría propuesta por Melzack en 1990 consiste en la neuromatrix24, la cual consiste en la idea de la existencia de redes neurales a la altura del tálamo, la corteza somatosensorial, la formación reticular, el sistema límbico y la corteza parietal posterior, las cuales configuran el sustrato anatómico del «ser» y la «percepción del yo». El resultado de la actividad de estas zonas es una firma neural específica del individuo que le provee información acerca de su cuerpo y sus sensaciones. La neuromatrix está programada genéticamente, pero puede modificarse por la experiencia. La amputación, por tanto, originaría un flujo de información anormal sobre la neuromatrix que altera su funcionamiento y crea la sensación fantasma.
De la interacción de todos estos factores se desprenden las teorías más plausibles del desarrollo del síndrome del miembro fantasma. Ramachandran25 identificó, al menos, cinco factores clave en la generación de la experiencia dolorosa, que interactúan entre sí y se refuerzan: la formación de neuromas, el mapeo cortical, el esquema corporal y sus cambios posteriores a una lesión, la formación de «memoria del dolor» en la extremidad previa a la lesión y descargas neurales, producto de la lesión de los nervios.
Manifestaciones clínicasCasi la totalidad de las personas amputadas perciben sensaciones del miembro fantasma26, las cuales han sido descritas y clasificadas por Weinstein como cinéticas, cinestésicas y exteroceptivas27. Las sensaciones cinéticas se refieren a las sensaciones de movimiento en una extremidad fantasma, las cinestésicas hacen referencia a sensaciones que abarcan forma, tamaño y posición, y las exteroceptivas incluyen las sensaciones de frío, calor y parestesias, entre otras. El dolor en la extremidad fantasma se incluiría en esta última clase de sensación.
Los pacientes pueden experimentar dolor de tipo «quemante», «calambre» o parestesias. El dolor puede ser de intensidad intensa, puede ser continuo o en paroxismos, o de tipo incidental sin factor desencadenante específico. En algunos casos reportan que el dolor tiene las mismas características que presentaba antes de la realización de la amputación.
Todos los pacientes deben ser evaluados con escalas unidimensionales, como la escala análoga de dolor, visual, verbal o de rostros de acuerdo con su edad. También pueden ser utilizadas escalas conductuales en caso de niños de corta edad y escalas multidimensionales si se cuenta con personal entrenado en su uso.
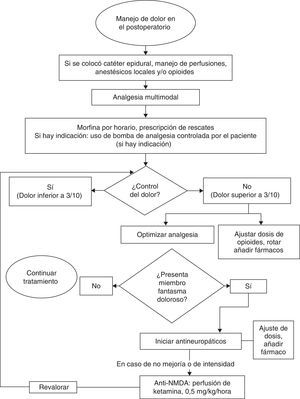
TratamientoEn el manejo del síndrome doloroso del miembro fantasma es de gran importancia el control óptimo del dolor antes de la amputación, lo cual podría prevenir la generación de «memoria» del dolor. Sin embargo, no todos los estudios avalan la relación entre el desarrollo del síndrome doloroso y la existencia de dolor previo. Se han propuesto esquemas de manejo preventivo sin que tampoco se haya podido establecer un consenso en su utilización. En el estudio del St. Jude Research Children Hospital, los autores atribuyen la disminución de la proporción de pacientes afectados por el síndrome al cabo de 1 año al uso habitual de técnicas de anestesia regional y al suministro de medicamentos, como el gabapentino antes de la cirugía.
Se han propuesto múltiples tratamientos para el síndrome del miembro fantasma sin que, a fecha de hoy, los estudios disponibles avalen una conducta en particular en todos los casos. La mayoría de la evidencia disponible se centra en reportes de caso y algunos ensayos clínicos con limitaciones metodológicas en el uso de controles. Así lo documenta una revisión sistemática realizada en Australia en el año 2002, con revisión de la bibliografía desde 1966-1999, donde se incluyeron 12 estudios clínicos, de los cuales sólo 3 fueron de asignación aleatoria.
Los tratamientos incluidos en los estudios abarcaron temas sobre manejo epidural temprano, bloqueos nerviosos, uso de calcitonina, uso de estimulación eléctrica transcutánea. Los autores concluyen que hay evidencia insuficiente para realizar una recomendación al respecto de estas técnicas y que existe una brecha entre la investigación y el manejo de los pacientes con síndrome doloroso del miembro fantasma.
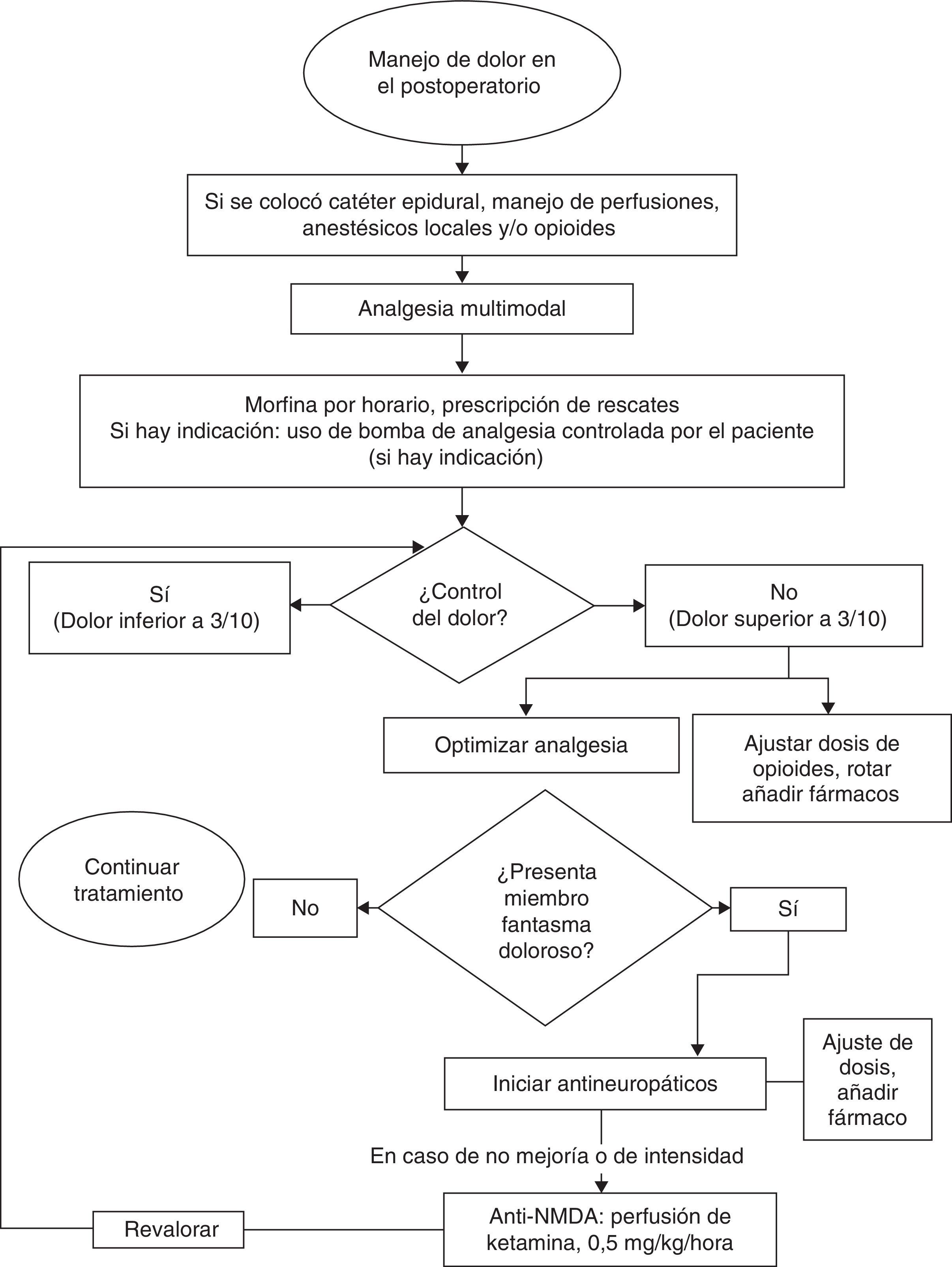
En cuanto al manejo farmacológico del síndrome se han propuesto intervenciones con analgésicos comunes antiinflamatorios no esteroideos (AINE), antidepresivos, anticonvulsionantes, opioides, betabloqueadores, antagonistas de NMDA, neurolépticos y relajantes musculares, entre otros. En la revisión sistemática realizada por The Cochrane Collaboration28, de 583 referencias, sólo 13 publicaciones cumplieron los criterios de selección de los autores. Los estudios incluyeron pacientes de todas las edades y concluyeron que la morfina, el gabapentino y la ketamina demostraron tener eficacia analgésica en el corto plazo. Sin embargo, estos hallazgos deben ser interpretados con precaución por el pequeño número de estudios y de pacientes incluidos en las muestras.
La publicación incluyó dos estudios sobre medicamentos como el gabapentino, que ha probado ser útil para el manejo del dolor neuropático crónico. Bone (2002)29 y Smith (2005)30 compararon el gabapentino frente a placebo en un seguimiento a 6 semanas. El primero reportó disminución significativa del dolor en brazos del gabapentino, pero no se encontraron diferencias significativas en otros desenlaces, como el patrón de sueño, uso de rescates ni funcionalidad. El segundo estudio no demuestra estadísticamente el beneficio del gabapentino. Sin embargo, si se combinan los resultados de estos dos estudios, el metaanálisis favorece el brazo experimental.
En la población pediátrica no se cuentan con estudios clínicos de asignación aleatoria que avalen el uso del gabapentino. Se dispone del reporte de casos que favorecen la utilización de este medicamento31. En mayores de 12 años se puede administrar a dosis de 300mg por vía oral 3 veces al día y se puede aumentar hasta 1.800mg al día por vía oral. En menores de 12 años se puede utilizar una dosis de 5mg/kg la noche del primer día, luego 5mg por vía oral cada 12 horas y después aumentar según la respuesta hasta 35mg/kg al día.
Otros medicamentos que se han utilizado habitualmente, como la amitriptilina, no muestran ningún beneficio en la revisión sistemática de Cochrane y, aunque la eficacia de la pregabalina en algunos tipos de dolor neuropático se ha confirmado, no hay estudios que evalúen la utilidad de este medicamento en esta entidad.
En cuanto a los opioides se encontraron dos estudios relevantes: uno evaluó la eficacia de la morfina oral comparada con la de placebo (Huse, 200132) y el otro comparó la morfina intravenosa frente a la perfusión de lidocaína y placebo (Wu, 200233). Los dos estudios demuestran una reducción estadísticamente significativa del dolor en el brazo de la morfina. En el estudio de Wu se calcula el NNT de los 2 para lograr una reducción del 30% del reporte de dolor.
Otros medicamentos utilizados incluyen los antagonistas del receptor NMDA. La revisión de Cochrane incluyó dos estudios sobre la utilidad de la ketamina: Nikolajsen (1996)34, en el cual se compara ketamina frente a placebo y el de Eichenberger (2008)35, con cuatro brazos en los cuales se compara la ketamina frente a calcitonina, la combinación de las dos y un brazo de placebo. En el primer estudio se reportó una disminución significativa en el reporte del dolor de los pacientes con perfusión a dosis de 0,5mg/kg/hora. En el segundo estudio se demostró también disminución significativa en el reporte de dolor en los brazos que incluyeron ketamina a dosis de 0,4mg/kg/hora.
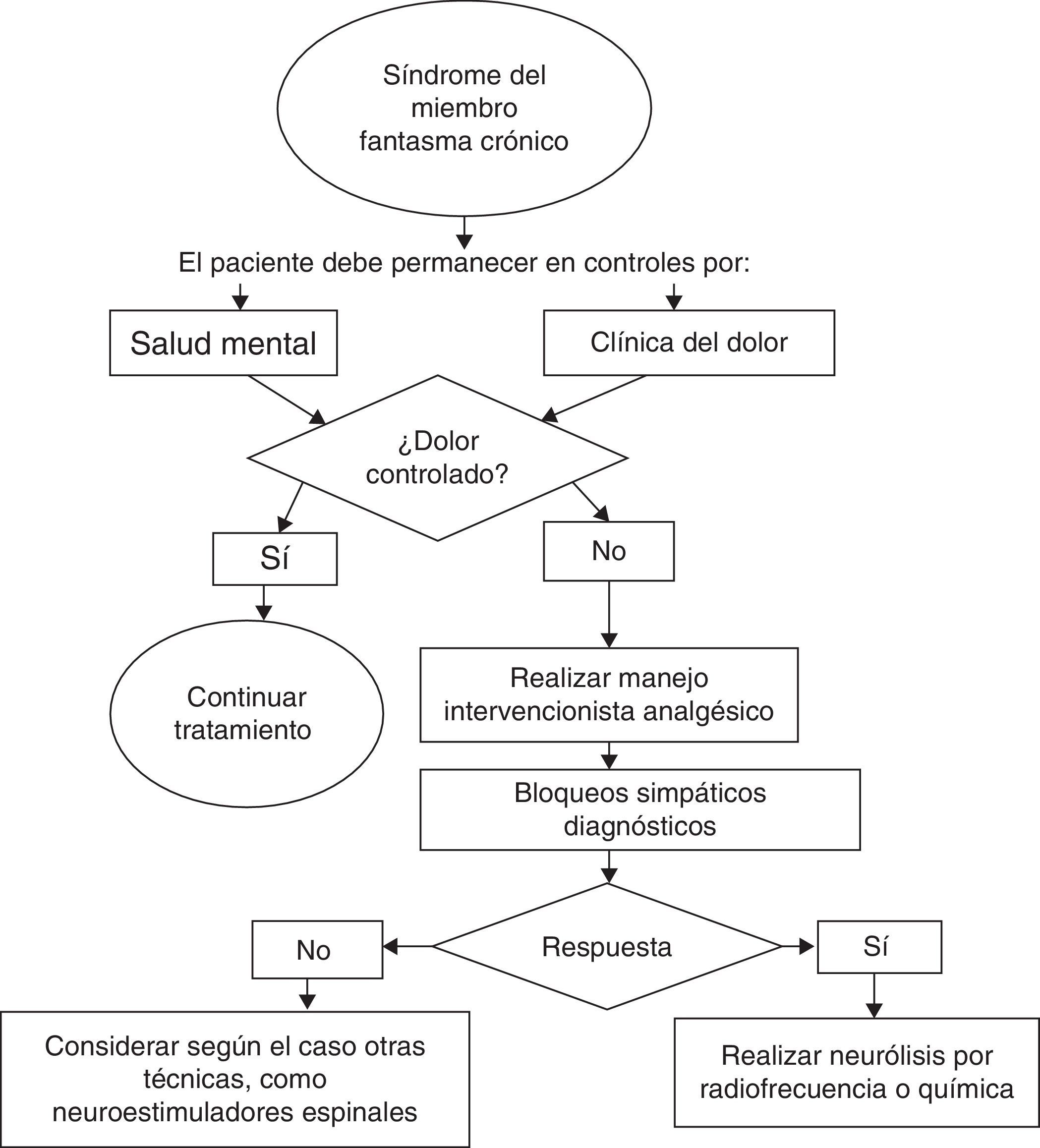
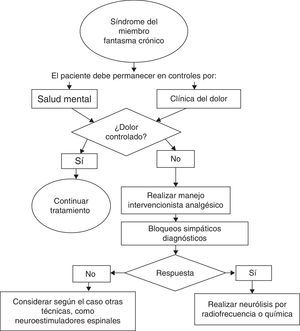
En cuanto a las técnicas analgésicas intervencionistas para el manejo del síndrome doloroso del miembro fantasma, se han publicado series de casos sobre bloqueos del sistema nervioso simpático. Una publicación del Johns Hopkins School of Medicine realizó en 17 amputados bloqueos simpáticos y los comparó con placebo, tras lo cual encontró reducción estadísticamente significativa en el reporte de dolor en el brazo experimental, pero sus beneficios no se mantenían a largo plazo.
Dentro de las técnicas intervencionistas propuestas se incluyen la realización de neurólisis por radiofrecuencia de los neuromas, la neurólisis por radiofrecuencia del ganglio de la raíz dorsal o técnicas de estimulación espinal sin que se cuente con un nivel evidencia que permita realizar una recomendación específica36. Los casos de dolor intenso y persistente deben analizarse de forma individual para proponer la mejor estrategia de intervención.
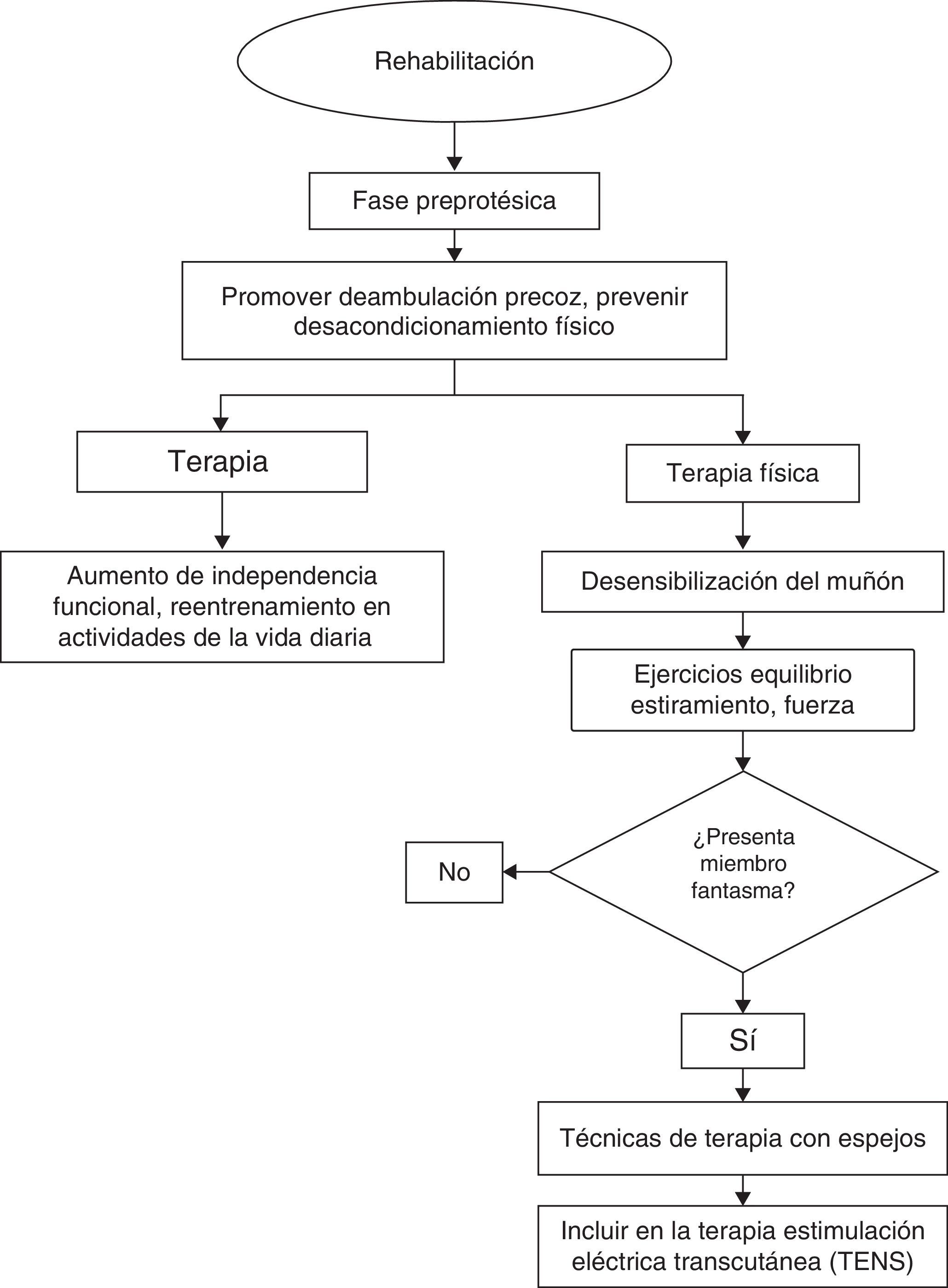
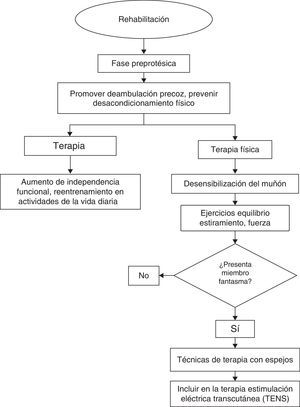
La intervención temprana de rehabilitación incluye terapia física, terapia ocupacional y el apoyo de técnicos en prótesis, y constituye un componente integral en el manejo de los pacientes amputados. Entre las terapias utilizadas se encuentran las técnicas de desensibilización del muñón, la realización de ejercicios de estiramiento, fortalecimiento muscular, la mejora de condiciones de equilibrio, propiocepción y la protetización temprana.
La rehabilitación integral se considera un modelo básico de atención, por lo cual todos los pacientes deben beneficiarse de su intervención37.
En rehabilitación para el tratamiento del dolor del miembro fantasma se ha utilizado la estimulación eléctrica transcutánea (TENS). El uso de TENS ha sido estudiado en series de casos. Esta terapia consiste en la aplicación de un estímulo eléctrico de baja frecuencia sobre la piel, que causa la estimulación de neuronas sensitivas a nivel central. En un reporte de caso se encontró que la estimulación con TENS en la extremidad sana sobre la región donde se experimenta dolor fue significativamente mejor que el placebo al reducir la sensación fantasma38.
Otro tipo de terapia empleada que ha mostrado beneficio para el control del dolor en estos pacientes es la terapia con espejos39–41, propuesta por Ramachandran en 1996. En este tipo de terapia se coloca un espejo cuyo reflejo es observado por el paciente en el lugar que correspondería a su extremidad amputada y se le pide que realice una rutina de ejercicios. El estudio de Chan (2007)42 reporta la disminución marcada de la intensidad dolorosa después de la realización de este tipo de terapia comparada con técnicas de visualización y de ejercicios con el espejo cubierto en el 60% de los individuos.
Por último, otro de los aspectos básicos considerados como modelo de atención hace referencia al concurso de servicios de salud mental; la amputación de una extremidad ocasiona una gran alteración de la imagen corporal con consecuencias psicológicas en todos los individuos que puede originar síntomas psiquiátricos y emocionales que merecen el seguimiento y acompañamiento por psicología o psiquiatría. Para el tratamiento del síndrome doloroso del miembro fantasma en estos pacientes se han utilizado técnicas cognitivo-conductuales por parte de psicólogos entrenados43,44.
Conclusiones y recomendacionesEl síndrome doloroso del miembro fantasma es una entidad clínica que se presenta con frecuencia en los niños amputados por cáncer. No existe consenso frente a su manejo y la bibliografía en el tema es escasa. De la revisión realizada se extrapoló información de varias etiologías y se extrajeron las siguientes recomendaciones para mejorar la atención del paciente al cual se le va a realizar una amputación.
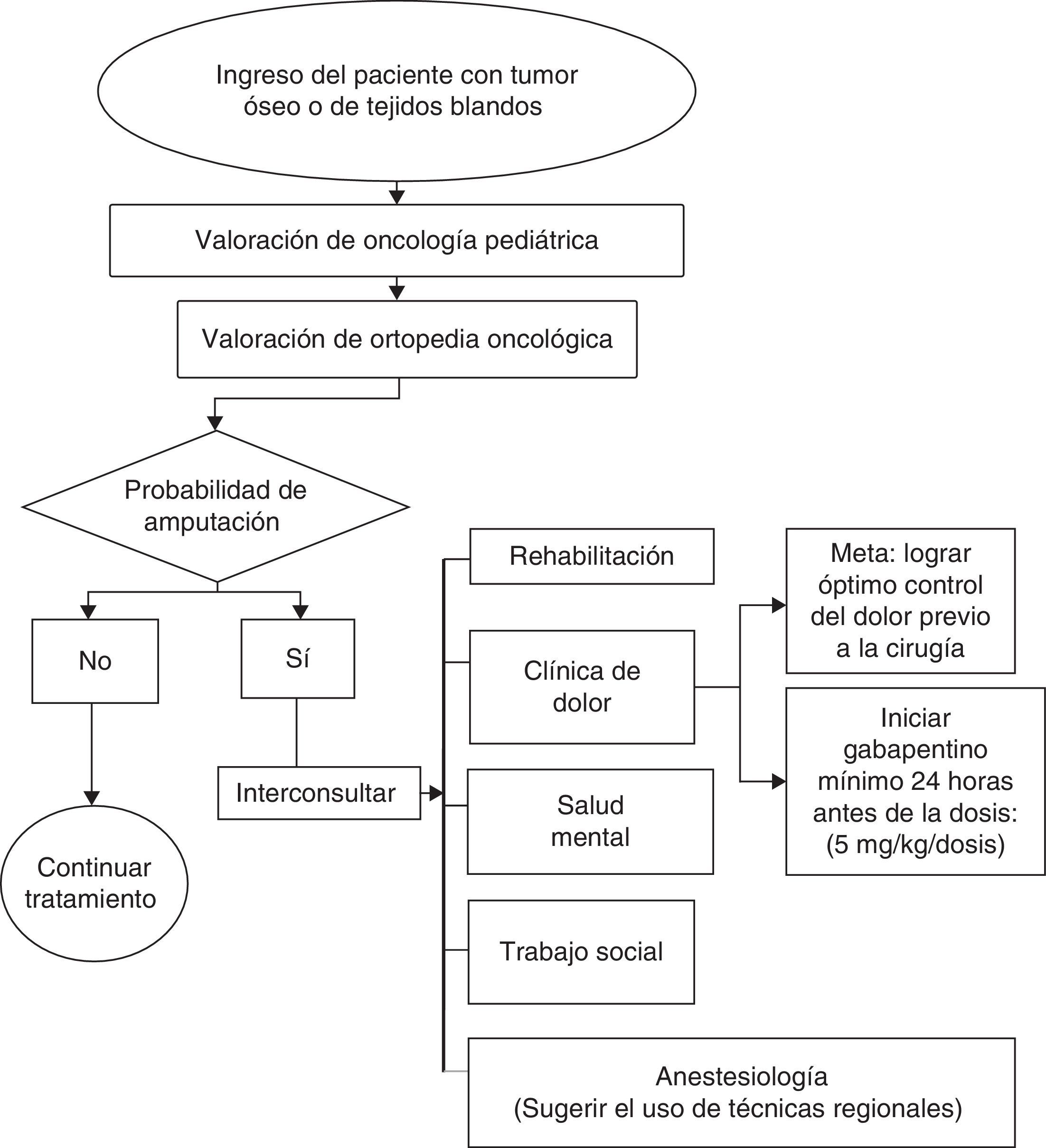
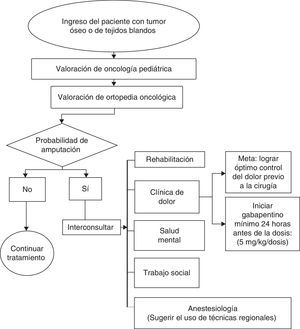
Para la prevención y tratamiento temprano del síndrome doloroso del miembro fantasma se requiere el trabajo coordinado de múltiples especialidades, lo cual incluye la participación de clínica del dolor, salud mental, rehabilitación, trabajo social, oncología, ortopedia y anestesiología (fig. 1).
Los servicios de rehabilitación deben iniciar tratamiento de forma temprana con el objetivo de mejorar la funcionalidad del paciente. Su intervención incluye, entre otros, reacondicionamiento físico, desensibilización del muñón, mejorar las condiciones de equilibrio, propiocepción, emplear terapias con espejos y TENS. En los casos en que esté indicada, debe realizarse protetización temprana (figs. 1 y 2).
El concurso de los servicios de salud mental es fundamental para la evaluación e intervención en los factores de riesgo psicosociales y el acompañamiento de los pacientes y sus familias con el objetivo de mejorar sus mecanismos de adaptación y afrontamiento, lo cual disminuye el riesgo de desarrollo de dolor crónico y alteraciones psiquiátricas (fig. 1).
Trabajo social debe valorar y acompañar todo caso de niños con riesgo social, dificultades administrativas y disfunción familiar (fig. 1).
Uno de los objetivos para la prevención y tratamiento precoz es lograr el óptimo control del dolor en el preoperatorio y posterior a la amputación. Las estrategias analgésicas deben ser de tipo multimodal e incluyen el uso de neuromoduladores, como el gabapentino, opioides y otros medicamentos, como bloqueadores de receptores de NMDA (figs. 3 y 4).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.