El objetivo de este trabajo es describir las características clínicas, gérmenes aislados en muestras tomadas en quirófano, tipo de procedimientos quirúrgicos y desenlaces en el tratamiento realizado a pacientes con pie diabético atendidos en nuestra institución.
Materiales y MetodosEstudio descriptivo retrospectivo observacional tipo serie de casos, describiendo resultados obtenidos de los cultivos tomados en cirugía, características clínicas según la clasificación de Wagner, número y tipo de procedimientos entre Enero de 2012 y Diciembre de 2016 por complicaciones derivadas de pie diabético.
ResultadosSe obtuvieron 58 pacientes, con edad media de 65 años, 69% eran varones. El estadio clínico en la evaluación prequirúrgica fue de 39.7% Wagner III, 37.9% IV; en la evaluación intraquirúrgica fue 32.8% III, 50% IV. Los gérmenes aislados, en 1er lugar 15.5% Escherichia Coli, de estas 11.9% era BLEE positiva y 3.6% multisensible; otro 15.5% Pseudomona Aeruginosa, variantes multirresistentes 10.7% productoras de carbapenemasas 1.2%, y resistentes a meropenem 1.2% y multisensibles 2.4%. 77.5% de los pacientes requirió cambio de antibiótico. Un tercio de los pacientes requirieron amputaciones mayores de los cuales 46.6% presentaban infecciones por gérmenes de multirresistentes.
DiscusiónEncontramos que los gérmenes predominantes son bacilos gram negativos en su mayoría multirresistente. Sugerimos la toma de muestras de manera intraquirúrgica previo al inicio de antibioticoterapia. Dado la flora bacteriana aislada en esta serie, al iniciar antibioticoterapia empírica se sugiere el uso de carbapenémicos.
Nivel De EvidenciA: IV
The main purpose of the study is to describe the clinical characteristics, micro-organisms isolated in specimens taken in the operating room, types of surgical procedures, and outcomes in treatments performed on patients with diabetic foot.
MethodsA case series study is presented, describing results obtained from cultures taken in surgery, clinical characteristics according to Wagner's classification, and number and type of procedures performed between January 2012 and December 2016 due to complications derived from diabetic foot..
ResultsThe study included 58 patients, with a mean age of 65 years, and 69% were men. The clinical stage in the pre-surgical evaluation was 39.7% and 37.9% Wagner III and IV, respectively, and during the operation it was 32.8% III, 50% IV. The isolated micro-organisms were 15.5% Escherichia Coli, of these 11.9% were ESBL positive and 3.6% multisensitive. Another 15.5% were Pseudomonas Aeruginosa, multiresistant variants 10.7%, producing carbapenemases 1.2%, resistant to meropenem 1.2%, and multiple sensitivity 2.4%. The large majority (77.5%) of the patients required a change of antibiotic. One third of the patients required major amputations, of which 46.6% had infections caused by multidrug-resistant germs.
DiscussionThe predominant micro-organisms found were multi-resistant gram negative bacilli. It is suggested taking specimens intraoperative prior to the start of antibiotic therapy. Given the bacterial flora isolated in this series, when starting empirical antibiotic therapy, the use of carbapenems is suggested.
Evidence Level: IV
Las infecciones graves del pie diabético son una de las principales causas de hospitalización en los pacientes diabéticos y con frecuencia conducen a la amputación menor o mayor del miembro inferior, lo que en ocasiones incluso arriesga la vida1,2.
Habitualmente, estas infecciones se desarrollan a partir de úlceras crónicas que se asocian a repetidos ciclos de tratamiento antibiótico y hospitalización. Hay 3 aspectos que pueden asociarse a un riesgo alto de aparición de microorganismos multirresistentes: Cronicidad, tratamiento antibiótico inadecuado y hospitalización3.
La infección con microorganismos resistentes a múltiples antibióticos puede aumentar la morbimortalidad, así como la duración de la estancia hospitalaria y los costos del tratamiento4–6.
El objetivo de este trabajo es describir las características clínicas, los gérmenes aislados en muestras tomadas en el quirófano durante los procedimientos quirúrgicos, el tipo de procedimientos quirúrgicos y los desenlaces en el tratamiento realizado a pacientes con pie diabético,
Materiales y MetodosPara describir las características clínicas, los gérmenes aislados en muestras tomadas en el quirófano durante los procedimientos quirúrgicos, el tipo de procedimientos quirúrgicos y los desenlaces en el tratamiento realizado a pacientes con pie diabético, se realizó un estudio descriptivo retrospectivo observacional tipo serie de casos en el que se detallan los resultados obtenidos de las muestras de cultivo tomado en salas de cirugía durante el acto quirúrgico, así como las características clínicas de los pacientes teniendo en cuenta la clasificación de Wagner para pie diabético, el número y tipo de procedimientos realizados por el Servicio de Ortopedia en el Hospital Universitario Mayor – Universidad del Rosario entre Enero de 2012 y Diciembre de 2016 por complicaciones derivadas de pie diabético. Se presentó y aprobó el protocolo de investigación por el comité de académico y de ética en el acta 1/2018 del Hospital Universitario Mayor.
Criterios de Inclusión
- •
Pacientes con diagnóstico de diabetes mellitus y pie diabético que tengan clasificación de Wagner reportado en la historia clínica.
- •
Pacientes que requirieron tratamiento quirúrgico.
- •
Pacientes en quienes se tenga reporte de toma de muestras de cultivo en salas de cirugía durante el desbridamiento quirúrgico.
- •
Pacientes atendidos en el Hospital Universitario Mayor Méderi entre el 1 Enero de 2012 y 31 de Diciembre de 2016.
Criterios de Exclusión
- •
Pacientes con necrosis de miembros inferiores secundarios a otras patologías diferentes a la diabetes mellitus.
- •
Ausencia de toma de cultivo.
Las variables estudiadas fueron:
- •
Edad
- •
Género
- •
Grado de pie diabético (clasificación de Wagner7)
- •
Germen aislado en cultivos
- •
Germen gramm positivo o gramm negativo
- •
Germen Aerobio, Anaerobio o Facultativo
- •
Antecedentes quirúrgicos en relación con pie diabético (amputaciones mayores/menores/desbridamientos)
- •
Tipo y número de procedimientos realizados al paciente durante la hospitalización (amputaciones mayores/menores/desbridamientos)
- •
Antibiótico inicial (empírico)
- •
Antibiótico final (antibioticoterapia dirigida)
- •
Número de días de antibiótico.
Para la identificación de los gérmenes fueron utilizados los siguientes equipos en el laboratorio de microbiología del Hospital Universitario mayor:
- •
Identificación y antibiogramas (Vitek 2xLs ® de Biomerieux) 8.
- •
Identificación espectrómetro de masas: (Vitek Ms ® de Biomerieux).
Para los puntos de corte de antibiótico se siguieron los parámetros (Clinical & Laboratory Standards Institute 2012, 2014, 2015 y 2016 respectivamente) CLSI 20129.
Estudio estadístico.Los estadísticos utilizados en la investigación de acuerdo con el tipo de variable son:
- •
Variables cuantitativas: media, desviaciones estándar
- •
Variable cualitativa Nominal: Estadísticos descriptivos como frecuencias y proporciones.
Se utilizará como paquete estadístico para analizar la información el software SPSS V.25 para Windows®.
ResultadosSe evaluaron a 192 pacientes con pie diabético que ingresaron a la institución en el periodo descrito, a los cuales se les realizo al menos un procedimiento quirúrgico, se recolectó la información de las historias clínicas, sin embargo, teniendo en cuenta los criterios de inclusión y exclusión para la investigación se obtuvieron 58 pacientes, la razón principal de exclusión fue la ausencia de toma de cultivos para aislamiento microbiológico.
La edad media de los sujetos estudiados fue de 65 años con rango entre los 42 a 83 años, el 69% de los sujetos eran varones y el 31% de los sujetos eran mujeres.
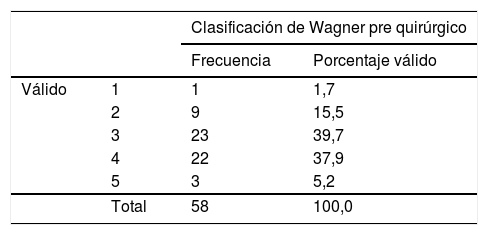
El estadio del pie diabético en la evaluación clínica prequirúrgica en su mayoría fue de un 39.7% Wagner III, 37.9% IV y en la evaluación intraquirúrgica fue de 32.8% III, 50% IV, tabla 1.
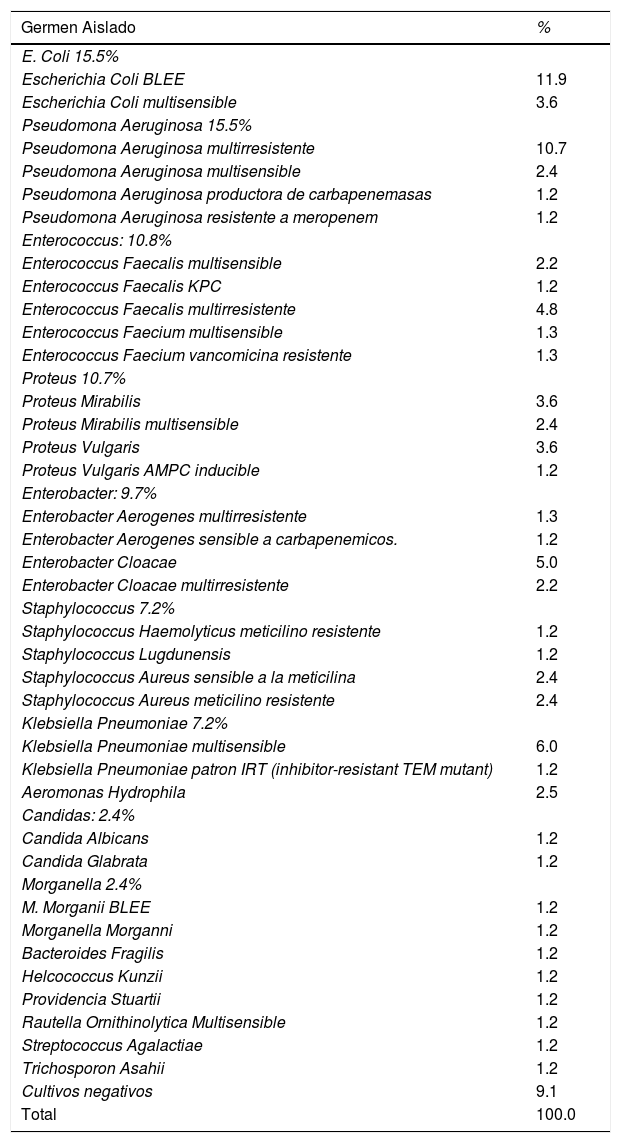
En cuanto a los gérmenes aislados en cultivos intraquirúrgicos, tenemos en el primer lugar 2 tipos de gérmenes, cada uno con 15.5% los cuales son la Escherichia Coli y la Pseudomona Aeruginosa, dentro de esta mayoría la Escherichia Coli BLEE fue encontrada en un 11.9% y multisensible 3.6% de los aislamientos; en cuanto al grupo de la P. Aeruginosa, las variantes multirresistentes 10.7% productoras de carbapenemasas 1.2%, y resistentes a meropenem de se presentaron en el 1.2%, multisensibles en un 2.4%. En segundo lugar, se encuentra los Enterococos encontrados en el 10.8% siendo más frecuente dentro de este grupo el E. faecalis multirresistente aislado en el 4.8%, en tercer lugar, también se aislo Proteus encontrado en un 10.7% dentro de estos los más frecuentes fueron el Proteus Mirabilis en el 6%; La Klebsiella Pneumoniae se aisló en el 7.2% siendo multirresistente el 6%. El Staphylococcus Aureus se aisló en el 4.8%, siendo MRSA el 2.4%, por último y menos frecuentes encontramos en el 1.2% el Streptococcus agalactiae, Candida albicans entre otros como se aprecia en la tabla 2, también se aprecia que en 8 pacientes los cultivos tomados fueron negativos a todos se les había iniciado antibioticoterapia empírica, 4 con Ampicilina Sulbactam, 2 con Cefepime, 1 con Oxacilina y 1 con Piperacilina Tazobactam + Vancomicina. Así mismo en esta serie encontramos que el 24% fueron infecciones polimicrobianas.
Gérmenes aislados y su porcentaje
| Germen Aislado | % |
|---|---|
| E. Coli 15.5% | |
| Escherichia Coli BLEE | 11.9 |
| Escherichia Coli multisensible | 3.6 |
| Pseudomona Aeruginosa 15.5% | |
| Pseudomona Aeruginosa multirresistente | 10.7 |
| Pseudomona Aeruginosa multisensible | 2.4 |
| Pseudomona Aeruginosa productora de carbapenemasas | 1.2 |
| Pseudomona Aeruginosa resistente a meropenem | 1.2 |
| Enterococcus: 10.8% | |
| Enterococcus Faecalis multisensible | 2.2 |
| Enterococcus Faecalis KPC | 1.2 |
| Enterococcus Faecalis multirresistente | 4.8 |
| Enterococcus Faecium multisensible | 1.3 |
| Enterococcus Faecium vancomicina resistente | 1.3 |
| Proteus 10.7% | |
| Proteus Mirabilis | 3.6 |
| Proteus Mirabilis multisensible | 2.4 |
| Proteus Vulgaris | 3.6 |
| Proteus Vulgaris AMPC inducible | 1.2 |
| Enterobacter: 9.7% | |
| Enterobacter Aerogenes multirresistente | 1.3 |
| Enterobacter Aerogenes sensible a carbapenemicos. | 1.2 |
| Enterobacter Cloacae | 5.0 |
| Enterobacter Cloacae multirresistente | 2.2 |
| Staphylococcus 7.2% | |
| Staphylococcus Haemolyticus meticilino resistente | 1.2 |
| Staphylococcus Lugdunensis | 1.2 |
| Staphylococcus Aureus sensible a la meticilina | 2.4 |
| Staphylococcus Aureus meticilino resistente | 2.4 |
| Klebsiella Pneumoniae 7.2% | |
| Klebsiella Pneumoniae multisensible | 6.0 |
| Klebsiella Pneumoniae patron IRT (inhibitor-resistant TEM mutant) | 1.2 |
| Aeromonas Hydrophila | 2.5 |
| Candidas: 2.4% | |
| Candida Albicans | 1.2 |
| Candida Glabrata | 1.2 |
| Morganella 2.4% | |
| M. Morganii BLEE | 1.2 |
| Morganella Morganni | 1.2 |
| Bacteroides Fragilis | 1.2 |
| Helcococcus Kunzii | 1.2 |
| Providencia Stuartii | 1.2 |
| Rautella Ornithinolytica Multisensible | 1.2 |
| Streptococcus Agalactiae | 1.2 |
| Trichosporon Asahii | 1.2 |
| Cultivos negativos | 9.1 |
| Total | 100.0 |
Los gérmenes gram positivos se aislaron en el 16.1% y los gram negativos 73.2%. Los gérmenes aerobios se aislaron en un 18% y los anaerobios en el 82%,
En cuanto a los antibióticos empíricos utilizados en estos pacientes tenemos que el más utilizado y fue la Ampicilina Sulbactam en el 29.3%, luego en el 8.6% antibióticos el Cefepime y Piperacilina tazobactam, además de combinaciones antibióticas de la cual tenemos Oxacilina + Clindamicina que se presenta en igual porcentaje. Sin embargo, al 77.5% de los pacientes se le realizó cambio de antibiótico dependiendo del tipo de germen aislado en los cultivos. En la tabla 3 esta descrito el antibiótico empírico iniciado, el germen o gérmenes aislados en los cultivos y la antibioticoterapia dirigida.
Antibiótico empírico, germen aislado y antibioticoterapia dirigida
| Antibiótico empírico | Germen aislado | Antibiótico dirigido |
|---|---|---|
| Piperacilina Tazobactam + Vancomicina | Bacteroides Fragilis, E Coli | Ciprofloxacina, Metronidazol |
| Ampicilina Sulbactam | E Coli BLEE, Pseudomona multisensible | Meropenem + Ciprofloxacina |
| Ampicilina Sulbactam | Aeromona Hydrophila | TMT + SMX |
| Ertapenem | Candida Albicans | Fluconazol |
| Ampicilina Sulbactam | E. Coli resistente a AMPC | Ertapenem |
| Oxacilina, Clindamicina | E. Coli BLEE | Ertapenem |
| Cefepime | E. Coli BLEE de baja producción, Pseudomonas Aeruginosa multirresistente. | Meropenem, Colistina |
| Ampicilina Sulbactam | E. Coli BLEE positivo | Meropenem, Vancomicina |
| Ampicilina Sulbactam | E. Coli multirresistente, Pseudomona Aeruginosa productora de carbapenemasas. | Doripenem + Polimixina B |
| Cefepime, Vancomicina, Meropenem | E. Coli. | Cefazolina |
| Cefepime | E. Faecalis, KPC, M. Morganii Blees, gérmenes multirresistentes | Polimixina B, Doripenem |
| Cefepime, Vancomicina | Enterobacter Aerogenes sensible a carbapenemicos. | Ertapenem |
| Oxacilina + Clindamicina | Enterobacter Aerogenes, Morganella Morganni, Streptococcus Agalactiae, Enterobacter cloacae, Proteus Vulgaris y S. Aureus. | Ampicilina Sulbactam |
| Ciprofloxacina | Enterobacter Cloacae | Ertapenem |
| Ampicilina Sulbactam + Vancomicina + Piperacilina Tazobactam | Enterobacter Cloacae multirresistente | Tigeciclina |
| Amoxicilina, Ampicilina Sulbactam | Enterobacter Cloacae multirresistente. | Ertapenem |
| Ampicilina Sulbactam | Enterobacter Cloacae, Enterococcus Faecalis. | Ertapenem |
| Clindamicina, Ciprofloxacina | Enterococcus Faecalis | Ampicilina Sulbactam |
| Cefepime | Enterococcus Faecalis multirresistente | Cefepime, Daptomicina, Amoxicilina |
| Oxacilina, Clindamicina | Enterococcus Faecalis multirresistente | Amoxicilina |
| Oxacilina, Clindamicina, Cefepime. | Enterococcus Faecalis multirresistente. | Ampicilina Sulbactam, Amoxicilina |
| Ampicilina Sulbactam | Enterococcus Faecalis multirresistente. | Ampicilina Sulbactam |
| Ampicilina Sulbactam | Enterococcus Faecalis. | Ciprofloxacina |
| Ampicilina Sulbactam, Clindamicina, Ciprofloxacina | Escherichia Coli multirresistente. | Cefuroxima |
| Clindamicina, Ampicilina Sulbactam, Piperacilina | Escherichia Coli. | Cefuroxima |
| Piperacilina Tazobactam | Helcococcus Kunzii | Cefazolina |
| Oxacilina, Clindamicina | Klebsiella Pneumoniae | Tigeciclina + Ciprofloxacina |
| Ampicilina Sulbactam | Klebsiella Pneumoniae | Ampicilina Sulbactam |
| Oxacilina, Clindamicina, Cefazolina | Klebsiella Pneumoniae | Vancomicina, Piperacilina Tazobactam |
| Ampicilina Sulbactam | Klebsiella Pneumoniae | Ampicilina Sulbactam |
| Ampicilina Sulbactam | Klebsiella Pneumoniae | Ampicilina Sulbactam |
| Ampicilina Sulbactam, Vancomicina, Meropenem, Piperacilina Tazobactam | Klebsiella Pneumoniae patrón IRT | Cefepime |
| Piperacilina Tazobactam | Proteus Vulgaris APMC inducible, Enterococcus Faecium | Meropenem, Linezolid |
| No se inicio | Proteus Mirabilis | Cefepime |
| Piperacilina Tazobactam | Proteus Mirabilis | Meropenem, Polimixina B |
| Clindamicina + Cefepime | Proteus Mirabilis multisensible, Pseudomona Aeruginosa resistente a meropenem | Amikacina + Ciprofloxacina |
| Cefepime, Vancomicina | Proteus Mirabilis multisensible. | Ninguno (foco erradicado) |
| Ampicilina Sulbactam | Proteus Vulgaris | Ciprofloxacina |
| Ampicilina Sulbactam, Clindamicina, Ertapenem | Proteus Vulgaris, Pseudomona Aeruginosa, E. Coli BLEE positivo | Meropenem |
| Ampicilina Sulbactam | Pseudomona Aeruginosa | Cefepime |
| Ampicilina Sulbactam | Pseudomona Aeruginosa + Aeromonas Hydrophila | Ciprofloxacina |
| Vancomicina + Piperacilina Tazobactam | Pseudomona Aeruginosa multisensible, Staphylococcus Haemolyticus meticilinorresistente. | Ciprofloxacina |
| Oxacilina, Clindamicina | Pseudomona Aeruginosa, E Coli resistente AMPC | Cefepime, Amikacina |
| Vancomicina, Clindamicina | Pseudomona Aeruginosa, Providencia Stuartii | Vancomicina, Clindamicina |
| Ampicilina Sulbactam | Pseudomona Aeruginosa, Enterobacter Cloacae, Enterococcus Faecium vancomicina resistente, Candida Glabrata, Pseudomonas Aeruginosa silvestre | Meropenem, Linezolid, Fluconazol, Ciprofloxacina, TMT SMX |
| Meropenem | Pseudomonas Aeruginosa | Meropenem, Colistina |
| Vancomicina + Cefepime | Rautella Ornithinolytica Multisensible, MSSA, Staphylococcus Lugdunensis | TMT SMX |
| Piperacilina tazobactam | Staphylococcus Aureus resistente a la meticilina. | Vancomicina |
| Piperacilina Tazobactam | S. Aureus meticilino resistente | Vancomicina |
| Piperacilina tazobactam | Trichosporon Asahii | Piperacilina tazobactam |
En cuanto a procedimientos quirúrgicos previos a la hospitalización actual, al 5.4% de los pacientes se les había realizado amputaciones por encima de la rodilla, al 10.7% alguna amputación menor y al 18% algún desbridamiento quirúrgico.
Durante la hospitalización se obtuvo una media de 2 procedimientos con un rango entre 1 y 6 procedimientos en total, de los cuales se realizó desbridamientos quirúrgicos en aproximadamente un tercio de los pacientes, otro tercio amputaciones menores y en el tercio restante amputaciones por encima de la rodilla como se expone en la tabla 4. A los pacientes que se le realizo 6 procedimientos corresponden a 2 pacientes a los cuales se les aisló a uno Escherichia Coli multirresistente como único germen y a otro infección polimicrobiana con Rautella Ornithinolytica Multisensible, Staphylococcus Aureus meticilino sensible, Staphylococcus Lugdunensis, a ambos se les redirecciono la antibioticoterapia y presentaron un desenlacé que requirió amputación por encima de la rodilla. De los 16 pacientes requirieron amputaciones mayores 7 presentaban infecciones por gérmenes de multirresistentes o de alta virulencia siendo en ellos la Escherichia coli multirresistente. Así mismo podemos evidenciar que 14 de los pacientes con amputaciones mayores se requirió cambio del antibiótico instaurado.
La media de días de tratamiento fue de 23 días con un rango de 3 a 90 días.
DiscusiónLa edad y genero son similares a la literatura internacional encontrada, con una edad media de 68 años, así mismo hay similitud en la proporción de género10,11.
Según la clasificación de Wagner encontramos que la mayoría de los pacientes se presenta un pie diabético en estadio III y IV tanto pre quirúrgicamente como postquirúrgicamente datos que se correlacionan con la literatura encontrando reportes de 40.8% para Wagner 4 y 11.1% para 512; en nuestra serie evidenciamos mayor porcentaje en estos estadios, sin embargo se evidencia que en la observación intraquirúrgica de nuestra serie el porcentaje se duplica en el pie diabético Wagner V, por lo que podemos inferir que hay diferencia en la apreciación inicial al ingreso de urgencias y al instaurar antibiótico empírico, con respecto a la que se realiza en salas de cirugía por parte del especialista en ortopedia que describe los hallazgos al momento de realizar el procedimiento bajo anestesia.
Sabemos que el patógeno más importante en las infecciones del pie diabético es S. aureus, ya sea como agente único o como agente que forma parte de una infección mixta. La proporción que se publicó de SARM y de S. aureus sensible a meticilina (SASM) en la infección del pie diabético oscila entre el 70 y el 77,5%13,14. La posibilidad de que MRSA esté presente en el pie diabético infectado oscila entre el 9 y el 24%15. Sin embargo los resultados de este estudio no coincidieron con los referenciados previamente y tampoco con el tipo de microorganismos implicados siendo en la literatura predominantemente cocos aerobios grampositivos, con frecuencia asociados a bacilos gramnegativos y a veces a anaerobios16 en esta serie encontramos que los gérmenes predominantes son bacilos gram negativos es decir enterobacterias y Pseudomonas aeruginosa. El cultivo fue polimicrobiano en el 24% de los casos, en la literatura este valor oscila entre un 11-55%17.
Los procedimientos quirúrgicos intrahospitalarios comparando con la literatura los desbridamientos quirúrgicos oscilan entre un 16% al 25%, las amputaciones menores entre un 25 a 50% y las amputaciones mayores alcanzan un 50%18, para a los pacientes que tuvieron un desenlace en amputación mayor podemos ver que 93.3% de estos requirió un cambio en el antibioticoterapia previamente instaurada, asociado a que cursaban con infecciones por gérmenes multirresistentes como lo es la Escherichia coli multirresistente por lo que podemos sugerir realizar un desbridamiento quirúrgico prioritario, la obtención de un aislamiento microbiano previo en salas de cirugía antes de iniciar una antibioticoterapia empírica, también vemos que 15/16 pacientes con amputaciones mayores cursaban con pie diabético Wagner 4 y 5.
En cuanto a la duración del tratamiento antibiótico encontramos que este se correlaciona con el rango mínimo de tratamiento siendo este en una 4 días19 sin embrago el rango máximo fue de 4 semanas 20–22 dentro de los cuales en nuestro estudio 3 días fue para pacientes en los que se realizó tratamiento radical del foco infeccioso, mientras que los pacientes que requirieron antibiótico prolongado es decir 42 días o más fueron aquellos que se les realizó mayor número de desbridamientos quirúrgicos, de los cuales el 20% al final requirió amputación supracondílea, y el 53% una amputación menor, el tratamiento prolongado se debió a que el promedio de días de tratamiento para la osteomielitis sin erradicación radical del foco es de 42 días23.
Dado el alto porcentaje (77.5%) de modificación en la antibioticoterapia sugerimos la toma de muestras de manera intraquirúrgica para el aislamiento de gérmenes en los pacientes con pie diabético si las condiciones clínicas del paciente lo permiten, es decir que el paciente sea se encuentre hemodinámicamente estable para así lograr un tratamiento más eficaz, en caso de pacientes hemodinámicamente inestables y dado la flora bacteriana aislada en esta serie, se sugiere iniciar antibioticoterapia empírica con carbapenémicos.
Se necesita continuar con este tipo de estudios y realizar similares multicéntricos, en los cuales se definan y expongan variables como la severidad de la infección, el estado vascular de la extremidad dado que el pie diabético es una patología que afecta la microvasculatura y la enfermedad arterial oclusiva crónica como una comorbilidad que genera un pronóstico desfavorable. También se pueden incluir variables como por ejemplo el estado de glicemia central, hemoglobina glicosilada, las condiciones generales y hemodinámicas dado que estas pueden influenciar clínicamente para la toma de decisiones frente al inicio de un antibiótico empírico y por lo tanto no solo utilizar la clasificación de Wagner como criterio para clasificar y estratificar a los pacientes. Se debe cuestionar ¿cuáles son los factores de riesgo que influyen más en la morbi – mortalidad de pacientes con pie diabético?
Dado la gran variedad de gérmenes aislados, así como su comportamiento frente a los antibiogramas las comorbilidades asociadas siempre se recomienda el tratamiento conjunto entre Medicina Interna, Infectología, Cirugía vascular periférica, Clínica de Heridas, Cirugía plástica y Ortopedia.
Fuentes de FinanciaciónRecursos propios de los autores.
Conflicto de interésLos autores no declaran algún conflicto de interés.