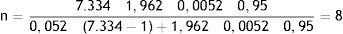El cáncer es la segunda causa de muerte en Estados Unidos (adultos) y ocupa el tercer lugar en México; las metástasis forman parte de su evolución natural y la mayoría (>80%) se presentan en el momento de la muerte. La enfermedad metastásica tiene mayor afinidad por el esqueleto axial, seguida del segmento proximal del fémur. El número creciente de neoplasias aunado al incremento en la eficacia del tratamiento ha aumentado las expectativas de la vida del paciente y de manera secundaria ha aumentado el número de metástasis y fracturas patológicas, con un elevado índice de morbimortalidad. El objetivo del estudio es determinar la incidencia de fracturas patológicas por metástasis del fémur proximal tratadas en un hospital de referencia de una economia emergente entre 2009 y 2014.
Materiales y métodosCon la autorizacion del comité local de investigacion, se realizó un estudio observacional, transversal, descriptivo y retrospectivo. Se evaluaron los registros médicos y se encontró la incidencia de las fracturas en tejido previamente lesionado por alguna tumoración metastásica.
ResultadosSe trataron 98 fracturas en 95 pacientes, que representaron el 0,93% de todos los pacientes, con una incidencia calculada de 0,70 casos por cada 100.000 personas/año.
DiscusiónSe confirmó una incidencia superior a la reportada en estudios previos. El tratamiento debe orientarse a mejorar la calidad de vida, con una fijación estable y una vida útil superior a las expectativas de vida del paciente. Se deben llevar a cabo medidas de prevención primaria, como el escrutinio habitual en busca de metástasis en este grupo vulnerable de pacientes.
Nivel de evidencia clínicaNivel III.
Cancer is the second leading cause of death in the United States (adults) and the third in Mexico: Metastases are part of its natural evolution, occurring in the majority (> 80%) at the time of death. Metastatic disease has a greater affinity for the axial skeleton, followed by the proximal segment of the femur. The increasing number of neoplasia together with the increase in treatment efficacy has increased patient life expectancy and, in turn, has increased the number of metastases and pathological fractures, with a high morbidity and mortality rate. The aim of the study is to determine the incidence of pathological fractures due to metastasis of the proximal femur treated in a referral hospital from 2009 to 2014 in an emerging economy.
Materials and methodsAfter receiving approval from the local research committee, an observational, cross-sectional, retrospective, and descriptive study was carried out. Medical records were evaluated and the incidence of fractures occurred in tissue previously injured by some metastatic tumour.
ResultsA total of 98 fractures were treated in 95 patients, representing 0.93% of all patients, with a calculated incidence of 0.70 cases per 100,000 person-years.
DiscussionAn incidence higher than that reported in previous studies was confirmed. Treatment should aim at improving the quality of life, with a stable fixation and a useful life of the fixation itself superior to the life expectancy of the patient. Primary prevention measures, such as routine examination for metastasis should be performed on this vulnerable group of patients.
Evidence levelIII.
El cáncer es la segunda causa de muerte entre los adultos en Estados Unidos y en México ocupa el tercer lugar desde 20111–3, con el cáncer de próstata, mama, cervicouterino, pulmón y estómago como los más prevalentes4–6.
La enfermedad metastásica se define como la capacidad de las células tumorales de abandonar el tumor primario, migrar e implantarse en tejidos de un órgano a distancia para proliferar y formar nuevos focos tumorales; forman parte de la evolución natural de las neoplasias malignas en su fase de progresión y constituyen el tumor óseo maligno más frecuente7. La mayoría de las personas con cáncer (>80%) las presentan en el momento de su muerte8,9.
Puede afectar a cualquier hueso, pero presentan mayor afinidad por el esqueleto axial y el fémur en su porción proximal. Constituye el sitio extravertebral más frecuente para su localización10–12.
Dicha predilección está determinada por un conjunto de factores anatómicos (sistema circulatorio linfático y sanguíneo). La mayor tasa de perfusión sanguínea en el hueso esponjoso y factores quimiotácticos proporcionan un microambiente adecuado para la colonización y desarrollo de las células tumorales. En el fémur, comparten localización con la zona de mayor esfuerzo biomecánico, por lo que las fracturas por tumor son más frecuentes en su porción proximal13, lo que explica que aproximadamente el 10% de los pacientes con enfermedad metastásica presentará alguna fractura patológica14.
Las lesiones osteolíticas son el patrón de presentación más frecuente de la enfermedad metastásica. En su patogénesis, las células tumorales aportan poco de forma directa a la resorción ósea; sin embargo, producen factores bioquímicos que estimulan el reclutamiento y activación de los osteoclastos y, además, estas células tumorales poseen la capacidad de perpetuar la formación de la lesión lítica mediante una vía de destrucción cíclica. Se inicia con la célula oncogénica, que libera mediadores bioquímicos (citocinas IL-1, IL-6, IL-11, péptido relacionado con hormona paratiroidea [PTHrP] y factor de transformación de crecimiento β [TGF-β]; factor de necrosis tumoral alfa [TNF-a], osteocalcina y otras), que interactúan activando a los osteoclastos a través de la vía RANKL (Receptor Activator of Nuclear Factor Kappa b-Ligand), que es producida por los osteoblastos y es disregulada por proteínas secretadas en las células oncogénicas (PTHrP y TGF-β), que se adhieren al receptor RANK en las células precursoras de los osteoclastos y estimulan su diferenciación y activación para iniciar la resorción ósea. De forma normal, la osteoprotegerina compite con el RANK por su receptor RANKL y modula su efecto, por lo que disminuye la osteólisis y favorece la formación ósea, pero la ausencia de osteoprotegerina aumenta la resorción ósea. El PTHrP actúa sobre los receptores de la hormona paratiroidea y estimula la resorción ósea, además de favorecer la resorción renal del calcio. Por ello surge el hallazgo paraclínico de hipercalcemia. La resorción ósea libera distintos factores mediadores, como TGF-β, y este estimula a las células oncogénicas y el ciclo se reinicia con la estimulación de las células oncogénicas para la producción de IL-6, IL-11 y PTHrP.
En las lesiones osteoblásticas, los factores liberados por las células oncogénicas estimulan la activación de los osteoblastos. La endotelina 1 (ET-1), producida por células neoplásicas, estimula a los osteoblastos a través del receptor A de endotelina (ETAR) y forma nuevo hueso patológico. La ET-1 también activa el WNT e inicia una vía al disminuir el supresor del WNT, el DKK-1, por mecanismos que aún no han sido bien dilucidados; con el descenso del DKK-1, se incrementa la actividad osteoblástica; se han encontrado otras sustancias en distintos tipos de células cancerígenas, como la PTHrP en células de cáncer de próstata, proteína morfogenética 7 (BMP-7), conocida por su capacidad de inducción de formación ósea y el PDFG, que también han sido encontrados en células oncogénicas de mama y próstata.
La fractura patológica es una grave complicación que deteriora notablemente la calidad de vida del paciente oncológico por el aumento del dolor y la incapacidad funcional que produce; incluso se ha asociado con un incremento >20% del riesgo de muerte15.
El gran número de casos de fracturas por metástasis óseas se puede atribuir a la mayor tasa de supervivencia de los pacientes, por los avances en los métodos de diagnóstico y la mayor eficacia del tratamiento de los tumores primarios, con un incremento en su esperanza de vida; estas mejoras no solo han permitido que el paciente con enfermedad metastásica viva más tiempo, sino que también tenga una vida más activa16,17.
Este tipo de fracturas representa un problema de salud público, mayor que el reconocido, pues no existe evidencia clara de la magnitud del problema al no contar con estudios publicados que ponderen las características epidemiológicas de este grupo de pacientes en México. La información apropiada de nuestro medio ayudaría a la toma de decisiones con base en la evidencia científica y facilitaría su tratamiento y ayudaría a encaminar programas preventivos de estas lesiones.
El objetivo del estudio fue analizar retrospectivamente durante un período de 5 años la incidencia de las fracturas patológicas del fémur proximal por metástasis óseas, tratadas en el servicio de un hospital de concentración de una economía emergente.
Materiales y métodosSe diseñó un estudio observacional, transversal, descriptivo y retrospectivo, con el objetivo de analizar retrospectivamente los nuevos casos de fracturas patológicas del fémur proximal por metástasis óseas, tratadas en el servicio de un hospital de concentración.
Tras la aprobación por el comité local de investigación, que consideró el estudio sin riesgo, se revisaron los registros médicos de los pacientes con 18 años o más que cursaron estancia hospitalaria en nuestra unidad con el diagnóstico de fractura patológica por metástasis en fémur proximal, desde el 15 de agosto de 2008 hasta el 14 agosto de 2014. No se incluyeron registros incompletos ni reingresos al servicio para evitar duplicidad de la información y no se tuvieron criterios de eliminación porque las variables solo fueron medidas una vez.
Se encontró en el registro de ingresos un total de 11.307 pacientes en el periodo de estudio, de los cuales 7.334 presentaron alguna fractura en el segmento proximal del fémur18.
Métodos estadísticosPor el diseño del estudio, no se consideró un número mínimo de casos; sin embargo, se realizó un cálculo de tamaño de muestra con la fórmula para el cálculo de tamaño de muestra en poblaciones finitas, donde:
N=total de la población (7.334).
Z2α=1,96 al cuadrado (seguridad del 95%).
p=proporción esperada (en este caso, 0,052%=0,0052).
q=1 - p (para este estudio 1 - 0,05=0,95).
d=precisión (5%).
Se previó una pérdida de información del 20% de los registros por cada año de estudio, por lo que se incrementó el número del tamaño de muestra hasta un total de 16 registros.
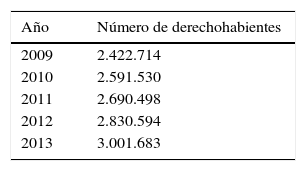
Posteriormente se identificó el número de población derechohabiente en el área de influencia del hospital de fuentes oficiales, el cual resultó no ser homogéneo a lo largo de los 5 años de estudio, por lo que se decidió realizar el cálculo de incidencia anual y para la totalidad del estudio el cálculo de la densidad de incidencia.
Se ajustó el número de población acorde al grupo etario del estudio y se excluyó a la población menor de 18 años.
Se calculó una incidencia anual con la fórmula: incidencia=número de casos/población.
Y la tasa de incidencia o densidad de incidencia con la fórmula:
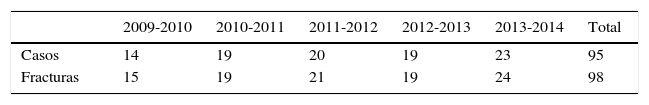
ResultadosSe identificó a un total de 95 pacientes con 98 fracturas patológicas por metástasis en fémur proximal; 3 pacientes presentaron fractura bilateral simultánea en la fecha de su ingreso (tablas 1 y 2).
Número de derechohabientes
| Año | Número de derechohabientes |
|---|---|
| 2009 | 2.422.714 |
| 2010 | 2.591.530 |
| 2011 | 2.690.498 |
| 2012 | 2.830.594 |
| 2013 | 3.001.683 |
Capítulo II. Población derechohabiente potencial. Cuadro II.11.5 Población derechohabiente potencial por delegación 2000-2013 (*) http://www.imss.gob.mx/sites/all/statics/pdf/estadisticas/memoria/2013/02_poblacionderechohabiente.xls
Entorno demográfico y epidemiológico y la presión que ejercen sobre el gasto médico http://www.imss.gob.mx/sites/all/statics/pdf/informes/20122013/c02.pdf
Se calculó una incidencia anual para:
- -
2009-2010: 0,57 casos cada 100.000 habitantes.
- -
2010-2011: 0,73 casos cada 100.000 habitantes.
- -
2011-2012: 0,74 casos cada 100.000 habitantes.
- -
2012-2013: 0,67 casos cada 100.000 habitantes.
- -
2013-2014: 0,76 casos cada 100.000 habitantes.
Y la tasa de incidencia o densidad de incidencia con la fórmula:
Densidad de Incidencia=9513,536,924=0,70 nuevos casos por cada 100.000 personas/año de seguimiento.
De los 95 pacientes identificados, 41 fueron hombres y 54 mujeres, cuya edad estuvo en el rango de los 18 a los 90 años, con una mediana de 66 y un promedio de 65,3 años. 81 pacientes se fracturaron en su domicilio y 14 en la vía pública, todos con mecanismos de baja energía, 48 de lado derecho, 44 en el izquierdo y tres pacientes sufrieron fractura bilateral.
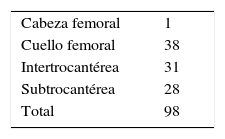
La localización anatómica de la lesión se concentró en la zona trocantérica, con 31 fracturas transtrocantéricas y 28 en la región subtrocantérica, 38 en el cuello femoral y una en la cabeza femoral (tabla 3).
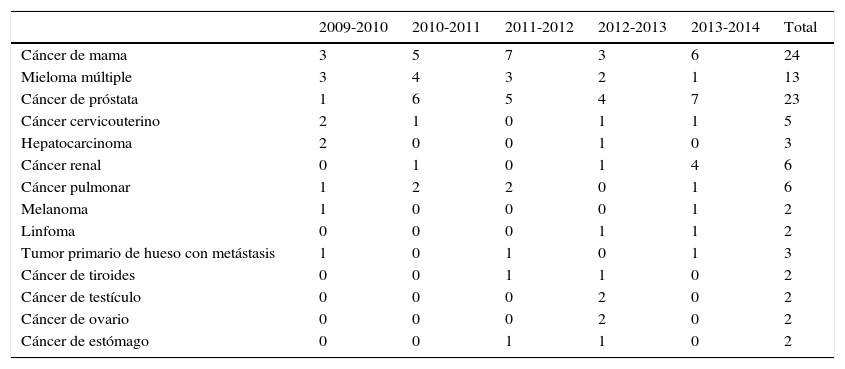
La fuente primaria de las metástasis fueron el cáncer de mama en 26 pacientes, cáncer de próstata en 23, mieloma múltiple en 13 casos, seguido por cáncer renal y pulmonar con 6 casos cada uno, cáncer cervicouterino en 5 pacientes; en 3 pacientes, el origen fue un cáncer primario de hueso con metástasis, 3 por neoplasias de origen hepático y los 12 casos restantes por fuentes menos frecuentes (testicular, linfoma, tiroides, ovario, estómago, melanoma, etc.; tabla 4).
Cáncer primario
| 2009-2010 | 2010-2011 | 2011-2012 | 2012-2013 | 2013-2014 | Total | |
|---|---|---|---|---|---|---|
| Cáncer de mama | 3 | 5 | 7 | 3 | 6 | 24 |
| Mieloma múltiple | 3 | 4 | 3 | 2 | 1 | 13 |
| Cáncer de próstata | 1 | 6 | 5 | 4 | 7 | 23 |
| Cáncer cervicouterino | 2 | 1 | 0 | 1 | 1 | 5 |
| Hepatocarcinoma | 2 | 0 | 0 | 1 | 0 | 3 |
| Cáncer renal | 0 | 1 | 0 | 1 | 4 | 6 |
| Cáncer pulmonar | 1 | 2 | 2 | 0 | 1 | 6 |
| Melanoma | 1 | 0 | 0 | 0 | 1 | 2 |
| Linfoma | 0 | 0 | 0 | 1 | 1 | 2 |
| Tumor primario de hueso con metástasis | 1 | 0 | 1 | 0 | 1 | 3 |
| Cáncer de tiroides | 0 | 0 | 1 | 1 | 0 | 2 |
| Cáncer de testículo | 0 | 0 | 0 | 2 | 0 | 2 |
| Cáncer de ovario | 0 | 0 | 0 | 2 | 0 | 2 |
| Cáncer de estómago | 0 | 0 | 1 | 1 | 0 | 2 |
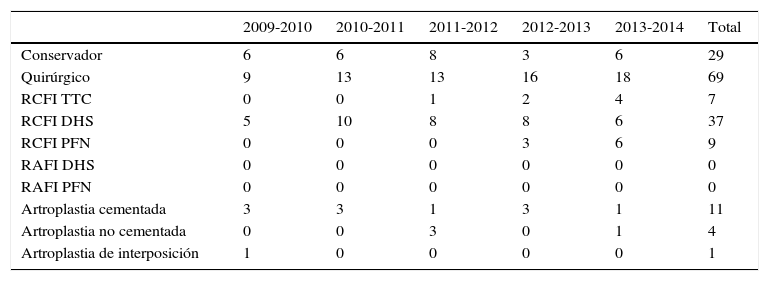
La elección del tratamiento se basó en el estado de salud del paciente y no se sometió a los riesgos de un procedimiento quirúrgico a 29 pacientes con estado de salud precario, sino que se los trató de manera paliativa; de las 69 fracturas remantes, se realizaron 37 procedimientos con reducción cerrada y fijación interna con sistema DHS, seguido de la artroplastia total de cadera con 15, de las cuales 11 fueron cementadas y en 4 se optó por la colocación de vástago femoral no cementado por cardiopatía subyacente; 9 reducciones cerradas con fijación interna mediante colocación de clavo centromedular PFN y 7 reducciones cerradas con fijación interna percutánea con tornillos transcervicales y una artroplastia de interposición de tejidos blandos (tabla 5).
Tratamiento de las fracturas*
| 2009-2010 | 2010-2011 | 2011-2012 | 2012-2013 | 2013-2014 | Total | |
|---|---|---|---|---|---|---|
| Conservador | 6 | 6 | 8 | 3 | 6 | 29 |
| Quirúrgico | 9 | 13 | 13 | 16 | 18 | 69 |
| RCFI TTC | 0 | 0 | 1 | 2 | 4 | 7 |
| RCFI DHS | 5 | 10 | 8 | 8 | 6 | 37 |
| RCFI PFN | 0 | 0 | 0 | 3 | 6 | 9 |
| RAFI DHS | 0 | 0 | 0 | 0 | 0 | 0 |
| RAFI PFN | 0 | 0 | 0 | 0 | 0 | 0 |
| Artroplastia cementada | 3 | 3 | 1 | 3 | 1 | 11 |
| Artroplastia no cementada | 0 | 0 | 3 | 0 | 1 | 4 |
| Artroplastia de interposición | 1 | 0 | 0 | 0 | 0 | 1 |
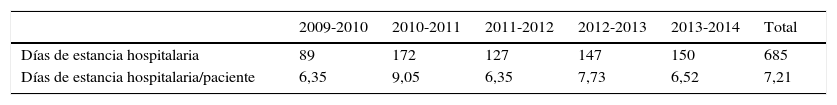
La estancia hospitalaria acumulada fue de 685 días, desde 1 hasta 20 días, con una mediana de 6 días y 7,21 días de estancia hospitalaria como promedio (tabla 6).
DiscusiónLa estabilización quirúrgica de estas fracturas ha sido una interrogante para el ortopedista. El deseo de tratarlas frecuentemente se ve mitigado por la preocupación de estar sometiendo a un paciente oncológico a una cirugía, en la cual los beneficios pueden no superar a los riesgos y el temor de diseminar el proceso neoplásico.
Las fracturas patológicas femorales presentan indicación quirúrgica, por la gran pérdida de calidad de vida que producen; sin embargo, debe individualizarse cada caso.
La meta de cualquier tratamiento que se elija debe estar encausada a mejorar la calidad de vida con el alivio del dolor19.
Para la adecuada elección del tratamiento quirúrgico debe procurarse cumplir con tres objetivos primarios: primero, que el paciente sobreviva a la cirugía; segundo, que pueda alcanzar la carga completa de peso de la extremidad afectada, y tercero, que la supervivencia del implante sea mayor que la del paciente.
Las metas del tratamiento son:
- -
Alivio del dolor.
- -
Proporcionar gran estabilidad.
- -
Restablecer la resistencia biomecánica.
- -
Mantener la movilidad.
- -
Permitir, en caso de ser posible, la deambulación.
- -
Permitir siempre la movilización para los cuidados del paciente.
- -
Mantener el mayor grado de independencia posible.
Sin embargo, estas no siempre se consiguen de manera completa. La imprevisibilidad de la supervivencia del paciente hace más difícil la elección del tratamiento adecuado.
Se han generado distintas estrategias quirúrgicas, incluyendo el uso de los implantes para fijación interna (intramedular o extramedular), clavos, placas y tornillos, y la reconstrucción endoprotésica20.
Debe procurarse elegir un tratamiento definitivo que permita la carga inmediata de forma que un paciente no necesite pasar por un prolongado periodo de rehabilitación cuando solo le quedan unos meses de vida y debe ser lo suficientemente resistente como para durar muchos años, en el caso de que el paciente tenga una buena evolución.
En el tratamiento de fracturas intracapsulares se aconseja una hemiartroplastia o la artroplastia total debido a la alta tasa de falta de unión. Otra ventaja sobre la fijación interna es que permite la remoción del tumor del área afectada y minimiza el riesgo de la progresión.
La artroplastia total se recomienda cuando existe afección acetabular; otros autores prefieren realizarla cuando el acetábulo está radiológicamente sano y la esperanza de vida sea aproximadamente igual o mayor a un año. Siempre hay que asumir el riesgo de que tiene una tasa de luxación protésica superior a la de la hemiartroplastia.
No existe un consenso entre el uso de vástagos cortos o largos. De manera general, si existe una lesión distal, debe usarse el vástago largo ya que puede mitigar el riesgo de fracturas potenciales.
Los componentes de las artroplastias deben ser cementados ya que el hueso suele tratarse con radioterapia. Siempre se debe recordar que existe el riesgo de las complicaciones cardiacas ya descritas con la cementación, particularmente con los vástagos largos.
La implantación de una prótesis total de tipo tumoral, con resección ósea de toda la lesión metastásica, se reserva para pacientes con buen estado general, con esperanza de vida mayor o igual a 1 año, con la región acetabular sana y con una única lesión metastásica objetivable.
Las principales complicaciones potenciales con el uso de endoprótesis son la recurrencia local, infección, aflojamiento aséptico, falla mecánica y fractura (prótesis o hueso).
En el tratamiento de fracturas extracapsulares (trocantérea, subtrocantérea o ambas), se requiere la restauración de la función de la articulación coxofemoral y demandan de la diáfisis femoral la capacidad de carga completa de peso, por lo que esta región requiere una fijación estable biomecánicamente y el restablecimiento de la función de la extremidad pélvica, y por ello la decisión de fijar la lesión o extirparla y reemplazarla por una prótesis es más complicada.
En la fijación interna, el enclavado intramedular bloqueado proporciona gran estabilidad en el foco de fractura al repartir las cargas a lo largo de toda la diáfisis e impide la movilidad axial y rotatoria del foco de fractura y, aunque la lesión metastásica permanece in situ con progresión de la osteólisis, la osteosíntesis permanece generalmente estable.
El enclavado cefalomedular es más exitoso que la placa con tornillo deslizante de cadera.
La osteosíntesis con tornillo-placa deslizante (DHS), que defienden algunos autores, presenta mayor morbilidad.
Debe valorarse la artroplastia cementada.
Sin embargo, las fijaciones con placa y clavo tienen una gran tasa de falla a 2 años después de la cirugía. La tasa posterior a la fijación interna alcanza el 75-90%. La mayoría de las faltas de unión se han desarrollado en pacientes que han sido tratados con radioterapia y los pacientes con cáncer renal tienen la mayor tasa de reoperación.
La reconstrucción endoprotésica de la región extracapsular del fémur requiere una disección extensa de tejidos blandos. Dada la extensión de la cirugía, muchos pacientes presentaran debilidad postoperatoria y, aunque la falta de unión no es una preocupación con este tratamiento, la luxación e infección son más frecuentes que con la fijación interna.
No se han realizado estudios prospectivos en que se comparan ambos procedimientos. Wedin et al. realizaron un estudio retrospectivo en que se compararon 146 lesiones, 37 tratadas con fijación interna mediante enclavado cefalomedular y 109 con reemplazo articular, definiendo como falla la necesidad de reoperar. Demostraron que el 16% de lesiones tratadas con osteosíntesis falló por falta de unión u osteonecrosis, y el 8,3% de los reemplazos articulares falló por luxación o fracturas distales, y concluyeron que el riesgo de reoperación a 2 años es superior en pacientes con fijación interna21.
Un caso particular está determinado por los carcinomas de células renales, que son especialmente resistentes al tratamiento con quimioterapia y radioterapia, por lo que la reconstrucción endoprotésica es más apropiada como método terapéutico.
En nuestro estudio, la localización anatómica de las fracturas fue superior en la zona del cuello femoral con el 38,7%, seguido de la zona trocantérica con el 31,6% y el 28,5% en la región subtrocantérica (28), y 1 fractura en la cabeza femoral, lo cual difiere de reportes previos en los cuales más de la mitad de los casos se presentaban en el cuello femoral, el 20% en la región pertrocantérica y el 30% en la región subtrocantérica.
Para la elección del tratamiento de las fracturas en nuestros pacientes, nos basamos en el estado general de salud y optamos por un tratamiento conservador en 29 de los 95 pacientes dado que los beneficios esperados no superaban los riesgos de la cirugía.
De las 69 fracturas remantes, una vez considerados aptos para tratamiento quirúrgico nos basamos en el patrón y localización anatómica de la fractura, para la elección del tratamiento.
De 39 fracturas intracapsulares, 38 en el cuello femoral, se eligió la artroplastia total de cadera en 15, de las cuales 11 fueron cementadas y en 4 se optó por la colocación de vástago femoral no cementado por cardiopatía subyacente, 7 reducciones cerradas con fijación interna percutánea con tornillos transcervicales en pacientes con una baja expectativa de vida; se realizó además una artroplastia de interposición de tejidos blandos.
Dentro del segmento extracapsular (59 fracturas), 37 fueron tratadas con el sistema del placa y tornillos (DHS) por medios cerrados y 9 reducciones cerradas con fijación interna mediante colocación de clavo centromedular PFN.
Determinar la esperanza de vida en pacientes con fractura patológica es muy difícil al igual que estimar el rol del método quirúrgico o la elección del implante en la supervivencia. Muchos factores asociados han demostrado tener mayor influencia en la supervivencia del paciente, como la edad, el estado de general de salud preoperatorio, el tipo de cáncer, la localización de las metástasis en el fémur y la existencia de metástasis únicas o múltiples.
Algunos autores reportan el 12% de decesos durante el primer mes. La expectativa de vida a 6 meses es del 40-45% y del 30% a 1 año, el 15% a 2 años y menor al 10% a 3 años.
La relación de la tasa de supervivencia con el tumor primario productor de la fractura patológica varía en cada reporte, con una supervivencia para el carcinoma de mama de 24 meses de media, en el de próstata de 18 meses, en el de riñón de 1 año y en el de pulmón de 4 a 6 meses.
Determinar la supervivencia del implante también es supremamente difícil debido a las características individuales de cada fractura patológica y a las características individuales de la metástasis que originó la fractura. Se relacionaron los fracasos con factores como el tipo de carcinoma (mayor en el de riñón y menor en el de próstata), se definió como factor predisponente al aflojamiento del implante la supervivencia prolongada tras la fractura patológica22–25. Según el método terapéutico elegido, con una tasa local de fallas del 11% en un tiempo promedio de 8 meses, es menor la incidencia de fallos en la artroplastia (del 2 al 10%) que en la osteosíntesis, en dispositivos intramedulares (del 2 al 22%) y en la fijación con placas que ha reportado tasas del 44 al 70%26,27.
Múltiples estudios retrospectivos respaldan el uso de cada uno de los métodos terapéuticos; sin embargo, existe una extensa lista de factores asociados con el paciente y su estado de salud para la toma correcta de decisiones y no caer en los extremos del encarnizamiento terapéutico.
Es importante no enfrentarse a estos pacientes con una actitud pesimista. Actualmente no se considera que el episodio de la fractura patológica metastásica marque obligatoriamente la fase terminal de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.