La evolución de las técnicas quirúrgicas tradicionales y los modelos de formación de los cirujanos exigen cambios, por esta razón el centro de investigación y entrenamiento en cirugía de mínima invasión (CLEMI) ha desarrollado y aplicado modelos de enseñanza que permiten aprender técnicas quirúrgicas mínimamente invasivas como la microcirugía. CLEMI propone un modelo de entrenamiento basado en el uso de un modelo experimental, impartido en un ambiente controlado, estructurado y progresivo que vaya al ritmo individual de cada uno de los estudiantes. Inicialmente el estudiante encontrará conceptos teóricos de instrumental, equipos y ergonomía, posteriormente en la fase práctica usando un modelos sintéticos y finalmente usando un modelo de biológico con los que se desarrollan de una serie de ejercicios para desarrollar destrezas técnicas que permiten alcanzar el nivel necesario para el manejo de las técnicas básicas de microcirugía. El entrenamiento en modelos bajo ambiente controlado disminuye el período de aprendizaje y eleva la competencia del participante. El objetivo principal del entrenamiento es alcanzar las habilidades mínimas necesarias para realizar con éxito una técnica de microcirugía.
Nivel de Evidencia: IV.
The evolution of the traditional surgical techniques and the training models of the surgeons demand changes. For this reason the minimally invasive surgery research and training centre (CLEMI) has developed and applied teaching models as an aid to learn minimally invasive surgical techniques like microsurgery. CLEMI proposes a training model based on the use of an experimental model, presented in a controlled, structured, and progressive environment that is adjusted to the rhythm of the individual student. Initially, the student will encounter theoretical concepts of instrumental, equipment, and ergonomics. Later, in the practical phase, they will use synthetic models and then a biological model with which they perform a series of exercises in order to perfect the technical skills in order to reach the level necessary for the management of basic techniques of microsurgery. Training in controlled environment models reduces the learning period and increases the skills of the participant. The main objective of the training is to achieve the minimum skills necessary to successfully perform a microsurgery technique.
Level Evidence: IV.
El Centro Latinoamericano de Investigación y Entrenamiento en Cirugía de Mínima Invasión, CLEMI, ha desarrollado el Curso Básico de Microcirugía como parte de una metodología de enseñanza y entrenamiento para la especialidad de microcirugía, como base fundamental de la curva de aprendizaje que demanda este tipo de procedimientos en la actualidad. Este curso busca proporcionar los elementos básicos para el inicio de las prácticas en microcirugía que posteriormente podrán ser aplicados a procedimientos en microcirugía avanzada. Este proceso se fundamenta en el uso del microscopio, el cual permite a los especialistas en formación el desarrollo de habilidades visomotoras, aumentando la destreza y la capacidad en las diferentes competencias al efectuar este tipo de procedimientos quirúrgicos.
El curso se desarrolla en forma teórico-práctica en el transcurso de dos días. La parte teórica consta de una serie de charlas sobre equipos, instrumental microquirúrgico, microsutura y ergonomía. La parte práctica consiste en el manejo del microscopio, del instrumental empleado y de la microsutura, así como la realización de ejercicios prácticos dispuestos en un orden ascendente de dificultad mediante el empleo de plantillas, modelos orgánicos y modelos experimentales.
Objetivos generales del curso- •
Ofrecer al estudiante espacios de reconocimiento e interacción con microscopio, instrumental y sutura microquirúrgica1–3.
- •
Mostrar al estudiante la importancia de la adopción de posturas ergonómicas en las prácticas con microscopio e instrumental4–6.
- •
Promover en el estudiante el desarrollo de habilidades y destrezas fundamentales para la práctica quirúrgica en microcirugía mediante ejercicios prácticos7–10.
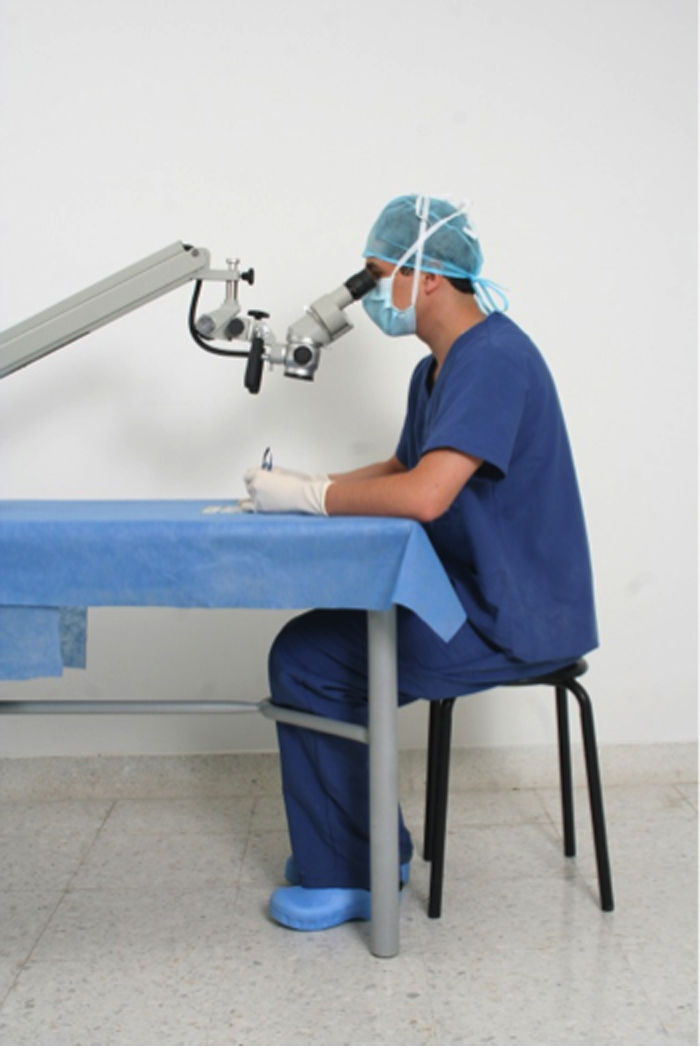
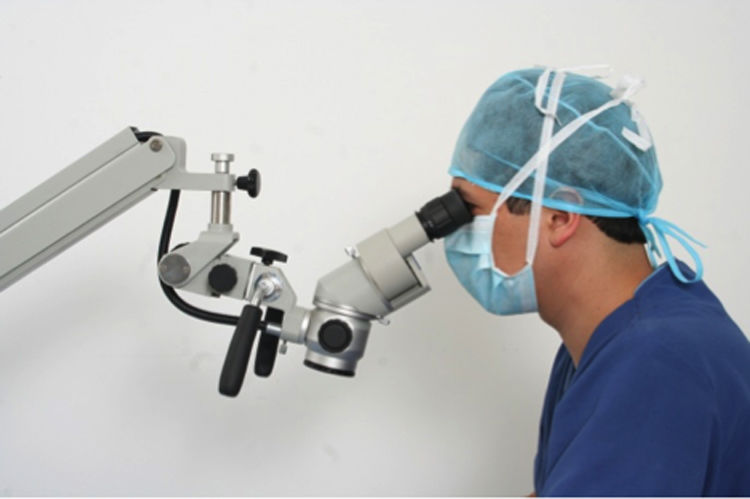
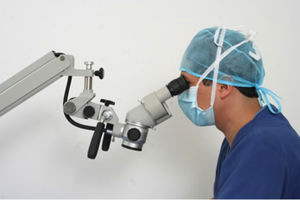
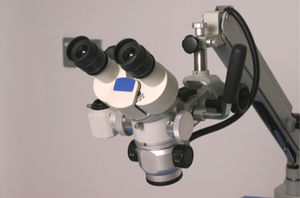
La postura correcta para el desarrollo de técnicas microquirúrgicas se realizan en una posición sentado siendo esta la posición de trabajo más confortable, ya que ayuda a reducir la fatiga corporal, disminuye el gasto de energía e incrementa la estabilidad y la precisión en las acciones desarrolladas. Sin embargo, esta postura también puede resultar perjudicial para la salud si no se tienen en cuenta los elementos que intervienen en la realización del trabajo, principalmente, la silla y la mesa o el plano de trabajo y si no se dispone de la posibilidad de cambiar de posición de vez en cuando; posición correcta para el uso del microscopio (fig. 1), tenga en cuenta:
- 1.
Posición correcta de la cabeza y el cuello
- 2.
Mantenga los ojos sobre los binoculares.
- 3.
Trabaje con el cuello en un ángulo de 30°
Las consecuencias de mantener una postura de trabajo sentada inadecuada son: molestias cervicales, abdominales, trastornos en la zona lumbar de la espalda y alteraciones del sistema circulatorio y nervioso que afectan, principalmente, a las piernas.
Es importante detallar la posición de la cabeza y el cuello para no generar lesiones musculoesqueleticas al usar el microscopio (fig. 2).
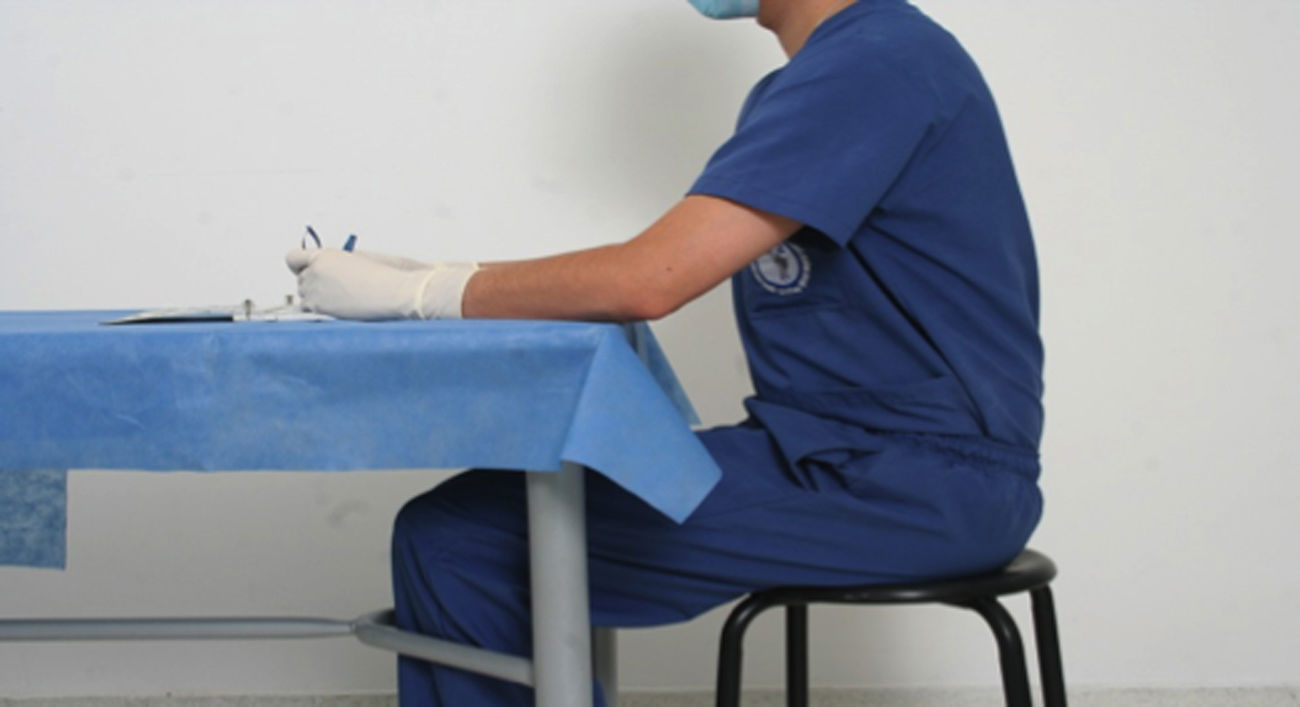
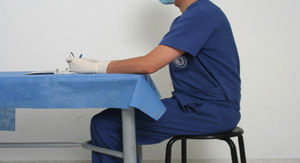
Posición correcta del tronco y las extremidadesEl puesto de trabajo del cirujano en entrenamiento debe ser correctamente diseñado para la comodidad y perfecto desemvolvimiento de la persona al ralizar los ejercicios y este mismo fundamento aplica para la practica medica, asi se evitará cualquier tipo de alteración postural, como se señala a continuación (fig. 3).
Posición correcta para iniciar los ejercicios:
- 1.
Para reducir el cansancio visual y la fatiga muscular, no fuerce ningún segmento corporal.
- 2.
Mantenga los antebrazos y la región hipotenar de la mano bien asentados sobre la mesa.
- 3.
Mantenga la espalda recta y un correcto apoyo lumbar en la silla.
- 4.
Maneje el instrumental con armonía y precisión en los movimientos.
- 5.
Tome el instrumental con el primer, segundo y tercer dedo, tal como se toma un lápiz para escribir.
- 6.
Apoye fuertemente el instrumental en la depresión existente entre el primer y el segundo dedo.
- 7.
Apoye bien los pies en la silla o en la mesa para tener la estabilidad necesaria. (fig. 4)
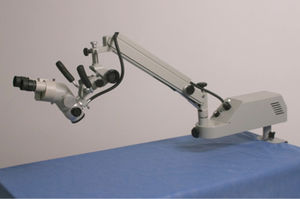
El conocimiento del aparato y la estructura de un microscopio quirúrgico es un prerrequisito para realizar microcirugía. El cirujano debe aprender a manejar la magnificación y el foco con los pedales. La visión binocular estereoscópica es crucial. Se debe tener la distancia binocular adecuada y se debe determinar la posición de esta al principio del entrenamiento. También se debe acostumbrar a trabajar en el centro del campo operatorio. Poder utilizar el instrumentar y traerlos al campo operatorio, sin desviación de la mirada del microscopio, previene la pérdida de tiempo y la fatiga ocular11.
Partes del microscopioEl microscopio actual está formado básicamente por: 1) Tubos binoculares; 2) Sistema de variación de aumento; 3) Lentes de f-200 y f-300; 4) Manilares y 5) Sistema de iluminación (fig. 6).
Material quirúrgico convencional- 1.
Mango de bisturí No. 3
- 2.
Tijeras de corte
- 3.
Tijeras de disección
- 4.
Pinzas Adson con o sin dientes
- 5.
Pinza mosquito
- 6.
Portaagujas
- 7.
Hoja de bisturí No. 15
- 8.
Regla
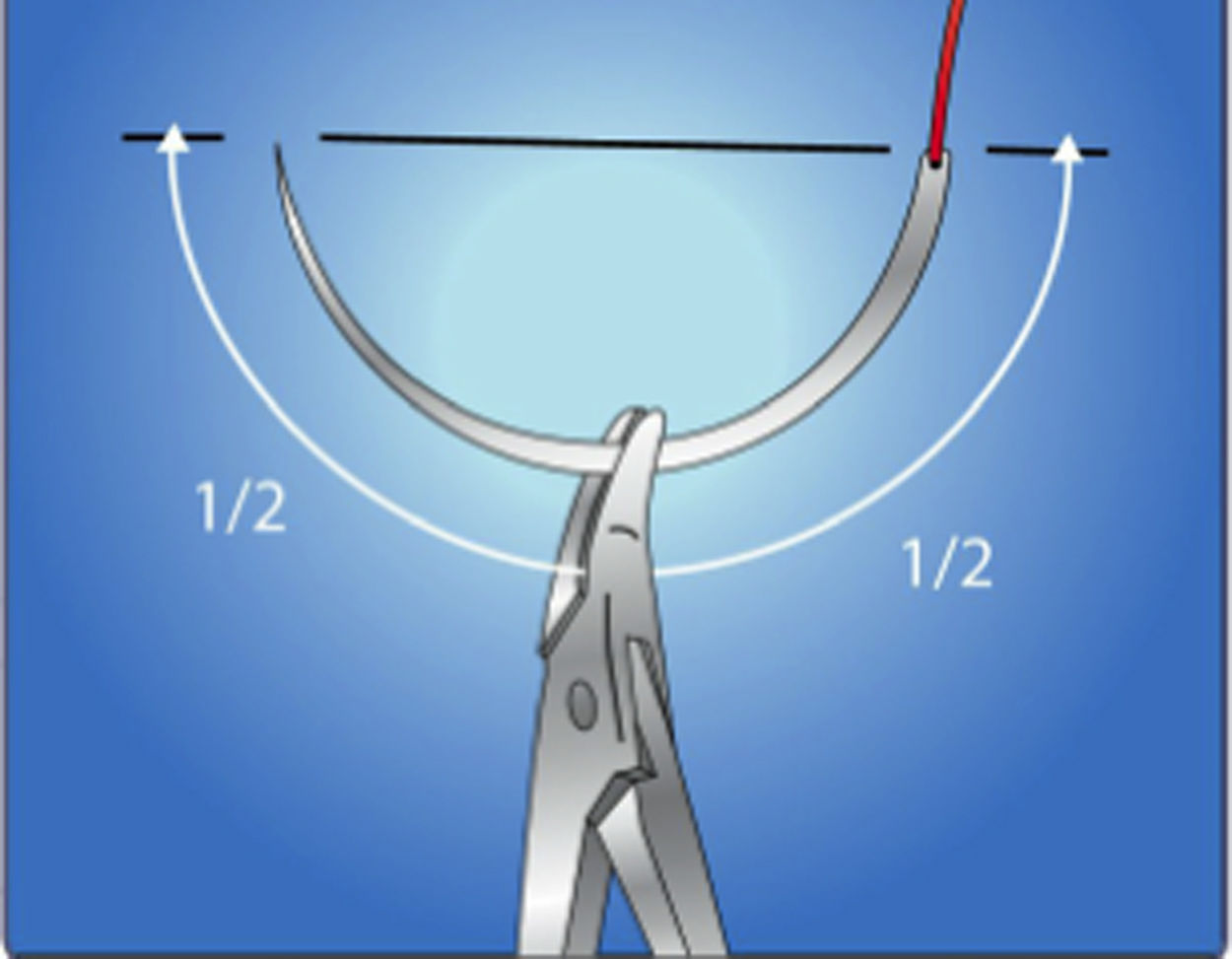
El instrumental se debe tomar en la misma manera que se toma un lápiz. El cirujano se debe acostumbrar a cargar la aguja con la porta-aguja a una distancia de 2/3 de la punta. No se debe tomar la aguja o el hilo con mucha fuerza, ya que esto los puede dañar.
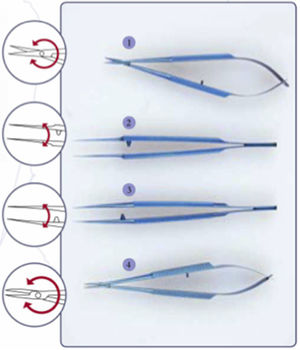
El instrumental para entrenamiento está compuesto por: 1) Porta-agujas; 2) Pinzas de relojero sin garra; 3) Pinzas relojero con garra y 4) Tijeras para microcirugía (fig. 7).
Clamps vasculares: los clamps vasculares están disponibles en varios tamaños, opciones para las arterias y para las venas. La opción doble con una ligera vuelta al final de la abrazadera es adecuada para las arterias de pared gruesa (fig. 8). La opción sencillo está destinada a todas las venas y arterias de paredes delgadas.
Material de sutura y aguja: Respecto a la sutura, podemos utilizar materiales no reabsorbibles, como el nilón o el polipropileno, con calibres de 8/0 a 12/0 (fig. 9).
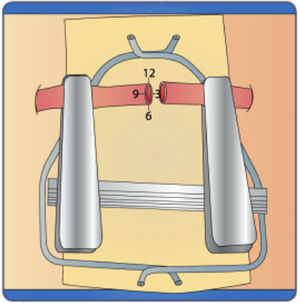
Módulo I. Ejercicios de parametríaObjetivos del módulo- •
Instruir al estudiante para que adopte una posición ergonómica adecuada frente al microscopio y el instrumental microquirúrgico12–15.
- •
Ofrecer al estudiante los ejercicios pertinentes para que adquiera un manejo adecuado de la profundidad16–20.
- •
Fomentar en el estudiante la adquisición de destreza y motricidad fina en ambas manos21–25.
- •
Promover en el estudiante el manejo cuidadoso del instrumental microquirúrgico26–29.
- •
Dos cajas de petri
- •
Una hoja en blanco
- •
Un lápiz ecológico No. 2
- •
Una gasa extendida sobre una hoja con figuras geométricas
- •
Un cigarrillo
- •
Una hebra de sutura 3-0
- •
Un mango de bisturí No. 3
- •
Una cuchilla de bisturí No. 15
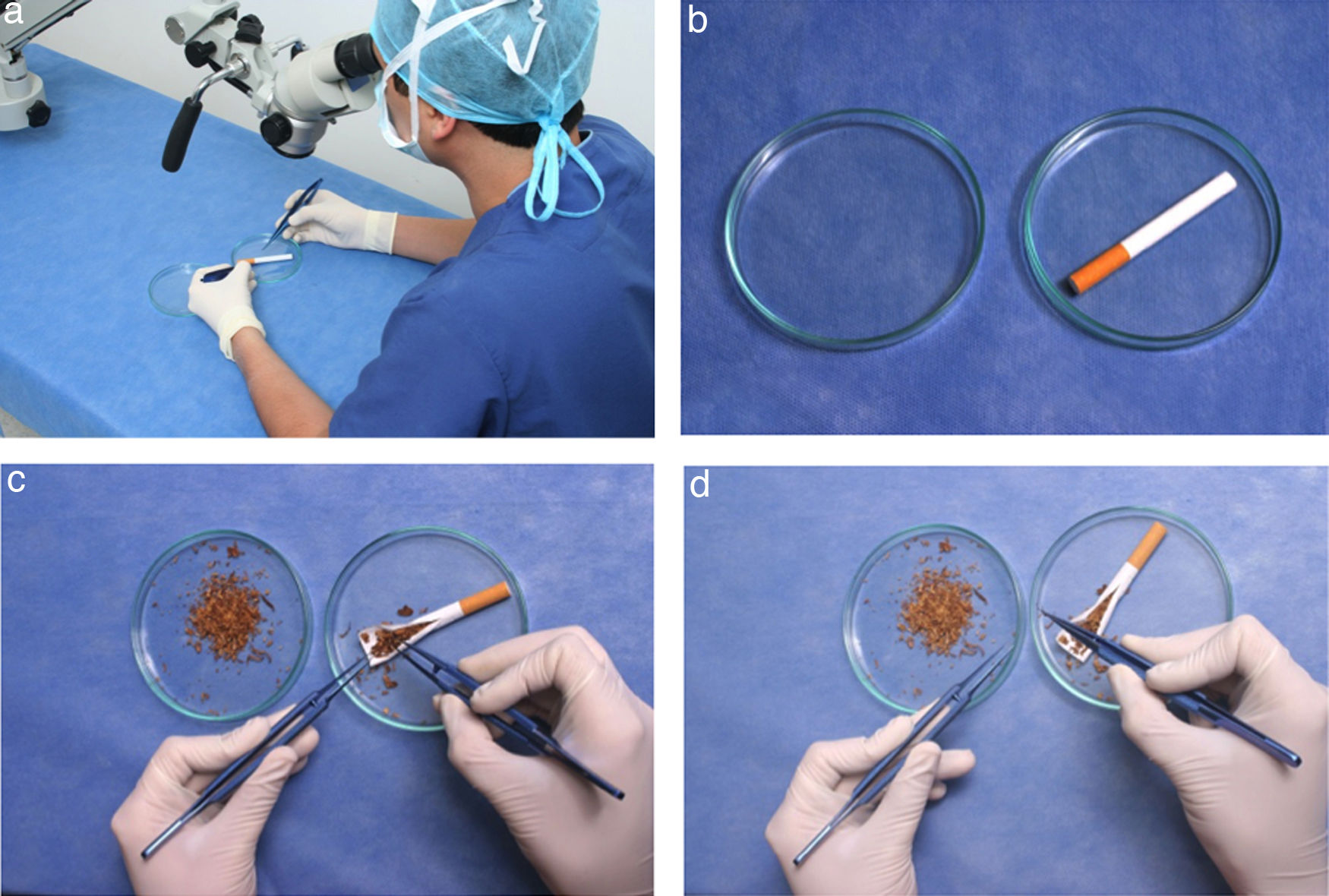
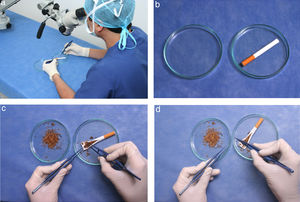
Este ejercicio consiste en manipular elementos pequeños con las pinzas de relojero con un aumento de 0,5 x 12 (aproximadamente 6 aumentos).
Instrucciones- 1.
Ajuste la altura de la silla a sus necesidades ergonómicas (fig. 10 a).
- 2.
Adapte los lentes del microscopio tomando una posición ergonómica adecuada.
- 3.
Haga una incisión longitudinal en el cigarrillo con el bisturí, separe el papel hacia cada lado con las pinzas de relojero e identifique los elementos del tabaco (fig. 10b).
- 4.
Coja una pinza de relojero con cada mano, (fig. 10c).
- 5.
Tome uno a uno los elementos del tabaco y deposítelos en la caja de petri vacía. (fig. 10d).
- 6.
Repita este ejercicio primero con la mano dominante y luego con la otra mano.
- 7.
Realice este ejercicio incrementando progresivamente el aumento de los lentes del microscopio.
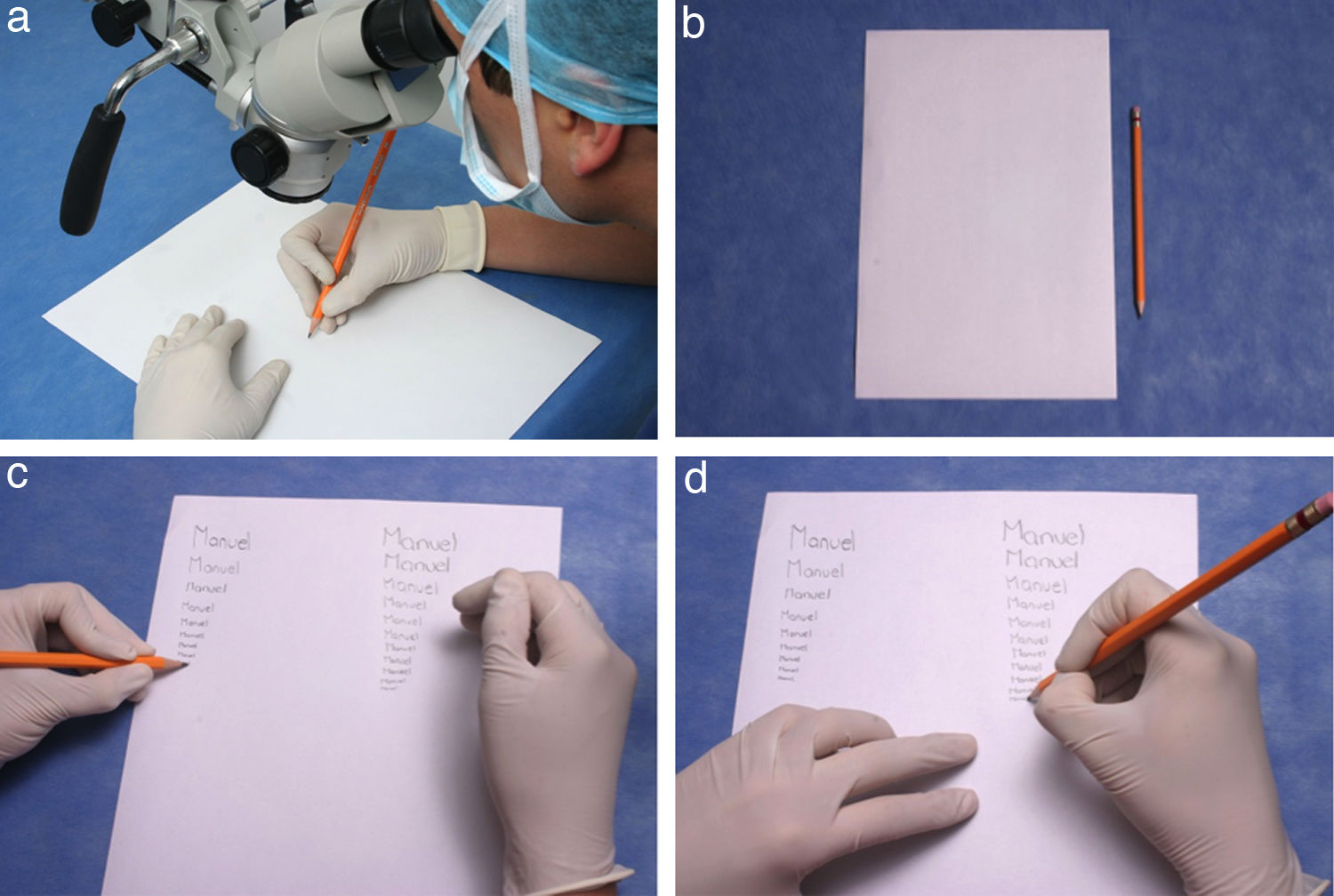
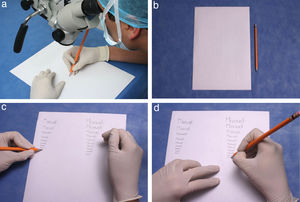
Este ejercicio se lleva a cabo con una hoja en blanco y un lápiz.
Instrucciones- 1.
Ajuste el microscopio a sus condiciones visuales y ergonómicas.
- 2.
Tome una hoja en blanco tamaño carta y ubíquela debajo del lente de manera vertical. (fig. 11b).
- 3.
Tome un lápiz con su mano dominante y escriba su nombre.
- 4.
Realice esta actividad varias veces alternando de mano y disminuyendo el tamaño de su escritura.
- 5.
Realice el trazo muy despacio y con la mayor precisión posible. (fig. 11c).
- 6.
Inicie este ejercicio con el lente de mayor aumento y disminúyalo paulatinamente. (fig. 11d).
Para este ejercicio se utiliza una hoja blanca con figuras geométricas impresas (triángulo, cuadrado, rombo, rectángulo) con gasa adherida sobre su superficie (fig. 12a)30,31.
Instrucciones- 1.
Ajuste el microscopio a sus condiciones visuales y ergonómicas.
- 2.
Ubique bajo el microscopio la hoja con la gasa adherida (fig. 12b).
- 3.
Sujete las pinzas con cada mano
- 4.
Pase una hebra de sutura entre las fibras de la gasa siguiendo las formas geométricas de la hoja (fig. 12c).
- 5.
Para la primera figura, introduzca la hebra con la mano dominante y recíbala con la otra. Luego, cambie la mano con la que inicia el ejercicio, y así sucesivamente hasta terminar todas las figuras (fig. 12d).
- •
Instruir al estudiante para que adopte una posición ergonómica adecuada frente al microscopio y el instrumental microquirúrgico32–35.
- •
Implementar actividades que le permitan al estudiante adquirir habilidades en sutura con ambas manos realizando puntos simples y continuos36–38.
- •
Promover en el estudiante la ejecución de movimientos de bastante precisión con pinzas, portaagujas y sutura39–42.
- •
Desarrollar la habilidad en la manipulación delicada y precisa de los tejidos43–45
- 1.
Plantilla de sutura
- 2.
Sutura 3-0 y 10-0
- 3.
Portaagujas
- 4.
Pinzas de relojero
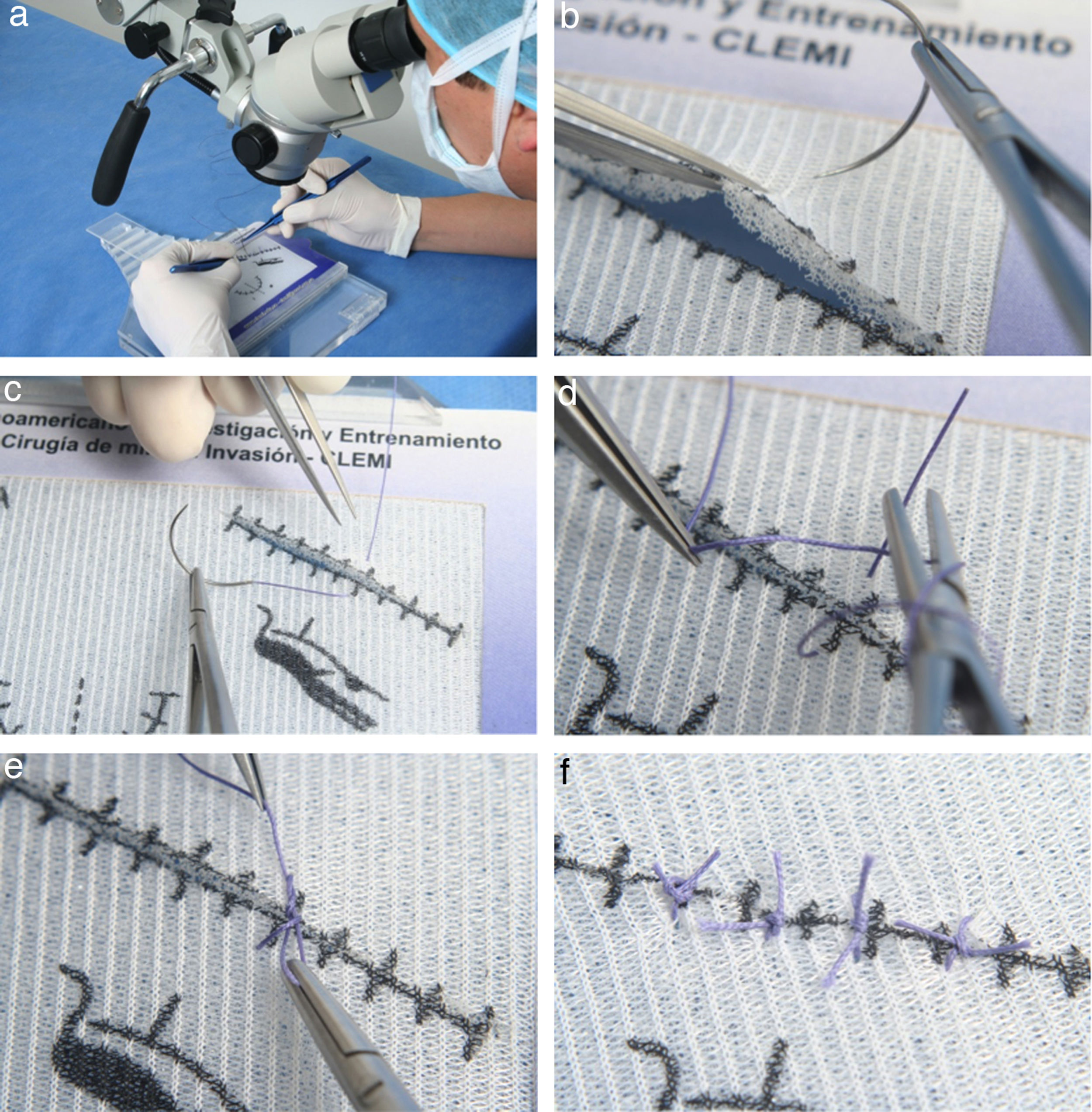
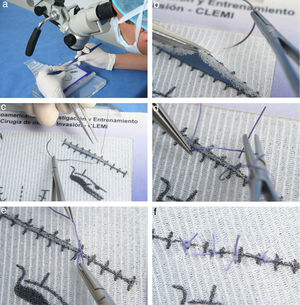
Este ejercicio consiste en realizar puntos simples sobre trazos (lineales y semicurvos) demarcados en la plantilla, la cual está dividida en dos partes iguales, izquierda y derecha. Realice los puntos en el lado de la plantilla que corresponde a su mano dominante (fig. 13a)46.
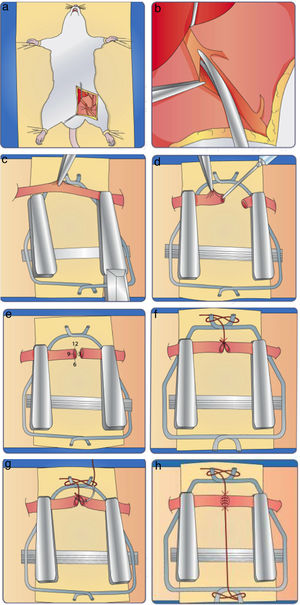
a. General del microscopio, participante y ejercicio. b. Sutura pinza tomando borde superior y preparando la aguja. c. Hale la aguja para pasar el hilo. d. Realizado los 2 bucles o giros preparándose para tomar el cabo suelto. e. Tensionando para cerrar el nudo tomando el cabo suelto. f. Varios nudos a lo largo de toda la plantilla.
- 1.
Pase la aguja en forma perpendicular a través del trazo lineal en dos tiempos. En el primer tiempo, tome con la pinza el borde superior de la incisión y atraviéselo con la aguja. En el segundo tiempo, tome con la pinza el borde inferior y atraviéselo con la aguja (fig. 13b).
- 2.
Las distancias entre los lugares de entrada o salida de la aguja y el borde de la incisión deben ser iguales y escasas.
- 3.
Con el fin de generar el menor trauma posible, pase la aguja mediante un giro de muñeca y no empujándola. Igualmente, cuando la hale para pasar el hilo hágalo en sentido horizontal y no vertical u oblicuo. (fig. 13c).
- 4.
Para anudar, levante el hilo con la mano izquierda tomándolo a 1,5cm del cabo. Pase la sutura dejando un pequeño cabo que le servirá para cerrar el nudo.
- 5.
Realice un doble giro o bucle con la pinza sobre el portaagujas. (fig. 13d).
- 6.
Tome el cabo suelto con el portagujas y deje deslizar los bucles sobre este hasta tensar el nudo (fig. 13e).
- 7.
Realice de nuevo dos giros o bucles sencillos sobre el portaagujas en sentido contrario, deslice y tensione de nuevo. Corte los extremos de la sutura.
- 8.
Repita este procedimiento en ambas partes de la plantilla y sobre el trazo semicircular (fig. 13f).
- •
Instruir al estudiante para que adopte una posición ergonómica adecuada frente al microscopio y el instrumental microquirúrgico
- •
Implementar actividades que le permitan al estudiante adquirir habilidades en corte y sutura con ambas manos realizando puntos simples47.
- •
Promover en el estudiante la ejecución de movimientos de precisión con pinzas, portaagujas y sutura
- •
Desarrollar habilidades en la manipulación cuidadosa de los tejidos
- •
Crear habilidades en corte, disección y sutura de vasos sanguíneos48.
- 1.
Sutura 3-0 4-0
- 2.
Portaagujas
- 3.
Pinzas de relojero
- 4.
Tijera
- 5.
Material orgánico cilíndrico
- 6.
Base para material orgánico cilíndrico
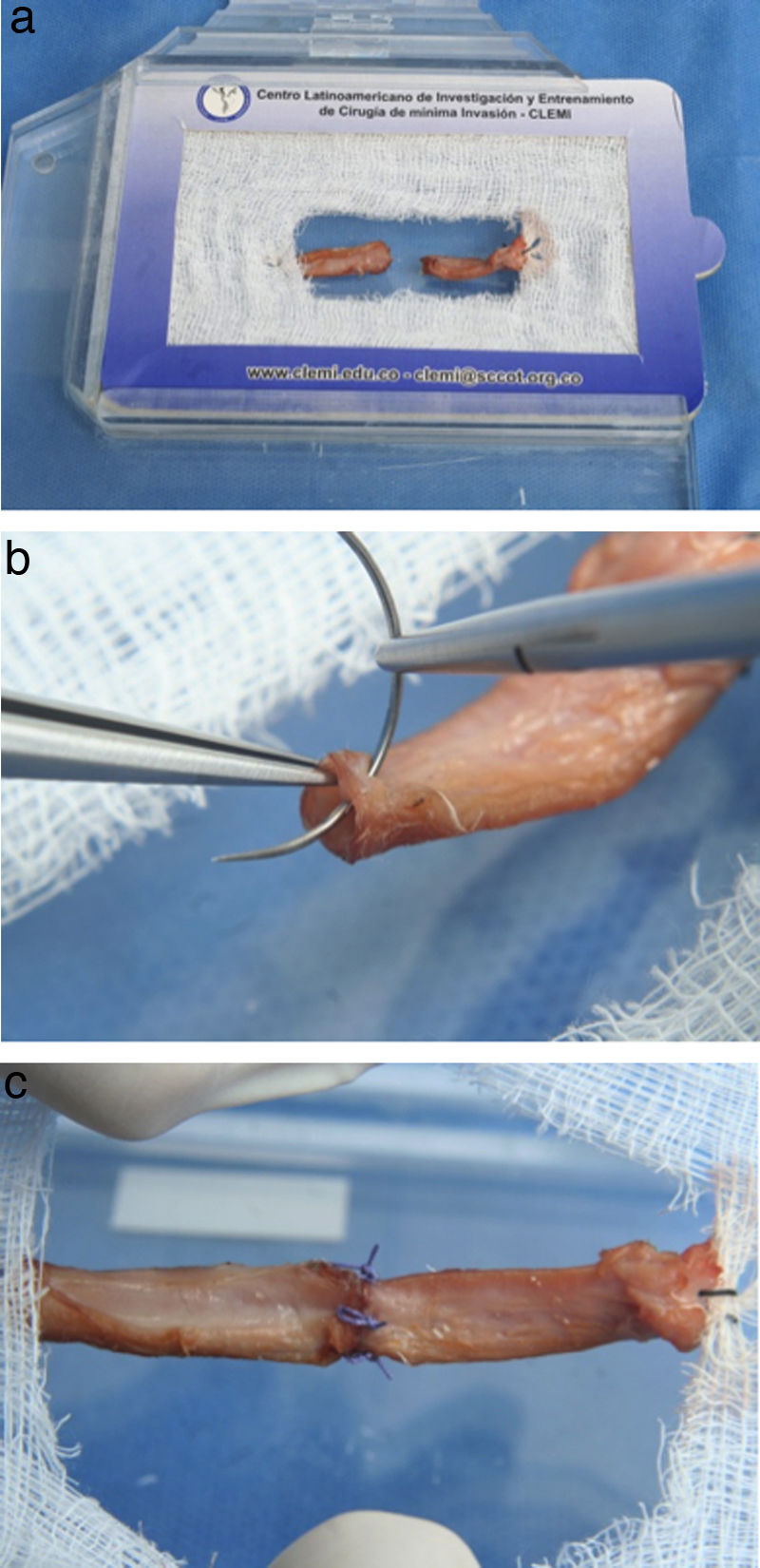
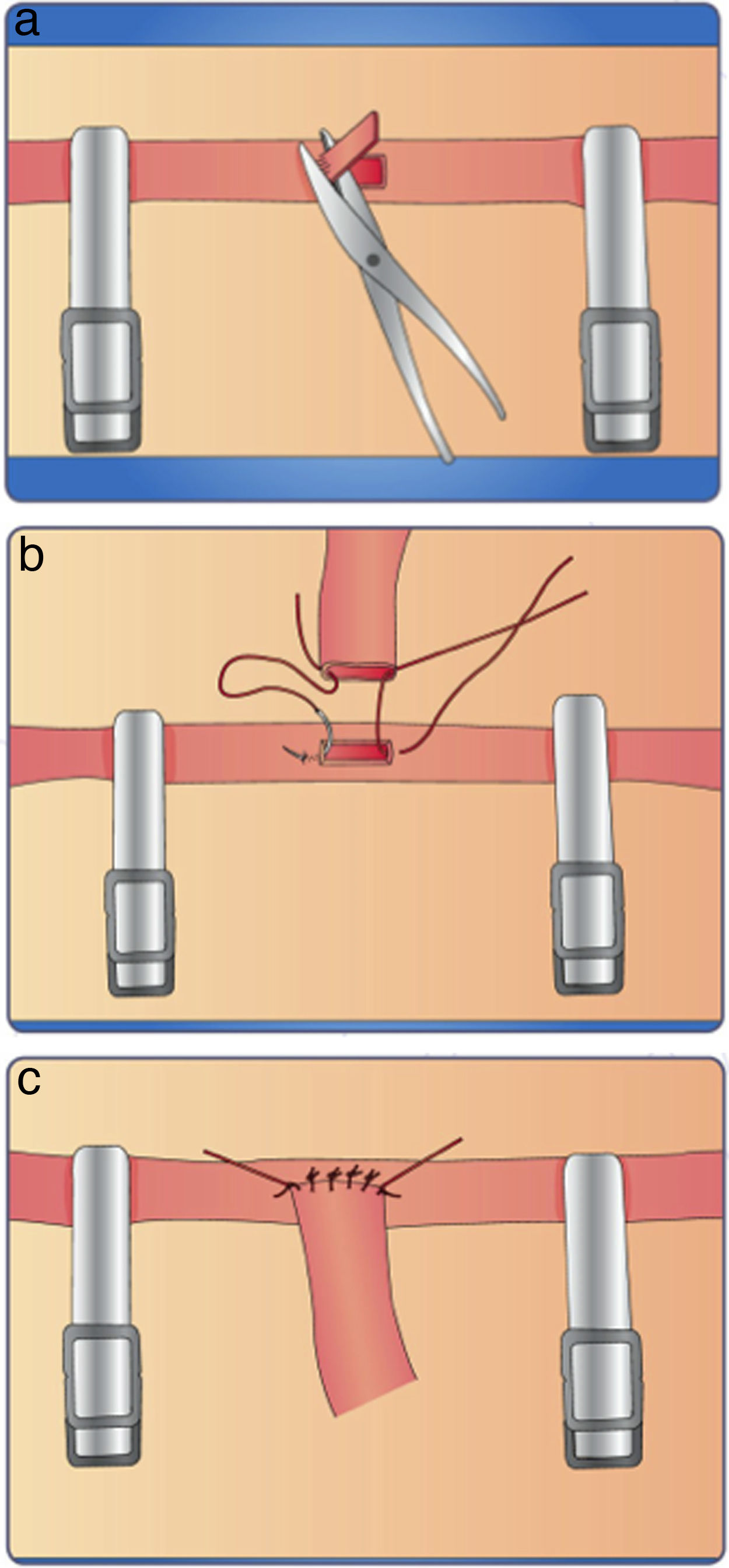
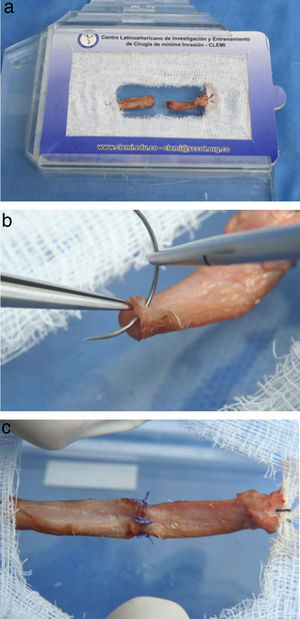
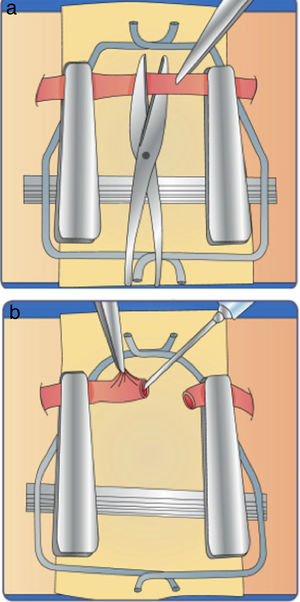
Este ejercicio consiste en realizar la técnica de anudado término-terminal sobre una arteria extraída de un órgano bovino.
Instrucciones- 1.
Ajuste el microscopio a sus necesidades ergonómicas.
- 2.
Ubique la arteria y haga un corte sobre la parte media de la misma (fig. 14a).
- 3.
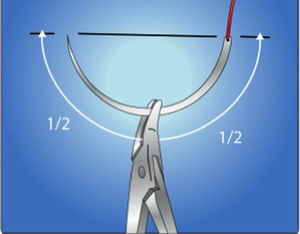
Para realizar la sutura, tome como guía las manecillas del reloj.
- 4.
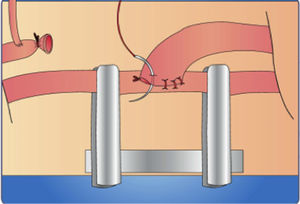
Coloque la primera sutura a las 9:00 del reloj, sea diestro o zurdo. (fig. 14b).
- 5.
La segunda sutura debe quedar a las 6:00, la tercera a las 3:00 y la última a las 12:00, con el fin de que la distancia entre los puntos sea la misma. (fig. 14c).
- •
Instruir al estudiante para que adopte una posición ergonómica adecuada frente al microscopio y el instrumental microquirúrgico.
- •
Fortalecer las habilidades adquiridas durante el desarrollo del curso.
- •
Afianzar en el estudiante la ejecución de movimientos que requieren precisión.
- •
Desarrollar habilidades en la manipulación cuidadosa y delicada de los tejidos49,50.
- 1.
Suturas 3-0, 10-0, 9-0
- 2.
Portaagujas
- 3.
Pinzas de relojero
- 4.
Tijera
- 5.
Modelo experimental animal (rata Winstar)
A continuación se describe una guía con las maniobras básicas para llevar acabo este tipo de técnica:
- 1.
Tome la parte media de la aguja con el portaagujas o la pinza angulada de relojero en su mano dominante tome la aguja en parte media o 2/3 con relación a la punta de la misma y posiciónela perpendicularmente a la pared del vaso, de manera que formen un ángulo de 90°, (fig. 15a).
Figura 15.a. Paso de la aguja. b. Distancia de ingreso de la aguja. c. Sujeción distal de la aguja. d. Contrapresión al atravesa la pared del vaso.e. Paso de la aguja con movimientos suaves. f. Cabo de 4 ó 5 mm. g. Toma correcta del cabo. h. Cruce del cabo al otro extremo del campo de sutura. i. Ubicación de portaagujas y pinza para el anudado. j. Maniobra para la realización de bucles o giros. k. Toma del cabo suelto. l. Tracción de laaguja y el cabo en sentidos opuestos. m. Tracción cuidadosa de la hebra. n. Cierre del nudo halando cada hebra. o. Ajuste y cierre del nudo. p. Paso de aguja y hebra al lado izquierdo. q. Realización del bucle o giro sencillo o doble. r. Toma del cabo suelto. s. Paso del cabo suelto a través del bucle. t. Nudo finalizado. u. Ajuste y cierre de nudo. v. Corte del nudo.
- 2.
Penetre en el borde de la incisión tomando una distancia, 2 veces del espesor de la incisión, tome la pinza de relojero en su mano izquierda semiabierta en la luz del vaso para hacer contrapresión (fig. 15b).
- 3.
Empuje la aguja suavemente con pequeños movimientos muy finos en línea con la curvatura de la aguja.
- 4.
Tome distalmente la aguja con el portagujas o pinza (fig. 15c).
- 5.
Introduzca la punta en el interior del lumen y nuevamente en dirección perpendicular a la dirección del vaso, atraviéselo haciendo contrapresión en el exterior con la pinza de relojero (fig. 15d).
- 6.
Empújela con movimientos suaves (fig. 15e).
- 7.
Extraiga la aguja y la mayor cantidad de hilo de manera que sobre un cola de 4 o 5mm por fuera (fig. 15f).
- 8.
Tome con la pinza en la mano derecha el cabo que tiene la aguja y crúcelo al otro extremo del campo de la sutura (al lado del inicio) (fig. 15g y fig. 15h).
- 9.
Pase la pinza de la mano izquierda por debajo del hilo y haga una doble lazada. Coja el cabo suelto que está al lado derecho y anude sin tensión de tal forma que los bordes queden afrontados (fig. 15i, fig. 15j, fig. 15k, fig. 15l, fig. 15m, fig. 15n, fig. 15ñ y 15°)
- 10.
Con la mano izquierda regrese el cabo que tiene la aguja al lado izquierdo. (fig. 15p)
- 11.
Pase la pinza derecha por debajo del hilo y con la mano izquierda haga una lazada y anude (fig. 15p, fig. 15q, fig. 15r, fig. 15s, fig. 15t y fig. 15u).
- 12.
El anudar es visual, no ejerza mucha tensión ya que podría romper el hilo. Corte los hilos a 1 o 2mm del nudo (fig. 15v).
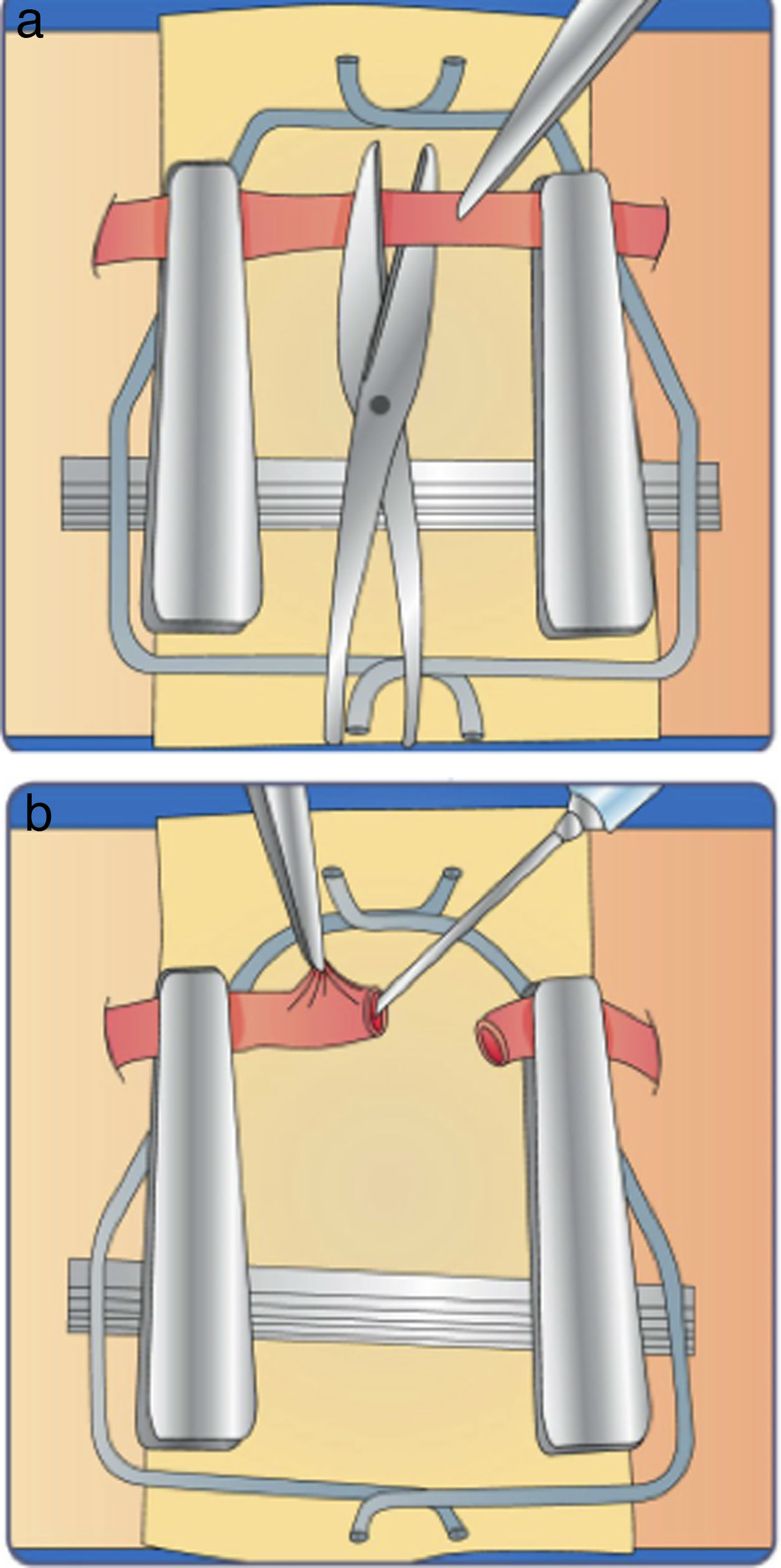
Esta técnica se basa ubicar los puntos, de tal manera que facilite el anudado simetrico de los puntos siguientes.
Instrucciones- 1.
Coloque la primera sutura en la posición 10:00 según las manecillas del reloj dejando largas las hebras con el fin de sujetarlos en el marco.
- 2.
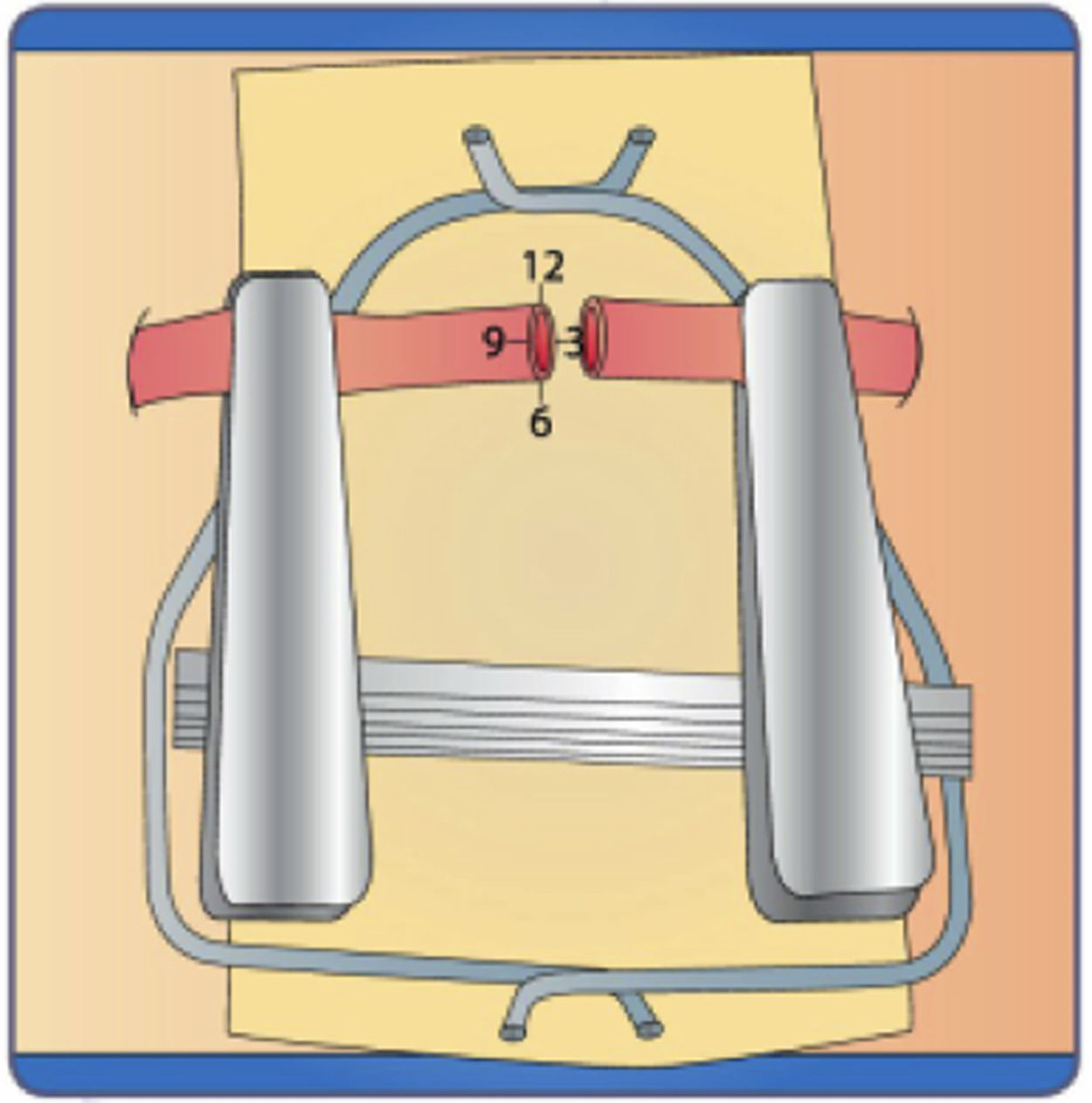
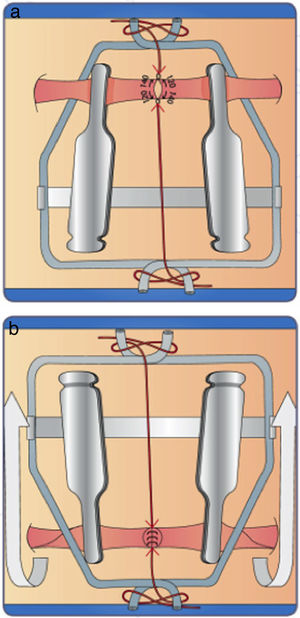
Coloque la segunda sutura debe quedar a 120° - 140° de la inicial es decir a las 6:00 fije las hebras o hilos en el marco con suficiente tensión, se recomienda ubicar el siguiente punto a 120° de los iniciales “tercer punto” dejando la hebra con suficiente longitud para manipular y así mismo formar el efecto “carrel” el cual separa la pared posterior del vaso evitando así tomarla con los demás puntos (fig. 16 a)
- 3.
Suture la pared anterior, posteriormente se gira el clamp y se prosigue a suturar la pared posterior, con número de puntos a criterio y espacio existente (fig. 6b)
Esta técnica se basa ubicar los puntos de tal manera que facilite el anudado simétrico de los puntos siguientes.
Instrucciones- 1.
Coloque la primera sutura es colocada en una posición 3:00 0 9:00 de acuerdo a las manecillas del reloj, la segunda sutura es ubicada 180° a la inicial.
- 2.
Invierta el clamp y se sutura la pared posterior.
- 3.
Invierta nuevamente el clamp- y se procede a realizar sutura en la pared anterior, con un número de puntos a criterio y espacio existente. Verifique siempre que no sea la pared opuesta (fig. 17a).
Este ejercicio se basa en realizar anastomosis en el modelo experimental basado en las técnicas de sutura explicadas anteriormente
Instrucciones- 1.
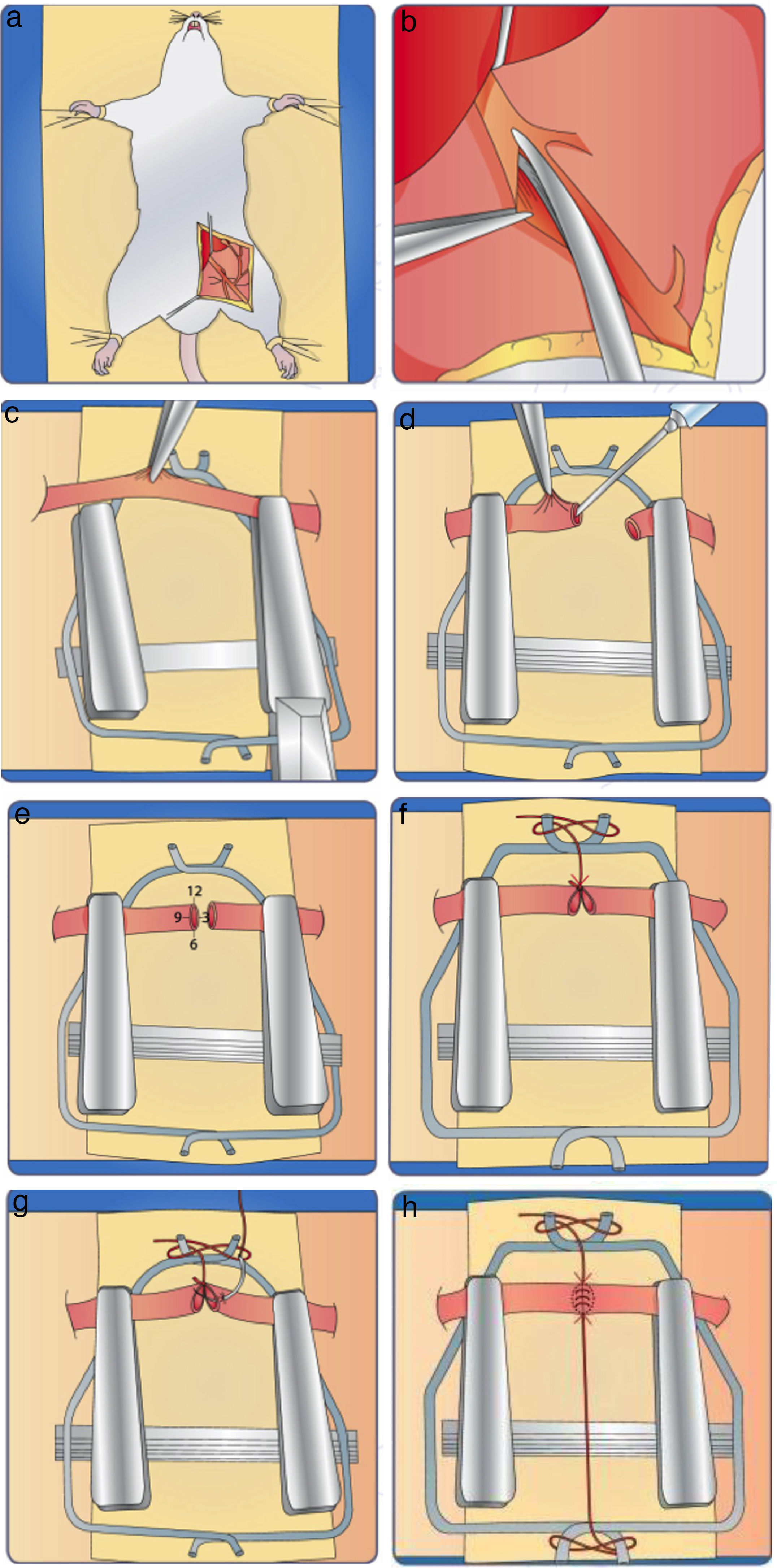
Ajuste el microscopio a sus necesidades ergonómicas y ubique el modelo experimental debajo del campo visual.
- 2.
Haga una incisión en el miembro inferior a lo largo de la región femoral (fig. 18a)
- 3.
Diseque y despeje los vasos femorales arteria y vena (fig. 17 b)
- 4.
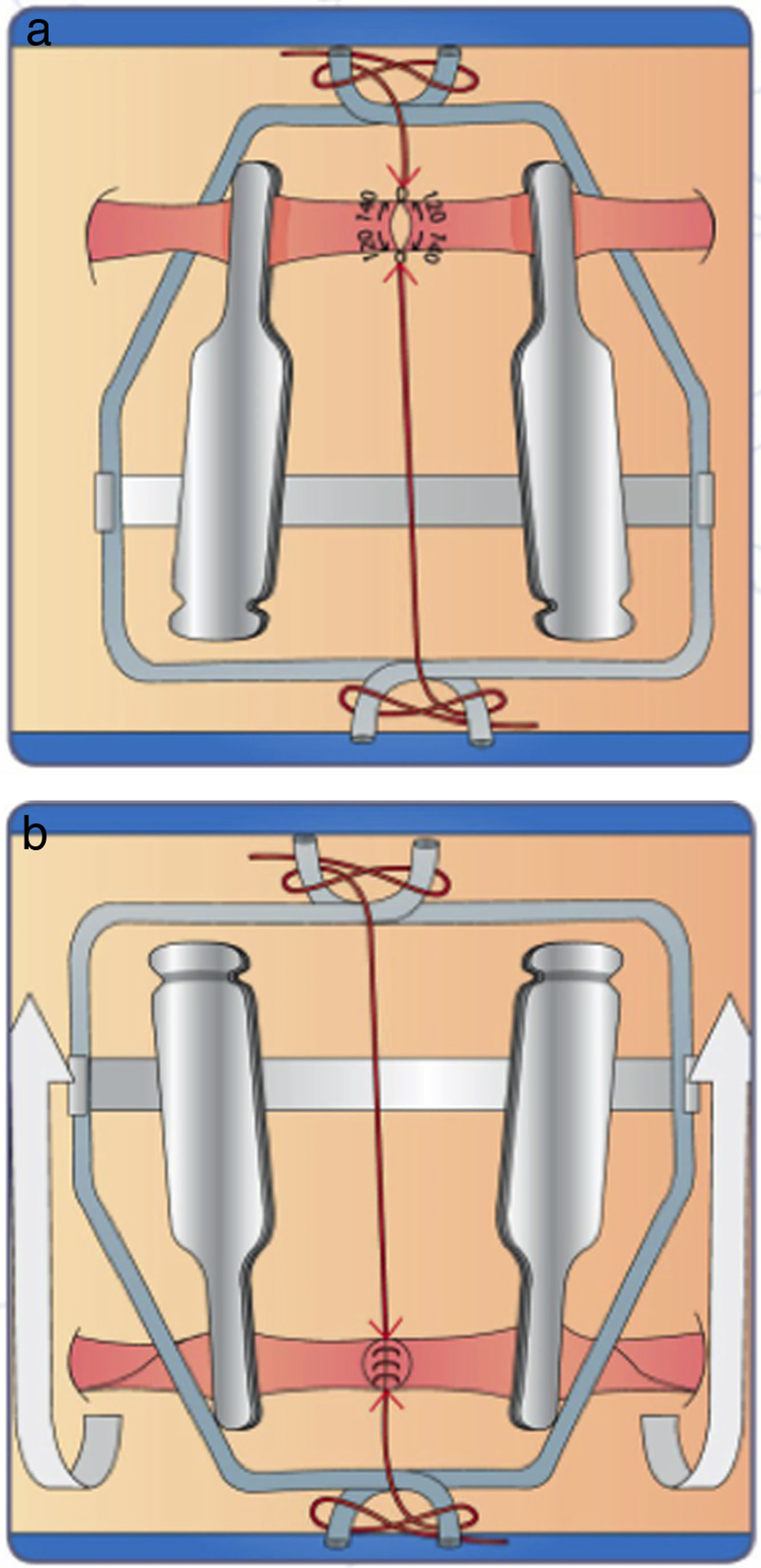
Una vez liberado el vaso colocamos el clamp doble Acland, teniendo la precaución de evitar el enrollamiento del mismo y aproximamos los extremos de los vasos a anastomosar para quitar tensión al mismo (fig. 18c).
- 5.
Debajo del vaso ubique un material que sirva de contraste de color azul, amarillo o verde con el fin de obtener trasfondo, Realice la arteriotomia siempre con un buen alineamiento del vaso.
- 6.
Para evitar el vasoespasmo aplique lidocaína al 1% o con una gasa con solución universal tibia, para manipular los vasos hágalo con las pinzas cogiendo solamente la adventicia, dilate suavemente el orificio del vaso utilizando para ello la punta roma de la pinza de relojero por ello no tome el vaso (fig. 18d).
- 7.
La técnica se basa en la realización de tres puntos guías, dos en la cara anterior y uno en la cara posterior con una separación de 120° entre cada uno de ellos, alrededor de los cuales iremos realizando los restantes puntos, hasta terminar la sutura.
- 8.
Coloque el primer punto guía en la cara anterior del vaso a la altura de las 12:00 en la esfera del reloj (fig. 18e).
- 9.
Una vez realizado, y con el fin de mantener la visión, enrolle en uno de los extremos del clamp (fig. 18f)
- 10.
Realice el segundo punto también en la cara anterior y a 120° del primero, a la altura de las 4:00 en la esfera del reloj (fig. 18g). Coloque el tercer punto guía en la parte media a la altura de las 8:00 y traccione. Realice los puntos restantes, situándolos a ambos lados de cada punto guía a una distancia proporcional entre estos y el punto guía hasta finalizar la suturan del vaso.
- 11.
Terminada la sutura, lave el campo operatorio con solución universal tibia. Quite el clamp distal y, luego, el proximal. Revise que no hallan fugas y si las hay, ponga de nuevo el clamp y realice los puntos de sutura necesarios (fig. 18h)
- 12.
Retire el clamp y realice la prueba de permeabilidad del vaso.
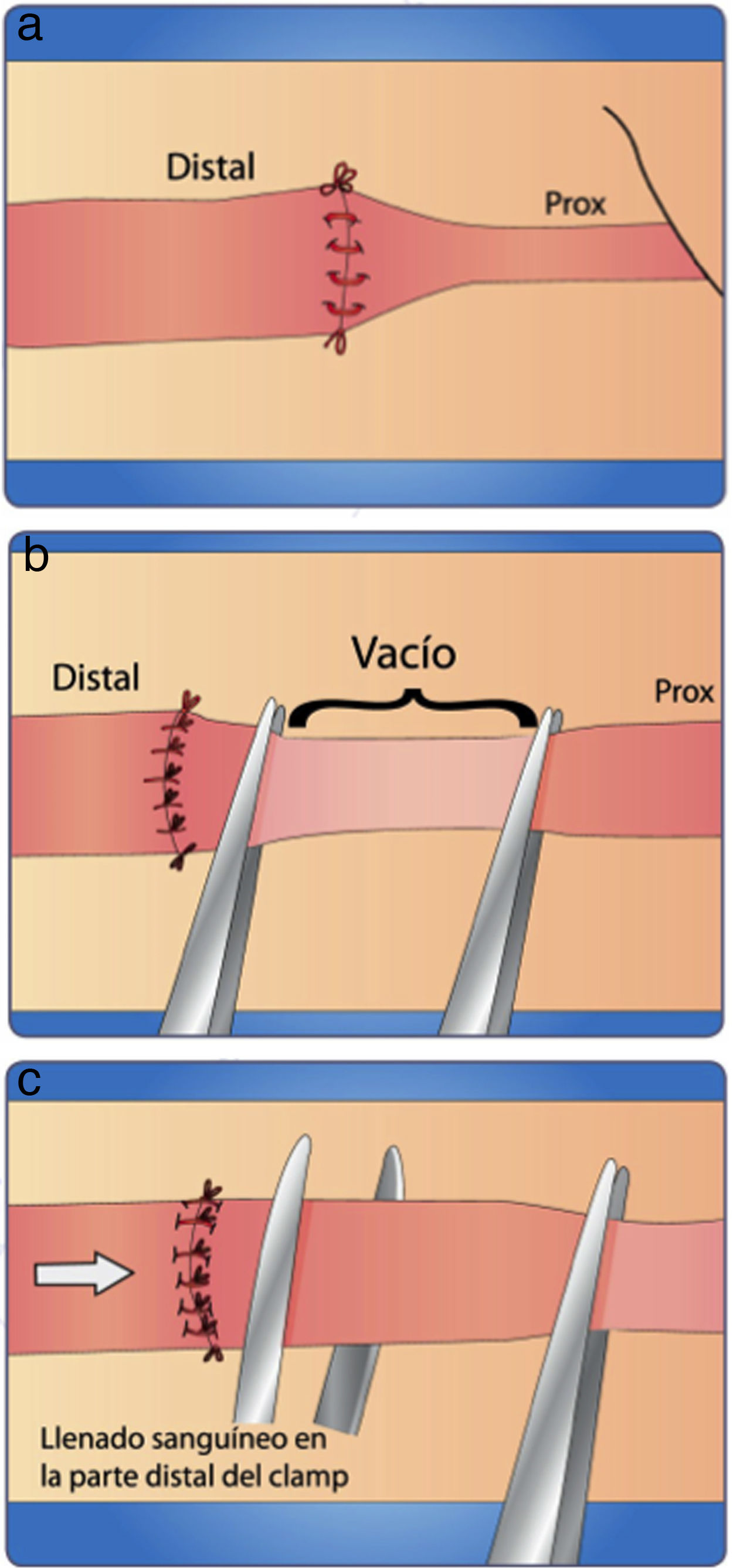
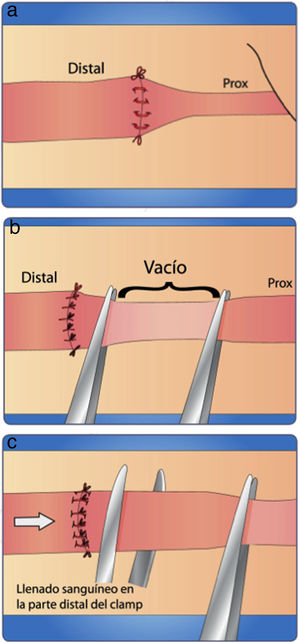
Suelte la mordaza distal del clamp y evalúe el retorno venoso (si se distiende la vena) (fig. 19a)
Coloque una pinza proximal a la sutura, ordeñe con otra pinza (fig. 19b) de la proximal hacia distal en forma muy suave y suéltela
Verifique que el vaso se llena nuevamente (fig. 19c).
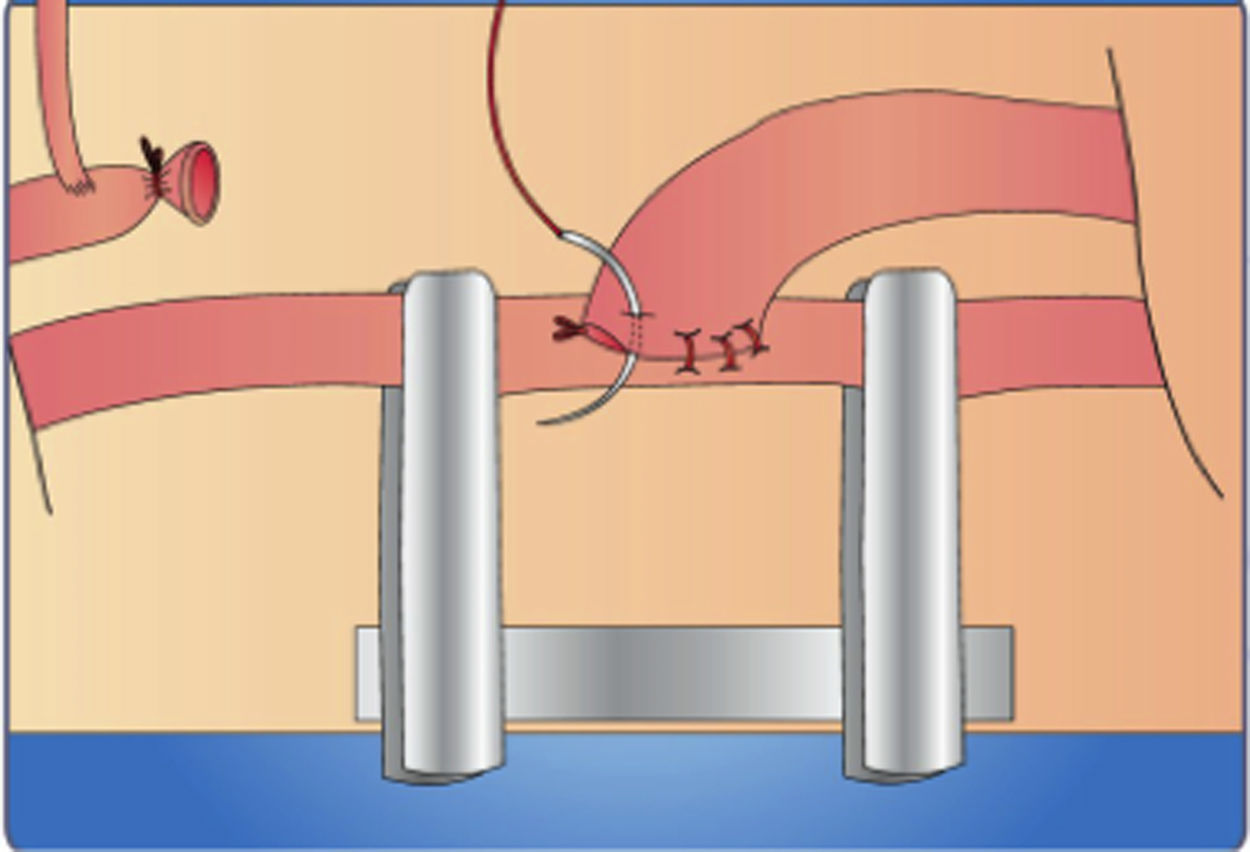
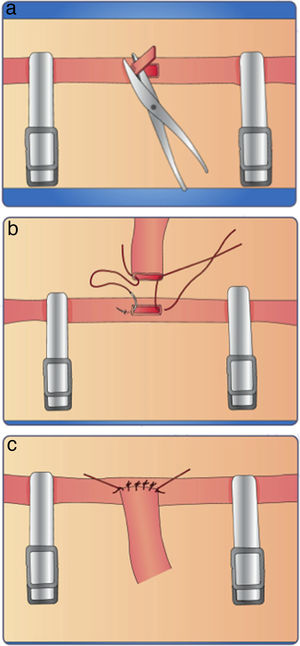
Ejercicio No 6. Anastomosis término-lateralInstruccionesColoque el clamp vascular en el vaso receptor, seguidamente resecaremos una superficie de su capa adventicia de igual tamaño que el diámetro del vaso donante.
En el mismo lugar de la adventicia resecada, seccione y reseque una parte de esta arteria de igual tamaño al del diámetro donante y lave el campo quirúrgico con una solución de liquido universal (fig. 20a).
Aproxime el vaso donante al orificio realizado como vaso receptor. Fíjelos mediante la colocación de dos puntos en sus extremos, evitando la tensión con los clamps; estos dos puntos le van a servir como guía.
Suture la pared superior en la parte media y posteriormente la pared inferior (fig. 20b)
Comience a situar el resto de los puntos continúe con puntos separados hasta completar la anastomosis (fig. 20c).
Ejercicio No 7. Sutura término-terminal venosaInstrucciones- 1.
La técnica de preparación es similar a la arterial, la vena es una pared más delgada y por ello la manipulación debe ser sumamente cuidadosa.
- 2.
Coloque el clamp en la parte distal luego de una transección de la vena. Ubique una cinta de color con el fin de obtener trasfondo y haga una venotomía continuando con un lavado tanto de la sangre como del campo quirúrgio (fig. 21a).
- 3.
Identifique el lumen y para ello irrigue con solución universal abundante creando una laguna lo cual facilita el procedimiento, la distancia para el paso de las suturas desde el borde de la vena debe ser dos a tres veces el espesor de la pared. Con el campo quirúrgico limpio, reseque la capa adventicia (fig. 21b)
- 4.
Continue con el mismo procedimiento realizado con la anastomosis arterial.
- 1.
Ubique el vaso receptor, clampeelo y diseque la adventicia.
- 2.
Seccione y reseque la circunferencia receptora de la vena, teniendo en cuenta el diámetro del vaso donante. Lave la sangre del campo quirúrgico así como la existente en la luz vascular.
- 3.
Aproxime el vaso donante al orificio realizado en el vaso receptor; recuerde que antes de esta maniobra se ha resecado la adventicia del extremo del vaso donante. Fije los vasos mediante la colocación de dos puntos en sus extremos evitando la tensión con los clamps. Coloque un tercer punto de fijación en la parte media para facilitar la sutura.
- 4.
Gire el clamp 180° para suturar la parte anterior del vaso; inicie con un punto en la parte media para facilitar la sutura.
- 5.
Una vez terminada la sutura, lave y limpie el campo quirúrgico y quite los clamps (fig. 22a).
Los autores declaran no tener ningún conflicto de intereses.