La viabilidad miocárdica es un concepto originado en la observación de la mejoría de la función ventricular posterior a la revascularización miocárdica. Su identificación no implica necesariamente la recuperación funcional después de la intervención. Puede ser evaluada mediante varios métodos no invasivos de imagen cardiaca que aportan información complementaria haciendo de su abordaje un método multimodal. Las modalidades de imagen disponibles se seleccionarán de acuerdo con la información requerida para el manejo clínico. Los métodos de Medicina nuclear proveen información acerca de la anatomía, fisiología y perfusión miocárdica, identificando lesiones coronarias funcionalmente significativas, segmentos viables y función sistólica global y regional ventricular izquierda. La perfusión miocárdica por tomografía computarizada por emisión de fotón único, SPECT-MPI gatillado, cuenta con evidencia de un adecuado rendimiento operativo y costoefectivo que permite evaluar de manera apropiada la presencia de viabilidad. La tomografía por emisión de positrones –PET- permite evaluar viabilidad, enfermedad microvascular coronaria, enfermedad coronaria sin obstrucción epicárdica significativa, isquemia subendocárdica e insuficiencia cardiaca. La decisión de revascularización es multifactorial e individualizada, en cuyo caso la determinación de viabilidad es uno de los factores de análisis.
Myocardial viability is a concept arising from the observation of the improvement in ventricular function after myocardial revascularisation. Its identification does not necessarily imply functional recovery after the intervention. It can be evaluated by several non-invasive cardiac imaging methods that provide complimentary information, making its approach a multimodal method. The imaging modes available are selected depending on the information required for clinical management. The Nuclear Medicine methods provide information on the anatomy, myocardial physiology and perfusion, identifying functionally significant coronary lesions, viable segments, global systolic and regional left ventricular function. Gated single-photon emission computed tomography (SPECT) myocardial perfusion imaging (MPI), has shown to be a suitable and cost-effective tool to effectively evaluated viability. Positron emission tomography (PET) can evaluate viability, coronary microvascular disease, coronary disease without significant epicardial obstruction, subendocardial ischaemia, and heart failure. The decision to revascularise depends on many factors and is individualised, in which case viability is one of the analysis factors.
Entre las modalidades no invasivas de imagen cardíaca, la Medicina nuclear dispone de la perfusión miocárdica por tomografía computarizada por emisión de fotón único SPECT-MPI gatillado, de la tomografía por emisión de positrones PET y de métodos híbridos. El SPECT-MPI gatillado ha logrado situarse como herramienta diagnóstica fundamental dentro del abordaje diagnóstico, pronóstico y de decisión terapéutica en Cardiología, con suficiente evidencia clínica acerca de su rendimiento y costoefectividad1. Permite diagnosticar y localizar la enfermedad coronaria, evaluar la extensión y gravedad de trastornos de perfusión detectables mediante gammagrafía y establecer el pronóstico, en especial en individuos sintomáticos2, contribuyendo a la planificación de la terapia farmacológica e intervencionista3. Provee información importante acerca de la perfusión coronaria en reposo y post-estrés, así como de la viabilidad y la función sistólica global y regional ventricular izquierda. Adicionalmente, permite la evaluación de disincronía intraventricular izquierda mediante el análisis de fase para estimar la respuesta a terapia de resincronización cardíaca. El resultado de la perfusión cambia la conducta y orienta al cardiólogo hacia la mejor aproximación terapéutica.
El objetivo de esta revisión es presentar evidencia sobre la utilidad de los estudios gammagráficos para valorar la viabilidad miocárdica en el contexto de pacientes con fracción de eyección disminuida.
DefiniciónEl concepto de viabilidad miocárdica se difunde en la literatura médica en la década de los ochenta4–6, para explicar la observación de mejora en la función ventricular en pacientes sometidos a revascularización miocárdica. Constituye un término general que agrupa miocardio normal (viable por definición, metabólicamente activo con función contráctil normal y con reserva contráctil en respuesta al estrés farmacológico o con el ejercicio) y miocardio enfermo (aturdido o hibernante). El aturdimiento miocárdico se refiere a la disfunción contráctil postisquémica en presencia de flujo coronario relativamente normal, después de un proceso de isquemia transitoria seguido de reperfusión. Implica procesos reversibles, únicos, múltiples, leves y cortos o prolongados, que van desde la enfermedad coronaria estable con episodios de isquemia transitorios, hasta el espectro del síndrome coronario agudo7. La recuperación funcional en general se produce horas a días después, y toma mayor tiempo en el caso de episodios isquémicos más largos previos al restablecimiento del flujo coronario. Se atribuye a la formación de radicales libres y niveles de calcio miocárdico elevados que llevan a daño de proteínas de los miocitos o de su retículo sarcoplasmático y desensibilización al calcio por sobrecarga inicial durante la reperfusión, que genera proteólisis de troponina I8.
El estado de hibernación miocárdica describe la disfunción crónica por alteración persistente del flujo coronario, y constituye un proceso reversible al mejorar la perfusión permitiendo la recuperación de la función contráctil. De esta manera, la evaluación de viabilidad puede realizarse previa a la revascularización, pero la identificación del estado hibernante puede hacerse solo a posteriori.
La denominación de viabilidad miocárdica no implica necesariamente la recuperación funcional después de la intervención, a pesar de usarse frecuentemente en la literatura científica de manera intercambiable con el concepto de hibernación, cuando en realidad son conceptos diferentes9. Las respuestas adaptativas de aturdimiento e hibernación pueden coexistir con presencia de tejido cicatricial necrótico junto con miocitos que exhiban función normal o disfunción metabólica o contráctil y flujo sanguíneo coronario normal o alterado.
Desde el punto de vista clínico, en pacientes que tienen grados similares de disfunción ventricular pueden verse grandes diferencias en la cantidad de miocardio viable e incluso grados extremos de adelgazamiento de la pared ventricular que no necesariamente indican la ausencia de viabilidad, lo cual puede convertirse en una limitación para ciertos métodos diagnósticos que evalúen morfología, pero no función o perfusión.
Cuando se evalúan diferentes pruebas para identificación de miocardio viable, pueden plantearse varios objetivos no clásicos de medición de viabilidad: recuperación de la fracción de eyección en reposo, recuperación de la función diastólica, prevención de isquemia inducible; prevención, estabilización y regresión de remodelado adverso, prevención de arritmias ventriculares.
Tradicionalmente, el concepto de viabilidad se refiere a la identificación de disfunción regional reversible tras la revascularización y en ese sentido, todas las técnicas de imágenes diagnósticas para identificar miocardio viable se han evaluado para este desenlace. Además del mejoramiento de la función, pueden estudiarse otros desenlaces para definir el beneficio de la intervención. Por ejemplo, se ha demostrado el efecto favorable de la revascularización en los volúmenes ventriculares, incluso sin mejoría en la fracción de eyección. Los volúmenes telediastólico y telesistólico aumentados son predictores de mortalidad en pacientes con disfunción ventricular izquierda, independientes de la fracción de eyección FE10–12. Aún este desenlace no ha sido adoptado para evaluar la precisión de técnicas que miden viabilidad.
FisiopatologíaEl sustrato energético miocárdico para la generación de ATP se basa en un 70% de ácidos grasos libres13, porcentaje que resulta mayor en diabéticos14. La disminución del aporte de oxígeno en enfermedad coronaria, insuficiencia cardíaca e hipertrofia ventricular izquierda virará la fuente de energía principal a la glicólisis, con un menor consumo de oxígeno, al reducirse el metabolismo oxidativo mitocondrial como mecanismo de mantenimiento funcional, que puede conducir a la disminución de la función contráctil. El cambio de ácidos grasos a glucosa como sustrato, probablemente representa la respuesta adaptativa más temprana a la isquemia miocárdica y es el proceso que ocurre durante la hibernación miocárdica. Puede originar reprogramación celular debida a episodios de isquemia recurrente, semejándose al ambiente fetal miocárdico dado por el incremento en el glucógeno miocárdico y ATP intracelular15.
Desde el punto de vista fisiopatológico, aturdimiento e hibernación comparten una reducción severa del flujo coronario y la restauración de la función contráctil al restablecer el flujo nuevamente, es decir la ausencia de necrosis miocárdica. La estrecha relación entre metabolismo y función contráctil ofrece la oportunidad de evaluar el desempeño cardíaco a diferentes niveles in vivo: flujo coronario, perfusión miocárdica, entrega de oxígeno, metabolismo y contractilidad16.
Los requerimientos fisiológicos para el estado de viabilidad celular miocárdica incluyen aporte suficiente de flujo sanguíneo miocárdico, sarcolema intacto, función membranosa mitocondrial y actividad metabólica preservadas, procesos que pueden ser evaluados apropiadamente mediante las técnicas de Medicina nuclear. El flujo sanguíneo miocárdico debe ser el suficiente para entregar el sustrato al miocito y ser usado en los procesos metabólicos para remover los productos finales de los mismos. Si el flujo regional se encuentra severamente reducido o ausente, los productos finales se acumularán y causarán inhibición de las vías enzimáticas, depleción de fosfatos de alta energía, disrupción de membrana y muerte celular. De este modo, en los extremos del rango de flujo sanguíneo los trazadores de la perfusión miocárdica proveen información respecto al estado de viabilidad.
Técnicas de Medicina nuclear para la evaluación de la viabilidad miocárdicaLas técnicas no invasivas disponibles para evaluar la viabilidad miocárdica pueden agruparse según el proceso fisiológico analizado, así:
- •
Evaluación de perfusión y metabolismo: SPECT-MPI gatillado, PET, ecocardiografía contrastada.
- •
Evaluación de función sistólica y reserva contráctil: ecocardiografia estrés con dobutamina o ejercicio, resonancia magnética cardiaca con estrés farmacológico, SPECT-MPI con vasodilatador, eco doppler tisular.
- •
Necrosis miocárdica: resonancia magnética cardiaca con realce tardío, tomografía computarizada (TC) multicorte cardíaco con realce tardío.
A continuación se revisan las modalidades disponibles en Medicina nuclear.
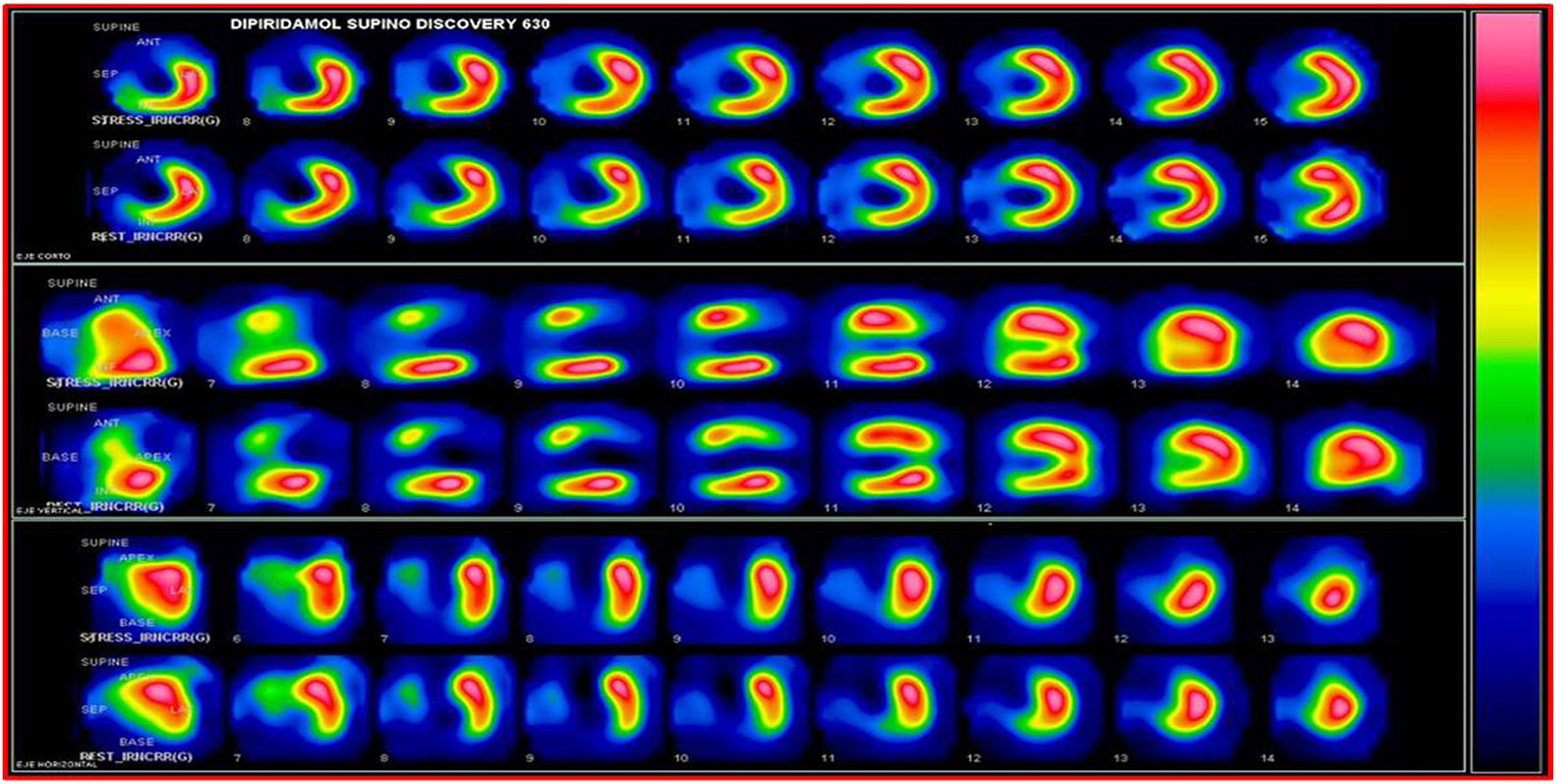
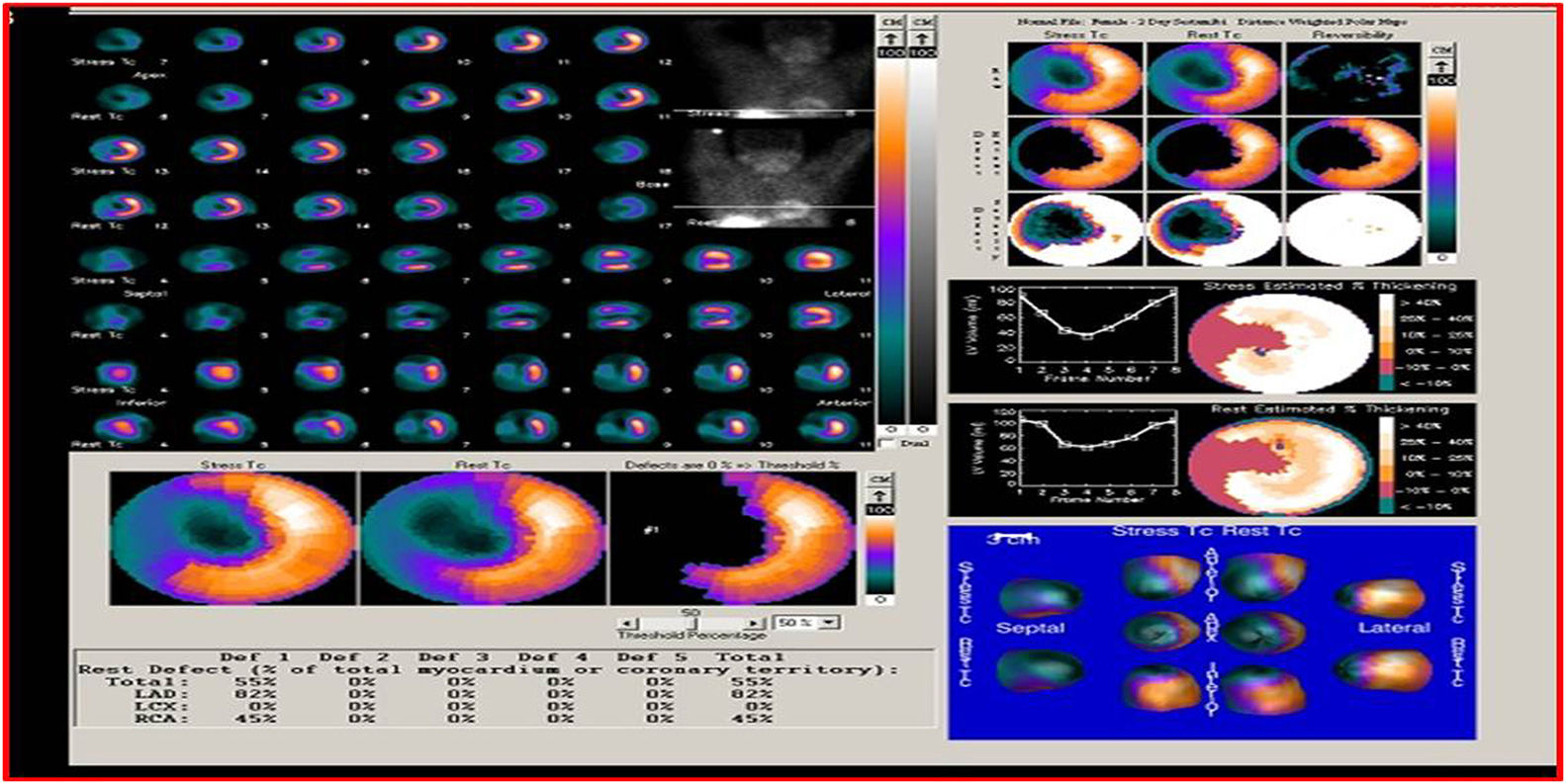
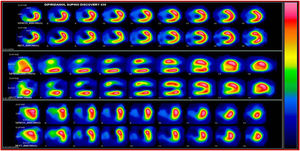
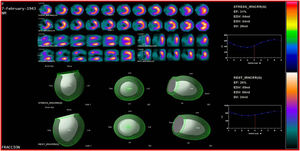
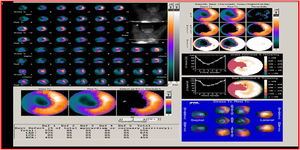
SPECT-MPI gatilladoEs una de las técnicas más utilizadas para la evaluación de viabilidad miocárdica. La demostración de viabilidad implica la integridad de la membrana de los miocitos mediante la captación de radiotrazadores como Tc99m SESTAMIBI MIBI y Tc99 tetrofosmin (menos validado en viabilidad), que son los más usados, y talio 201 ya en desuso por sus niveles de radiación mayores que los agentes marcados con tecnecio. Los estudios de perfusión miocárdica solicitados para juicio de presencia de necrosis e isquemia en pacientes con falla cardiaca, deben reportar los segmentos que captan el trazador por encima del 50% y que se consideran viables.
La viabilidad se valora en el mismo estudio de perfusión miocárdica usado para medir isquemia o se puede hacer con una sola adquisición después de la administración de nitrato sublingual para optimizar la captación del radiotrazador. En el caso de evaluación de isquemia y viabilidad se emplean dos inyecciones de radiotrazador: la primera durante ejercicio o vasodilatador y la segunda en reposo. El criterio de definición de viabilidad está representado por una captación mayor al 50% del trazador en un segmento disfuncional17 (figs. 1-3).
En cuanto al rendimiento diagnóstico se ha demostrado sensibilidad adecuada y similar (87% con rango entre 76-96% vs. 83% con rango entre 72 y 96%) entre Tc 99 y talio 201 para la predicción de recuperación funcional postrevascularización18, con mayor especificidad para los estudios con trazadores con tecnecio (65% rango 53-88 vs. 54% rango 25-65%)19.
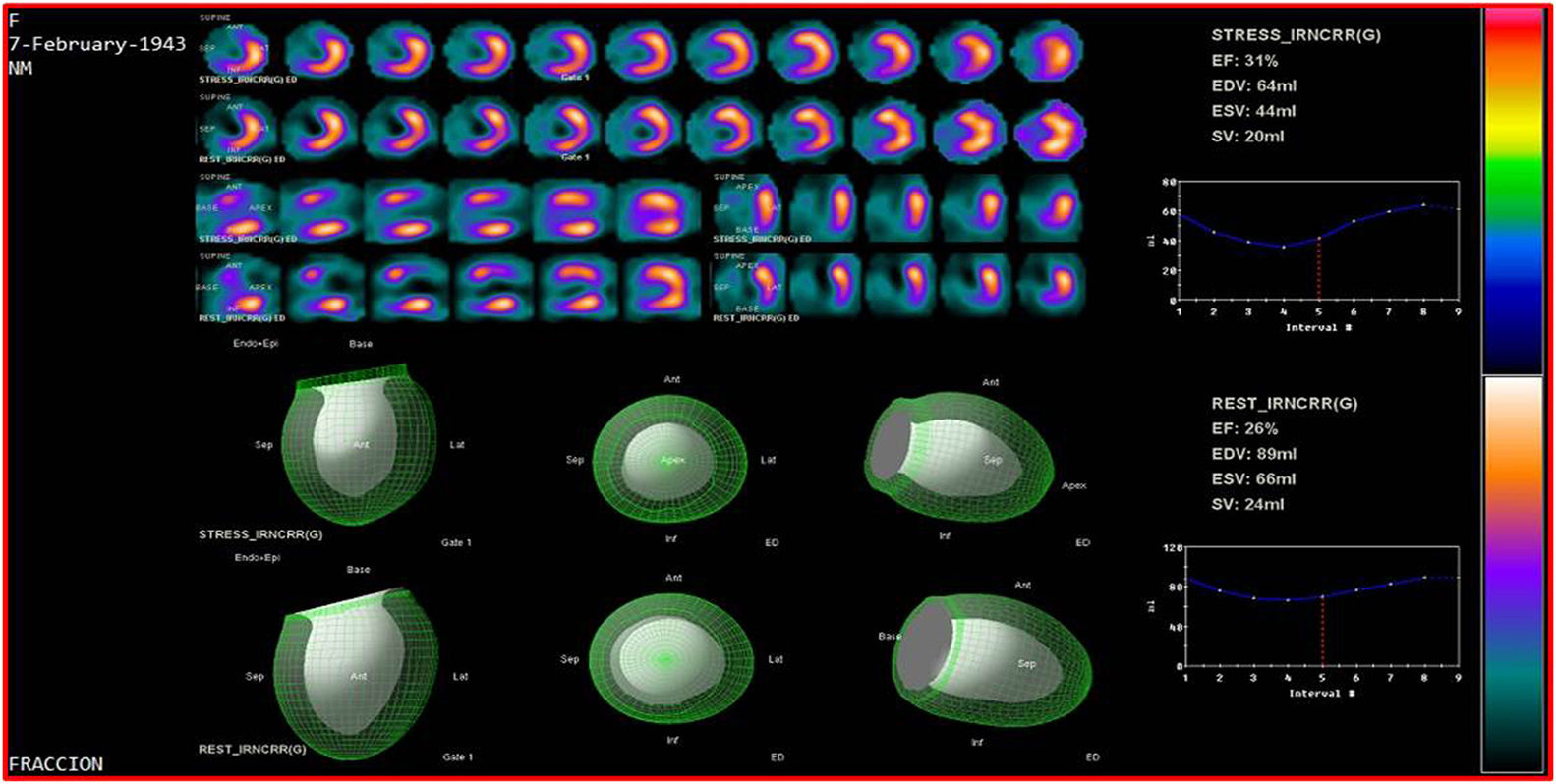
La adquisición gatillada facilita el estudio de la función regional y global, el engrosamiento regional, el cálculo de volúmenes telediastólicos y telesistólicos así como la estimación de la fracción de eyección ventricular izquierda, y la evaluación con estrés farmacológico. Se determina la función y la perfusión por segmentos, lo que la convierte en una de las técnicas más completas de evaluación de viabilidad al incrementar la especificidad al 78%20.
Si los radiotrazadores de tecnecio ven “viva” la célula, no se justifica el uso de técnicas más costosas como lo sería la tomografía por emisión de positrones.
Tomografía por emisión de positronesLa perfusión miocárdica con PET mediante el uso de amonio marcado con nitrógeno (13NH3) o rubidio-82 o agua marcada con oxígeno-15, permite la medición absoluta del flujo miocárdico. La imagen metabólica emplea 18F-fluorodesoxiglucosa (18F-FDG).
El tejido viable preserva o incrementa incluso el consumo de glucosa a diferencia del no viable, metabólicamente inactivo. Un estudio de perfusión normal con captación de glucosa normal es indicativo de viabilidad. El aturdimiento miocárdico mostrará función disminuida con perfusión y metabolismo relativamente normales.
El miocardio hibernante puede ser identificado por perfusión reducida con preservación o incremento del metabolismo (“mismatch” o incongruencia metabolismo-perfusión). El tejido necrótico tendrá función, perfusión y metabolismo reducidos o ausentes (“match” metabolismo perfusión).
Durante la fase metabólica es frecuente el uso de carga de glucosa oral o soluciones dextrosadas e insulina para el caso de los pacientes diabéticos con el fin de magnificar la captación miocárdica de glucosa del miocardio hibernante, que compite por la entrada al miocito. La evaluación del metabolismo cardíaco mediante PET facilita el estudio de la enfermedad microvascular coronaria, la enfermedad coronaria sin obstrucción epicárdica significativa, la isquemia subendocárdica, aquella asociada al remodelamiento hipertrófico y la insuficiencia cardiaca con fracción de eyección preservada como aplicaciones clínicas diferentes a la evaluación de viabilidad. El aporte de los estudios de PET se deriva de la posibilidad de la técnica de reconocer como viables los segmentos que no cumplen criterios con los trazadores de tecnecio empleado en SPECT. Los segmentos viables con tecnecio también van a captar adecuadamente con 18F-fluorodesoxiglucosa (18-FDG). Estos trazadores permiten evaluar la perfusión del miocardio al demostrar la integridad de la membrana celular y del metabolismo mitocondrial para su retención y captación en las imágenes sin presentar redistribución significativa a diferencia del talio201.
Un metaanálisis acerca de la capacidad predictiva de recuperación de la función regional, que combina perfusión y metabolismo con PET, encontró sensibilidad de 88% y especificidad del 74%20. La recuperación de la función global en términos de fracción de eyección es más relevante clínicamente, pero ha sido medida en pocos estudios. En un estudio europeo multicéntrico un incremento>5% en la FEVI fue predicho mediante PET, con sensibilidad de 79% pero baja especificidad (55%)21.
Varios estudios han comparado las técnicas de SPECT y PET encontrando resultados equivalentes22. Inicialmente se comparó el SPECT con Tl-201 encontrándose 88% de concordancia para viabilidad con imágenes de PET con 18F-FDG23. Un estudio que evaluó el desenlace de sobrevida libre de eventos en el que se comparó manejo guiado por PET con 13NH3 o 18F-FDG vs. SPECT Tc-99m concluyó que ambas técnicas son comparables para la detección de viabilidad24. Un metaanálisis a partir de 24 estudios observacionales publicado en 2002 que reúne 3.088 pacientes, mostró similar capacidad predictiva en términos de sobrevida posterior a revascularización entre las dos técnicas25, al igual que un metaanálisis del año 200426. Estos trabajos tienen grandes limitaciones por tratarse de estudios observacionales retrospectivos y en muchos casos no aleatorizados.
La extensión de tejido viable necesario para predecir beneficio después de revascularización no está definida y podría variar según el escenario clínico. La mayoría de estudios sugieren que se requiere al menos 18-30% de la masa ventricular izquierda para mejorar la FEVI27,28, valor que hasta el momento también resulta arbitrario. Porcentajes menores podrían ser relevantes clínicamente si reducen los eventos isquémicos, permiten el remodelamiento inverso, previenen la dilatación ventricular adicional promoviendo estabilidad eléctrica y mejoran la sintomatología y la capacidad funcional. Estos desenlaces deben ser evaluados mediante grandes estudios prospectivos que resuelvan los múltiples interrogantes existentes a la fecha.
Imagen cardíaca híbridaLa fusión de imágenes combina modalidades como la tomografía computarizada o la resonancia magnética y la perfusión miocárdica o la tomografía por emisión de positrones, y en teoría mejorarían la estratificación al añadir información anatómica y funcional29. Su indicación aún no está lo suficientemente establecida para efectos de costo vs. beneficio en el escenario de evaluación de viabilidad miocárdica.
Viabilidad y evidencia clínicaDesde el punto de vista clínico, los procedimientos de revascularización miocárdica y percutánea, así como la terapia médica se indican con el fin de mejorar la sobrevida y la sintomatología y reducir la incidencia de desenlaces como insuficiencia cardiaca, reinfarto, arritmias, entre otros. Los estudios disponibles en cuanto al rendimiento diagnóstico de evaluar viabilidad en la toma de decisiones, han definido varios desenlaces: función ventricular izquierda global y regional, clase funcional, capacidad de ejercicio, criterios de remodelación reversa, prevención de muerte súbita, volúmenes ventriculares y sobrevida.
Esta evidencia, en su mayoría, se basa en estudios retrospectivos, observacionales y metaanálisis que sugieren la viabilidad como factor asociado a la mejoría en la función ventricular y sobrevida en pacientes llevados a revascularización30,31. Aunque pareciese una consecuencia lógica el beneficio de la mejoría en la función ventricular posterior a la revascularización en los desenlaces clínicos, aún permanece el debate acerca del papel de la revascularización en el miocardio viable y la certeza de su beneficio definitivo en la sobrevida32.
En cardiopatía isquémica crónica, los estudios aleatorizados prospectivos, PET and Recovery Following Revascularization (PARR-2)33,34, Heart Failure Revascularization (HEART)35 y Surgical Treatment for Ischaemic Heart failure (STICH)36,37 no lograron demostrar un beneficio claro en la sobrevida de pacientes revascularizados con miocardio viable en comparación con el tratamiento médico óptimo aislado.
Estos ensayos poseen importantes problemas metodológicos, por ejemplo, el caso del estudio STICH, que fue diseñado para evaluar el papel de la viabilidad, donde se aleatorizaron enfermos coronarios con disfunción ventricular severa que fueron sometidos a tratamiento médico o revascularización quirúrgica con o sin cirugía de restauración ventricular. Se requiere evidencia categórica que permita resolver los múltiples interrogantes que dejan los estudios a la fecha.
De la imagen a la conducta clínicaLa definición adecuada del componente de viabilidad en pacientes con falla cardiaca de origen coronario cambia la decisión sobre revascularización y/o terapia farmacológica.
En el contexto de pacientes con insuficiencia cardíaca, la determinación de viabilidad hace parte de múltiples variables determinantes de la conducta clínica y en este sentido, las modalidades de imagen disponibles se seleccionarán con base en la información requerida para el manejo clínico de los pacientes, ya sea evaluación de integridad de membrana, estado de perfusión, actividad metabólica, reserva contráctil o morfología. Los pacientes con insuficiencia cardiaca requieren la diferenciación de etiología isquémica vs. no isquémica, la determinación de la necesidad de revascularización en el grupo de los isquémicos, la evaluación de la morfología y la función ventricular, la presencia y severidad de insuficiencia mitral y la posibilidad de uso de terapia de resincronización cardiaca. Por esta razón, el abordaje clínico de viabilidad es multimodal38.
La consideración de lo que constituye una técnica ideal para la evaluación de viabilidad va más allá de la rapidez, seguridad o reproducibilidad con la que cuentan SPECT-PMI gatillado y PET. Incluso una modalidad de imagen ideal, con la evidencia actualmente disponible, no existe, pues tendría que permitir cuantificar en forma precisa el territorio viable sin limitaciones técnicas ni artificios y con alta resolución espacial e incluso puede resultar insuficiente para predecir la mejora contráctil con beneficio clínico después de la revascularización39.
Existen factores adicionales no relacionados con limitaciones técnicas del método diagnóstico que pueden reducir su capacidad predictiva. Entre las descritas se encuentra el IAM peri- o postoperatorio no diagnosticado40, la revascularización incompleta a consecuencia de enfermedad coronaria difusa41 y la presencia de extenso territorio cicatricial adyacente a regiones con viabilidad que impida una mecánica contráctil correcta en caso de que se recuperen las zonas viables42.
Para segmentos miocárdicos en los que la reducción del flujo sanguíneo es de severidad intermedia, la evaluación aislada de la perfusión podría resultar insuficiente para determinar la viabilidad, y podría requerirse información adicional como los índices metabólicos, si bien las lesiones intermedias probablemente serían tributarias más de manejo médico que intervencionista o quirúrgico. Los segmentos evaluados como viables con los trazadores con tecnecio serán visibles con PET. Los trazadores PET utilizables en Colombia pueden identificar segmentos que cumplan el criterio de viabilidad en aquellos que con trazadores con tecnecio no lo cumplen.
De esta manera, ante flujo sanguíneo reducido con compromiso funcional ventricular global, las técnicas que evalúen la función de membrana celular o los procesos metabólicos celulares como SPECT-MPI gatillado y PET serían las de elección.
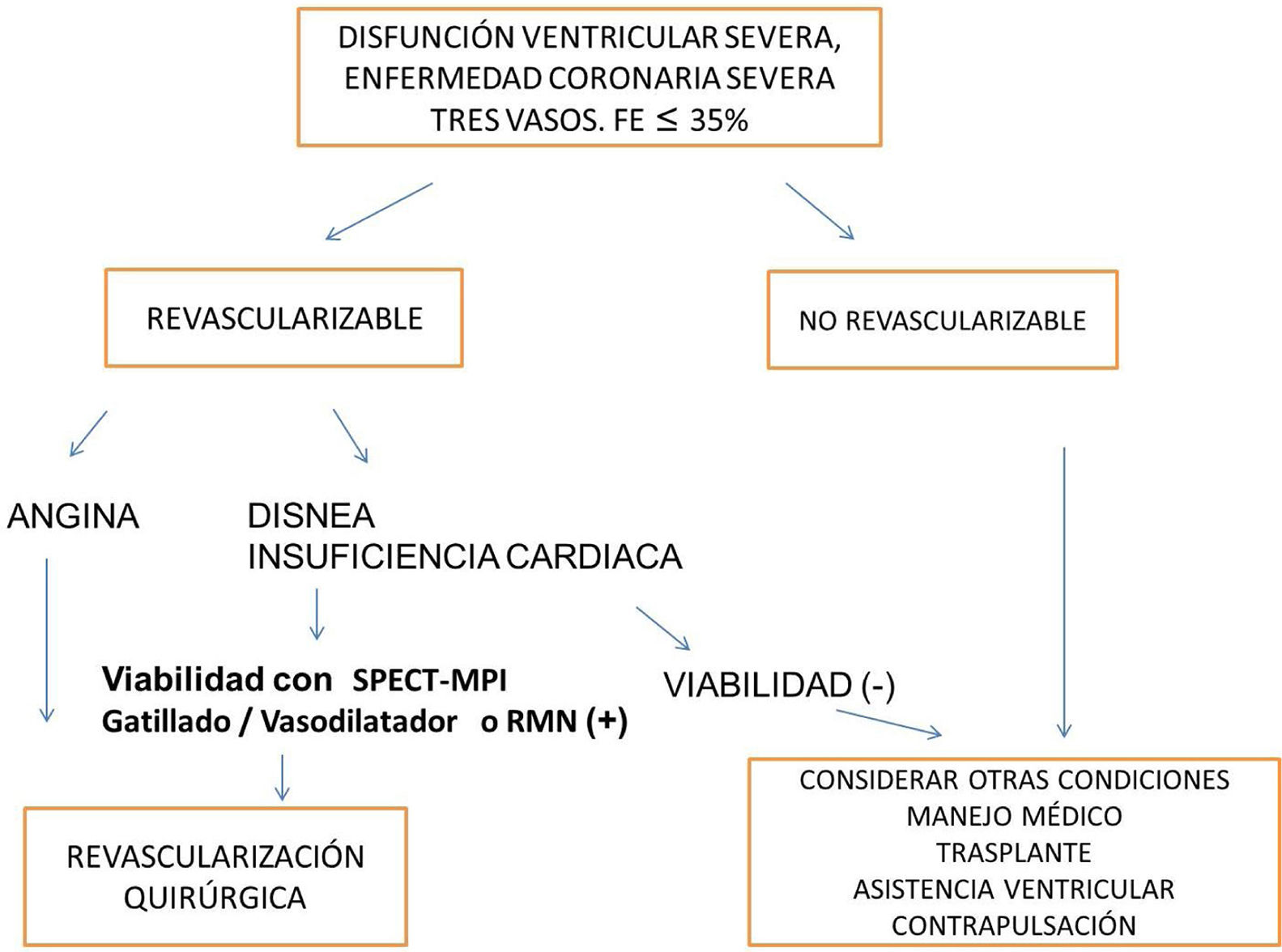
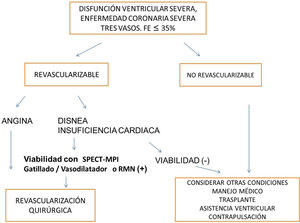
La aplicación clínica de los métodos diagnósticos de viabilidad se ha considerado como el definir cuáles pacientes van a una estrategia terapéutica de revascularización. Sin embargo, hay varios escenarios en los que el estudio de viabilidad no debería representar un prerrequisito para intervenir al paciente: síntomas anginosos, limitantes de la clase funcional a pesar de terapia médica óptima, gran territorio isquémico, FEVI preservada mayor del 50%, adecuados lechos coronarios revascularizables y bajo riesgo quirúrgico43. También hay condiciones que fortalecen la indicación de evaluar la viabilidad: disnea o falla cardíaca, infarto previo, FEVI reducida (en especial, menor de 30%), lechos coronarios de regular calidad y alto riesgo quirúrgico de morbimortalidad43.
La viabilidad es un concepto que aún se encuentra en construcción, y hace referencia a como traducir los hallazgos diagnósticos en los mejores desenlaces clínicos posibles y poder seleccionar los pacientes que realmente se beneficiarán de una estrategia de revascularización, así como a la integración de la información que métodos como el PET y los híbridos podrían aportar acerca de perfusión y metabolismo como marcadores de desenlaces clínicos útiles para guiar la terapéutica. La evaluación aislada de viabilidad miocárdica puede ser clínicamente no significativa y debería ser considerada e interpretada dentro de todo el conjunto de variables clínicas, lo que constituye una evaluación personalizada38.
ConclusionesEl concepto de viabilidad aún está en desarrollo y de su mayor conocimiento dependerá definir la selección adecuada de cuáles pacientes requieren su determinación y cuál es el umbral significativo clínico adecuado. La decisión de revascularización es multifactorial y la determinación de viabilidad es uno de ellos. Los métodos de Medicina nuclear aportan información relevante acerca de viabilidad dentro del enfoque multimodal de las imágenes en Cardiología (fig. 4).
Conflicto de interesesNinguno.