La disminución del flujo sanguíneo altera el endotelio, cambia la relación óxido nítrico/endotelina-1, estrecha capilares y produce disfunción microcirculatoria. La anoxia secundaria lleva a desacople energético mitocondrial, depleción de adenosín-trifosfato y alteración de la homeostasis intracelular de hidrógeno, sodio y calcio. Si el flujo se reanuda, la reperfusión estimula la expresión endotelial de moléculas de adhesión que atraen polimorfonucleares y plaquetas, con infiltración subendotelial de estas células y su atrapamiento en la microvasculatura, así como vasoconstricción, edema endotelial y disminución de la flexibilidad de la membrana celular. La isquemia/reperfusión puede derivar en inflamación y fallo orgánico.
ObjetivoDeterminar si la solución salina hipertónica disminuye la lesión isquemia/reperfusión en hígado, riñón e íleon.
Materiales y métodosEstudio experimental en cerdos. Supresión del flujo sanguíneo aórtico (15min) y reperfusión (60min). El grupo experimental recibió pretratamiento con solución salina hipertónica al 7,5% y el grupo control solución salina normal al 0,9%. Se realizaron mediciones hemodinámicas, gasométricas, bioquímicas y determinación sérica y tisular de ET-1, TNF-alfa, IL-10, IL-2.
ResultadosNo hubo diferencias significativas en la expresión tisular de ET-1, TNF-alfa, IL-10, IL-2 entre los grupos. Los grupos presentaron un comportamiento hemodinámico similar. El grupo tratado con hipertónica exhibió un índice sistólico post-reperfusión que aumentó hasta los valores basales, mientras que el índice sistólico del grupo control presentó una caída significativa (p=0,015).
ConclusiónLa solución hipertónica antes del insulto isquémico mejora la función ventricular después de la reperfusión.
Decreased blood flow disrupts the endothelium, changes the nitric oxide/endothelin-1 ratio, narrows the capillaries and results in microcirculatory dysfunction. Secondary anoxia leads to mitochondrial energy imbalance, depletion of adenosine-triphosphate and disruption of the intracellular hydrogen, sodium and calcium homeostasis. If the flow is restored, the reperfusion stimulates the endothelial expression of adhesion molecules attracting polymorphic nucleotides and platelets, with sub endothelial infiltration of these cells and their entrapment in the microvasculature, as well as vasoconstriction, endothelial edema and reduced flexibility of the cellular membrane. Ischemia/reperfusion may result in inflammation and organ failure.
ObjectiveTo determine whether hypertonic saline solution reduces the ischemic/reperfusion injury in the liver, the kidney, and the ileum.
Materials and methodsExperimental trial in pigs. Aortic blood flow suppression (15min) and reperfusion (60min). The experimental group was pretreated with 7.5% hypertonic saline and the control group received normal 0.9% saline solution. Hemodynamic, gasometric, and biochemical measurements were taken, and the serum and tissue levels of ET-1, TNF-alpha, IL-10, and IL-2 were determined.
ResultsThere were no significant differences in the tissue expression of ET-1, TNF-alpha, IL-10, and IL-2 between the two groups. The hemodynamic behavior was similar in both groups. The group treated with hypertonic solution showed an increasing post-perfusion systolic rate up to the basal values, while the systolic rate in the control group dropped significantly (P=.015).
ConclusionHypertonic solution prior to the ischemic insult improves the ventricular function after reperfusion.
Se han propuesto diversos modelos para explicar los mecanismos de lesión tisular secundaria a la isquemia y a la reperfusión1-7. En el contexto de la isquemia se ha demostrado que a nivel tisular las variaciones del flujo pulsátil sobre el arterial wall shear stress trastornan el microambiente celular, alterando el balance entre las concentraciones de endotelina-1 (ET-1)/óxido nítrico (NO)/prostaciclina, lentificando el flujo sanguíneo hasta límites de no reflujo y favoreciendo la concurrencia de los eritrocitos, llevando finalmente a la supresión del aporte de oxígeno y glucosa a la célula1,8. La respuesta celular a la anoxia9,10 involucra el desacople energético de la mitocondria, la depleción de adenosín-trifosfato (ATP) y las alteraciones de la homeostasis de los iones hidrógeno (H+), sodio (Na+) y calcio (Ca+2); estos eventos activan enzimas proteolíticas y deterioran la capacidad de regulación del volumen celular (edema celular), afectando específicamente a las células endoteliales y a los macrófagos. Este fenómeno, aunado al cambio de la relación en la producción de NO/ET-1, contribuye al estrechamiento de la luz de los capilares y a la disfunción microcirculatoria. El estrechamiento de los capilares conlleva la acumulación de los neutrófilos (PMN) y, concomitantemente, la activación de los macrófagos estimula la liberación de especies de oxígeno reactivo (ROS). Las ROS también son liberadas por la vía mitocondrial o la vía de la xantina/xantina oxidasa (X/XO) de las células endoteliales y por la acción de citoquinas inflamatorias, incluyendo factor de necrosis tumoral alfa (TNF-α) e interleucinas (IL)4. Las citoquinas inducen la expresión en el endotelio de moléculas de adhesión (intracellular adhesion molecule1 [ICAM] y vascular endotelial cell adhesion molecule [VCAM]) y las quimiocinas producen la activación y el reclutamiento de los PMN. La IL-1 y el TNF-alfa reclutan y activan a los linfocitosT CD4+, los cuales producen factor estimulante de colonias granulocito-macrófagos (GM-CSF), interferón-gamma (IFN-γ) y TNF-β.
No obstante, la lesión tisular empeora cuando es restituido el flujo sanguíneo y hay un aporte de cantidades importantes de oxígeno. Estudios de perfusión postisquémica demuestran que una de las sustancias más involucradas en los cambios de la microcirculación de los órganos es la ET-1; juegan también un papel preponderante las ROS, en especial las mediadas por la vía de la X/XO, siendo significativa la contribución de ROS derivadas de los PMN y de los macrófagos. Factores como el tiempo de isquemia y la temperatura durante la misma modifican la vía de producción de ROS11.
La activación del endotelio por estímulos mecánicos desencadena una respuesta química mediada inicialmente por NO y ET-1; la producción de NO no siempre está asociada a un proceso benéfico de vasodilatación. De hecho, cantidades de NO liberadas bajo la acción de la óxido nítrico sintetasa inducible (iNOS) pueden ser lesivas, pues su liberación es tardía y al combinarse con el anión superóxido favorecen la producción de peroxinitrito, que actúa como un poderoso oxidante6,12.
La lesión I/R sobre el endotelio estimula la expresión de moléculas de adhesión que interactúan con los PMN y las plaquetas, permitiendo la infiltración subendotelial de los primeros, así como su atrapamiento en la microvasculatura, facilitado por la vasoconstricción, el edema endotelial y la disminución de la flexibilidad de la membrana celular. Se favorece también la activación de las diferentes subpoblaciones de linfocitosT por acción del complemento13. Los mecanismos de daño de los PMN incluyen la liberación de ROS luego de la explosión respiratoria del sistema nicotinamida-adenina-dinucleótido-fosfato (NADPH) oxidasa, la liberación de enzimas proteolíticas, la estimulación de liberación de citoquinas de las células endoteliales reclutando más PMN y el taponamiento de los capilares, lo que empeora el no reflujo14. Adicionalmente, la hipoxia altera la capacidad de los mecanismos adaptativos intracelulares para el mantenimiento del volumen celular. El volumen celular se mantiene por eventos de señalización intracelular, como cambios en el potencial transmembrana, en la composición de los iones intracelulares, en las cascadas de los segundos mensajeros, fosforilación de diferentes proteínas, expresión de ciertos genes y apoptosis8,12,15,16. Dicho proceso es fundamental tanto para la función de los eritrocitos como para la transferencia epitelial, la regulación del metabolismo, la liberación hormonal y la contracción, migración y proliferación celular, siendo todos estos mecanismos implicados en la tolerancia a la hipoxia y en la reparación tisular.
La solución salina hipertónica (SSH) al 7,5% ha sido utilizada en clínica humana en reanimación por choque hemorrágico y como terapia de segunda línea en hipertensión intracraneana; y se han diseñado experimentos con animales en modelos de isquemia en corazón, riñón, pulmón, hígado e intestino. Su mecanismo de acción implica la optimización rápida del volumen intravascular y de la contractilidad miocárdica, y adicionalmente el mantenimiento de la dilatación de las arteriolas terminales y del flujo, evitando el «apelotonamiento» de eritrocitos y leucocitos17-20. También mantiene el volumen celular corrigiendo el edema de la célula endotelial y del eritrocito, disminuyendo la adhesión de PMN al endotelio, y la inflamación21,22.
El presente trabajo plantea como hipótesis que la SSH infundida antes del período de isquemia disminuye el impacto sistémico y tisular de la lesión I/R. El objetivo del estudio es determinar el comportamiento hemodinámico, así como la expresión sérica y tisular de mediadores de inflamación con el uso de SSH.
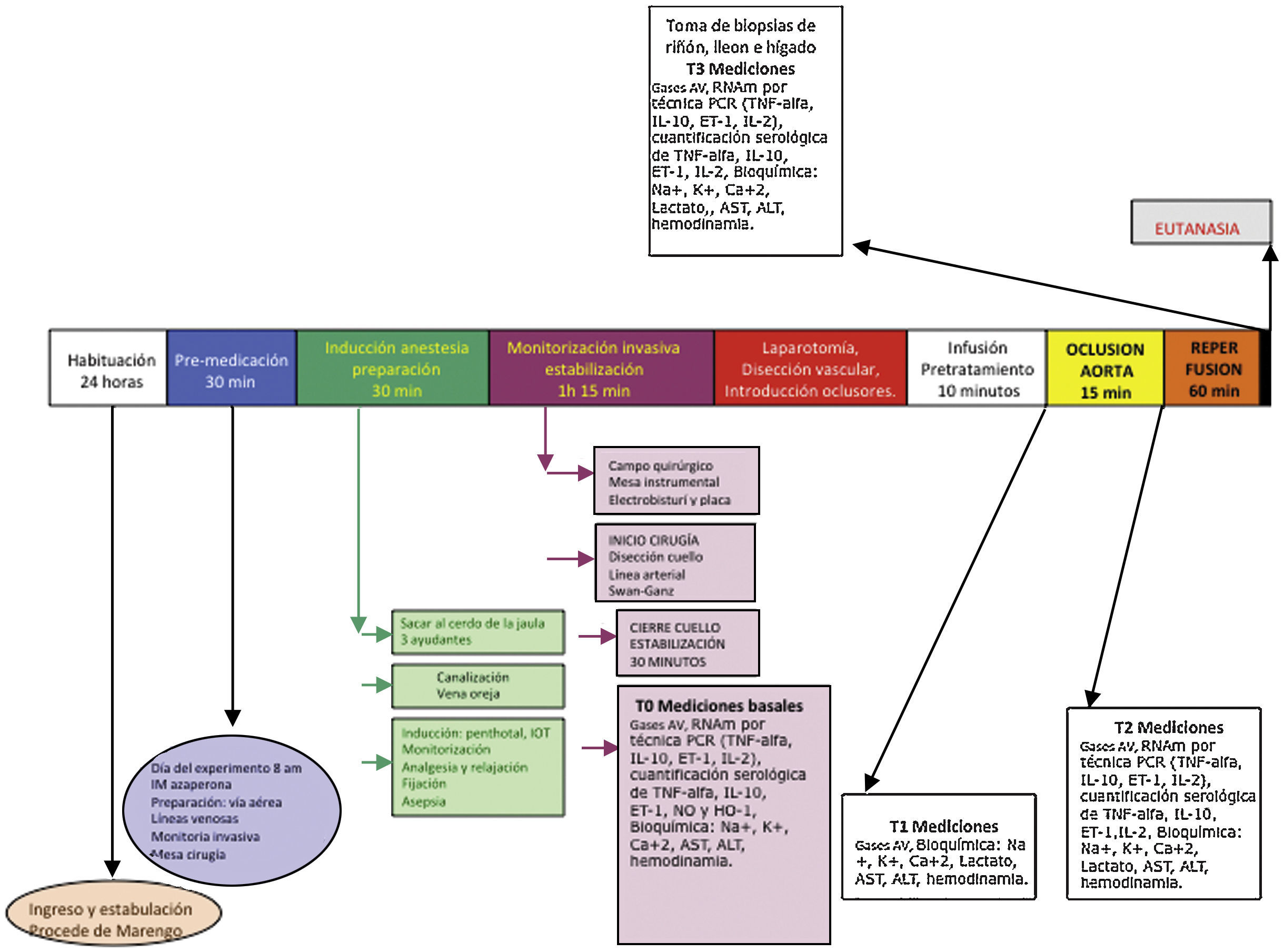
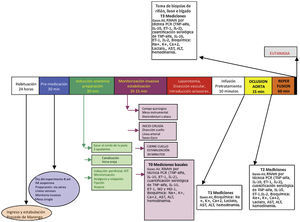
Diseño experimentalCon la aprobación de los Comités de Ética de la Facultad de Medicina Veterinaria y Zootecnia, y de la Facultad de Medicina de la Universidad Nacional de Colombia, se realizó un estudio experimental aleatorizado en cerdos. Bajo anestesia general, los animales fueron intervenidos con un modelo de supresión del flujo sanguíneo, en el cual se realizó oclusión extrínseca de la aorta por encima del tronco celiaco durante 15min, luego de los cuales se procedió a la restauración del flujo. La valoración de la lesión por reperfusión se realizó a los 60min del retiro de la oclusión de la aorta (fig. 1).
AnimalesSe utilizaron 14 cerdos de línea terminal en cruces híbridos de razas (Tecniagro XG&PX Landtrace), previa solicitud para programación de camadas y trámite de guía de movilización para su trasporte. La línea Tecniagro tiene en su conformación animales de la línea Large White XPietran. Los animales portaban chapeta de vacunación y estaban desparasitados. Estos procedimientos se llevaron a cabo cumpliendo las guías y normas del Instituto Colombiano Agropecuario. Se utilizaron cerdos de 20 a 25kg de peso procedentes del Centro Agropecuario Marengo, de la Sede Bogotá de la Universidad Nacional de Colombia.
Asignación de los gruposLos animales fueron asignados a uno de dos grupos utilizando un método de aleatorización simple con ocultamiento de la asignación mediante la utilización de sobres opacos. Los investigadores que realizaron las mediciones de los desenlaces clínicos y paraclínicos estuvieron ciegos a la asignación. Los grupos fueron:
- •
Grupo Hipertónica [GH] (n=7): recibieron SSH al 7,5% en dosis de 4ml/kg de peso, 10min antes de la oclusión aórtica.
- •
Grupo Control [GC] (n=7): recibieron solución salina normal (SSN) al 0,9% en dosis de 4ml/kg de peso, 10min antes de la oclusión aórtica.
Los animales se ingresaron y estabularon 24 a 36h antes del procedimiento; permanecieron en las instalaciones de la facultad de veterinaria con libre acceso a agua y a alimento. Durante las 12h previas a la cirugía tuvieron acceso solamente a agua y cumplieron ayuno para pienso. Se premedicaron con azaperona (presentación 40mg/ml) intramuscular en dosis de 2mg/kg, 30min antes de la inducción anestésica. Al ingreso a quirófano fueron pesados y tallados. Se realizó inducción inhalatoria con isofluorano, canalización venosa periférica en pabellón auricular con catéter venoso periférico núm. 18G y mantenimiento con SSN al 0,9%. Para manejo de vía aérea se administró tiopental sódico i.v. (10mg/kg), intubación orotraqueal con tubo núm. 6,5F, fijación del tubo y acomodación de los animales en decúbito supino, ventilación mecánica con máquina de anestesia (volumen corriente: 10ml/kg y frecuencia respiratoria: 16/min), monitorización básica con oximetría de pulso y cardiovisoscopio continuo. La anestesia se mantuvo con isofluorano inhalado a 1%, citrato de fentanilo (5μg/kg/h i.v.), bromuro de vecuronio (0,2mg/kg i.v. cada 2h) y fluidos intravenosos (SSN 0,9% a 5ml/kg/h).
Bajo anestesia general y previa inmovilización de las cuatro extremidades, con los animales en decúbito supino, se realizó incisión cervical oblicua anterolateral derecha, sección del músculo platisma y retracción lateral del músculo esternocefálico. Se disecó hasta encontrar la vena yugular interna y la arteria carótida común, para posteriores reparos con seda 0. Se hizo ligadura distal de la vena yugular interna, venotomía e introducción de catéter de Swan Ganz, con verificación de la localización de su extremo en la arteria pulmonar mediante la monitoría de presiones. En la arteria carótida común se hizo disección, ligadura distal e introducción de catéter de monitoría de presión arterial. Posteriormente se realizó laparotomía mediana, disección de la aorta infradiafragmática, 1cm por debajo del hiato del diafragma, reparo con hiladillo, preparando torniquete de Rummel. Al finalizar el procedimiento se tomaron biopsias del hígado (resección en cuña del lóbulo medial derecho de 3×2cm), del riñón izquierdo (polo inferior de 2×1cm) y del intestino delgado-íleon distal (segmento de 4cm de longitud, previa ligadura de los vasos del mesenterio).
IntervenciónLuego del procedimiento anestésico y quirúrgico previamente descrito, se permitió la estabilización del animal durante 30min. Posteriormente fueron entregadas al investigador encargado del procedimiento anestésico jeringas sin marcar de 20ml con la solución para infundir que habían sido preparadas por el auxiliar de investigación, según la instrucción de cada sobre sellado para cada animal.
- •
Grupo Hipertónica (GH): se infundieron durante 10min 4ml/kg de SSH al 7,5%. Al final de la infusión se realizó oclusión aórtica durante 15min, luego de los cuales se liberó la oclusión, dando paso a un período de 60min de reperfusión.
- •
Grupo Control (GC): se infundieron durante 10min 4ml/kg de SSN al 0,9%. Al final de la infusión se realizó oclusión aórtica durante 15min, luego de los cuales se liberó la oclusión, dando paso a un período de 60min de reperfusión.
- •
Variables hemodinámicas medidas: frecuencia cardiaca (FC), presión arterial sistólica (PAS), presión arterial diastólica (PAD), presión arterial media (PAM), presión pulmonar sistólica (PPS), presión pulmonar diastólica (PPD), presión pulmonar media (PPM), presión aurícula derecha (PAD), presión capilar pulmonar (PCP) y gasto cardiaco (GC).
- •
Variables hemodinámicas calculadas: índice cardiaco (IC), índice de resistencia vascular pulmonar (IRVP) y sistémica (IRVS), índice de trabajo ventricular izquierdo (ITVI) y derecho (ITVD).
- •
Variables gasométricas: presión arterial de O2 (PaO2), presión arterial de CO2 (PaCO2), pH arterial (pHart), saturación arterial de O2 (SataO2), exceso de base arterial (BEart), concentración de lactato arterial (Lactatoart), presión venosa de O2 (PvO2), presión venosa de CO2 (PvCO2), pH venoso (pHven), saturación venosa de O2 (SatvO2), exceso de base venoso (BEven), PaO2/FiO2, tasa de extracción de O2 (ExtO2).
- •
Hemoglobina, hematocrito.
- •
Química sanguínea: glucemia, BUN, creatinina, transaminasas (AST, ALT), sodio (Na+), potasio (K+), calcio (Ca+2).
- •
Biología molecular: determinación sérica de niveles de TNF-α e IL-2 (citoquinas inflamatorias), IL-10 (citoquina antiinflamatoria), ET-1 (marcadores de lesión endotelial) en suero o plasma por técnica de Enzyme-Linked-Immuno-Sorbent-Assay (ELISA).
- •
Detección de la expresión de proteínas mediante inmunohistoquímica para TNF-α (citoquinas inflamatorias) e IL-10 (citoquina antiinflamatoria) en tejido de hígado, riñón e íleon.
- •
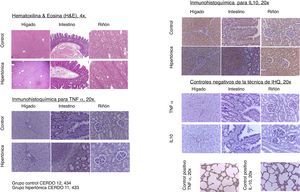
Determinación histológica (mediante hematoxilina/eosina [HE] en intestino, hígado y riñón) de lesión por isquemia/reperfusión. Se analizó el grado de congestión y hemorragia, edema y la presencia de dehiscencia intercelular, necrosis, apoptosis.
- •
T0. Estado basal: luego de la inducción anestésica y una vez cumplidos los 30min de estabilización del animal. Se registraron variables hemodinámicas y se tomaron muestras sanguíneas para gases arteriales y venosos, química sanguínea y biología molecular.
- •
T1. Al finalizar la infusión de SSN o de SSH (10min): previo a la oclusión de la aorta. Se registraron variables hemodinámicas y se tomaron muestras sanguíneas para gases arteriales y venosos, química sanguínea y biología molecular.
- •
T2. Luego de 15min de oclusión aórtica: antes de retirar los oclusores de la aorta se registraron variables hemodinámicas y se tomaron muestras sanguíneas para gases arteriales y venosos, química sanguínea y biología molecular.
- •
T3. Luego de 60min post-reperfusión: se registraron variables hemodinámicas y se tomaron muestras sanguíneas para gases arteriales y venosos, química sanguínea y biología molecular. Con posterior toma de biopsias de hígado, riñón e íleon.
- •
Gases arteriales: del catéter monolumen insertado en la arteria carótida.
- •
Gases venosos: de la vía proximal del catéter de arteria pulmonar.
- •
Química sanguínea y biología molecular: a través de la vía proximal del catéter de arteria pulmonar se obtuvieron muestras en plasma y en suero.
Todas las muestras, debidamente rotuladas y embaladas según protocolo del experimento, se enviaron para procesamiento al Laboratorio Clínico de la Facultad de Medicina Veterinaria y al Laboratorio de Ciencias Fisiológicas de la Facultad de Medicina de la Universidad Nacional.
Muestras de tejidosPara evitar sangrado que comprometiera hemodinámicamente al animal durante la toma de muestras de tejido, se obedeció el siguiente orden:
- •
Biopsia del íleon en cuña del borde antimesentérico: a 30cm de la unión ileocecal se realizó pinzamiento del intestino proximal y distal con clamps atraumáticos en un segmento de 10cm, evitando tomar el mesenterio con el clamp. Del borde antimesentérico se tomó una biopsia en cuña con bisturí, con una base de 3cm y con el vértice a 5mm del borde mesentérico. Luego se suturó el intestino en un plano con polipropileno 4-0.
- •
Biopsia en cuña del borde libre del hígado: Corte con bisturí frío, base de 5cm y vértice de 1cm. Se realizó hemostasia con punto de polipropileno 4-0.
- •
Biopsia en cuña de la corteza renal: corte con bisturí frío, base de 5cm y vértice de 1cm, verificando macroscópicamente la inclusión de la totalidad de la corteza en el corte.
Todos los fragmentos de tejido de 0,3cm3 de cada órgano biopsiado (íleon, hígado y riñón) se depositaron en frascos no estériles con formaldehído al 10% para envío al Laboratorio de Patología de la Facultad de Medicina.
EutanasiaLuego de finalizado el protocolo, manteniendo al animal bajo anestesia general, se administraron 40miliequivalentes de cloruro de potasio en bolo sin diluir por la vía distal del catéter de arteria pulmonar. Cuando desapareció la actividad cardiaca, se suspendió el manejo anestésico. Cada animal fue dispuesto en doble bolsa de residuos animales del laboratorio de experimentación y se llevó al congelador para posterior recolección por los encargados del manejo de los desechos hospitalarios.
Análisis estadísticoLos datos de las variables continuas se expresaron con media, desviación estándar y rangos; los datos de las variables categóricas se expresaron como números y porcentajes. Las variables cuantitativas fueron comparadas con t de Student y las cualitativas con chi cuadrado o test de Fisher. Para las variables de distribución no normal se utilizó la U de Mann-Whitney. Se consideró un valor de p≤0,05. El análisis estadístico fue realizado con el programa STATA 10.1 (STATA Corp LP).
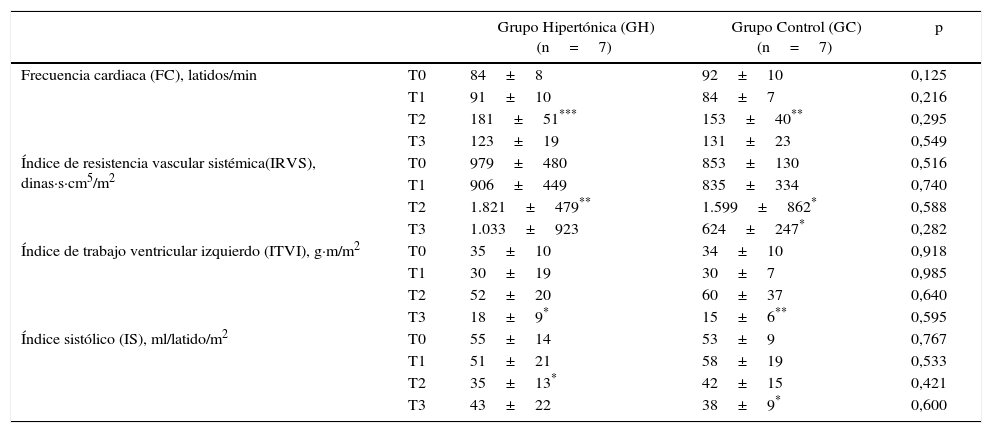
ResultadosLas mediciones de los cambios hemodinámicos a lo largo del experimento no presentaron diferencias significativas entre los grupos (tabla 1).
Comportamiento hemodinámico a lo largo del experimento
| Grupo Hipertónica (GH) (n=7) | Grupo Control (GC) (n=7) | p | ||
|---|---|---|---|---|
| Frecuencia cardiaca (FC), latidos/min | T0 | 84±8 | 92±10 | 0,125 |
| T1 | 91±10 | 84±7 | 0,216 | |
| T2 | 181±51*** | 153±40** | 0,295 | |
| T3 | 123±19 | 131±23 | 0,549 | |
| Índice de resistencia vascular sistémica(IRVS), dinas·s·cm5/m2 | T0 | 979±480 | 853±130 | 0,516 |
| T1 | 906±449 | 835±334 | 0,740 | |
| T2 | 1.821±479** | 1.599±862* | 0,588 | |
| T3 | 1.033±923 | 624±247* | 0,282 | |
| Índice de trabajo ventricular izquierdo (ITVI), g·m/m2 | T0 | 35±10 | 34±10 | 0,918 |
| T1 | 30±19 | 30±7 | 0,985 | |
| T2 | 52±20 | 60±37 | 0,640 | |
| T3 | 18±9* | 15±6** | 0,595 | |
| Índice sistólico (IS), ml/latido/m2 | T0 | 55±14 | 53±9 | 0,767 |
| T1 | 51±21 | 58±19 | 0,533 | |
| T2 | 35±13* | 42±15 | 0,421 | |
| T3 | 43±22 | 38±9* | 0,600 |
Datos reportados como media±desviación estándar, intervalo de confianza de 95%.
Durante la oclusión de la aorta (T2) se produjeron incrementos significativos, respecto de los valores basales en cada grupo, en la frecuencia cardiaca (p=0,0023 GH, p=0,0004 GC), la presión arterial media sistémica (p=0,0005 GH, p=0,003 GC) y la resistencia vascular sistémica (p=0,009 GH, p=0,04 GC).
Con la subsecuente reperfusión (T3), ambos grupos mostraron disminución de la resistencia vascular sistémica. El grupo tratado con SSH presentó una caída de los valores de IRVS que quedaron cercanos a los basales. Para el grupo control, la caída en el IRVS llegó a valores significativamente más bajos que los medidos basalmente (p=0,049). En la reperfusión, los valores de trabajo ventricular izquierdo disminuyeron significativamente (p=0,019 GH, p=0,002 GC) con respecto a los valores basales en ambos grupos. En este período, el índice sistólico (IS) como variable de contractilidad se incrementa en el grupo tratado con SSH. En el grupo control (GC) el IS disminuye, cayendo a valores significativamente más bajos (p=0,015) con relación al basal.
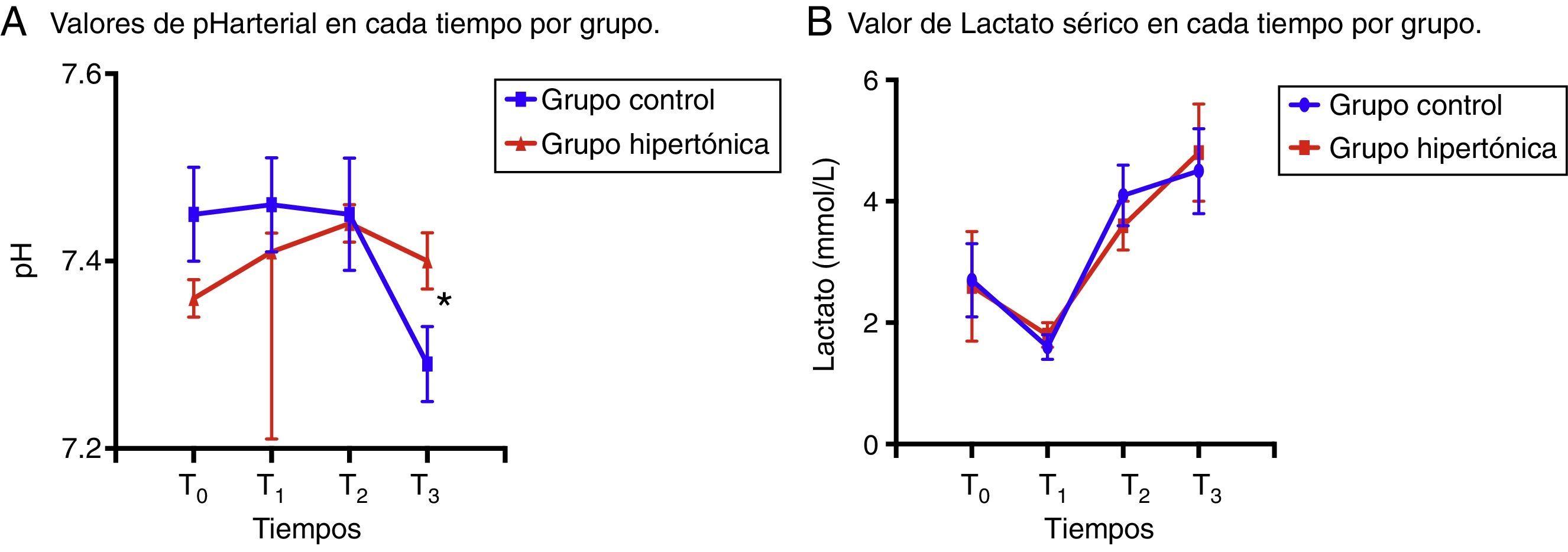
En los análisis de gasometría sanguínea, el pH arterial presentó variaciones que se tornaron en diferencias significativas entre los grupos con la reperfusión (T3), momento en el cual el grupo control presentó acidosis con una disminución significativa del pH arterial (fig. 2A).
Con relación a los demás parámetros de gasometría sanguínea, el comportamiento de los grupos fue similar.
Particularmente, los valores de lactato sérico disminuyeron con la infusión intravenosa de fluido (solución hipertónica [GH] o solución salina normal [GC]) en T1 en los dos grupos, para luego presentar aumento sostenido con valores significativamente superiores en comparación con T1 (T2: p=0,006 GH, p=0,001 GC; T3: p=0,002 GH, p=0,003 GC) (fig. 2B).
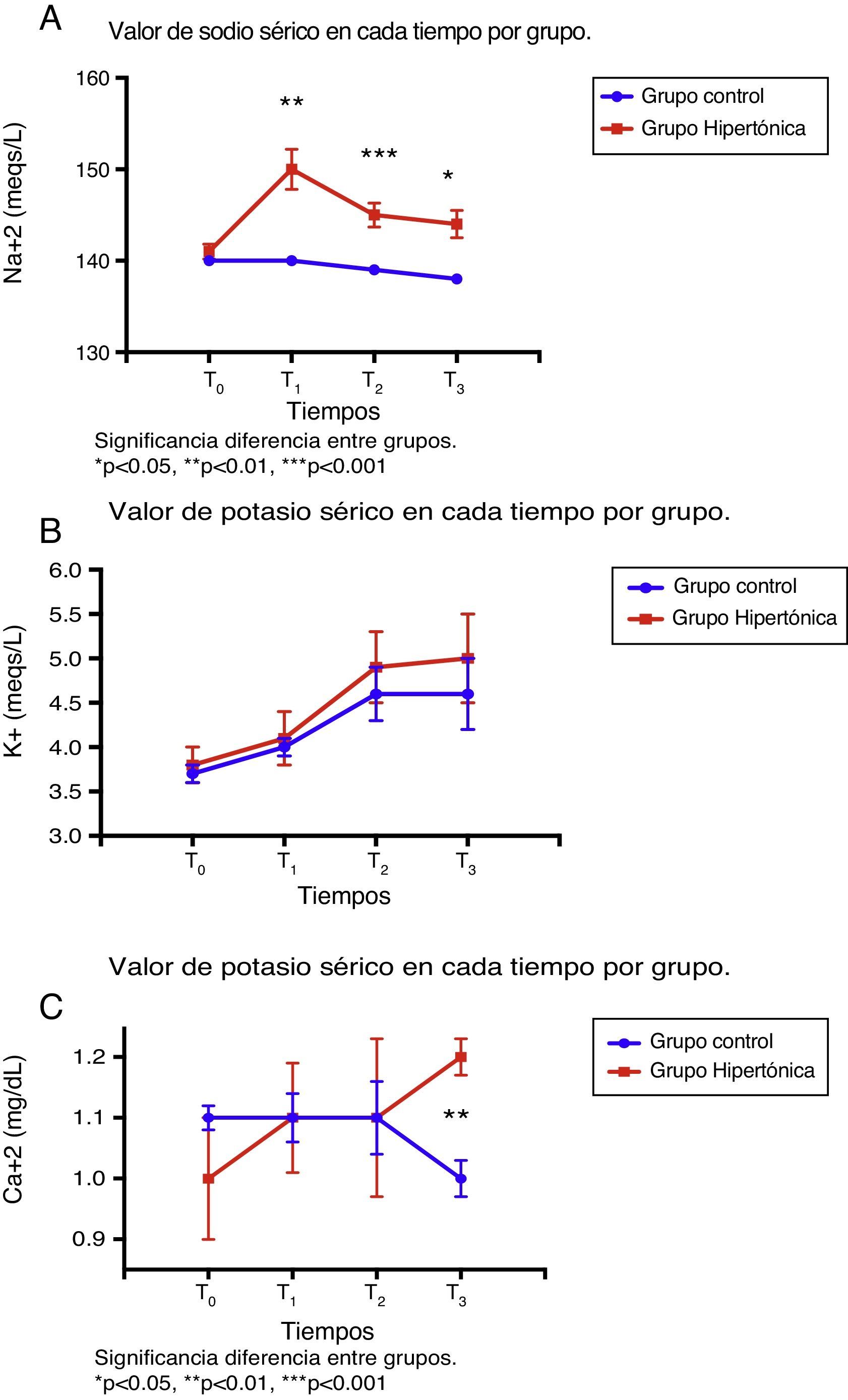
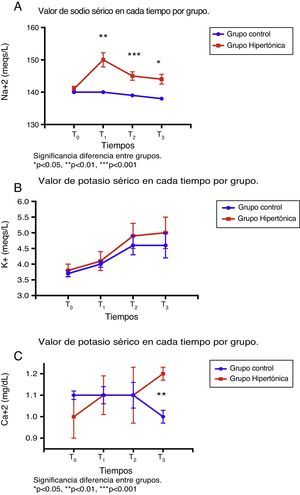
En cuanto al comportamiento de los electrólitos séricos, los valores basales (T0) fueron similares en ambos grupos (fig. 3).
Hubo diferencias significativas entre los grupos en los niveles de sodio. El grupo tratado con SSH (GH) presentó valores significativamente más altos de sodio a lo largo del experimento en comparación con el grupo control (T1: p=0,001; T2: p=0,0006; T3: p=0,019). El valor pico en el grupo tratado se alcanzó luego de la infusión (T1). Los valores de sodio para los dos grupos se mantuvieron dentro de los rangos normales durante el experimento (fig. 3A).
En cuanto al potasio sérico, no hubo diferencias entre los grupos en los niveles a lo largo del experimento (T0 a T3); las cifras de potasio se incrementaron de manera progresiva dentro de rangos de referencia normales en cada tiempo (fig. 3B).
Los niveles de calcio sérico fueron similares en ambos grupos durante T0 a T2; con la reperfusión (T3), los niveles son significativamente diferentes (p=0,006) por la disminución en el valor del calcio del grupo control (fig. 3C).
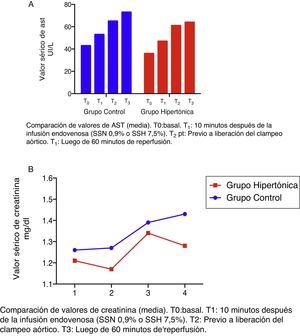
Las cifras de creatinina y de transaminasas presentan una curva con tendencia a la elevación a lo largo del experimento (T0 a T3) en los dos grupos, sin diferencias significativas entre ellos.
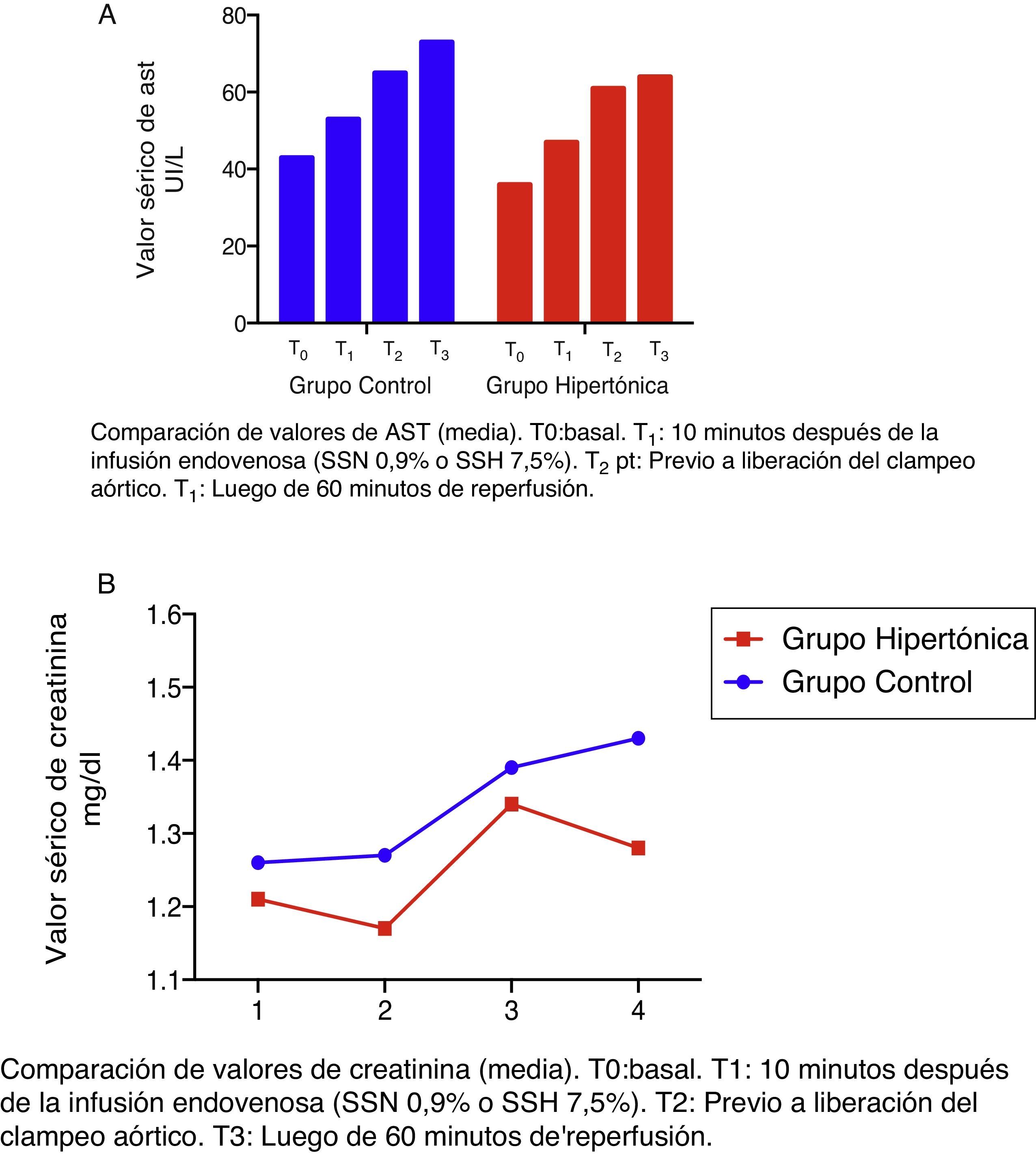
Los niveles de transaminasas aspartato-amino-transferasa (AST) se elevan a partir de T1 fuera del rango de normalidad (fig. 4A). En el grupo control (GC) esta elevación es significativa con respecto al valor basal (T2: p=0,018; T3: p=0,034).
Los niveles de creatinina se mantienen en rango de valores normales (fig. 4B).
Ninguno de los valores referidos (creatinina y transaminasas) descienden en los grupos luego de la reperfusión (T3) (fig. 4).
Los niveles séricos de TNF-alfa y de IL-2 no presentaron diferencias significativas entre los grupos a lo largo del experimento (T0 a T3). No hubo elevación significativa de cada citoquina durante la oclusión aórtica (T2) ni durante la reperfusión (T3). Los valores observados tanto de TNF-α como de IL-2 se mantuvieron dentro del rango de valor normal.
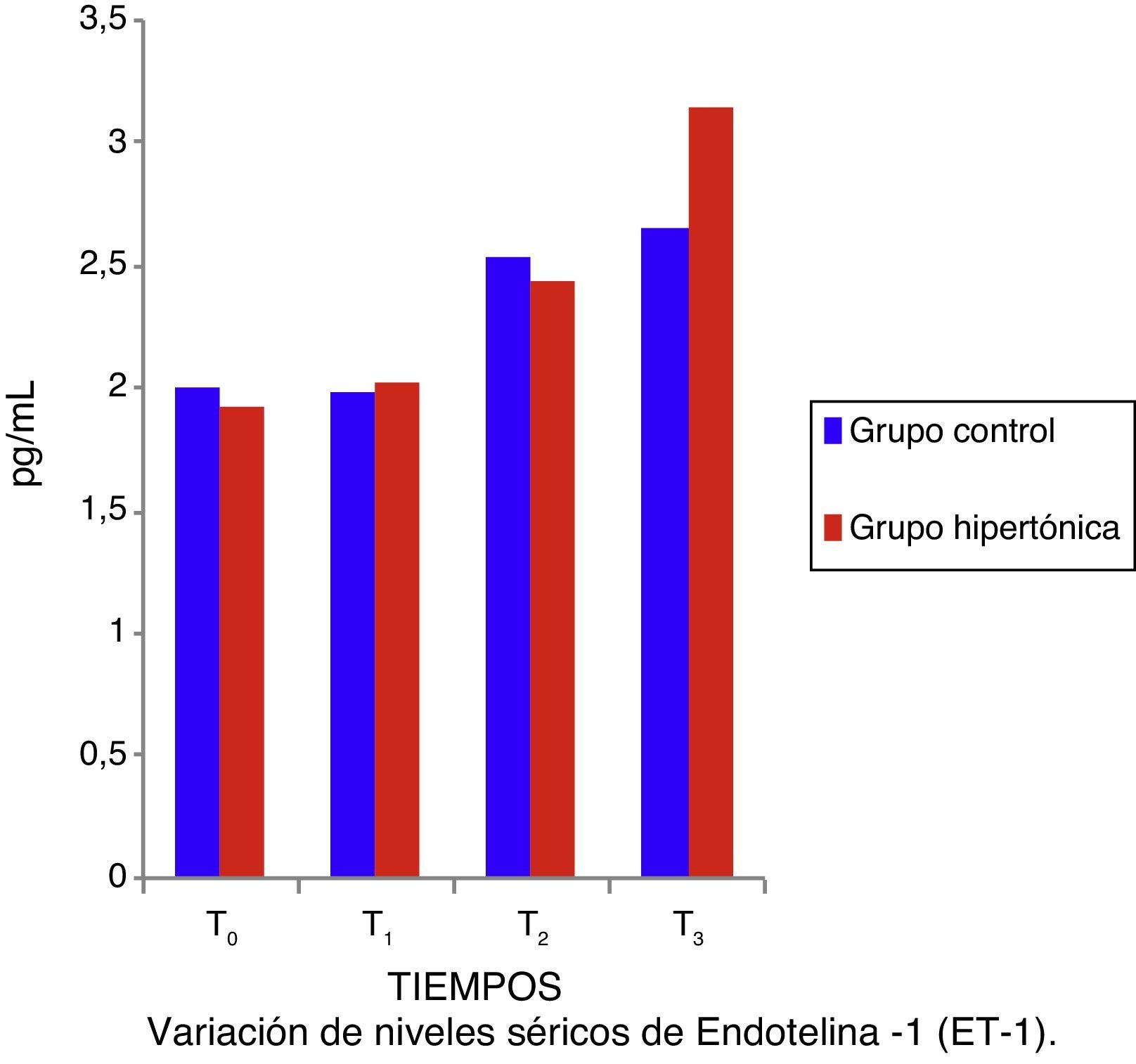
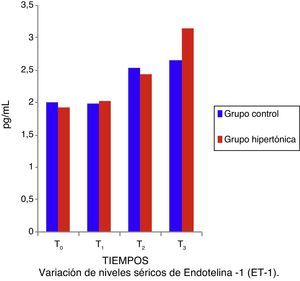
Los niveles de ET-1 (fig. 5) y de IL-10 no tuvieron diferencias significativas entre los grupos. Tanto la ET-1 como la IL-10 presentaron cifras anormales, por encima de los valores de referencia a lo largo del experimento (T1 a T3). No hubo correlación entre los valores de IL-10 y de ET-1 con los del índice sistólico (IS: parámetro de contractilidad) para ningún momento del experimento (test de correlación pareada con ajuste de Bonferroni) en ningún grupo.
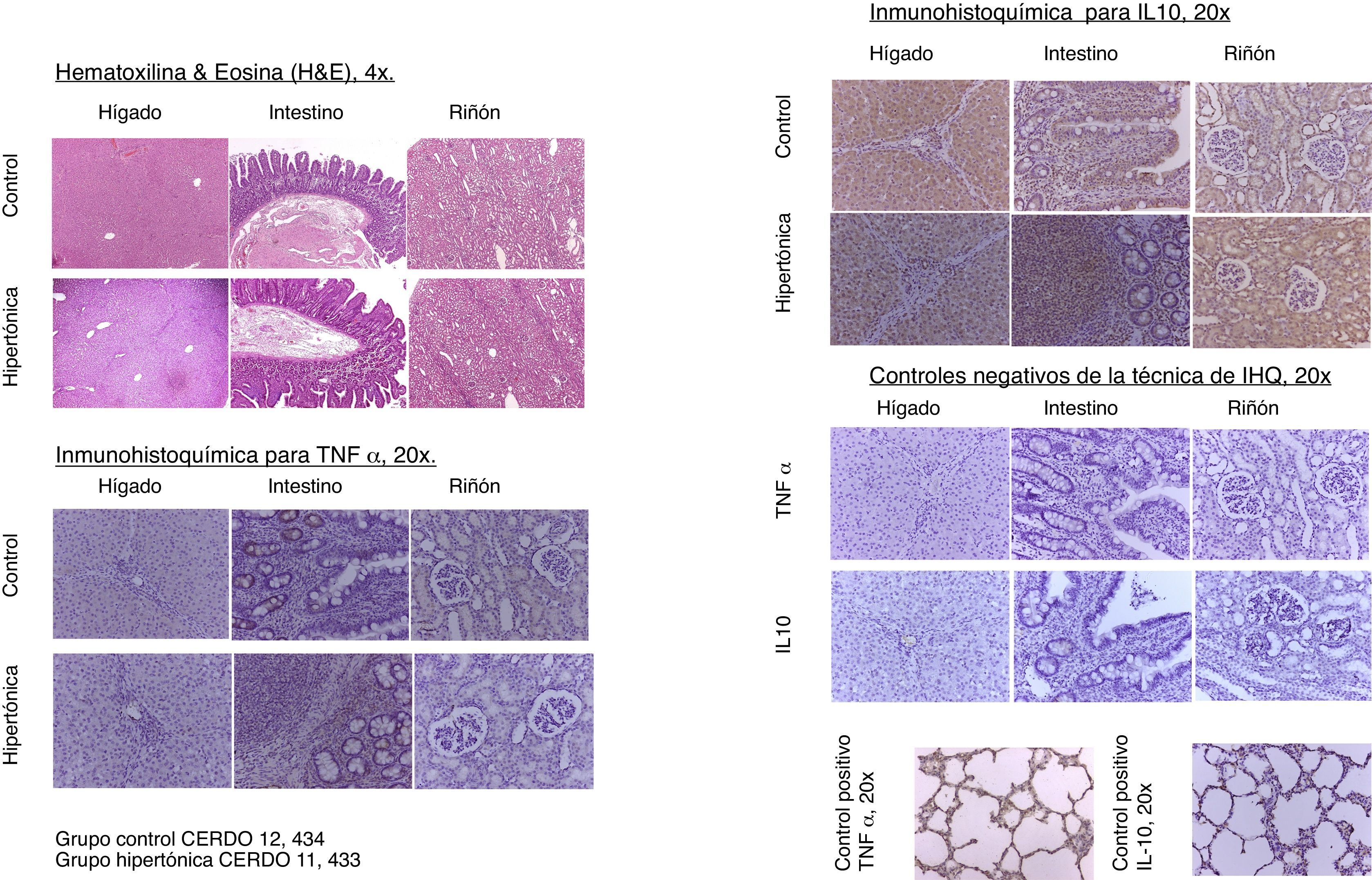
Con relación a los hallazgos en histopatología, para la estandarización del análisis y la interpretación se utilizaron cinco parámetros (edema, infiltrados, necrosis, apoptosis y sustancias de depósito), interpretados como presente (P=1) o ausente (A=0), para establecer un puntaje de evaluación para cada órgano (hígado, riñón, intestino). Se evaluó también una caracterización general como normal (N=0) o anormal (A=1). Los resultados de análisis de estudio de patología con hematoxilina/eosina no presentaron diferencias entre los grupos. No se evidenció necrosis ni apoptosis en ninguna muestra. La caracterización general de las placas de histopatología fue normal (N=0). Aquellas con patrón de anormalidad presentaron edema sin otra alteración (fig. 6).
El análisis de inmunohistoquímica realizado en tejidos para TNF-α y para IL-10 no reportó diferencias entre los grupos. Para la estandarización del análisis y la interpretación se utilizaron tres parámetros evaluados por puntuación: inmunorreactividad leve (1), moderada (2) o severa (3). No hubo diferencias entre los grupos al comparar las puntuaciones para TNF-α e IL-10. La expresión tisular de TNF-α e IL-10 no presentó diferencias significativas entre los grupos (fig. 6).
DiscusiónLa disminución anormal del flujo sanguíneo (hemorragia, parada cardiaca, obstrucción vascular, etc.) conduce a la hipoxia, y como consecuencia de la misma se presentan acidosis intracelular, alteraciones en la concentración intracelular de sodio y calcio, degradación de los fosfolípidos del sarcoplasma y de las proteínas del citoesqueleto, edema mitocondrial y pérdida del potencial transmembrana, disminución de glutatión y de alfa-tocoferol, secreción de sustancias desencadenantes de pre-acondicionamiento (adenosina, bradicinina, angiotensina, opiáceos, etc.) y expresión de moléculas de adhesión, citoquinas (p.ej.,TNF-α) y agentes vasoactivos (p.ej.,endotelina)23-24. Con la reperfusión hay modificaciones en la vasorreactividad (dependiente y no dependiente del endotelio) con pérdida del balance entre vasodilatación y vasoconstricción en todos los lechos, disfunción endotelial y alteración en la expresión y reactividad a sustancias como la ET-1 y el NO23,25. Además, la reperfusión promueve una respuesta inflamatoria inicialmente local que deriva en liberación sistémica de citoquinas, quimiocinas, activación del complemento y de los neutrófilos, producción de radicales libres de oxígeno, necrosis y apoptosis26,27. La severidad de la lesión depende de la extensión (compromiso de uno o varios órganos) y la duración de la hipoxia, como fue verificado hace varias décadas por Flores et al.28, quienes publicaron un modelo de isquemia renal, demostrando que la oclusión del flujo sanguíneo mayor a una hora se asociaba con zonas de obstrucción vascular por edema celular a pesar de la restitución del flujo sanguíneo, y plantearon también cómo era posible revertir este fenómeno de «no reflujo» con la utilización de soluciones hipertónicas (manitol para el trabajo citado) que disminuían el edema celular y aminoraban la obstrucción de la microcirculación.
La solución salina hipertónica (SSH) genera un gradiente osmótico a través de las membranas celulares que desplaza fluido desde el espacio intersticial inicialmente, y luego desde las células, hacia el espacio intravascular29. El movimiento de fluido desde las células contribuye con la disminución del edema endotelial capilar, evento que mejora la microcirculación particularmente en escenarios de choque30. En modelos de músculo cardiaco aislado se han demostrado también los efectos inotrópico y lusitrópico positivos de la SSH, mediados por la hiperosmolaridad y la acción del sodio sobre el intercambiador Na+-Ca+2, manteniendo la homeostasis del calcio intracelular y su salida del retículo sarcoplásmico31. Adicionalmente, la SSH modula la respuesta inflamatoria asociada a la reperfusión gracias a la atenuación de la activación de los PMN, disminución de los niveles séricos de TNF-α e incremento en la expresión de citoquinas antiinflamatorias (IL-1, IL-10)25,32. La utilización de la SSH en reanimación con bajos volúmenes en choque hemorrágico y séptico ha caracterizado su papel en la atenuación de la lesión por isquemia/reperfusión. Diversos trabajos han explorado los mecanismos involucrados en los efectos de la SSH, utilizándola tanto antes del insulto isquémico como de la reperfusión33-35.
En el experimento presentado se infundió SSH antes de la isquemia con el fin de evaluar su papel en la expresión de citoquinas, de sustancias vasoactivas y en el comportamiento hemodinámico luego de la restitución del flujo sanguíneo. En este estudio se encontró que la SSH no modifica la respuesta inflamatoria ocasionada por 15min de isquemia seguida de 60min de reperfusión. Tampoco modifica la respuesta hemodinámica a la oclusión aórtica y a la reperfusión. Sin embargo, en el grupo tratado con hipertónica se evidenció que la SSH modifica el comportamiento del miocardio al aumentar significativamente el índice sistólico una hora después de reanudado el flujo aórtico, incrementándolo a valores cercanos a los de las condiciones basales. El impacto de la SSH sobre el comportamiento hemodinámico se asoció también a una menor vasodilatación, tal como se demuestra por los cambios de la resistencia vascular sistémica.
Trabajos como los de Li et al.6 y de Gourdin et al.9 establecen que la existencia de cambios histológicos y de citoquinas séricas inflamatorias y antiinflamatorias dependen del tiempo de isquemia y de reperfusión. El presente experimento recurrió a un corto periodo de isquemia (15min) y de reperfusión (una hora), y los autores consideran que este tiempo de isquemia fue insuficiente para generar cambios histológicos o séricos en TNF-α e interleucinas inflamatorias; sin embargo, el hallazgo de elevación desde el tiempo1 (T1) de los valores séricos de ET-1 es coincidente con lo descrito por Sánchez-Etayo et al.36, y los cambios en la ET-1 son observables desde los primeros minutos de la disminución del flujo sanguíneo. En el presente experimento la ET-1 se incrementó desde la isquemia en ambos grupos. No hay diferencias entre los grupos, probablemente por el número de individuos; los valores de ET-1 se incrementaron permanentemente de manera significativa desde T0 a T3 en el grupo control.
En un interesante trabajo en clínica humana, Rizoli et al.37 demuestran las propiedades antiinflamatorias de la SSH con la medición entre otras citocinas de TNF-α. En el estudio incluyen pacientes con trauma contundente cuyos tiempos entre la lesión y el ingreso oscilaron entre 44 a 255min, con mínimo un episodio registrado de hipotensión. Estos autores realizaron un seguimiento a lo largo de las siguientes 24h después del manejo de resucitación de urgencias. Dentro de sus hallazgos están aumentos significativos de citoquinas antiinflamatorias con cifras que incrementan a partir de la tercera hora de la infusión.
El presente trabajo de oclusión aórtica y pretratamiento con SSH tiene como limitaciones el corto tiempo de isquemia y de reperfusión. Esto hizo que fuera posible evidenciar solo cambios en la contractilidad, sin impacto alguno en la modulación de la inflamación.
En conclusión, el pretratamiento con SSH antes de 15min de isquemia en modelo de supresión del flujo aórtico no modifica la expresión de marcadores de inflamación y antiinflamación sérica o tisular. La SSH incrementa la contractilidad ventricular después de la reperfusión.
FinanciaciónEsta revisión hace parte de la producción acordada en el Convenio de Cooperación Interinstitucional entre la S.C.A.R.E. y la Universidad Nacional de Colombia. Ambas instituciones financiaron el proyecto de investigación titulado «Determinación de la utilidad de la solución salina hipertónica para modificar la lesión tisular por isquemia/reperfusión: modelo porcino de oclusión de aorta».
Conflicto de interesesLos autores declaran no tener conflicto de intereses.