La analgesia epidural supone la técnica de elección para el alivio del dolor del parto. Se han descrito múltiples efectos adversos a nivel neurológico, y uno de ellos es el llamado síndrome de Horner (ptosis, miosis, anhidrosis), suele presentar evolución benigna y no requiere manejo específico, salvo vigilancia clínica por la más que probable difusión cefálica del anestésico local. La mayor parte de los casos existentes en la literatura son aislados. En nuestro trabajo presentamos una serie de 3 casos clínicos y repasamos su etiopatogenia y manejo en la paciente obstétrica.
Epidural analgesia involves the technique of choice for pain relief of labor. Adverse neurological effects have been reported, one of which is called Horner syndrome, its evolution is usually benign, it does not require specific management, except clinical monitoring for the probable spread of local anesthetic cephalic. Most of the existing literature cases are isolated, in our paper we present a series of 3 clinical cases and reviewed its pathogenesis and management in the obstetric patient.
El síndrome de Horner fue descrito en 1879 por el oftalmólogo suizo Johann Friedrich Horner y está caracterizado por la presencia de miosis, ptosis y anhidrosis con o sin enoftalmos1. Su causa primaria es la interrupción ipsilateral de las fibras simpáticas que inervan la pupila, el músculo elevador del párpado superior y la región facial2.
Cualquier obstáculo que afecte a esta red neuronal desde su origen hasta la última sinapsis puede dar lugar a este cuadro. Las causas adquiridas son las más frecuentes, como la iatrogénica debida a anestesia neuroaxial, que en determinadas poblaciones, como en la obstétrica, aumenta considerablemente su incidencia debido a los cambios anatómicos y fisiológicos que se producen. La analgesia epidural se considera la técnica analgésica de elección para el trabajo de parto3. El síndrome de Horner asociado a analgesia epidural para el parto fue descrito por Kepes en 1972. Se estima una incidencia entre el 0,4 y el 4%4-7.
En nuestro trabajo presentamos una serie de 3 casos clínicos de síndrome de Horner en pacientes gestantes que recibieron analgesia epidural para el parto. Revisamos también la fisiopatología, las implicaciones y su manejo.
Caso clínicoLa técnica empleada en los 3 casos se describe a continuación. Empleamos aguja Touhy 18 Gauge. El espacio elegido fue L3-L4, a través de abordaje intervertebral. Una vez localizado el espacio epidural mediante pérdida de resistencia con suero salino, se ubicó un catéter epidural multiperforado 4cm en el interior del mismo. La técnica transcurrió en todos los casos sin incidencias. Tras la administración de un bolo de ropivacaína 0,16% con 1μg/ml de fentanilo se inició la perfusión de anestésico a igual concentración. Como dosis test utilizamos 4ml de bupivacaína al 0,25% con epinefrina 1/200.000.
Caso 1Paciente de 27 años de edad primigesta de 38 semanas en parto espontáneo, 172cm de altura y 75kg de peso, sin antecedentes médicos de interés; destaca como rasgo significativo una llamativa hiperlordosis lumbar. El catéter epidural se colocó a los 4cm de dilatación, tras lo cual se le administraron 11ml de ropivacaína con fentanilo a la concentración referida con anterioridad, iniciándose una perfusión continua a 10mlh−1 de la misma solución anestésica. No recibió ningún bolo suplementario. Durante la fase de dilatación y tras 95min de haber iniciado la perfusión, la paciente refiere sintomatología compatible con parálisis braquial; tras la exploración neurológica se aprecia un déficit motor (nivel 3 según la escala Medical Research Council) que abarca todo el miembro superior, así como molestias inespecíficas a nivel ocular ipsilateral evidenciándose ptosis, miosis, enoftalmos y anhidrosis, compatible con síndrome de Horner. El nivel de bloqueo sensitivo alcanzó T2. Tras detener la perfusión, la clínica motora y ocular revirtieron pasados 115min.
Caso 2Paciente de 28 años de edad primigesta de 37 semanas, parto espontáneo, 160cm de altura y 55kg de peso, sin antecedentes personales de interés. Se administraron como bolo inicial 8ml de ropivacaína y fentanilo, seguido de perfusión continúa a 8mlh−1. La paciente recibió 2 bolos suplementarios: el primero a los 30min de iniciarse la perfusión y el segundo pasados 45min del bolo anterior. Durante la fase de dilatación y tras 80min del último bolo, la paciente describe clínica de ptosis, miosis y enoftalmos, sin anhidrosis manifiesta. No presentó déficit motor, y el déficit sensitivo ascendió hasta T3. La clínica desapareció a los 130min de detener la perfusión.
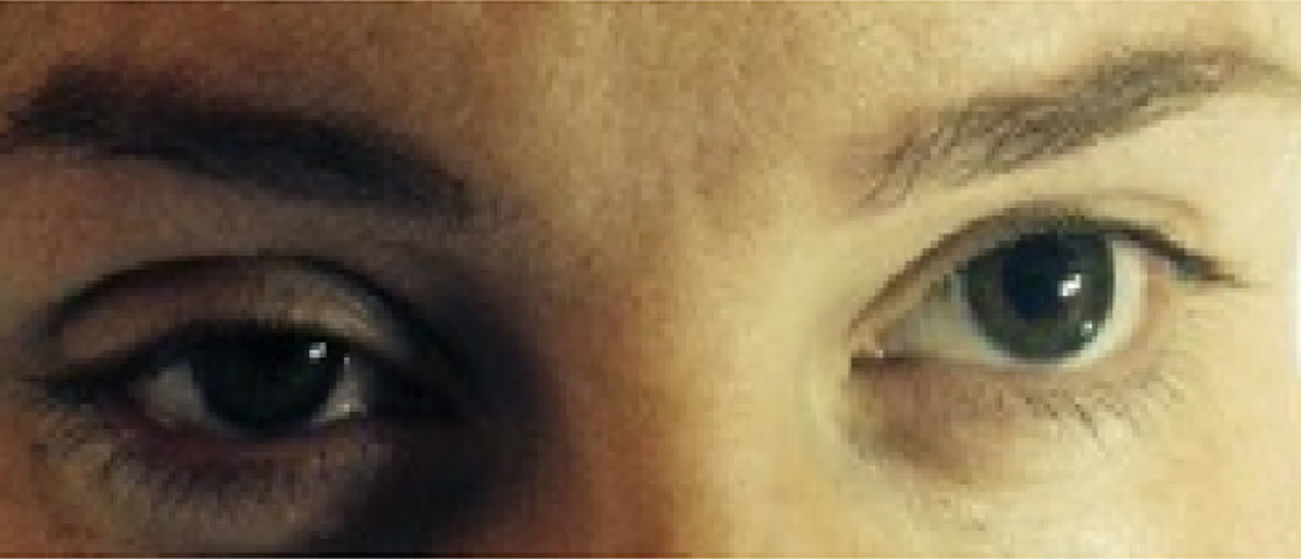
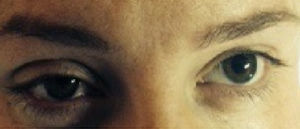
Caso 3Primigesta de 32 años de edad, parto inducido con 41 semanas de gestación, 155cm de altura y 60kg de peso. Hipertensión arterial crónica como antecedente de interés. Se le administró un bolo inicial de 9ml de ropivacaína y fentanilo, que se continuó con la perfusión continua a 8mlh−1. Pasados 45min, y por riesgo de pérdida de bienestar fetal, se decide cesárea urgente, para lo cual se administran 9ml de lidocaína 2%. Tras el comienzo de la cesárea, se aprecia clínica que sugiere síndrome de Horner (fig. 1); apenas habían pasado 15min del bolo anestésico de lidocaína. No refirió clínica motora. El nivel sensitivo alcanzó la metámera T2. Tras 95min de observación, la clínica desapareció sin medidas adicionales.
Tras el diagnóstico clínico mediante la evidencia de ptosis, miosis, enoftalmos y anhidrosis se inició una exploración neurológica (nivel sensitivo y función motora) y cardiorrespiratoria (monitorización continua de saturación arterial de oxígeno mediante pulsioximetría, electrocardiografía y presión arterial no invasiva).
Se detuvo la perfusión de anestésico local en todos los casos. Ninguna de las pacientes presentó complicaciones cardiorrespiratorias, manteniendo frecuencia cardiaca en torno a 70latidos por minuto, presión arterial media por encima de 65mm/hg y saturación arterial de oxígeno superior al 95% sin necesidad de oxígeno suplementario. La clínica revirtió en un tiempo variable tras detener la perfusión.
No se produjo repercusión neonatal en todos los casos expuestos.
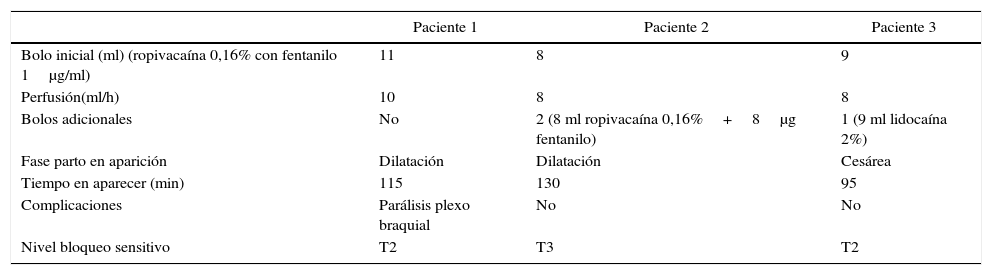
En la tabla 1 se resumen las características clínicas de las pacientes.
Descripción clínica de cada uno de los casos
| Paciente 1 | Paciente 2 | Paciente 3 | |
|---|---|---|---|
| Bolo inicial (ml) (ropivacaína 0,16% con fentanilo 1μg/ml) | 11 | 8 | 9 |
| Perfusión(ml/h) | 10 | 8 | 8 |
| Bolos adicionales | No | 2 (8 ml ropivacaína 0,16%+8μg fentanilo) | 1 (9 ml lidocaína 2%) |
| Fase parto en aparición | Dilatación | Dilatación | Cesárea |
| Tiempo en aparecer (min) | 115 | 130 | 95 |
| Complicaciones | Parálisis plexo braquial | No | No |
| Nivel bloqueo sensitivo | T2 | T3 | T2 |
Fuente: autores.
La clínica del síndrome de Horner es poco llamativa y puede pasar desapercibida, afirmando algunos autores que puede observarse en el 75% de los partos con cesárea que utilizan esta modalidad anestésica5. En gran parte de nuestras pacientes la clínica era sutil, con ptosis parcial.
Se han descrito múltiples razones para explicar la fisiopatología. La mayoría de los autores coinciden en que, para que se produzca este síndrome, es necesaria una dispersión cefálica del anestésico local, dando lugar a la interrupción de la cadena simpática desde C8 a T1, antes de entrar en el ganglio cervical superior. En la paciente gestante se producen una serie de cambios anatómicos que favorecen la difusión del anestésico hacia niveles superiores: hiperpresión abdominal por el útero grávido, contracciones uterinas y dilatación del plexo venoso epidural que reduce dicho espacio. La mayor sensibilidad de las fibras simpáticas a los anestésicos locales permite su bloqueo, conservando las sensitivas y las motoras. Sin embargo, en algunos casos, como el descrito anteriormente, se puede asociar a parálisis motora del plexo braquial, en probable relación a difusión hacia el espacio subdural o subaracnoideo8,9.
Existen variaciones anatómicas que facilitan el ascenso del anestésico local, como la presencia de tabiques fibrosos en el espacio epidural, hiperlordosis lumbar, escoliosis, espondilolistesis, adherencias posquirúrgicas, punciones epidurales repetidas. Una de las pacientes presentaba una marcada hiperlordosis lumbar; el resto de los casos tenían la anatomía habitual de la gestante.
Otras teorías explican que este fenómeno va más allá de los cambios que se producen en la gestante, argumentando una errónea ubicación del catéter epidural en el espacio subdural o bien su migración paravertebral. La introducción del catéter a nivel subdural produce la difusión del anestésico al espacio subaracnoideo, dando un bloqueo sensitivo que afecta a metámeras más cefálicas para el volumen y concentración empleado con afectación motora variable e incluso parada cardiorrespiratoria10. Debido a la evolución benigna, no se descartó mediante radiología su situación subdural, siendo probable que al emplear catéteres multiperforados se facilite su ubicación —aunque de manera parcial— en dicho espacio, estando algunos orificios a nivel epidural y otros a nivel subdural.
La posición en decúbito lateral durante la punción y el aumento de sensibilidad de la embarazada a los anestésicos locales, debido a la progesterona, son otros factores a tener en cuenta. Todas las punciones de nuestro paciente se realizaron en posición sedente.
El anestésico utilizado parece no influir en su incidencia. Así, en nuestra serie apareció tanto con la administración de ropivacaína como de lidocaína, si bien es cierto que en este último caso el tiempo de latencia y recuperación se redujo considerablemente. La administración repetida de dosis de anestésico local puede favorecer la difusión cefálica del mismo; en 2 de los casos se administraron bolos suplementarios aparte del inicial, uno de ellos en el momento de realizar la cesárea y el otro durante la fase de dilatación por requerimiento de la paciente (dolor medido por la escala visual analógica >4). Uno de los casos presentó la clínica con la perfusión continua sin bolo suplementario. El volumen administrado como bolo inicial de anestésico local se calculó en torno a 0,5-1ml por metámera a cubrir en función del estadio del parto.
La clínica del síndrome de Horner es en la mayor parte de los casos autolimitada, y se resuelve en un tiempo medio de 215min, presentado un curso relativamente benigno11. En general se mantiene la estabilidad cardiaca y respiratoria, siendo la hipotensión materna poco frecuente: en las pacientes de nuestro trabajo la clínica desapareció en un tiempo medio de 113min, y todas ellas mantuvieron la estabilidad cardiorrespiratoria.
Sin embargo, a pesar de su buena evolución, su presencia nos informa de un bloqueo simpático que alcanza niveles torácicos con riesgo potencial de colapso cardiorrespiratorio, por lo que la vigilancia del paciente se hace imprescindible, sobre todo en el caso que optemos por mantener el catéter epidural. Ante la mínima sospecha de afectación materna se debe retirar la perfusión de anestésicos locales y realizar un estrecho seguimiento del estado materno y fetal12. Nosotros optamos por retirar la perfusión en las pacientes que presentaron la clínica durante la fase de dilatación, valorando el potencial riesgo de afectación materno fetal, como se comentó previamente. La paciente que sufrió el episodio durante la realización de una cesárea tras bolo epidural permaneció en estrecho seguimiento, sin presentar complicaciones durante la recuperación.
Ante la aparición de esta complicación es conveniente realizar una exploración neurológica exhaustiva. La realización de pruebas complementarias no está indicada de manera sistemática, y se reservan para aquellas pacientes en las que la clínica persiste más allá de 12-24h, para descartar otras causas del mismo (tumor Pancoast, disección carotídea)13-14.
La mayor parte de las series descritas son casos aislados2-13. Pocas series de casos que afecten a varios pacientes han sido publicadas15, y la razón principal radica probablemente en su bajo índice de sospecha y el infradiagnóstico de dicho síndrome; es decir, hay que buscarlo activamente, ya que a pesar de su buen pronóstico, nos puede indicar de manera indirecta una difusión cefálica del anestésico local hasta niveles potencialmente peligrosos, siendo el manejo fundamental la observación y la vigilancia hasta la desaparición total de la clínica, optando por la suspensión de la perfusión de anestésico local hasta la remisión de la misma.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.