El síndrome de Parry-Romberg es una enfermedad degenerativa poco común caracterizada por una atrofia unilateral que afecta la piel, el tejido conjuntivo, el músculo y el hueso. El resultado final es una asimetría facial que cursa con otras alteraciones cutáneas, dentales, oculares, cardiovasculares y neurológicas.
Hallazgos clínicos, evaluación diagnóstica e intervencionesPresentamos un caso de un paciente con síndrome de Parry-Romberg programado para remodelación de colgajo frontonasal. Entre sus antecedentes destacan neuralgia del trigémino, epilepsia y 2 intervenciones quirúrgicas previas. Tras una adecuada preoxigenación y posterior inducción anestésica, se realiza una intubación endotraqueal sin incidencias mediante el videolaringoscopio Glideoscope®.
ConclusiónEl síndrome de Parry-Romberg presenta como características fenotípicas hemiatrofia facial grave y anomalías craneofaciales, que requieren una cuidadosa evaluación preoperatoria y el manejo de una vía aérea potencialmente difícil. Es por esto que los videolaringoscopios resultan una alternativa de primera línea. Debido a sus trastornos asociados, es esencial mantener la estabilidad hemodinámica y la prevención de posibles crisis convulsivas.
Parry-Romberg syndrome is a rare degenerative disease characterized by unilateral atrophy affecting the skin, connective tissue, muscle and bone. The end result is facial asymmetry associated with other skin, dental, visual, cardiovascular, and neurological disorders.
Clinical findings, diagnostic evaluation and interventionsThe case of a patient with Parry-Romberg syndrome programmed for frontonasal flap remodeling is discussed. The patient's history includes trigeminal neuralgia, epilepsy, and two previous surgical interventions. Uneventful endotracheal intubation with the Glideoscope® video laryngoscope was performed, upon adequate pre-oxygenation followed by anesthetic induction.
ConclusionThe phenotypical characteristics of Parry-Romberg syndrome are severe facial hemiatrophy and craniofacial anomalies that require careful preoperative evaluation and management of a potentially difficult airway. Consequently, the use of video laryngoscopes is a first-line approach. Due to the syndrome's associated disorders, it is essential to maintain hemodynamic stability and prevent any potential seizures.
El síndrome de Parry-Romberg (SPR), también conocido como hemiatrofia facial progresiva, es una rara enfermedad degenerativa que se caracteriza por una atrofia unilateral que afecta de forma variable la piel, el tejido subcutáneo, el músculo, el tejido conectivo y el hueso1,2. A veces puede extenderse hasta el cuello, e incluso a todo el cuerpo3. Característicamente, la atrofia se inicia en las primeras décadas de la vida1,3, progresando lentamente durante años hasta que termina estabilizándose3. El resultado final es una asimetría facial que puede acompañarse de otras alteraciones cutáneas, dentales, oculares y neurológicas. Por lo general afecta más a las mujeres y al lado izquierdo de la cara2. Su incidencia y etiología exacta no se conocen2,3, siendo la teoría más reciente y fiable la de una alteración genética en la embriogénesis del sistema nervioso central2 junto a la hiperactividad del sistema nervioso simpático a nivel cerebral, probablemente de causa autoinmune4.
El objetivo del tratamiento en el SPR es la remodelación del contorno facial minimizando las complicaciones asociadas a la atrofia2,3, la cual condiciona una vía aérea difícil (VAD) de abordar. Es de nuestro interés presentar un informe de caso de un paciente con SPR con predictores de VAD y una intubación orotraqueal (IOT) exitosa usando el videolaringoscopio (VL) Glideoscope®.
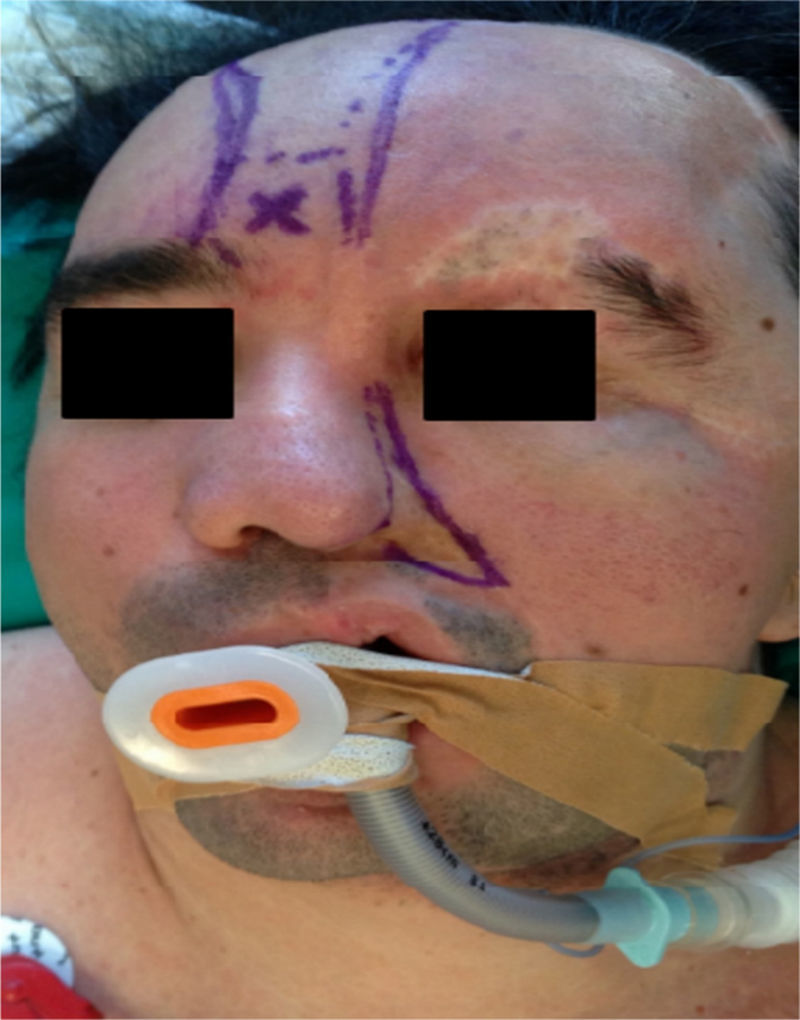
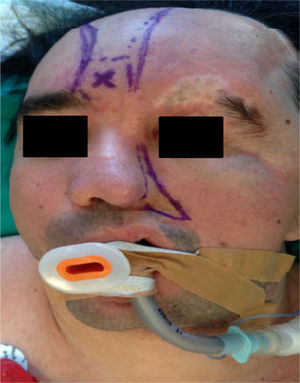
Caso clínicoPaciente de 33 años de edad programado para remodelación quirúrgica de un colgajo frontonasal con diagnóstico de SPR desde la infancia (fig. 1). Entre sus antecedentes destacan neuralgia del trigémino y epilepsia en tratamiento con carbamazepina y ácido valproico. No presenta patología cardíaca relevante. Como antecedentes quirúrgicos, 2 intervenciones previas de reconstrucción facial hace una década.
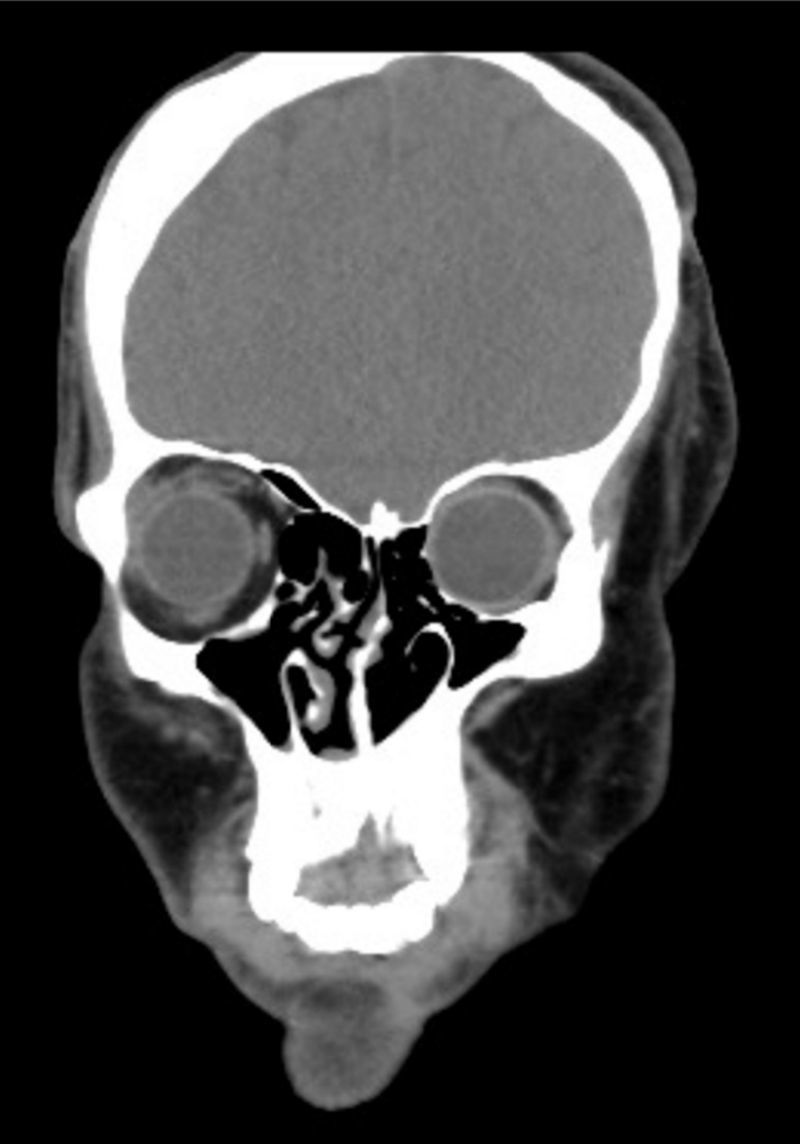
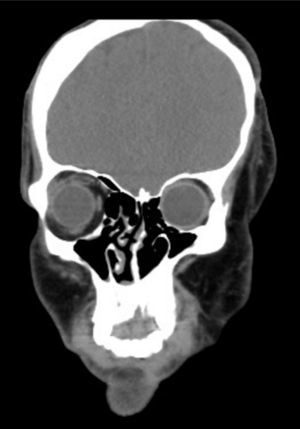
En la consulta preanestésica se realiza una exploración física minuciosa y se revisan las pruebas complementarias. Se evidencia una marcada asimetría facial, atrofia de la hemicara izquierda, retracción del ala nasal izquierda, desviación del tabique nasal, hipoplasia del hueso frontal, malar, maxilar y hemimandíbula izquierda. También se observa una redundancia temporal y de las mejillas debido al hiperdesarrollo del músculo temporal, del masetero y de la glándula parótida izquierda (fig. 2). Portador de una prótesis ocular (tras la pérdida del globo ocular izquierdo debido al endoftalmos). El peso es de 80kg.
En la evaluación de la vía aérea se determina un gradoiii en la clasificación de Mallampati, una distancia tiromentoniana de 5cm y una interdental de 4cm, así como desviación de la lengua y de la úvula y una discreta limitación de la extensión cervical. No se aprecian piezas dentales móviles. Analizando registros anestésicos anteriores, se constata una clasificación Cormack-Lehaneiib en las intubaciones previas, requiriendo el uso de una guía de Eshmann.
A su llegada a quirófano se monitoriza de forma habitual con presión arterial no invasiva, pulsioxímetro y electrocardiograma. Tras canalizar una vía venosa periférica, se preoxigena adecuadamente al paciente. Como técnica anestésica, se realiza una inducción intravenosa administrando 150μg de fentanilo y 180mg de propofol. No se presenta obstrucción de la vía aérea durante la ventilación manual con mascarilla facial. Mediante el empleo del VL Glideoscope® se obtiene una adecuada visualización glótica. Tras ello, se administra un bloqueante neuromuscular (rocuronio 50mg), consiguiéndose la IOT al primer intento sin incidentes. Después de comprobar la posición correcta del tubo traqueal por capnografía y auscultando ambos hemitórax, se procede a la fijación del mismo y se instaura la ventilación mecánica. Para el mantenimiento de la anestesia se emplea sevoflurano a 1CAM y fentanilo en función de las necesidades analgésicas. La intervención, de 120min, transcurre sin incidencias.
CalendarioNo se especifica por el formato del caso clínico.
Seguimiento y resultadoAl finalizar el procedimiento se administran 2g de metamizol y 4mg de ondansetrón y se revierte el bloqueo neuromuscular residual con 160mg de sugammadex, realizándose la extubación de forma exitosa. Se traslada a la unidad de recuperación postanestésica para vigilancia postoperatoria.
DiscusiónDiscusión de la literatura médicaDespués de realizar una búsqueda en la literatura médica solo encontramos un reporte de caso respecto al manejo anestésico del SPR1. Sin embargo, se trata de una enfermedad craneofacial multisistémica con trastornos asociados, cuyas implicaciones anestésicas no han sido definidas claramente. Consideramos que el conocimiento del mismo y de los múltiples sistemas que se pueden encontrar afectados es importante desde el punto de vista del manejo perioperatorio, prestando especial consideración a la VAD.
Los pacientes con SPR presentan como características fenotípicas hemiatrofia facial grave, asimetría facial, anomalías dentales y craneofaciales. A menudo existe desviación de la boca y de la nariz hacia el lado afecto, así como desviación de la lengua y la úvula1. Como en otros síndromes craneofaciales5, todo esto puede condicionar una VAD.
Respecto al manejo de una VAD prevista, la IOT con fibrobroncoscopio flexible es una técnica eficaz, segura y se considera el gold standard. Sin embargo, atendiendo al último algoritmo sobre VAD actualizado por la American Society of Anesthesiologists (ASA) en 20136, los VL están incluidos también como dispositivos de primera línea en el abordaje de la misma. Respecto al VL Glideoscope®, cabe destacar una mejor visualización glótica que con la laringoscopia directa7 mediante una alineación del eje oro-faríngeo-laríngeo, que resulta habitualmente complicada en los pacientes con síndromes craneofaciales5 como el SPR y que puede ser beneficioso en los casos de VAD7. Su angulación única de 60°, la visualización en tiempo real, la mejora en la clasificación de Cormack-Lehane y el estilete provisto apropiadamente ayudan a una adecuada IOT8. En un reciente estudio simulado que compara varios dispositivos para el manejo de la vía aérea9, concluye que con el VL Glideoscope® se consigue una menor tasa de intubación fallida y un menor tiempo tanto para una adecuada exposición glótica como para la consecución de una IOT exitosa9. Además, este dispositivo fue calificado como el más fácil de usar y el preferido en un escenario de VAD9.
Entre las manifestaciones sistémicas, la miocardiopatía hipertrófica se ha asociado con el SPR10. Antes de la intervención, y en función de la historia cardiológica, deben realizarse un electrocardiograma y una ecocardiografía, valorando la administración de un betabloqueante perioperatorio para optimizar el llenado ventricular10. También se han publicado 2 casos de pacientes con SPR con cardiopatía congénita11 y otro con taquicardia supraventricular1. Esto, junto con la hiperactividad del sistema nervioso simpático4, hace imprescindible un buen control del dolor y un mantenimiento adecuado del volumen intravascular12.
Entre las manifestaciones neurológicas se encuentran: neuralgia del trigémino, parestesia facial, migraña y epilepsia focal2,3. Esta última es la más común, estando descrita hasta en el 10% de los pacientes con SPR, consecuencia de las lesiones frontoparietales que suelen encontrarse en las pruebas de imagen. Un adecuado cumplimiento terapéutico, así como la administración de una benzodiacepina preoperatoria para la ansiólisis, resultan aconsejables.
El SPR está relacionado con otros trastornos autoinmunes, como enfermedad tiroidea, vitíligo, artritis reumatoide, espondilitis anquilosante, lupus eritematoso sistémico y tortícolis3. Especial mención merece la esclerodermia lineal en «golpe de sable». Para algunos autores ambas entidades coexisten, para otros el SPR se trata de una variante de esta enfermedad3.
En estos pacientes resulta relevante la identificación de dientes móviles (las raíces pueden estar poco desarrolladas) para evitar lesiones durante la IOT, así como de telangiectasias nasales u orales (en los casos asociados a esclerodermia) que pueden sangrar durante la misma. También es preciso evaluar la adecuada movilidad cervical dada la fibrosis propia de la patología o debida a cirugías previas o su asociación a artritis reumatoide y tortícolis.
Por tanto, los objetivos fundamentales que debemos marcarnos son: una evaluación perioperatoria frecuente que permita detectar nuevas manifestaciones de la enfermedad, una cuidadosa planificación y abordaje de una VAD, asegurar el mantenimiento de la estabilidad hemodinámica y la prevención de posibles trastornos neurológicos, en especial crisis convulsivas1.
Manejo de nuestro pacienteEn nuestro caso, conocíamos el grado de la clasificación de Cormack (iib) de las 2 intervenciones quirúrgicas previas, aunque estas se realizaron con bastaste anterioridad (más de una década). Por esto, dado el carácter progresivo de esta enfermedad, consideramos esta información como adicional y se decide planificar el manejo de la vía aérea basándonos en la situación actual. La vía aérea asimétrica como consecuencia de la atrofia del macizo facial izquierdo podía condicionar una obstrucción de la misma durante la ventilación con mascarilla facial. Dado el tipo de intervención propuesta, se opta por asegurar la vía aérea mediante IOT. En nuestro caso, elegimos el VL Glideoscope® dada nuestra amplia experiencia con el uso de este dispositivo y para valernos de lo que a nuestro juicio es una de sus principales atribuciones, la posibilidad de valorar in situ a través de una pantalla la vía aérea del paciente (siempre bajo un adecuado grado de hipnosis) previamente a la administración de un bloqueante neuromuscular. Esto supone una doble ventaja; por un lado, permite evaluar el grado de exposición glótica y la factibilidad de la intubación sin el riesgo de tener a un paciente con VAD bloqueado neuromuscularmente, pudiéndosele administrar dicho agente para facilitar la intubación y evitar lesiones iatrogénicas de las cuerdas vocales en condiciones de seguridad. En cualquier caso, debemos tener un plan alternativo, así como disponer de un carro de VAD totalmente equipado. Atendiendo a estas recomendaciones, contamos con una mascarilla laríngea Supreme®, por si la ventilación y/o la intubación resultaran dificultosas, y sugammadex ante la posibilidad de un escenario de no ventilación/intubación que requiriera despertar al paciente13.
En cuanto a los trastornos asociados, nuestro paciente no presenta patología cardiaca. Sin embargo, dados sus antecedentes de crisis epilépticas, se decide continuar con su tratamiento anticonvulsionante y asociar una benzodiacepina perioperatoria.
LeccionesDestacamos la importancia de una evaluación preoperatoria continua y minuciosa por los cambios faciales progresivos, la adecuada gestión de una VAD y la prevención de las posibles complicaciones cardiovasculares y neurológicas que puedan surgir para proporcionar una técnica anestésica segura en los pacientes con SPR. Destacamos el papel del VL Glideoscope®, que permite una excelente visualización glótica especialmente en pacientes con síndromes craneofaciales, siendo una alternativa de primera línea en estos pacientes en manos expertas.
Perspectiva del pacienteEl paciente percibió el manejo anestésico realizado como el que mayores beneficios aportaba dada la intervención quirúrgica y sus riesgos anestésicos asociados.
Consentimiento informadoSe obtuvo consentimiento informado por escrito para publicación del caso e imágenes asociadas, preservando la identidad del paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos y animales.
Confidencialidad de los datosLos autores destacan que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores destacan que en este artículo no aparecen datos de pacientes.
FinanciamientoNuestro trabajo no ha sido financiado.
Conflictos de interesesNo existen conflictos de intereses.