Determinar la capacidad buffer de la saliva al ser añadida a distintas bebidas energéticas comercializadas en Chile, mediante mediciones de pH in vitro.
MétodosFue requerida la participación de 3 pacientes jóvenes sistémicamente sanos, sin enfermedad de las glándulas salivales. Las muestras de saliva estimulada fueron obtenidas de cada paciente, las cuales fueron mezcladas y almacenadas en una sola muestra. Se seleccionaron 13 bebidas energéticas comercializadas a nivel nacional. Un total de 5mL de cada bebida energética se distribuyó en 4 tubos Falcon. Se midió el pH de cada una de las bebidas energéticas, de la saliva y del agua potable. Se añadió 1mL de agua potable al tubo Falcon número 1 y 1mL de saliva a los 3 tubos restantes, cada 3 min hasta completar 13mL de solución en cada uno (38% vol./vol.). Las mediciones de pH fueron realizadas en cada 1mL añadido (saliva/agua), para permitir al ph-metro registrar de manera correcta.
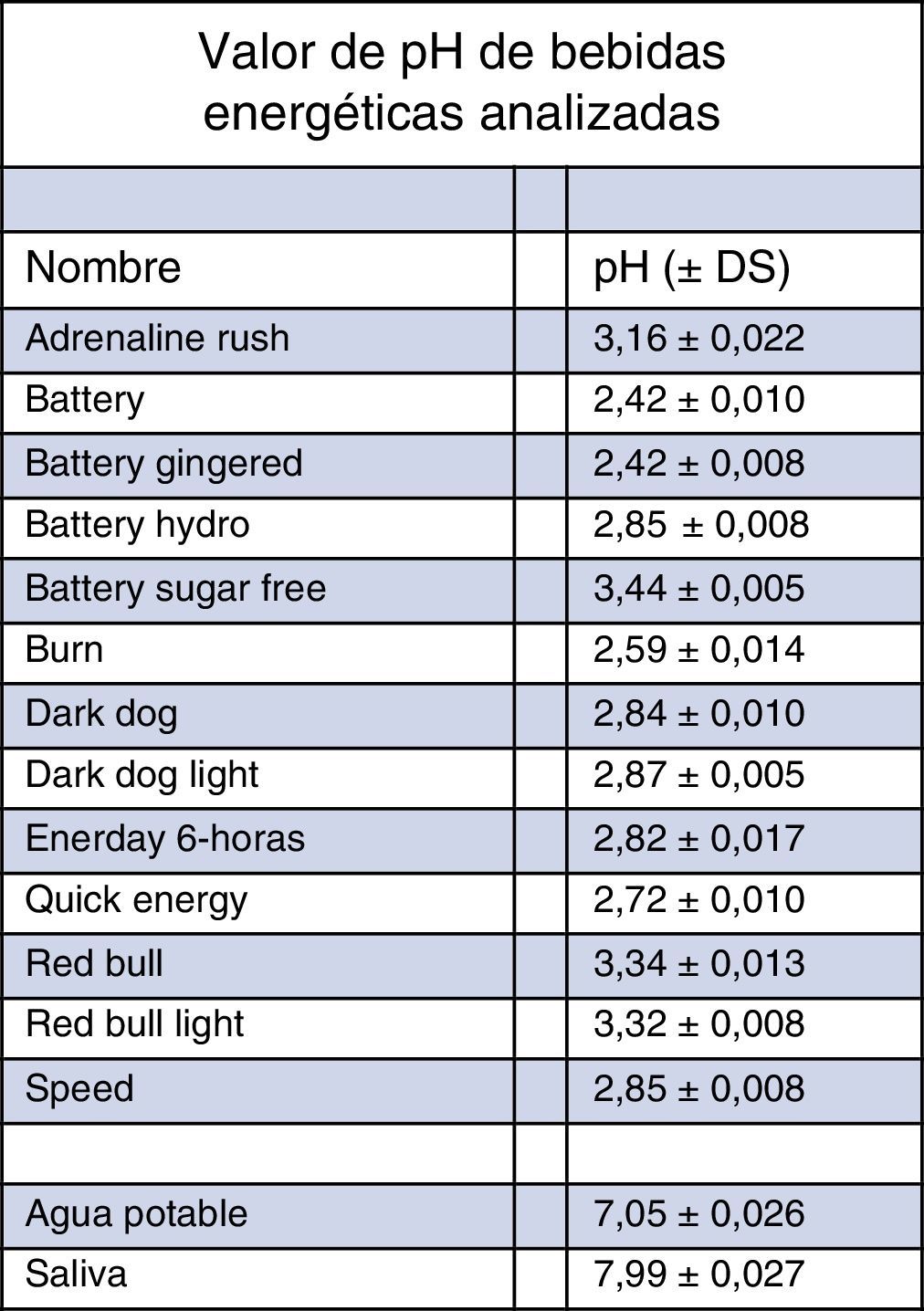
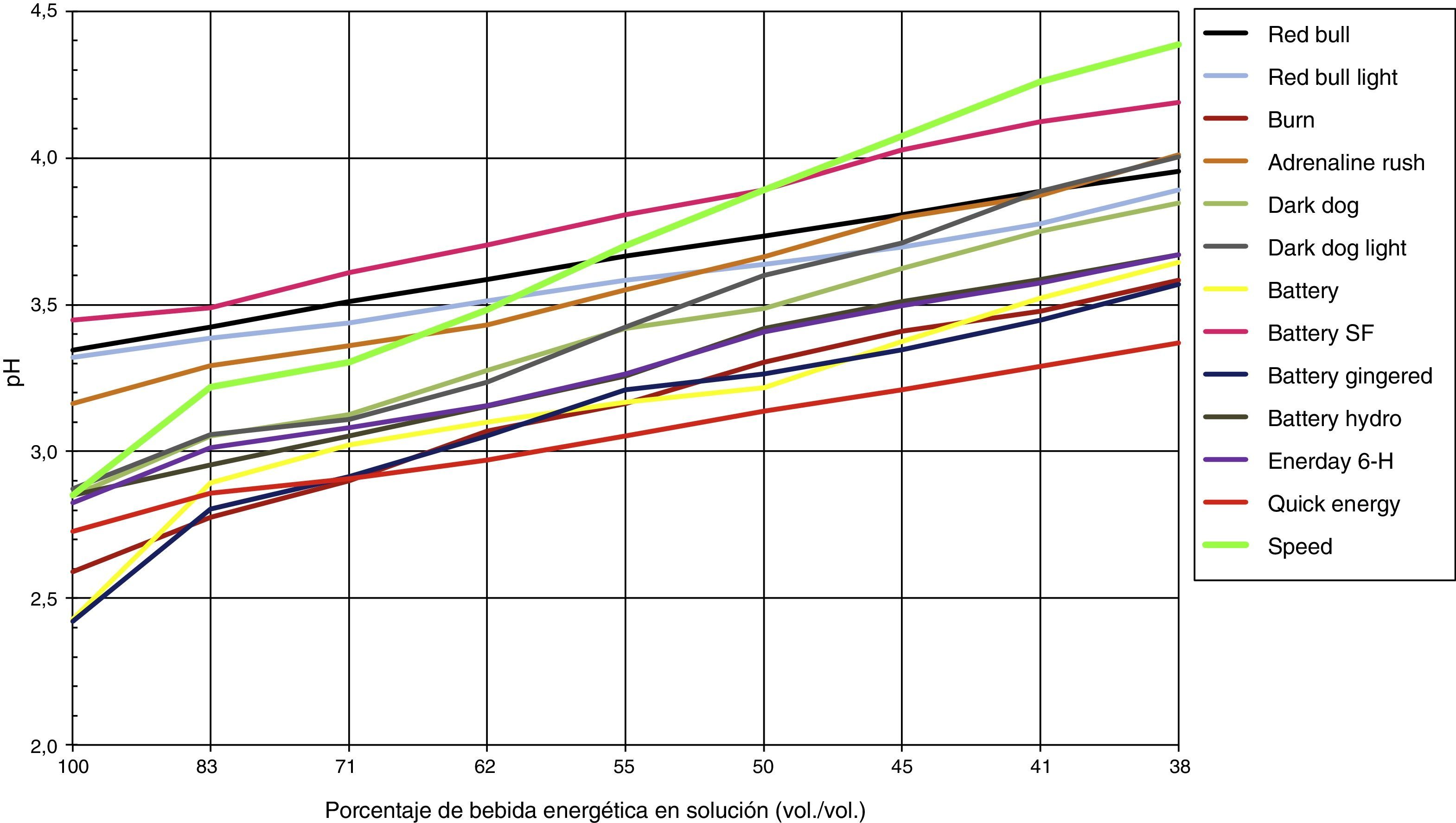
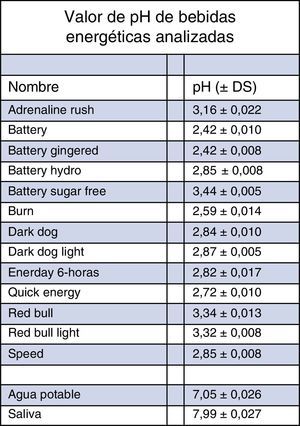
ResultadosLos rangos de pH para las bebidas energéticas van desde pH 2,42±0,008 (Battery Gingered®), hasta pH 3,44±0,005 (Battery Sugar Free®). La saliva en promedio tuvo un valor de pH 7,99 y el agua potable de 7,05. La bebida que más logró aumentar el pH, luego de agregar la saliva, fue la bebida Speed® que llegó a un valor de pH 4,38, mientras la que logró menos fue la bebida Quick Energy®, con un valor de pH 3,37.
ConclusiónLa capacidad buffer de la saliva logró aumentar entre 17 y 54% el pH de las bebidas energéticas analizadas en este estudio. Sin embargo, no pudo neutralizar los bajos niveles de pH de estas bebidas más allá de un pH final de 4,38, que es crítico para la estructura dentaria.
To determine, using in vitro pH measurements, the buffering capacity of saliva when added to different energy drinks sold in Chile.
MethodThe participation of 3 young and systemically healthy patients, with no diseases of the saliva glands, was obtained. Samples of stimulated saliva where obtained from each patient and then mixed and stored as one sample. The study used 13 energy drinks sold nationwide, with 5mL of each one being distributed into 4 Falcon tubes. The pH of each of the energy drinks, the saliva sample, and drinking water was measured. 1mL of drinking water was added into Falcon tube number 1, and 1mL of saliva into the 3 remaining every 3 min until completing 13mL of solution in each one (38% vol./vol.). The pH measurements where performed upon adding each 1mL (saliva/water) to allow the pH meter to correctly register the data.
ResultsThe pH levels for energy drinks range between pH 2.42±0.008 (Battery Gingered®), to pH 3.44±0.005 (Battery Sugar Free®). The saliva had a mean pH value of 7.99, and 7.05 for drinkable water. The energy drink that achieved a higher increase in pH level was Speed®, reaching a value of pH 4.38, while the energy drink that increased the pH level the least was Quick Energy®, only reaching a pH of 3.37.
ConclusionThe buffering capacity of saliva managed to increase the pH level of energy drinks analyzed in this study between 17 and 54%. However, saliva was unable to neutralize further than 4.38 the low levels of pH in these drinks, thus being critical to dental structure.
El consumo de bebidas deportivas y energéticas, especialmente en niños y adolescentes de los EE. UU., ha aumentado durante los últimos años1. Se ha informado que aproximadamente el 30-50% de los adolescentes y adultos jóvenes en los EE. UU. consumen bebidas energéticas y que entre el 51 y el 62% de los adolescentes consumen por lo menos una bebida deportiva al día1. En Chile, la realidad no es muy diferente, ya que el consumo de estas bebidas energéticas ha aumentado desde su llegada hace 10 años, con un crecimiento de hasta el 26,7%2.
Se presume que la mayoría de los consumidores no están plenamente informados de los contenidos de estas bebidas y, por lo general, piensan que son mejores y más saludables para los dientes que las bebidas carbonatadas. Sin embargo, la acidez de estas bebidas preocupa al sector odontológico debido al potencial de erosión que esta posee sobre el esmalte dentario3.
La erosión dental es el resultado físico de un ataque con ácido (no debido a las bacterias) sobre cualquier superficie expuesta del diente, causando locales desmineralizaciones de los tejidos duros dentales4. El potencial erosivo de una bebida está determinado por ciertos factores como: el pH, la capacidad buffer de la saliva frente a los ácidos, el tiempo de exposición y frecuencia de ingesta de la bebida, entre otros5.
Las bebidas energéticas son sustancias sin alcohol y con algunas virtudes estimulantes, las cuales no deben confundirse con las bebidas deportivas, cuya función principal es la hidratación. En los últimos años se ha investigado sobre sus componentes, analizando principalmente el contenido de azúcar (hidratos de carbono), cafeína, guaraná, vitaminas y ácido cítrico. El ácido cítrico presente se ha reportado que es muy erosivo para el esmalte dentario, ya que el efecto desmineralizador sobre él continúa incluso después de neutralizar el pH1.
Seow et al.6 realizaron un estudio sobre el efecto erosivo de algunas bebidas comunes sobre premolares extraídos. Analizaron bebidas como Coca-Cola®, jugo de limón, Pepsi® y Red Bull®, entre otras. Realizaron mediciones de pH y como este se comporta al agregar saliva y agua. Lograron demostrar una reducción en el grosor del esmalte dentario al exponerlo en las bebidas más ácidas. Pero no analizaron más a fondo la bebida Red Bull®, a pesar de presentar un pH de 3,1.
Hasta la fecha, la bebida energética con más estudios en esta materia es la bebida Red Bull®6–9. Sin embargo, recientemente Jain et al.10 compararon las bebidas energéticas con las bebidas deportivas y cómo estas afectaban al esmalte dentario. Analizaron las propiedades químicas de ambos tipos de bebidas, pH, cantidad de flúor (ppm) y acidez titulable, es decir, la cantidad en moles de NaOH necesaria para neutralizar el pH de una sustancia. Los resultados mostraron que las bebidas energéticas tienen una acidez titulable mayor y menor cantidad de flúor comparadas con las bebidas deportivas. Son los primeros investigadores en analizar más de 2 bebidas energéticas, obteniendo resultados satisfactorios. El estudio encuentra una relación significativa entre acidez titulable y pérdida de esmalte dentario.
La saliva presenta un punto de saturación frente a diferentes sustancias que son ingeridas, y algunas personas pueden tardar hasta 20-30min en neutralizar el pH intraoral11. En personas con baja concentración de calcio y fosfato, el pH crítico para la descalcificación de la hidroxiapatita podría ser de 6,5; mientras que en aquellos esmaltes con altas concentraciones de calcio y fosfato, el pH crítico podría ser de 5,5, y de pH 4,5 para esmaltes con concentraciones de flúor8,11,12.
Larsen y Nyvad 13 investigaron in vitro el potencial erosivo de bebidas carbonatadas, aguas minerales y zumos de naranja, y compararon las profundidades de erosión con el pH y la capacidad de amortiguación. Concluyeron que la erosión fue mínima en las bebidas que contenían un pH superior a 4,2, pero se hizo más evidente con la disminución de pH por debajo de 4,0.
La gran variedad de bebidas energéticas disponibles en el mercado y su consumo frecuente, así como investigaciones que afirman que el contenido de ácido de estas bebidas puede provocar daños en la estructura dentaria, llevó a los autores a realizar este estudio con el fin de determinar la capacidad buffer de la saliva al ser añadida a diferentes bebidas energéticas disponibles en el mercado chileno, mediante la medición de pH in vitro a distintas concentraciones de solución.
Materiales y métodosDiseño y selección de bebidas energéticasEl diseño experimental fue in vitro. Para la realización de este estudio fueron seleccionadas bebidas energéticas (n=13) disponibles en más de un establecimiento de consumo masivo y con red de distribución a nivel nacional, supermercados, estaciones de servicio y pequeños establecimientos. Fue considerada como bebida energética aquella que tuviera ingredientes estimulantes como: cafeína, taurina, ginseng o guaraná.
Sujetos y recolección de salivaFueron seleccionados 3 adultos sanos6 (edad 18-25 años, de ambos sexos) estudiantes y miembros del personal de la Facultad de Odontología, Universidad del Desarrollo, los cuales aceptaron participar voluntariamente en este estudio y firmaron el formulario de consentimiento informado. Los criterios de inclusión fueron: ser mayores de 18 años, COPD 0 y estar dispuestos a completar un cuestionario de revisión médica. Los criterios de exclusión fueron: participación en cualquier estudio oral concurrente, padecer periodontitis, ser fumadores, tener historia de alergias, enfermedades cardíacas o sistémicas, haber recibido terapia de radiación de cabeza y cuello, padecer enfermedades metabólicas como la diabetes, y presentar otras condiciones médicas, así como consumir fármacos y colutorios que pudieran afectar la tasa de flujo salival.
Las muestras de saliva estimulada fueron recolectadas en la Clínica Odontológica de la Universidad del Desarrollo, Santiago (Chile), en 2 sesiones para cada individuo, bajo las mismas condiciones de temperatura y humedad, entre las 8 y las 12 de la mañana con el objetivo de reducir la influencia de los ritmos circadianos de cada sujeto. Todos los voluntarios se abstuvieron de comer o beber por los menos 8 h antes de la recolección de saliva, y de realizar higiene bucal 2 h antes del estudio14. Se les permitió usar pasta dental fluorada durante la higiene bucal.
Cada voluntario se enjuagó la boca con agua durante 30 s y posteriormente masticó un trozo de cera de parafina sin sabor durante 5 min15. La saliva acumulada fue depositada en un envase de plástico de 60mL. Este ejercicio se repitió 5 veces hasta acumular 50-60mL de saliva por paciente, por sesión, para un total de 110mL de saliva por individuo.
Las muestras salivales fueron almacenadas durante 7 días a una temperatura de −21,5°C para evitar contaminación bacteriana.
Confección del conjunto de salivaLas muestras de saliva fueron trasladadas al Instituto de Ciencias de la Universidad del Desarrollo (Santiago, Chile). Una vez en el lugar, se dejaron descongelar a temperatura ambiente de 21,5°C. Toda la saliva se recolectó6 en un envase de vidrio, agrupando un total de 330mL de saliva (110mL por individuo). Luego, fueron dividas en 13 tubos Falcon de 25mL y congeladas a −21,5°C durante 7 días.
Mediciones de pHLas mediciones de pH fueron realizadas utilizando un electrodo de pH (HI 1110B, electrodo pH, conector BNC, 1mt cable) conectado al equipo Hanna pH 21 (Woonsocket, EE. UU.). Previamente el electrodo fue calibrado al inicio de cada sesión utilizando soluciones de tampón estándares de pH 4,0 y 7,0. Todas las mediciones fueron hechas a 21,5°C de temperatura.
Se procedió a descongelar las muestras de saliva a la temperatura anteriormente descrita. Posteriormente se vertieron 5mL de bebida energética en 4 tubos Falcon y se midió el pH inicial. Se agregó 1mL de agua al tubo número uno y 1mL de saliva a los 3 tubos restantes cada 3 min hasta obtener una solución de 13mL (38% vol./vol.). Las mediciones fueron hechas en cada 1mL añadido (saliva y agua) en períodos de 3 min para permitirle al ph-metro registrar de manera correcta el pH. Este procedimiento se realizó con cada una de las bebidas energéticas. Se obtuvo un total de 3 mediciones (bebida energética+saliva) y una medición (bebida energética+agua) para cada tipo de bebida energética.
El pH de la saliva fue determinado midiendo cada alícuota de saliva de 25mL, antes de ser mezclado con bebida energética, al igual que el agua potable.
Las pruebas se realizaron durante 5 días; entre cada procedimiento, el electrodo fue lavado con solución de lavado de proteínas para limpiar los residuos de saliva adosados, disminuyendo así algún error en la medición. Luego de terminar de ocupar el electrodo fue guardado en solución de almacenamiento.
ResultadosLos valores de pH de cada sustancia analizada se encuentran detallados en la figura 1.
Los rangos de pH para las bebidas energéticas van desde pH 2,42±0,008 (Battery Gingered®), hasta pH 3,44±0,005 (Battery Sugar Free®). Mientras que la saliva en promedio tuvo un valor de pH 7,99 y el agua potable de 7,05.
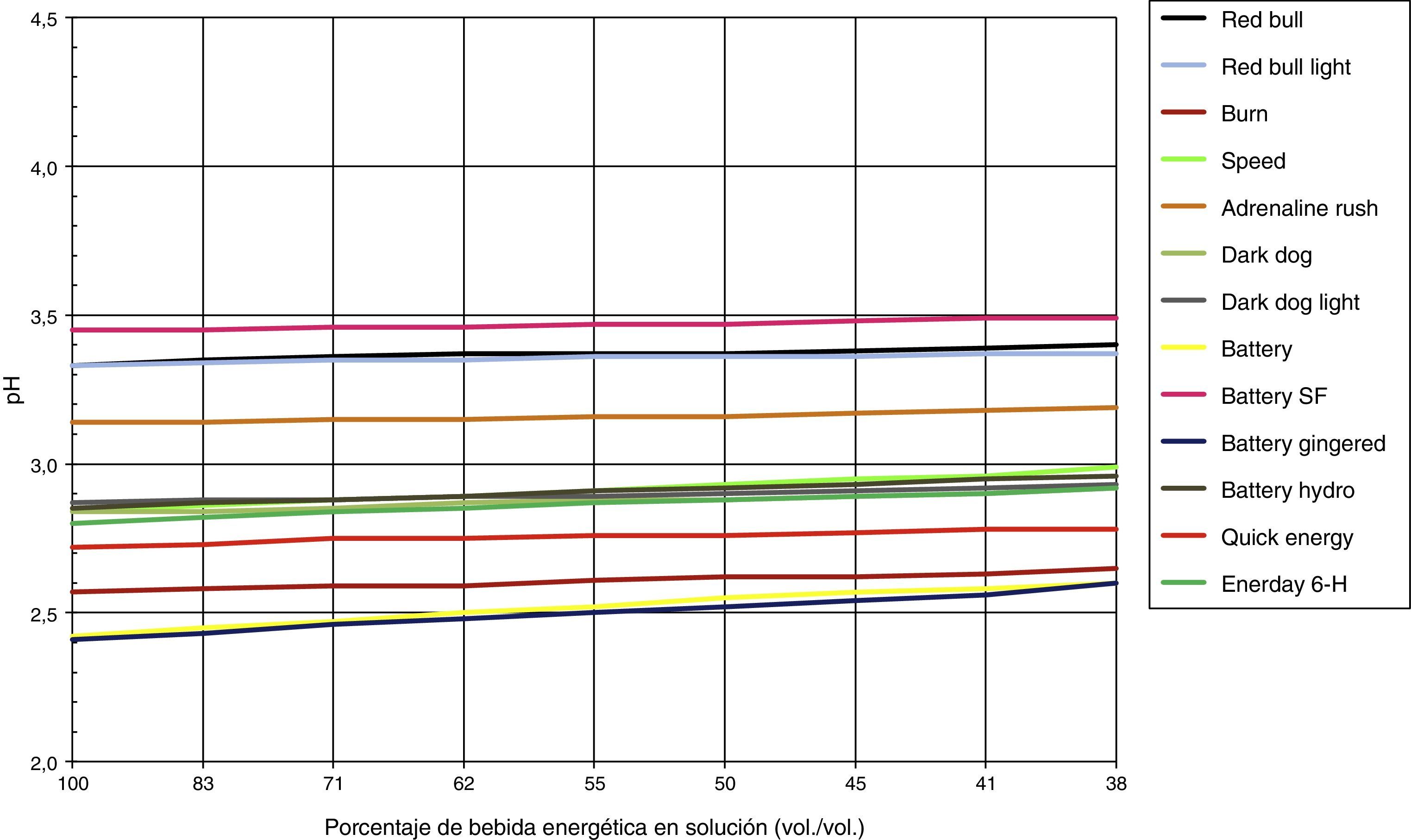
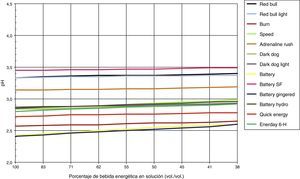
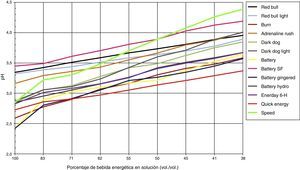
Los cambios de pH experimentados luego de adicionar agua o saliva se pueden observar en las figuras 2 y 3, respectivamente, donde el 100% de solución corresponden a 5mL de bebida energética y progresivamente va diluyéndose en saliva o agua agregada, hasta obtener una solución al 38% vol./vol de bebida energética.
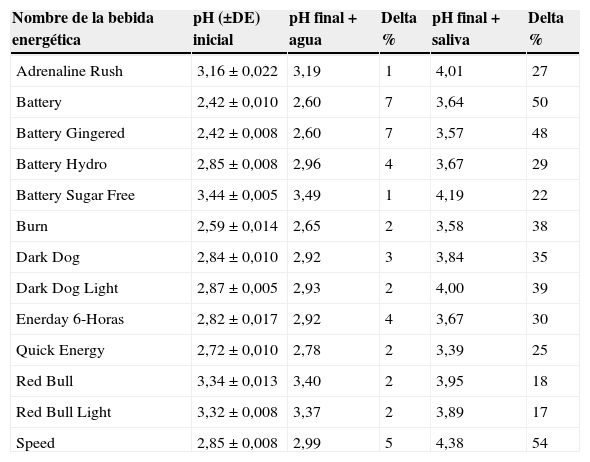
Los valores de pH inicial y de pH final para cada bebida luego de agregar agua o saliva se muestran en la tabla 1.
Valores de pH iniciales y finales para cada bebida energética. Se pueden apreciar los valores iniciales de cada bebida y los valores finales luego de agregar 8mL de agua/saliva a la solución
| Nombre de la bebida energética | pH (±DE) inicial | pH final+agua | Delta % | pH final+saliva | Delta % |
|---|---|---|---|---|---|
| Adrenaline Rush | 3,16±0,022 | 3,19 | 1 | 4,01 | 27 |
| Battery | 2,42±0,010 | 2,60 | 7 | 3,64 | 50 |
| Battery Gingered | 2,42±0,008 | 2,60 | 7 | 3,57 | 48 |
| Battery Hydro | 2,85±0,008 | 2,96 | 4 | 3,67 | 29 |
| Battery Sugar Free | 3,44±0,005 | 3,49 | 1 | 4,19 | 22 |
| Burn | 2,59±0,014 | 2,65 | 2 | 3,58 | 38 |
| Dark Dog | 2,84±0,010 | 2,92 | 3 | 3,84 | 35 |
| Dark Dog Light | 2,87±0,005 | 2,93 | 2 | 4,00 | 39 |
| Enerday 6-Horas | 2,82±0,017 | 2,92 | 4 | 3,67 | 30 |
| Quick Energy | 2,72±0,010 | 2,78 | 2 | 3,39 | 25 |
| Red Bull | 3,34±0,013 | 3,40 | 2 | 3,95 | 18 |
| Red Bull Light | 3,32±0,008 | 3,37 | 2 | 3,89 | 17 |
| Speed | 2,85±0,008 | 2,99 | 5 | 4,38 | 54 |
Según lo observado, la bebida que más logra aumentar el pH, luego de agregar la saliva, es la bebida Speed®, que llega a un valor de pH 4,38, mientras que la que menos logra aumentar el pH es la bebida Quick Energy®, que llega a un valor de pH 3,37.
DiscusiónLa erosión dental puede ser causada por factores intrínsecos y extrínsecos. Dentro de los factores extrínsecos, el consumo de bebidas ácidas está considerado como la principal causa. Las investigaciones que se han realizado sobre este tema se centran en la evaluación de diferentes parámetros como el pH, la acidez titulable, las concentraciones de calcio, fosfato y fluoruro, y el grado de saturación con respecto a la hidroxiapatita y a la fluorapatita. Numerosos estudios están de acuerdo en que el pH es el principal factor en determinar el potencial erosivo de las bebidas ácidas16–19, y se ha evidenciado que existe una correlación positiva entre la capacidad buffer de la saliva y el potencial erosivo con respecto al esmalte dentario9,20,21.
Los pH de las bebidas energéticas analizadas en este estudio son altamente ácidos, con valores que oscilan entre 2,42 (Battery®) y 3,44 (Battery Sugar Free®), los cuales están muy por debajo del pH crítico (6,5-4,5) para el esmalte.
Al analizar las variaciones de pH después de agregar agua, se puede apreciar que esta no logra variar el pH de ninguna bebida de manera significativa (1-7%), esto podría deberse a la carencia de elementos buffer. Por otro lado, el agua puede amortiguar los pH de diferentes sustancias por medio de la dilución, pero en este caso las bebidas energéticas tienen una concentración de iones de hidrógeno (H+) muy fuerte, lo que las hace muy difíciles de diluir. La bebida que sufrió la variación de pH más elevada luego de agregar agua fue la bebida Battery Gingered®, con un pH inicial de 2,42 y un pH final de 2,60.
La saliva es una sustancia compuesta por 99% agua y un 1% de diferentes componentes, entre estos: bicarbonato, fosfato, urea y diferentes proteínas que se comportan como buffers22. Luego de analizar los resultados, la saliva sí logró amortiguar y elevar el pH de todas las bebidas energéticas (17-54%), pero en ningún caso por encima del pH crítico del esmalte (4,5-6,5), esto en una solución de 38% de bebida energética (5mL bebida energética más 8mL de saliva). La bebida que logró alcanzar el pH más elevado y la mayor variación entre pH inicial y final, luego de agregar saliva, fue la bebida energética Speed® (pH inicial 2,85 y pH final 4,38). Por otro lado, la bebida que sufrió menos variación de pH fue Quick Energy® de 2,72 a 3,37. Esto no significa que la saliva no logre amortiguar el pH de las bebidas energéticas, sino que requiere más tiempo y volumen de saliva para lograr neutralizar este tipo de bebidas. El problema está durante ese tiempo, cuando la cavidad oral está expuesta a un pH muy bajo y, cuanto más tiempo transcurra antes de restablecer el pH, mayor será el riesgo de sufrir erosiones.
Dentro de las bebidas energéticas evaluadas en este estudio, la única que coincide con las analizadas por Jain et al.10 es Red Bull®, en la que se obtuvieron valores de pH (3,34±0,013) muy similares a los registrados por Jain et al. (3,37±0,06). Por otro lado, ellos utilizaron Red Bull Sugar Free® en la cual registraron valores de pH 3,27±0,01 que son muy cercanos a los obtenidos en este estudio con Red Bull Light® (3,32±0,008). Por lo tanto, es necesario hacer un análisis detallado de los ingredientes de cada una de estas bebidas y cómo influyen en su pH.
Algunas bebidas relativamente nuevas en el mercado chileno son las bebidas Enerday 6-H® y Quick Energy®, las cuales contienen tan solo 60mL y están compuestas en su mayoría por vitaminas. Estas bebidas son altamente ácidas y muy difíciles de neutralizar. Jain et al.10 en su estudio también analizan una de estas bebidas y llegan a la misma conclusión.
En este estudio se utilizó saliva estimulada de pacientes jóvenes y sanos. La saliva estimulada tiene un pH mayor que la saliva no estimulada y contiene más cantidad de bicarbonato11, considerado el principal buffer de la saliva, pero aún así, en este estudio no logró neutralizar los bajos niveles de estas bebidas más allá de un pH final de 4,38. La saliva posee adicionalmente otras funciones que no pudimos incluir en este estudio como el flujo salival, la película protectora y el clearance, que funcionan como barreras de protección frente a ataques ácidos, lo que podría provocar erosión en los dientes. Existe una mayor preocupación hacia los individuos que sufren de hiposalivación, xerostomía, película adquirida delgada y pH salival bajo, ya que estos individuos, al ingerir este tipo de bebidas, son más vulnerables y tienen mayor riesgo de sufrir erosiones dentales. La saliva demora aproximadamente entre 20 y 30 min en restablecer los niveles normales de pH en la cavidad oral después de la ingesta de sustancias ácidas, por lo que, en caso de existir una nueva ingesta de estas bebidas dentro de este tiempo, los dientes podrían estar expuestos a una mayor desmineralización10.
Es necesario el conocimiento por parte de los profesionales de la salud oral de los posibles efectos nocivos de las bebidas energéticas sobre la estructura dentaria, para que puedan asesorar a sus pacientes, especialmente a los jóvenes, y brindarles medidas de prevención después de consumir este tipo de bebidas, como masticar chicle para estimular la producción de saliva y tomar abundante agua.
ConclusiónLa presente investigación in vitro determinó que la capacidad buffer de la saliva no es suficientemente efectiva para neutralizar el pH ácido de las bebidas energéticas, manteniendo valores por debajo de 4,38, los cuales se encuentran dentro de un rango erosivo.
Debido a la masificación del consumo de este tipo de bebidas energéticas, se sugiere seguir investigando los posibles efectos de su consumo sobre la estructura dentaria.
FinanciaciónLas fuentes de financiamiento fueron realizadas por la Universidad del Desarrollo, Facultad de Medicina, Escuela de Medicina.
Conflicto de interesesTodos los autores declaran que no existe conflictos de interés en este trabajo, ni asociación o vinculación con alguna de las marcas comerciales utilizadas o nombradas en este estudio.
- -
A la Facultad de Medicina, Escuela de Odontología, Clínica Alemana-Universidad del Desarrollo por brindar su infraestructura en la elaboración de este trabajo.
- -
A la Dra. Paulette Conget y a Paola Ramos por la ayuda con los trabajos de laboratorio.
- -
A los voluntarios que participaron en este estudio.