El ictus representa la principal causa de dependencia funcional en la población adulta portuguesa.
ObjetivoAnalizar el impacto de la rehabilitación en el estado funcional y en las actividades básicas de la vida diaria (ABVD), tras 8semanas de sufrir un ictus, en una población de ancianos del noroeste de Portugal.
MetodologíaEstudio observacional, longitudinal y retrospectivo. Los pacientes fueron agrupados en 3 grupos de acuerdo con el tratamiento rehabilitador recibido: no rehabilitación (NR), rehabilitación ligera (RL) y rehabilitación intensa (RI).
Se recogieron datos sociodemográficos, variables clínicas (sobre el ictus), estancia hospitalaria, tratamiento rehabilitador y estado funcional (índice Barthel).
ResultadosTrescientos cincuenta pacientes con edad media de 75,83 (±8,02) años. La estancia hospitalaria fue mayor en el grupo de RL (19,7 [±8,69]), RI (17,67 [±10,05]) y del que no realizó rehabilitación (10,97 [±6,96]) (p=0,001).
Se observó un aumento significativo (p<0,001) en las puntuaciones del índice de Barthel desde el ingreso hasta las 8 semanas tras el ictus.
La edad (p=0,003) y la estancia hospitalaria (p=0,013) se presentaron como factores de riesgo de presentar dependencia funcional. De igual manera, teniendo como referencia a los pacientes que no se sometieron a rehabilitación, los sujetos que realizaron rehabilitación ligera (OR: 6,37; IC95%: 1,74-23,25; p=0,005) y rehabilitación intensa (OR: 2,28; IC95%: 1,08-4,82; p=0,030) tuvieron un riesgo significativamente mayor de presentar dependencia funcional.
ConclusiónLa realización de una rehabilitación intensa mejora el estado funcional y las ABVD con respecto a la rehabilitación ligera, a las 8 semanas de sufrir un ictus, en pacientes ancianos.
Stroke represents the main cause of functional dependence and in the Portuguese adult population.
ObjectiveTo analyse the impact of rehabilitation on functional state and basic activities of daily life (ABVD), 8weeks following a stroke, in a population of elderly people in north-western Portugal.
MethodologyObservational, longitudinal and retrospective study. The patients were grouped into 3 groups according to the rehabilitation treatment received: non-rehabilitation (NR), light rehabilitation (RL) and intense rehabilitation (RI).
Sociodemographic data, clinical variables (on stroke), hospital stay, rehabilitative treatment, and functional status (Barthel index) were collected.
Results350 patients, with a mean age of 75.83 (± 8.02) years. The hospital stay was longer in the group of RL (19.7 [±8.69]), RI (17.67 [±10.05]) and of those who did not undergo rehabilitation (10.97 [±6.96]) (P=.001).
A significant increase (P<.001) was observed in the Barthel index scores from admission to 8weeks after the stroke.
Age (P=.003) and hospital stay (P=.013) were shown as risk factors for functional dependence. Similarly, taking as a reference the patients who did not undergo rehabilitation, the subjects who underwent light rehabilitation (OR: 6.37; 95%CI: 1.74-23.25; P=.005) and intensive rehabilitation (OR: 2.28; 95%CI: 1.08-4.82; P=.030), had a significantly higher risk of presenting functional dependence
ConclusionUndergoing intensive rehabilitation improves functional state and ABVD compared to light rehabilitation, 8 weeks following a stroke in elderly patients.
La enfermedad cerebrovascular constituye en la actualidad una de las principales causas de discapacidad y muerte en todo el mundo1. En Europa cada año 1,3 millones de personas sufren un primer ictus, y el impacto socioeconómico es importante: se estima sobre 45 billones de euros2. Y parece que estos datos se incrementarán, ya que las proyecciones muestran que la carga del ictus aumentará en Europa un 35% en 2050, principalmente por el envejecimiento de la población3. En Portugal este escenario es aún peor, ya que se sitúa como la primera causa de muerte4. Y aunque la mortalidad por ictus ha ido disminuyendo a lo largo de los últimos años, sigue siendo un importante problema de salud en el norte del país5,6.
Este descenso de la mortalidad se debe en parte a los avances en el tratamiento del ictus y las medidas implementadas en los últimos años para el diagnóstico y el tratamiento precoz de la enfermedad cerebrovascular7. Estos avances en el tratamiento del ictus tienen como ejes fundamentales la atención neurológica precoz, el ingreso en las unidades de ictus, la aplicación del tratamiento fibrinolítico en el infarto cerebral y el tratamiento rehabilitador. De todos ellos, el tratamiento rehabilitador tiene una ventana terapéutica más amplia: se puede aplicar tanto en ictus isquémicos como hemorrágicos, mejora el pronóstico funcional incluso varios meses después de producido el ictus y reduce los costes asociados a la enfermedad8.
El ictus es la causa más importante de invalidez o discapacidad en el adulto. A los 6meses del ictus el 26,1% de los pacientes han fallecido, el 41,5% están independientes y el 32,4% son dependientes, estimándose de forma global que entre los supervivientes del ictus el 44% quedan con una dependencia funcional9.
El abordaje de los déficits neurológicos debe iniciarse en la fase aguda y debe mantenerse, asegurando una adecuada transición hacia otros recursos en los pacientes con objetivos funcionales en los que los déficits se prolonguen en el tiempo y requieran tratamiento a medio-largo plazo10,11. Este tipo de abordaje supone un reto para los pacientes con déficits moderados/graves, dado que la gravedad de sus déficits les puede hacer requerir mayor tiempo y más recursos técnicos y humanos que los normalmente administrados a pacientes con déficits leves12. Este hecho, unido a que uno de los más reconocidos predictores de discapacidad final postictus es la discapacidad inicial, hace que muchos de los pacientes con ictus moderados/graves sean considerados «malos candidatos» en términos de eficacia y coste para ser incluidos en programas de rehabilitación11. Si a esto añadimos el hecho de la prevalencia de pacientes que presentan una discapacidad moderada-grave a largo plazo, se comprende que el ictus constituya un auténtico problema para las estructuras sanitarias y sociales.
Tras un ictus, la recuperación y el retorno a una vida plena son el objetivo principal de los supervivientes, sus familias y los profesionales de la salud que se esfuerzan por proporcionar la mejor atención posible10,12. Esto se consigue, entre otras medidas, con la neurorrehabilitación.
La neurorrehabilitación se ha definido como el conjunto de métodos que tiene por finalidad recuperar las funciones neurológicas perdidas o disminuidas como consecuencia de un daño cerebral o medular. En los pacientes que han sufrido un ictus los métodos empleados en la neurorrehabilitación aprovechan la plasticidad cerebral para mejorar o normalizar los déficit neurológicos y funcionales8. Es un proceso limitado en el tiempo, cuyo objetivo es prevenir complicaciones y reducir el déficit neurológico a fin de conseguir la máxima capacidad funcional posible para facilitar la autonomía personal y la reintegración familiar y sociolaboral. Esta rehabilitación ha de iniciarse de forma precoz y coordinada y mantenerse durante las diferentes fases de la atención sanitaria13.
En pacientes supervivientes a un ictus la bibliografía establece la asociación entre retraso al iniciar el tratamiento y una peor evolución funcional, y entre inicio precoz del tratamiento y un mejor pronóstico. Así, los procesos de plasticidad cerebral se optimizan con los programas de rehabilitación iniciados de forma precoz, el tiempo diario que reciben tratamiento y la prolongación en meses de la rehabilitación8,14.
Así, la necesidad de rehabilitación efectiva tras un ictus se torna un elemento esencial en la continuidad de cuidados y de la atención que se debe dar a estos pacientes10. Este trabajo tiene por objetivo analizar el impacto de la rehabilitación en el estado funcional y en las actividades básicas de la vida diaria (ABVD), tras 8semanas de sufrir un ictus, en una población de ancianos del noroeste de Portugal.
MetodologíaEstudio observacional, longitudinal y retrospectivo, con muestreo consecutivo de pacientes ingresados por accidente cerebrovascular agudo en un hospital en el noreste de Portugal (Bragança) entre los años 2013 y 2017.
El estudio fue aprobado por el Comité de Ética de Investigación de la Unidade Local de Saúde do Nordeste EPE (ULSNe) y desarrollado de acuerdo con los principios expresados en la Declaración de Helsinki. El investigador principal firmó un documento de confidencialidad y se garantizó la confidencialidad de los datos y la custodia de la base de datos.
Los pacientes participantes cumplieron los siguientes criterios de inclusión: mayores de 65años que han sufrido un ictus isquémico o hemorrágico, que tuvieran la evaluación funcional con el índice de Barthel al ingreso, al alta y a las 8semanas tras el ictus. Los criterios de exclusión fueron: pacientes con accidente isquémico transitorio y pacientes fallecidos antes de las 8semanas.
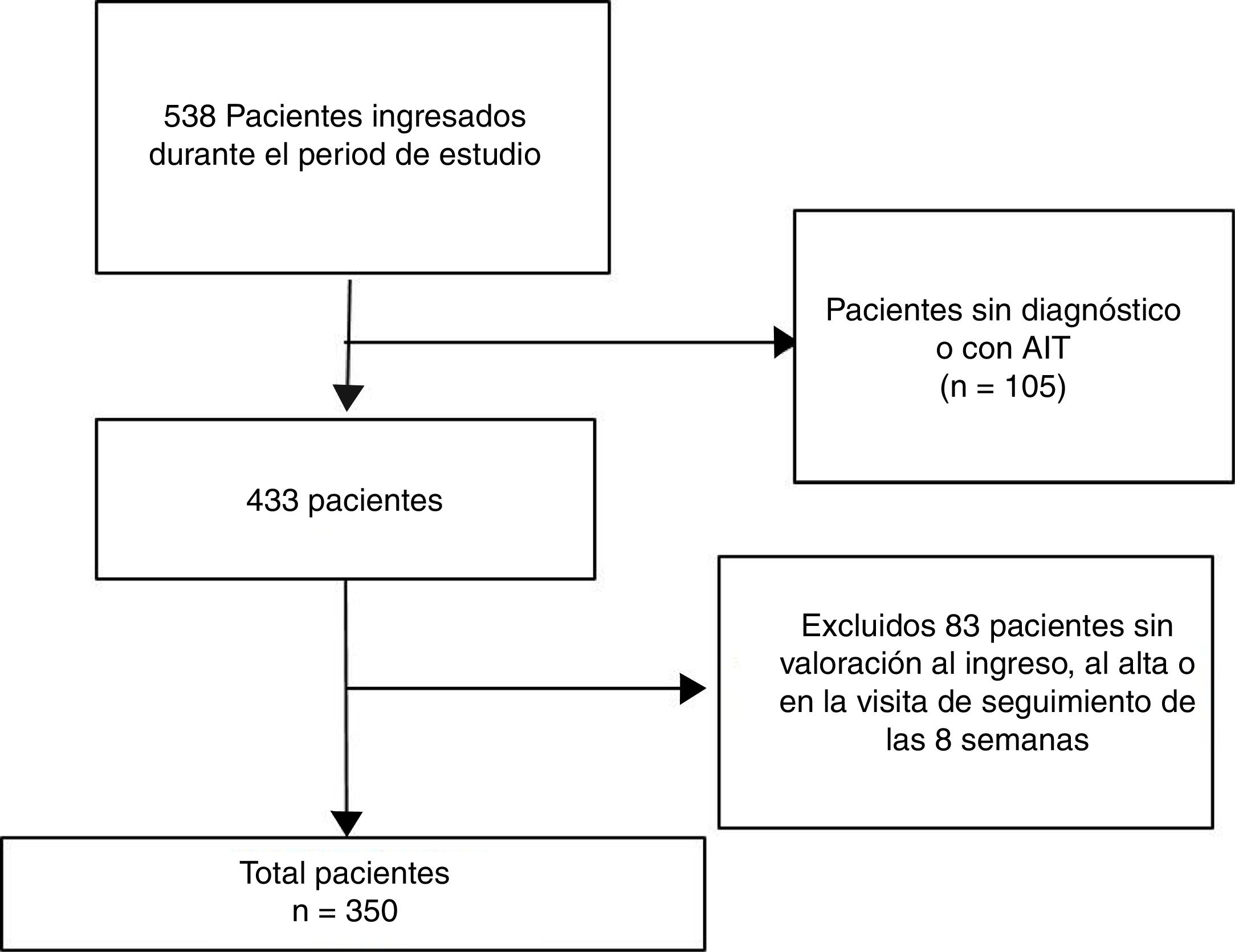
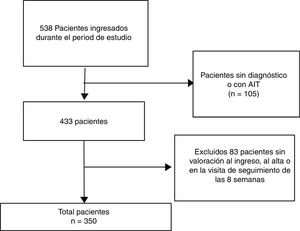
El diagrama de flujo de los participantes se muestra en la figura 1. Se observa como de los 538 pacientes que ingresaron, tras aplicar los criterios de participación la muestra final fue de 350.
Los pacientes fueron categorizados en 3 grupos acorde al tratamiento de rehabilitación recibido: no rehabilitación (NR), rehabilitación ligera (RL) y rehabilitación intensa (RI). Consideramos «no rehabilitación» a los pacientes que no recibieron ningún tipo de tratamiento rehabilitador por el sistema de salud; «rehabilitación ligera» a los pacientes que tenían 3días o menos a la semana de tratamiento rehabilitador, y «rehabilitación intensa» a los pacientes que recibían 4 o más días de rehabilitación a la semana o al alta hospitalaria iban a centros considerados de rehabilitación intensiva.
Se recogieron datos sociodemográficos como edad, sexo y variables clínicas tipo y subtipo de ictus, lateralidad, estancia en el hospital y tratamiento rehabilitador recibido; el estado funcional fue evaluado con el índice de Barthel.
La recogida de datos se llevó a cabo por las investigadoras principales. Los datos fueron recogidos de los historiales clínicos de los pacientes y fueron informatizados de forma disociada y anónima para respetar la confidencialidad y el anonimato del paciente. A estos datos solo tuvieron acceso las investigadoras principales.
Instrumentos de medidaLos tipos de ictus isquémicos se clasificaron según los criterios de la Oxford Community Stroke Project (OCSP)15. En 1991 el Oxfordshire Community Stroke Project propuso una clasificación que permite valorar la localización y el tamaño de la lesión, además de ofrecer información pronóstica precoz, rápida y sencilla sobre resultados clínicos. Los pacientes fueron clasificados como:
TACI (infarto total de la circulación anterior). Son los que incluyen la combinación o alteración en las funciones corticales (afasia o disfasia, discalculia o alteración visuoespacial), hemianopsia homónima y déficit motor o sensitivo que incluya al menos dos áreas de las siguientes: cara, extremidad superior y extremidad inferior.
PACI (infarto parcial de la circulación anterior). Son los que cumplen dos de las tres características del TACI o bien solo una disfunción de las funciones cerebrales superiores.
POCI (infarto de la circulación posterior). Se trata de un déficit neurológico focal que incluye: parálisis ipsilateral de pares craneales con déficit motor y/o sensitivo contralateral, déficit motor y/o sensitivo bilateral, alteración de los movimientos conjugados de los ojos, disfunción cerebelosa o una alteración aislada del campo visual.
LACI (infarto lacunar). Son los infartos que presentan un síndrome lacunar típico (déficit motor o sensitivo puro, hemiparesia-ataxia o disartria mano torpe).
Para la valoración del estado funcional se utilizó el índice de Barthel16, que evalúa el nivel de dependencia en las ABVD; sus valores oscilan entre 0 (mayor dependencia) y 100 (independencia). Sus resultados globales se han agrupado en categorías de dependencia: dependencia total (puntuación entre 0 y 20); dependencia grave (21-40 puntos); dependencia moderada (41-60 puntos); dependencia leve (61-90 puntos); independencia (91-100 puntos).
Análisis de datosSe realizó un análisis descriptivo de todas las variables recogidas. Las variables categóricas fueron descritas mediante porcentajes, y las variables cuantitativas, mediante la media y desviación estándar (DE).
Se establecieron relaciones entre variables. Para ello se empleó la prueba de chi-cuadrado para las variables cualitativas. Para comparar las variables cuantitativas se realizaron test de normalidad (Kolmogorov Smirnov) y se emplearon, según siguieran normalidad o no, test paramétricos (ANOVA) y no paramétricos (Kruskal-Wallis).
Además, se calcularon los odd ratio de las distintas variables mediante regresión logísitica binaria. En primer lugar se realizó un análisis univariable, y posteriormente las variables que se mostraron significativas formaron parte del análisis multivariante.
Los datos se analizaron con el programa estadístico SPSS para Windows v.22. Para todas las pruebas estadísticas el umbral de significación fue de p<0,05.
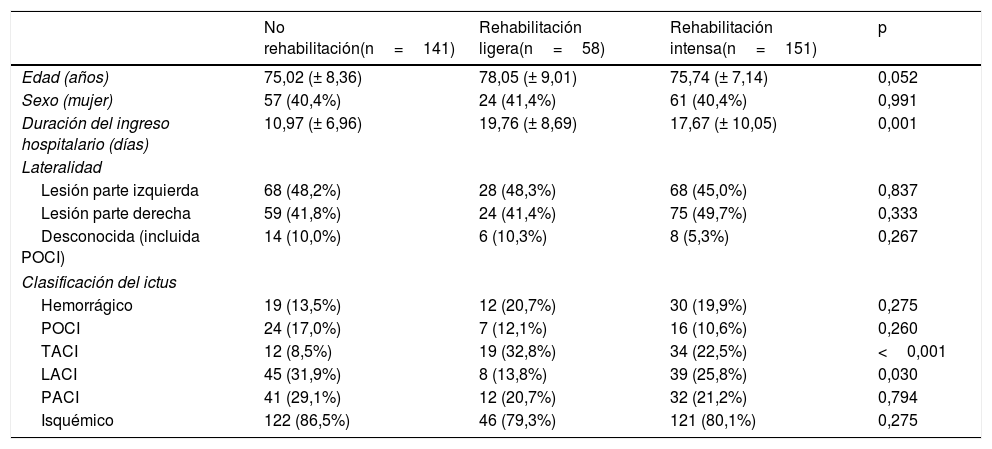
ResultadosSe incluyeron un total de 350 pacientes, con una edad media de 75,83 (±8,02) años. Las principales características clínicas según la rehabilitación postictus llevada a cabo se muestran en la tabla 1. Los días de estancia hospitalaria fueron mayores en el grupo de pacientes que recibieron rehabilitación ligera (19,76 [±8,69]), seguidos del grupo de rehabilitación intensa (17,67 [±10,05]) y del que no realizó rehabilitación (10,97 [±6,96]), existiendo diferencias significativas entre ellos (p=0,001). Respecto al tipo de ictus, se observaron diferencias significativas en la proporción de TACI y LACI entre los grupos (p<0,05). No se encontraron diferencias estadísticamente significativas en el resto de las variables analizadas.
Características basales de la población de estudio
| No rehabilitación(n=141) | Rehabilitación ligera(n=58) | Rehabilitación intensa(n=151) | p | |
|---|---|---|---|---|
| Edad (años) | 75,02 (± 8,36) | 78,05 (± 9,01) | 75,74 (± 7,14) | 0,052 |
| Sexo (mujer) | 57 (40,4%) | 24 (41,4%) | 61 (40,4%) | 0,991 |
| Duración del ingreso hospitalario (días) | 10,97 (± 6,96) | 19,76 (± 8,69) | 17,67 (± 10,05) | 0,001 |
| Lateralidad | ||||
| Lesión parte izquierda | 68 (48,2%) | 28 (48,3%) | 68 (45,0%) | 0,837 |
| Lesión parte derecha | 59 (41,8%) | 24 (41,4%) | 75 (49,7%) | 0,333 |
| Desconocida (incluida POCI) | 14 (10,0%) | 6 (10,3%) | 8 (5,3%) | 0,267 |
| Clasificación del ictus | ||||
| Hemorrágico | 19 (13,5%) | 12 (20,7%) | 30 (19,9%) | 0,275 |
| POCI | 24 (17,0%) | 7 (12,1%) | 16 (10,6%) | 0,260 |
| TACI | 12 (8,5%) | 19 (32,8%) | 34 (22,5%) | <0,001 |
| LACI | 45 (31,9%) | 8 (13,8%) | 39 (25,8%) | 0,030 |
| PACI | 41 (29,1%) | 12 (20,7%) | 32 (21,2%) | 0,794 |
| Isquémico | 122 (86,5%) | 46 (79,3%) | 121 (80,1%) | 0,275 |
LACI: infarto lacunar; PACI: infarto parcial de la circulación anterior; POCI: infarto de la circulación posterior; TACI: infarto total de la circulación anterior.
Datos expresados en media ±desviación estándar y frecuencias (porcentajes).
En la tabla 2 se muestran el estado de dependencia funcional en el ingreso, al alta hospitalaria y a las 8semanas del ictus según el grado de rehabilitación postictus. Se observaron diferencias significativas entre los 3 grupos de rehabilitación recibida en los tres momentos de valoración de la dependencia funcional (p<0,001), siendo en todos los casos los pacientes que recibieron rehabilitación ligera quien obtuvieron puntuaciones más bajas, seguido de los de rehabilitación intensa y no rehabilitación. En el análisis intragrupo se apreció una mejora en la puntuación de dependencia funcional en los 3 grupos de rehabilitación recibida (p<0,001), siendo las más altas cuando el Barthel se analizó a las 8semanas del ictus.
Evolución del estado funcional según el grado de rehabilitación postictus
| No rehabilitación(n=141) | Rehabilitación ligera(n=58) | Rehabilitación intensa(n=151) | pa | |
|---|---|---|---|---|
| Índice de Barthel al ingreso | 41,88 (± 29,7)1 | 6,12 (± 14,33) | 17,72 (± 20,30) | <0,001 |
| Índice de Barthel al alta | 84,15 (± 25,41) | 19,66 (± 18,70) | 46,59 (± 27,56) | <0,001 |
| Índice de Barthel a las 8 semanas del ictus | 85,89 (± 25,28) | 27,84 (± 27,32) | 59,57 (± 31,42) | <0,001 |
| pb | <0,001 | <0,001 | <0,001 |
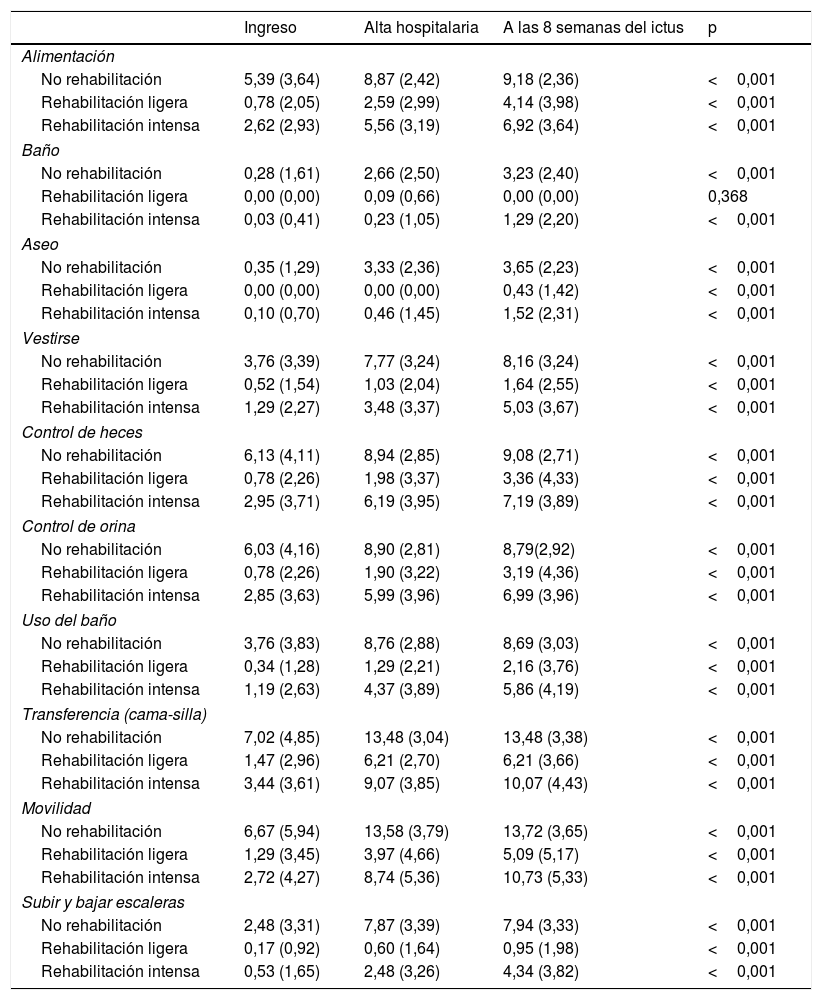
Se analizó el estado funcional en el desempeño de las ABVD con el índice de Barthel al ingreso, al alta hospitalaria y a las 8semanas en cada uno de los grupos de rehabilitación recibida (tabla 3). Se observó un aumento significativo (p<0,001) en las puntuaciones del índice de Barthel desde el ingreso hasta las 8semanas tras el ictus, a excepción del ítem bañarse/ducharse en el grupo de rehabilitación ligera (p=0,368).
Asociación entre cada actividad/ítem del índice de Barthel al ingreso, al alta y a las 8 semanas del ictus
| Ingreso | Alta hospitalaria | A las 8 semanas del ictus | p | |
|---|---|---|---|---|
| Alimentación | ||||
| No rehabilitación | 5,39 (3,64) | 8,87 (2,42) | 9,18 (2,36) | <0,001 |
| Rehabilitación ligera | 0,78 (2,05) | 2,59 (2,99) | 4,14 (3,98) | <0,001 |
| Rehabilitación intensa | 2,62 (2,93) | 5,56 (3,19) | 6,92 (3,64) | <0,001 |
| Baño | ||||
| No rehabilitación | 0,28 (1,61) | 2,66 (2,50) | 3,23 (2,40) | <0,001 |
| Rehabilitación ligera | 0,00 (0,00) | 0,09 (0,66) | 0,00 (0,00) | 0,368 |
| Rehabilitación intensa | 0,03 (0,41) | 0,23 (1,05) | 1,29 (2,20) | <0,001 |
| Aseo | ||||
| No rehabilitación | 0,35 (1,29) | 3,33 (2,36) | 3,65 (2,23) | <0,001 |
| Rehabilitación ligera | 0,00 (0,00) | 0,00 (0,00) | 0,43 (1,42) | <0,001 |
| Rehabilitación intensa | 0,10 (0,70) | 0,46 (1,45) | 1,52 (2,31) | <0,001 |
| Vestirse | ||||
| No rehabilitación | 3,76 (3,39) | 7,77 (3,24) | 8,16 (3,24) | <0,001 |
| Rehabilitación ligera | 0,52 (1,54) | 1,03 (2,04) | 1,64 (2,55) | <0,001 |
| Rehabilitación intensa | 1,29 (2,27) | 3,48 (3,37) | 5,03 (3,67) | <0,001 |
| Control de heces | ||||
| No rehabilitación | 6,13 (4,11) | 8,94 (2,85) | 9,08 (2,71) | <0,001 |
| Rehabilitación ligera | 0,78 (2,26) | 1,98 (3,37) | 3,36 (4,33) | <0,001 |
| Rehabilitación intensa | 2,95 (3,71) | 6,19 (3,95) | 7,19 (3,89) | <0,001 |
| Control de orina | ||||
| No rehabilitación | 6,03 (4,16) | 8,90 (2,81) | 8,79(2,92) | <0,001 |
| Rehabilitación ligera | 0,78 (2,26) | 1,90 (3,22) | 3,19 (4,36) | <0,001 |
| Rehabilitación intensa | 2,85 (3,63) | 5,99 (3,96) | 6,99 (3,96) | <0,001 |
| Uso del baño | ||||
| No rehabilitación | 3,76 (3,83) | 8,76 (2,88) | 8,69 (3,03) | <0,001 |
| Rehabilitación ligera | 0,34 (1,28) | 1,29 (2,21) | 2,16 (3,76) | <0,001 |
| Rehabilitación intensa | 1,19 (2,63) | 4,37 (3,89) | 5,86 (4,19) | <0,001 |
| Transferencia (cama-silla) | ||||
| No rehabilitación | 7,02 (4,85) | 13,48 (3,04) | 13,48 (3,38) | <0,001 |
| Rehabilitación ligera | 1,47 (2,96) | 6,21 (2,70) | 6,21 (3,66) | <0,001 |
| Rehabilitación intensa | 3,44 (3,61) | 9,07 (3,85) | 10,07 (4,43) | <0,001 |
| Movilidad | ||||
| No rehabilitación | 6,67 (5,94) | 13,58 (3,79) | 13,72 (3,65) | <0,001 |
| Rehabilitación ligera | 1,29 (3,45) | 3,97 (4,66) | 5,09 (5,17) | <0,001 |
| Rehabilitación intensa | 2,72 (4,27) | 8,74 (5,36) | 10,73 (5,33) | <0,001 |
| Subir y bajar escaleras | ||||
| No rehabilitación | 2,48 (3,31) | 7,87 (3,39) | 7,94 (3,33) | <0,001 |
| Rehabilitación ligera | 0,17 (0,92) | 0,60 (1,64) | 0,95 (1,98) | <0,001 |
| Rehabilitación intensa | 0,53 (1,65) | 2,48 (3,26) | 4,34 (3,82) | <0,001 |
Test de Kruskal-Wallis.
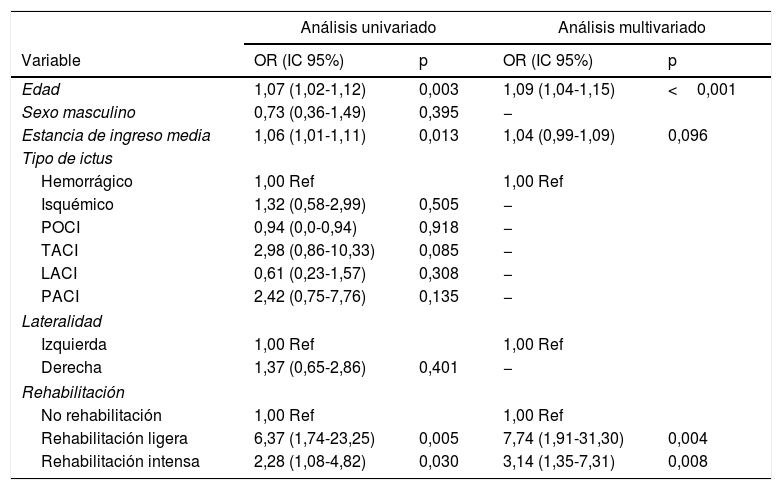
Finalmente se realizó un análisis univariado y multivariado con los factores basales que pudieran predecir obtener una dependencia funcional a las 8semanas del ictus (tabla 4). En el análisis univariado la edad (OR: 1,07; IC95%: 1,02-1,12; p=0,003) y la estancia de ingreso media (OR: 1,06; IC95%: 1,01-1,11; p=0,013) se presentaron como factores de riesgo de presentar dependencia funcional. De igual manera, teniendo como referencia a los pacientes que no se sometieron a rehabilitación, los sujetos que realizaron rehabilitación ligera (OR: 6,37; IC95%: 1,74-23,25; p=0,005) y rehabilitación intensa (OR: 2,28; IC95%: 1,08-4,82; p=0,030) tuvieron un riesgo significativamente mayor de presentar dependencia funcional. En el análisis multivariado se obtuvieron similares resultados, a excepción de la estancia de ingreso media, que no se presentó como factor de riesgo (OR: (1,04; IC95%: 0,99-1,09; p=0,096).
Factores basales predictores de dependencia funcional a las 8 semanas del ictus (n=264)
| Análisis univariado | Análisis multivariado | |||
|---|---|---|---|---|
| Variable | OR (IC 95%) | p | OR (IC 95%) | p |
| Edad | 1,07 (1,02-1,12) | 0,003 | 1,09 (1,04-1,15) | <0,001 |
| Sexo masculino | 0,73 (0,36-1,49) | 0,395 | − | |
| Estancia de ingreso media | 1,06 (1,01-1,11) | 0,013 | 1,04 (0,99-1,09) | 0,096 |
| Tipo de ictus | ||||
| Hemorrágico | 1,00 Ref | 1,00 Ref | ||
| Isquémico | 1,32 (0,58-2,99) | 0,505 | − | |
| POCI | 0,94 (0,0-0,94) | 0,918 | − | |
| TACI | 2,98 (0,86-10,33) | 0,085 | − | |
| LACI | 0,61 (0,23-1,57) | 0,308 | − | |
| PACI | 2,42 (0,75-7,76) | 0,135 | − | |
| Lateralidad | ||||
| Izquierda | 1,00 Ref | 1,00 Ref | ||
| Derecha | 1,37 (0,65-2,86) | 0,401 | − | |
| Rehabilitación | ||||
| No rehabilitación | 1,00 Ref | 1,00 Ref | ||
| Rehabilitación ligera | 6,37 (1,74-23,25) | 0,005 | 7,74 (1,91-31,30) | 0,004 |
| Rehabilitación intensa | 2,28 (1,08-4,82) | 0,030 | 3,14 (1,35-7,31) | 0,008 |
LACI: infarto lacunar; PACI: infarto parcial de la circulación anterior; POCI: infarto de la circulación posterior; TACI: infarto total de la circulación anterior.
Los principales hallazgos de nuestro estudio indican que la realización de una rehabilitación intensa en los pacientes que han sufrido un ictus previene de una dependencia funcional con respecto a los sometidos a una rehabilitación ligera.
El deterioro de la capacidad motora, con la consiguiente pérdida de la capacidad funcional, es una de las principales consecuencias del accidente cerebrovascular17,18. La recuperación, junto con el regreso a una vida plena y significativa después del evento cerebrovascular, es el objetivo principal para los supervivientes, sus familias y los profesionales de la salud que se esfuerzan por brindar la mejor atención posible. Los servicios de rehabilitación son el mecanismo primario por el cual se promueve la recuperación funcional y el logro de la independencia en pacientes con accidente cerebrovascular agudo10. Después del ingreso hospitalario agudo y antes del alta hospitalaria, los pacientes deben someterse a evaluaciones exhaustivas para valorar el daño corporal y el deterioro funcional sufrido tras el ictus19 y así los profesionales de la salud tomar la decisión del tipo de rehabilitación que debe llevarse a cabo. Sin embargo, en Portugal la gama de servicios de rehabilitación prestados a los pacientes con accidente cerebrovascular es amplia y altamente heterogénea, variando en el tipo de entornos de atención utilizados, en la duración, en la intensidad y en el tipo de intervenciones realizadas y en el grado de participación de especialistas médicos, de enfermería y otros especialistas en rehabilitación específicos. Esta falta de homogeneidad hace que no se siga un patrón común en la rehabilitación de pacientes postictus. Esto se ha visto reflejado en nuestro estudio, ya que los pacientes a quienes se les realizó una rehabilitación de intensidad ligera presentaban, tanto al ingreso como al alta hospitalaria, una puntuación media en el índice de Barthel más baja que los que fueron sometidos a rehabilitación intensa, y al ser evaluados a las 8semanas su recuperación fue menor. Esto nos plantea que quizá estos pacientes deberían haber sido sometidos a una rehabilitación más intensa e individualizada. Los resultados del ensayo clínico A Very Early Rehabilitation Trial (AVERT) sugieren que una rehabilitación temprana e intensiva puede mejorar la recuperación funcional y acelerar el regreso a la marcha sin ayuda20,21.Sin embargo, la pregunta de qué tipo de rehabilitación intensa llevar a cabo sigue sin resolverse. Más allá de los resultados relevantes del ensayo clínico AVERT, en la actualidad solo hay unos pocos estudios controlados y aleatorizados que evalúan la eficacia y la seguridad de las diversas técnicas de rehabilitación22,23. Sus resultados son controvertidos debido en parte a la heterogeneidad y al pequeño tamaño de las muestras incluidas. En nuestro trabajo, teniendo como referencia a los pacientes que no se sometieron a rehabilitación (ya que fueron los que tenían independencia funcional al alta), los sujetos que realizaron rehabilitación ligera presentaron mayor probabilidad de dependencia funcional a las 8semanas que los que realizaron rehabilitación intensa. Estos resultados fueron similares tanto en el análisis univariado como en el multivariado. Por otro lado, el tiempo de comienzo precoz de la rehabilitación intensa tras el ictus parece tener mayor importancia que el tipo de rehabilitación realizada24,25. Debido a las características del estudio realizado no disponemos del periodo transcurrido desde el evento al inicio de la rehabilitación, y es por ello que no los mostramos en nuestros resultados.
La edad se asocia con un pronóstico peor tras sufrir un ictus, sobre todo en ancianos mayores de 85años, en los que la presencia de comorbilidad es mayor y su situación funcional previa se encuentra más deteriorada que en pacientes más jóvenes26. En nuestro trabajo la edad se mostró como un factor de riesgo de dependencia funcional a las 8semanas tras el ictus tanto en el análisis univariado (OR: 1,07; IC95%: 1,02-1,12) como en el multivariado (OR: 1,09; IC95%: 1,04-1,15). Algunos estudios27,28 manifiestan una menor recuperación en pacientes con mayor edad, lo que hace cuestionarse en algunos casos la indicación de participar en programas específicos de rehabilitación. Sin embargo, por otro lado, se han publicado estudios en los que no se encuentra justificación de no realizar tratamiento rehabilitador, ya que la mejoría funcional tras el ictus sigue siendo evidente29, no debiendo de ser la edad un factor que determine la entrada en programas de rehabilitación tras un ictus30. Debido a las características de nuestro estudio, desconocemos las causas de por qué algunos pacientes han realizado rehabilitación leve y otros intensa.
Nuestro trabajo tiene varias limitaciones. En primer lugar, el diseño del estudio fue observacional y, por lo tanto, solo puede implicar asociación, pero no causalidad. Debido a las características retrospectivas del estudio, algunas variables que puedan haber influido en el resultado final no fueron recogidas, tales como el tiempo desde el ictus al inicio de la rehabilitación y el tipo realizado, o la presencia de comorbilidades. Además, un grupo era de un tamaño menor que los otros (141 vs 58 vs 151 pacientes, respectivamente). Finalmente, solo se ha valorado el estado funcional de los pacientes y no se ha tenido en cuenta la recuperación cognitiva ni la del lenguaje.
En conclusión, nuestros hallazgos sugieren que la realización de una rehabilitación intensa mejora el estado funcional y las ABVD, con respecto a la rehabilitación ligera, a las 8semanas de sufrir un ictus en pacientes ancianos. Por tanto, consideramos fundamental incrementar el esfuerzo de los sistemas de salud para que estos pacientes accedan a servicios de neurorrehabilitación que les permitan tener un tratamiento rehabilitador adecuado con el fin de mejorar su estado funcional tras el ictus.
FinanciaciónNinguna.
Conflicto de interesesS.R.M y F.L.E manifiestan que este estudio se ha realizado en el contexto de una estancia de investigación en el Departamento de Enfermería del Instituto Politécnico de Bragança.
Los demás autores manifiestan no tener conflicto de intereses.
A la Escola Superior de Saúde del instituto Politécnico de Bragança que acogió en la estancia de investigación a los profesores Sergio Rico y Fidel López.
Este trabajo ha sido posible gracias a las becas de movilidad al personal docente que concede la Consejería de Educación y Empleo de la Junta de Extremadura.
A Irene, Jaime y Elena.