El sistema de catalogación de los nódulos tiroideos (NT) TI-RADS (Thyroid Imaging Reporting and Data System), propuesto por Horvath et al. en 2009, se utiliza poco. El objetivo de este estudio fue evaluar una modificación en la escala de puntos con respecto a los criterios ecográficos de malignidad para conseguir una mejor aplicación de esta clasificación en la práctica diaria.
Materiales y métodosSe han clasificado 3650 NT en base a una escala de puntuación de posible malignidad. Se definieron los criterios ecográficos sospechosos de malignidad, de acuerdo con los estudios publicados y las directrices de diversas sociedades médicas internacionales. A cada criterio se le asignó un punto para la escala final de probabilidad de malignidad del NT, añadiendo otro cuando se detectaba un ganglio linfático cervical sospechoso.
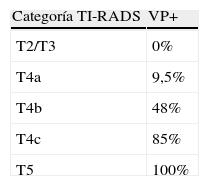
ResultadosLa puntuación de todos los nódulos tiroideos benignos (TI-RADS 2) o probablemente benignos (TI-RADS 3) fue cero. En el grupo TI-RADS 3 sólo un 2 2% de los NT fueron malignos. La escala de puntos de TI-RADS 4a, 4b y 4c fue, respectivamente, de uno, dos y tres-cuatro puntos, con una incidencia de malignidad del 9.5%, 48% y 85%. Los nódulos tiroideos TI-RADS 5 tuvieron cinco o más puntos, con un 100% de malignidad en este estudio.
ConclusiónUna clasificación TI-RADS basada en una escala de puntuación acorde al número de criterios ecográficos sospechosos de malignidad definidos es útil y puede aplicarse en la práctica diaria.
The classification system of the thyroid nodules (TN) TI-RADS (Thyroid Imaging Reporting and Data System) proposed by Horvath et al. in 2009 is rarely used. The aim of this study was to evaluate a modification of the score regarding the ultrasound criteria for malignancy in order to obtain a better application of this classification in daily practice.
Materials and methods3650 TN were classified according a score of possible malignancy. According published studies and guidelines of several medical international societies, suspicious US criteria for malignancy are defined. Each of them gets one point for the final score of malignant probability of the TN. If suspected cervical lymph nodes are detected, one point is added.
ResultsThe score in all benign (TI-RADS 2) or probably benign (TI-RADS 3) TN was zero. In the TI-RADS 3 group only 2.2% of the TN were malignant. The score of TI-RADS 4a, 4b and 4c was one, two and three to four points, respectively. Here the malignant rate was 9.5%, 48% and 85%, respectively. TI-RADS 5 TN had a score of five or more points with a malignancy of 100% in this study.
ConclusionA TI-RADS classification based on a score according the number of suspicious US criteria defined for malignancy can be applied in daily practice.
Los nódulos tiroideos (NT) pueden mostrar un patrón ecográfico muy diverso1,2 que muchas veces dificulta una segura catalogación con respecto a su malignidad. Por ello, Horvath et al.3 en el año 2009 propusieron un sistema de evaluación de los NT denominado TI-RADS (Thyroid Imaging Reporting and Data System), en semejanza al sistema de la mama BI-RADS (Breast Imaging Reporting and Data System)4,5. En el año 2011, Kwak et al.6 complementaron esta clasificación agregando un subtipo.
Sin embargo, ambos sistemas presentan dificultades en su aplicación. A pesar de que la clasificación TI-RADS se cita en la bibliografía médica, su empleo en la práctica diaria es poco frecuente, tal vez por cierta inseguridad de los diversos especialistas que la utilizan.
El objetivo de este estudio fue evaluar una clasificación TI-RADS de aplicación sencilla, hecha en base a una escala modificada de puntuación de los NT con respecto a los criterios ecográficos de malignidad presentes en cada caso.
Materiales y métodosSe revisó el sistema de digitalización, archivo y gestión de imágenes médicas (PACS/RIS) de 7960 ecografías de tiroides entre los años 2003 y 2013. Estas habían sido efectuadas o revisadas antes de su informe (en los casos en que hubiesen sido realizadas por médicos residentes en formación) por especialistas con una experiencia de entre 5 y 30 años en ecografía tiroidea. Ante la detección de un NT, su estudio ecográfico consistió en la evaluación de su ecogenicidad, contenido interno (presencia de lesiones quísticas y/o calcificaciones), bordes, configuración y vascularización. De acuerdo con los estudios y pautas de distintas sociedades médicas de diversas especialidades, tanto nacionales como internacionales7–16, se establecieron criterios ecográficos sospechosos de malignidad (tabla 1). A cada uno se le adjudicó un punto, y se añadió otro más, si se detectaban uno o varios ganglios linfáticos cervicales sospechosos de malignidad. De este modo, se obtuvo una escala de puntuación final sobre la posible malignidad de un NT.
Criterios ecográficos sospechosos de malignidad. A cada uno de ellos se le asigna un punto para la escala final de puntuación. Si se detectan ganglios linfáticos cervicales sospechosos, se añade otro punto a la escala para la catalogación del nódulo en la clasificación TI-RADS
| • Hipoecogenicidad |
| • Microcalcificaciones |
| • Nódulo parcialmente quístico con localización excéntrica del componente líquido y lobulación del componente sólido |
| • Bordes irregulares |
| • Invasión del parénquima tiroideo perinodular |
| • Configuración taller than wide (más alto que ancho) |
| • Vascularización intranodal |
Para la evaluación TI-RADS se llevó a cabo una selección de los NT adecuadamente documentados en el sistema de archivo de imágenes PACS (imágenes ecográficas de los NT en cortes sagitales y transversales, tomadas de forma convencional –modo B– y en Doppler color para la evaluación de la perfusión), a los cuales se les había realizado una punción aspirativa con aguja fina (PAAF) y/o una gammagrafía de tiroides y/o una elastosonografía y/u otro método de diagnóstico por imágenes (resonancia magnética [RM], tomografía computada por emisión de positrones [PET/TC]) y/o una evaluación histológica luego de la cirugía y/o al menos un año de seguimiento clínico con controles ecográficos.
Dado que se trató fundamentalmente de un estudio retrospectivo, no se solicitó la aprobación del Comité de Ética.
El análisis estadístico se apoyó en el cálculo de los valores predictivos de las categorías de la clasificación TI-RADS.
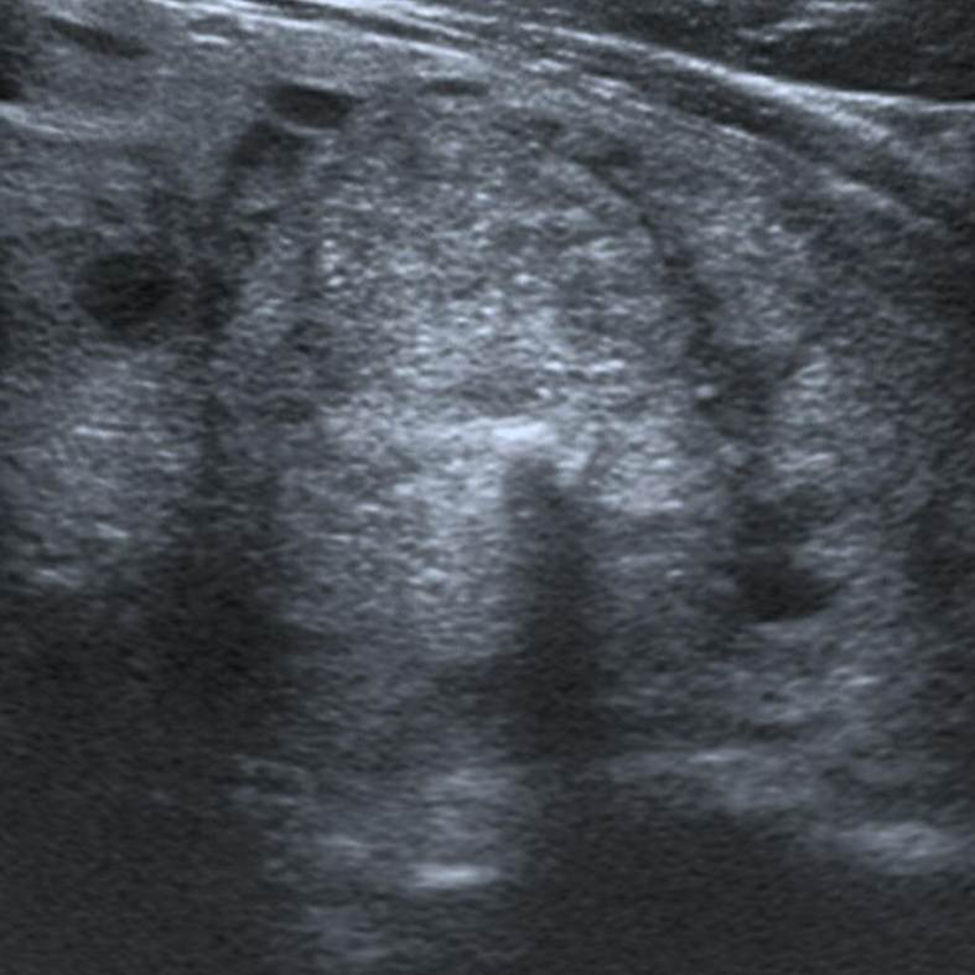
ResultadosDe las 7960 ecografías de tiroides evaluadas, en 6127 se advirtieron uno o varios NT, y en 1833 no se detectó ninguna lesión focal. De estas últimas (n=1833), 1454 casos mostraban una alteración difusa del parénquima tiroideo, ya sea por tiroiditis de Hashimoto o enfermedad autoinmune de la glándula (enfermedad de Graves-Basedow), mientras que los 379 pacientes restantes sin lesión focal tenían una glándula de tamaño normal, con un patrón ecográfico hiperecogénico (en comparación con la musculatura) y homogéneo, así como una vascularización normal en el Doppler color. Estas exploraciones ecográficas normales de la glándula tiroides, con una incidencia del 4,7% en nuestra serie (379/7960 casos), se clasificaron como TI-RADS 1, a semejanza de la clasificación BI-RADS de la mama (BI-RADS 1=mama normal)4,5.
De los 6127 pacientes con uno o varios NT, 1148 cumplieron con los requisitos planteados. De todos sus NT, 3650 estaban adecuadamente documentados y habían sido evaluados por los métodos diagnósticos de referencia, por lo que se utilizaron como base para la evaluación de la clasificación TI-RADS en este estudio.
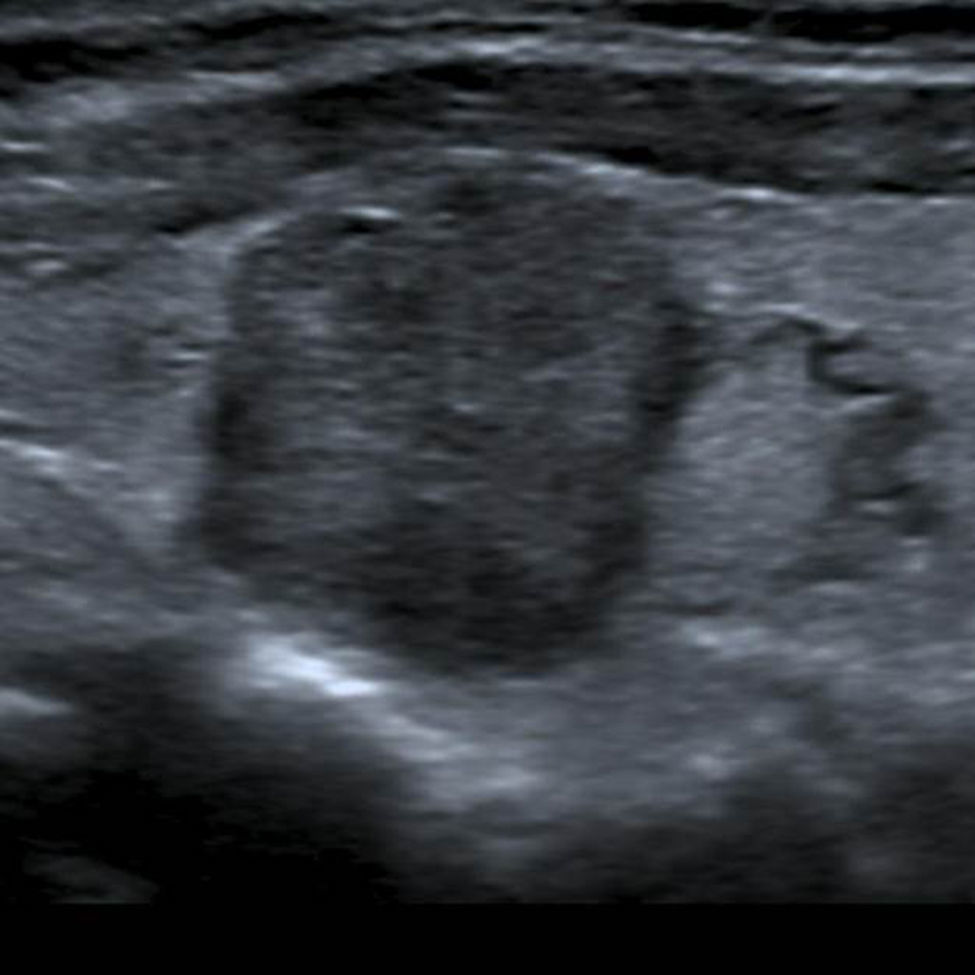
En relación con estos 3650 NT, 1302 (35,6%) mostraron características ecográficas benignas: 73/1302 quistes simples2,17, 104/1302 NT con un quiste central (tipo 1, según la clasificación de Kim et al. sobre los NT parcialmente quísticos)16, 56/1302 NT con calcificación periférica homogénea no interrumpida18 y 1069/1302 NT espongiformes2,19,20. Dado su patrón ecográfico y la inexistencia de criterios ecográficos de malignidad, estos NT tuvieron cero puntos en la escala. Además, las exploraciones adicionales (PAAF [n=88] y/o estudio histológico luego de la cirugía [n=132] y/o gammagrafía tiroidea [n=585] y/o elastosonografía [n=95] y/o RM/PET/TC [n=12] y/o seguimiento clínico y ecográfico de al menos 1 año [n=554]) tampoco revelaron malignidad. Así, a estos 1302 NT se los catalogó como TI-RADS 2.
Los otros 2194 NT (60,1%) del cómputo total de 3650 sin criterios ecográficos de malignidad (cero puntos en la escala) se mostraron: hiperecoicos, sin o con pequeñas alteraciones quísticas (527/2194); y sólidos con vascularización periférica y un patrón mixto de áreas hipo, iso o hiperecogénicas y/o pequeños cambios quísticos y/o macrocalcificaciones (1667/2194). Solo 48 (2,2% de los 2194) fueron malignos (comprobado histológicamente luego de cirugía). En los restantes 2146, las exploraciones adicionales (PAAF [n=177] y/o estudio histológico tras intervención [n=569] y/o gammagrafía tiroidea [n=687] y/o elastosonografía [n=128] y/o RM/PET/TC [n=18] y/o seguimiento clínico y ecográfico de al menos 1 año [n=843]) no revelaron malignidad. A este tipo de NT, se lo clasificó como TI-RADS 3 (es decir, con baja probabilidad de malignidad).
A su vez, 154/3650 NT (4,2%) obtuvieron uno o más puntos de posible malignidad (tabla 2). De ellos, 105 NT presentaron solo un punto en la escala, y de estos, 10 fueron malignos (10/105; 9,5%). En 12 de los 25 NT con dos puntos se detectó histológicamente un carcinoma de tiroides (12/25; 48%) y en el caso de los NT con tres-cuatro puntos, la malignidad aumentó hasta un 85% (12/14).
Con el fin de unificar la terminología, y teniendo en cuenta los porcentajes de malignidad publicados por Horvath et al.3 y Kwak et al.6, se clasificó como: TI-RADS 4a a los NT con un solo punto en la escala (malignidad inferior a un 10%), TI-RADS 4b a aquellos con dos puntos (malignidad entre un 10-50%) y TI-RADS 4c a los NT con tres-cuatro puntos (malignidad entre 50-85%). En los restantes 120 NT con uno a cuatro puntos en la escala no se detectó un carcinoma a través de los métodos de referencia.
Aquellos NT con cinco o más puntos fueron catalogados como TI-RADS 5 (probablemente malignos, a semejanza del sistema BI-RADS). En nuestro estudio, estos resultaron, histológicamente, un carcinoma diferenciado de tiroides (10/10; 100%). La distribución histológica de los carcinomas tiroideos fue papilar (n=25), folicular (n=15), oxifílica (n=2) o medular (n=2).
En 3/6127 de los casos se diagnosticó un carcinoma papilar tiroideo antes de la ecografía, debido a la extirpación de una adenopatía cervical metastásica. Al igual que en la clasificación BI-RADS, estos casos se definieron como TI-RADS 6.
En la tabla 3 se resumen los hallazgos en la escala de puntuación y la categoría correspondiente según la clasificación TI-RADS, a la vez que en la tabla 4 se muestra el valor predictivo positivo de las categorías TI-RADS en este estudio.
Clasificación TI-RADS de los nódulos tiroideos basada en una escala de puntuación acorde a los criterios ecográficos de malignidad
| TI-RADS 1: Tiroides normal. Ninguna lesión focal |
| TI-RADS 2: Nódulos benignos. Patrón notoriamente benigno (0% de riesgo de malignidad) |
| Cero puntos en la escala |
| TI-RADS 3: Nódulos probablemente benignos (<5% de riesgo de malignidad) |
| Cero puntos en la escala |
| TI-RADS 4: |
| • 4a – Nódulos de identidad incierta (5-10% de riesgo de malignidad) |
| Un punto en la escala |
| • 4b – Nódulos sospechosos (10-50% de riesgo de malignidad) |
| Dos puntos en la escala |
| • 4c – Nódulos muy sospechosos (50-85% de riesgo de malignidad) |
| Tres o cuatro puntos en la escala |
| TI-RADS 5: Nódulos probablemente malignos (>85% de riesgo de malignidad) |
| Cinco o más puntos en la escala |
| TI-RADS 6: Malignidad ya detectada por biopsia o punción |
Los NT son frecuentes. Su prevalencia en autopsias se encuentra entre el 8,2 y el 64,6%21,22, mientras que su detección ecográfica ha aumentado de un 19% a un 68% con el desarrollo tecnológico de los equipos de ultrasonido23–25. No obstante, la evaluación de los NT continúa siendo difícil y, por ello, existen un gran número de directrices clínicas. Tal es así, que solo en los últimos 10 años (aproximadamente) se han publicado, de acuerdo a una revisión bibliográfica realizada en PubMed/Medline para la preparación de este manuscrito, más de 250 trabajos entre estudios, recomendaciones de sociedades médicas y artículos de revisión sobre pautas a seguir luego de la detección de un NT9,11,13,14,26–35.
Los NT presentan distintos patrones ecográficos, con una estructura hipo, iso o hiperecogénica. Esta, a su vez, puede asociarse no sólo a cambios quísticos de forma y tamaño variables, sino también a macro y/o microcalcificaciones. Además, sus bordes y configuración pueden ser diferentes. Esta diversidad (mucho más amplia que la de las lesiones focales de otros órganos o glándulas, como el hígado o la mama) ocasiona serias dificultades en la correcta catalogación.
Con el objetivo de solucionar este problema, Horvath et al.3 propusieron en el 2009 una clasificación denominada TI-RADS (semejante al sistema para lesiones mamarias BI-RADS)4,5 y posteriormente Kwak et al.6 añadieron un subtipo (el 4c). Sin embargo, no todas las características ecográficas propuestas por Horvath et al. tienen una aplicación segura en la práctica diaria6, y en el caso de Kwak et al., ellos no emplearon dentro su clasificación la perfusión del NT en Doppler color. Así, en nuestro estudio, se valoró también la presencia de ganglios cervicales sospechosos (diferenciándonos de la clasificación de Kwak en los criterios de evaluación para la asignación de los puntos en la escala).
A pesar de que en la bibliografía médica la clasificación TI-RADS se cita, en la práctica diaria su utilización es escasa. Esto puede deberse, en primer lugar, a un desconocimiento por parte del amplio abanico de especialistas que realizan ecografías de tiroides (desde médicos de atención primaria o de familia, hasta internistas, endocrinólogos, cirujanos, radiólogos y especialistas en Medicina Nuclear), pero también puede responder a cierta inseguridad del que efectúa la ecografía (que teme catalogar incorrectamente al NT) o a su comodidad (ya que para algunos es más sencillo informar, por ejemplo, “bocio nodular” o “tiroides aumentada de tamaño con un nódulo hipoecogénico”, aunque esto no sea de gran ayuda para el médico que solicitó el estudio).
Desde esta perspectiva, se propone una clasificación TI-RADS, basada en un sistema de puntuación en el cual a cada alteración ecográfica sospechosa de malignidad se le adjudica un punto en la escala. Si se detectan uno o más ganglios linfáticos cervicales sospechosos de malignidad, se añade un punto más (tabla 1).
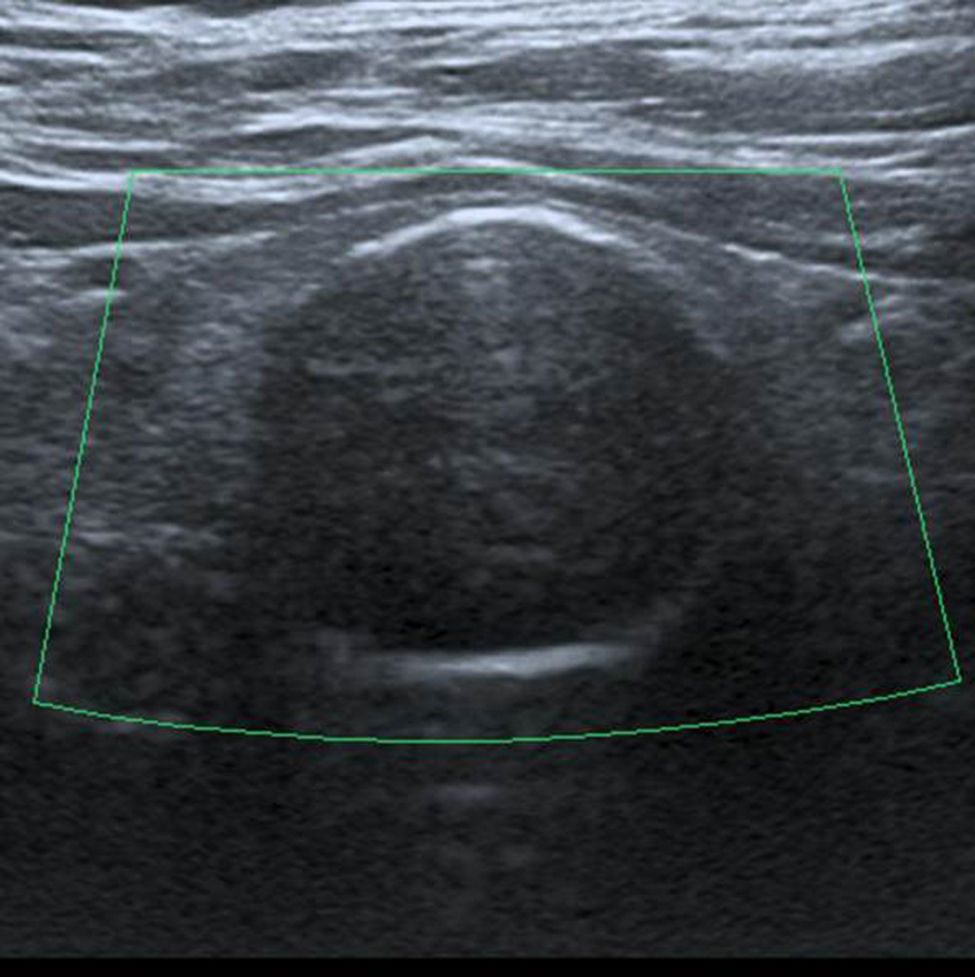
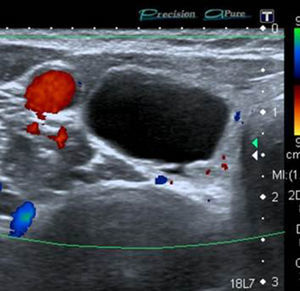
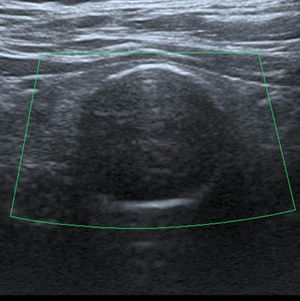
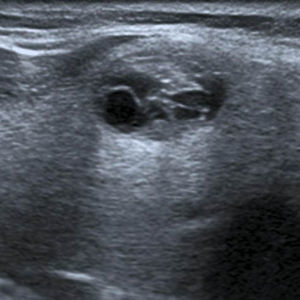
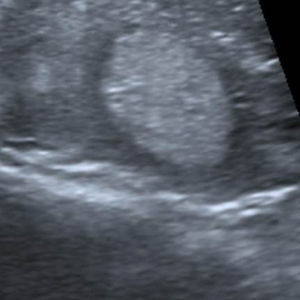
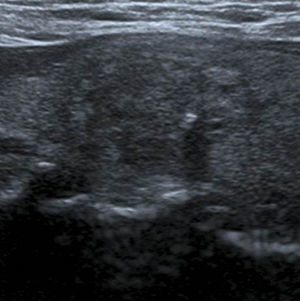
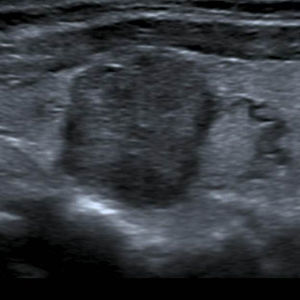
En este estudio, un 4,7% de las ecografías de tiroides no reveló lesión focal y la glándula tiroides mostró un patrón ecográfico hiperecogénico, homogéneo y normal, sin alteraciones en la vascularización. Estos casos constituyeron la categoría 1 de la clasificación TI-RADS (fig. 1), mientras que se catalogó como TI-RADS 2 a un 35,6% de los NT con criterios de benignidad bien definidos (quistes simples, nódulo sólido con quiste central, nódulos con calcificación periférica homogénea y nódulos espongiformes), cuyo resultado de benignidad fue confirmado por diversos métodos (figs. 2–5).
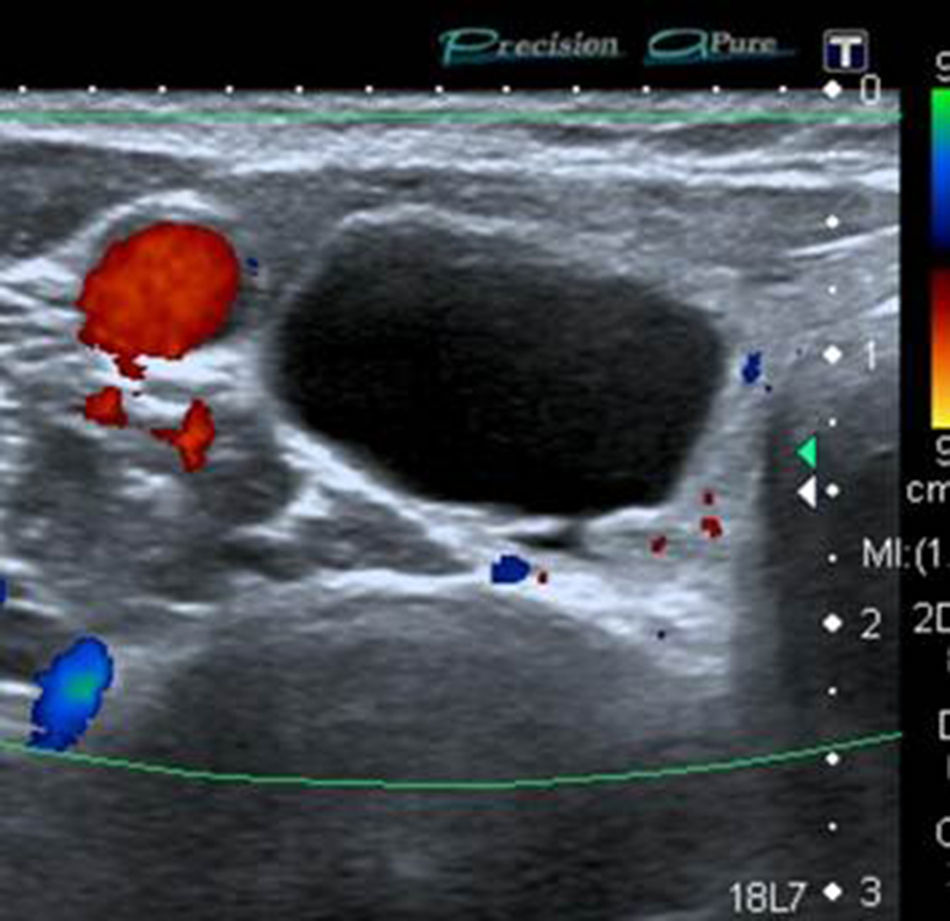
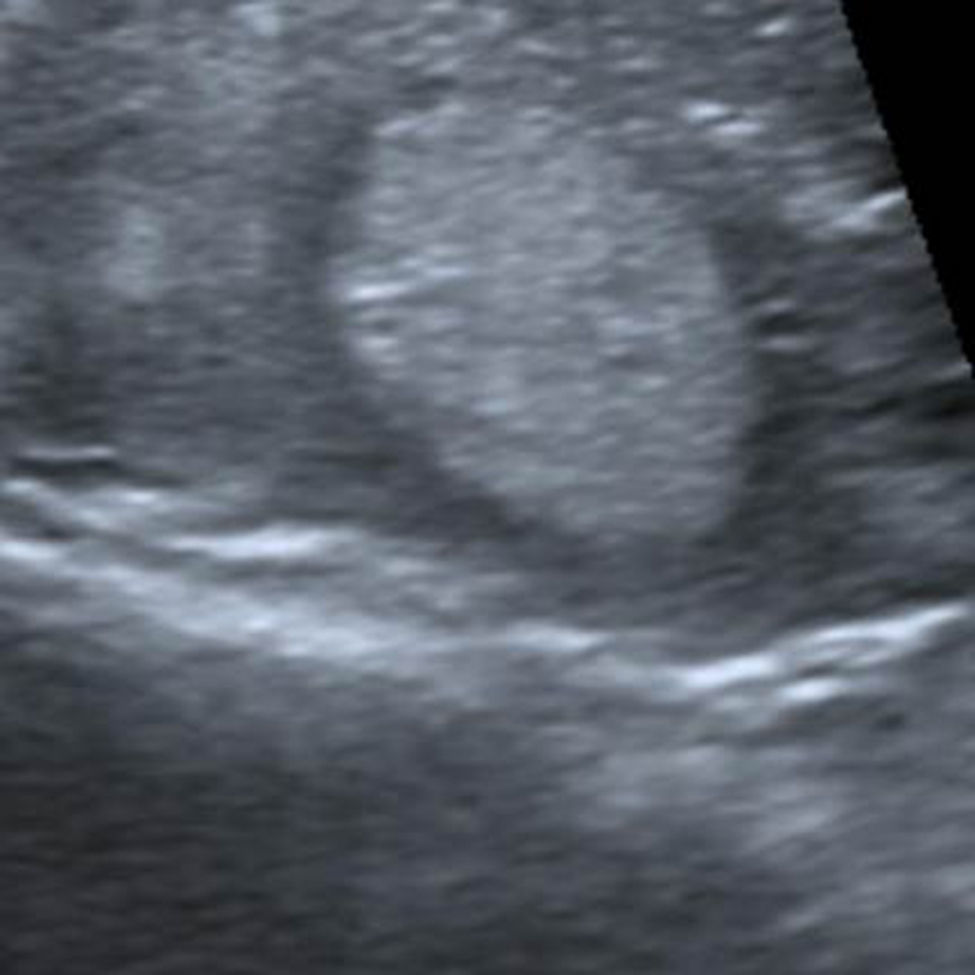
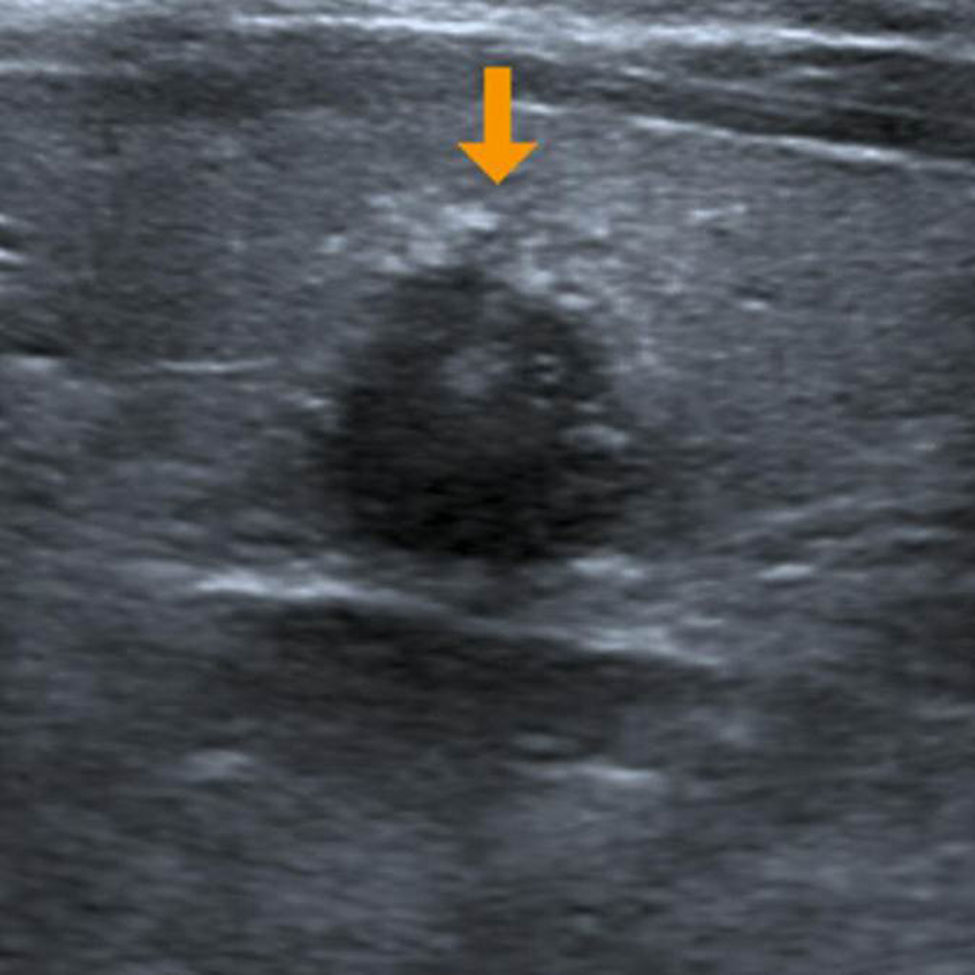
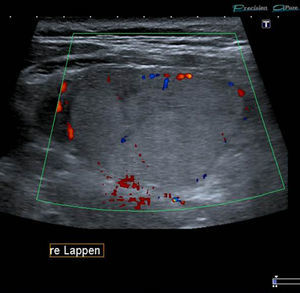
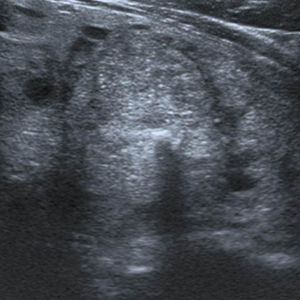
Sólo un 2,2% de los NT con vascularización periférica y un patrón ecográfico hiperecogénico (sin o con cambios quísticos) o diverso (hipo, iso o hiperecogénico, con cambios quísticos y/o macrocalcificaciones) resultó ser maligno. Estos NT con cero puntos en la escala y ecográficamente con probabilidades de benignidad se clasifican, según Horvath et al.3 y Kwak et al.6 (probabilidad de malignidad < 5%), como TI-RADS 3 (fig. 6). Al respecto, vale destacar que muchos de los nódulos TI-RADS 3 son adenomas tiroideos normofuncionantes o tóxicos (figs. 7–9) y que una malignidad en esta categoría no solo constituye una rareza, sino también un hallazgo histológico, por lo general inesperado, luego de la intervención quirúrgica de un bocio nodular (fig. 10). En nuestro estudio, un 9,5% de los NT con un único criterio de malignidad tuvo diagnóstico de carcinoma de tiroides.
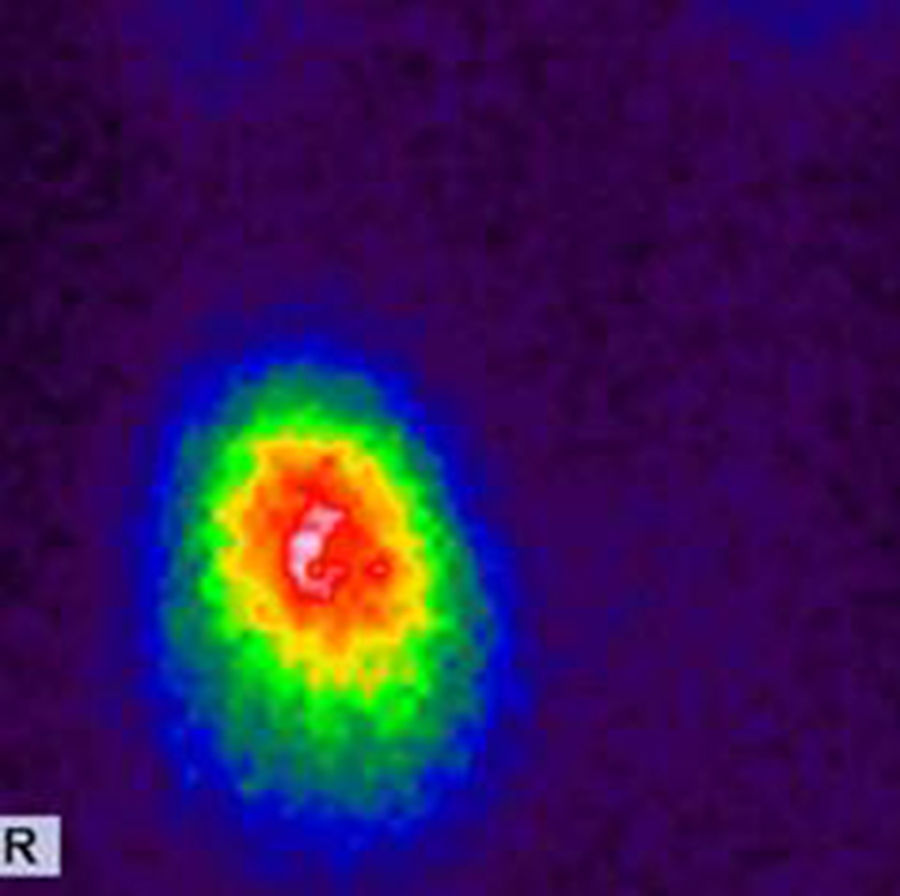
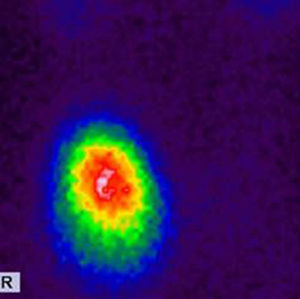
El nódulo de las Figura 7 corresponde a un adenoma tóxico en la gammagrafía tiroidea con 99mTc-pertecnetato.
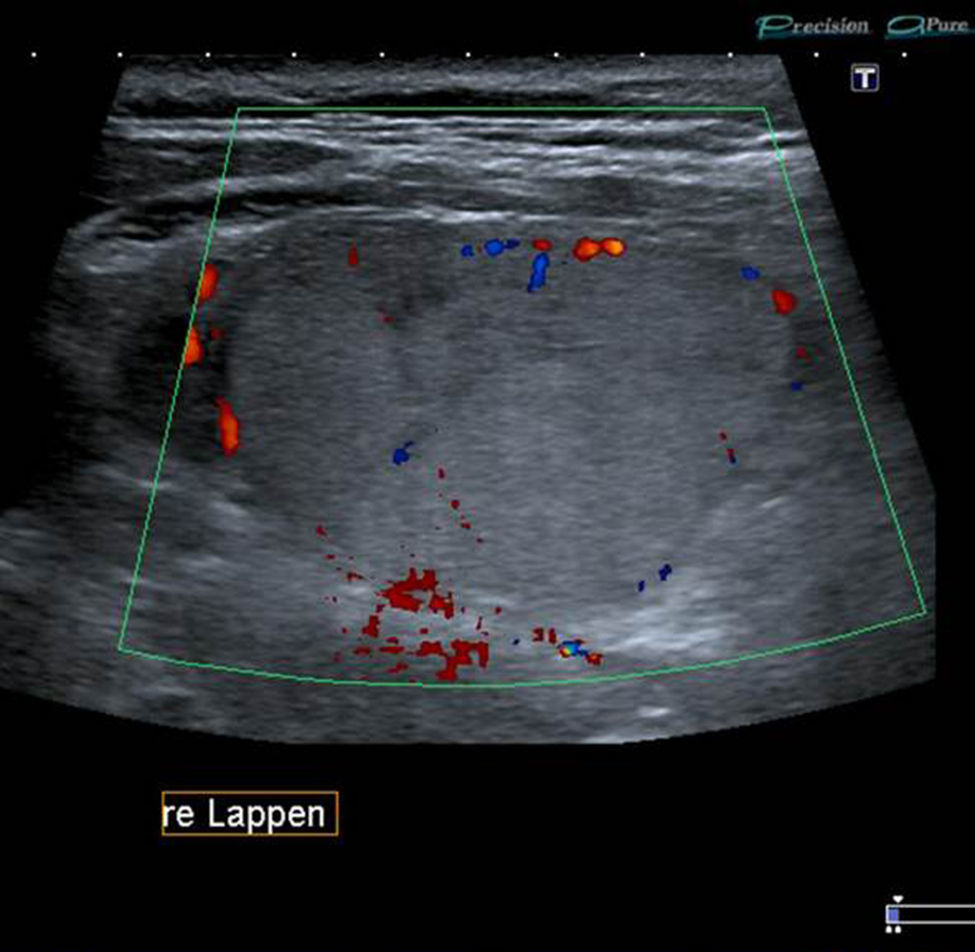
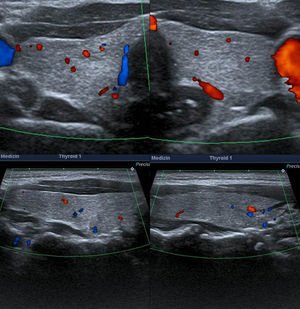
TI-RADS 3: varios nódulos en la misma glándula con un patrón ecográfico similar: nódulos hiper o isoecogénicos, con pequeños cambios quísticos y pequeñas áreas hipoecogénicas, así como también con con macrocalcificaciones (flecha) y perfusión periférica. En la gammagrafía tiroidea (fila inferior a la derecha) los NT constituyen adenomas tóxicos en un paciente con hipertiroidismo.
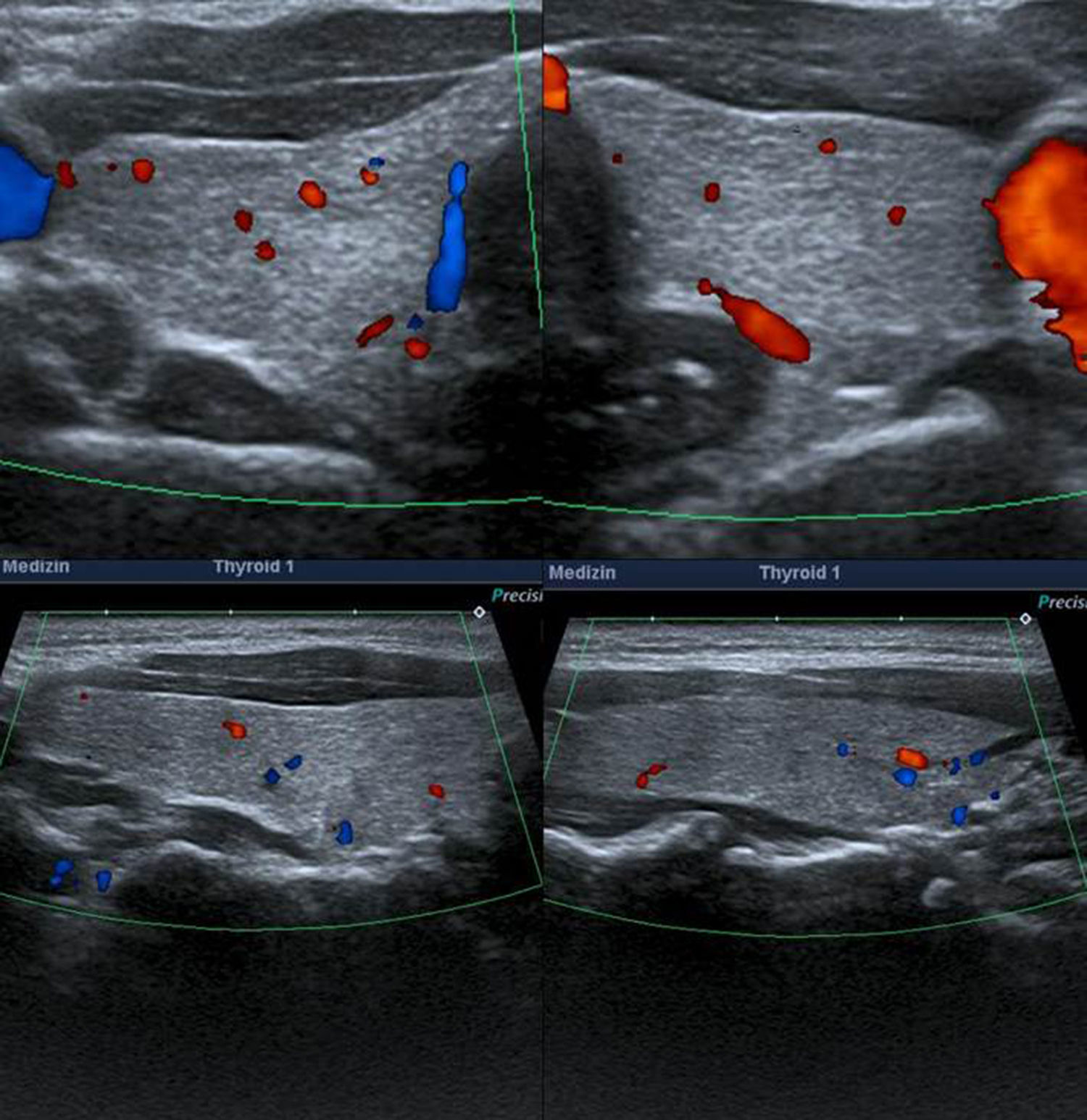
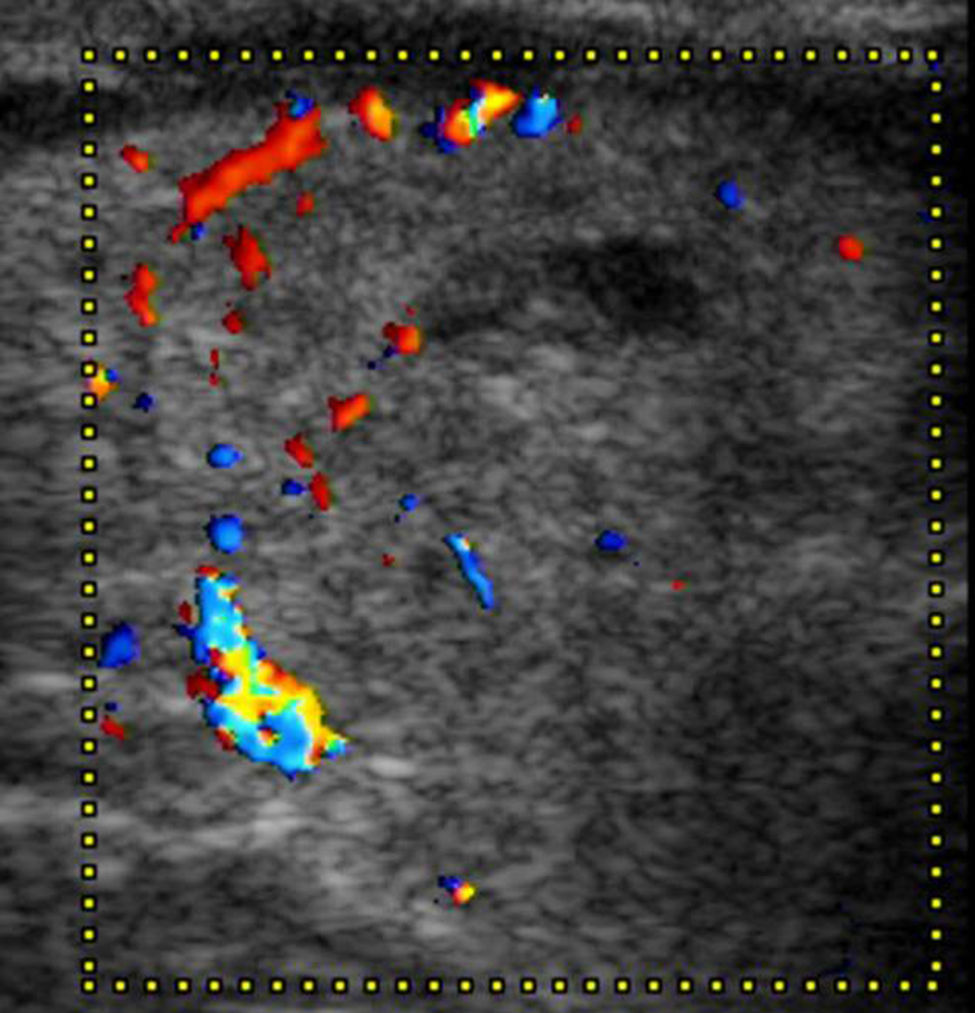
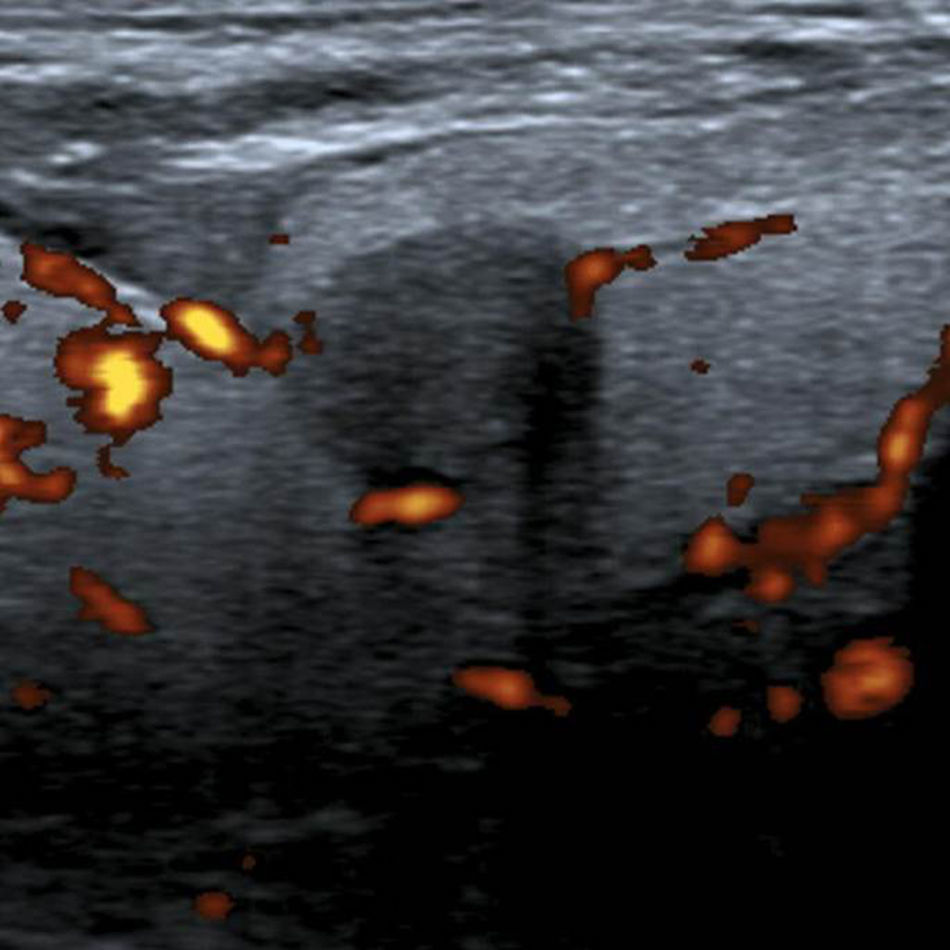
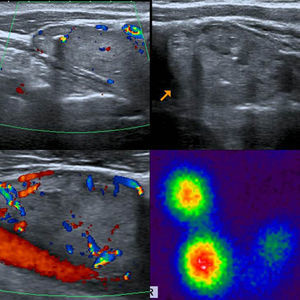
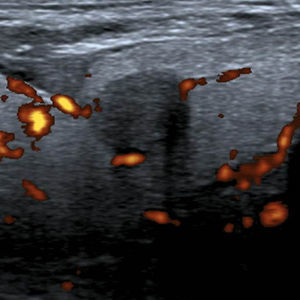
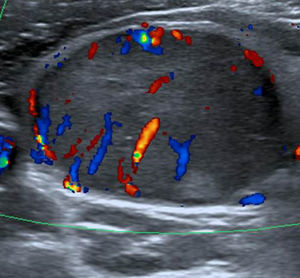
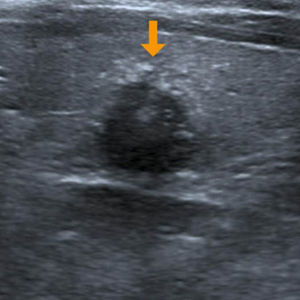
A los NT con un punto en la escala de valoración se les confirió la categoría 4a de la clasificación TI-RADS (fig. 11), mientras que aquellos NT con dos puntos en la escala fueron definidos como TI-RADS 4b (figs. 12 y 13). En este último caso, la incidencia de malignidad aumentó hasta un 48%. Por su parte, los NT con tres o cuatro puntos en la escala mostraron un aumento de la incidencia del carcinoma tiroideo de hasta un 85%, por lo que se incluyeron dentro de los TI-RADS 4c (figs. 14 y 15). En esta categoría, Kwak et al.6 refieren una malignidad de entre un 50 y 95%.
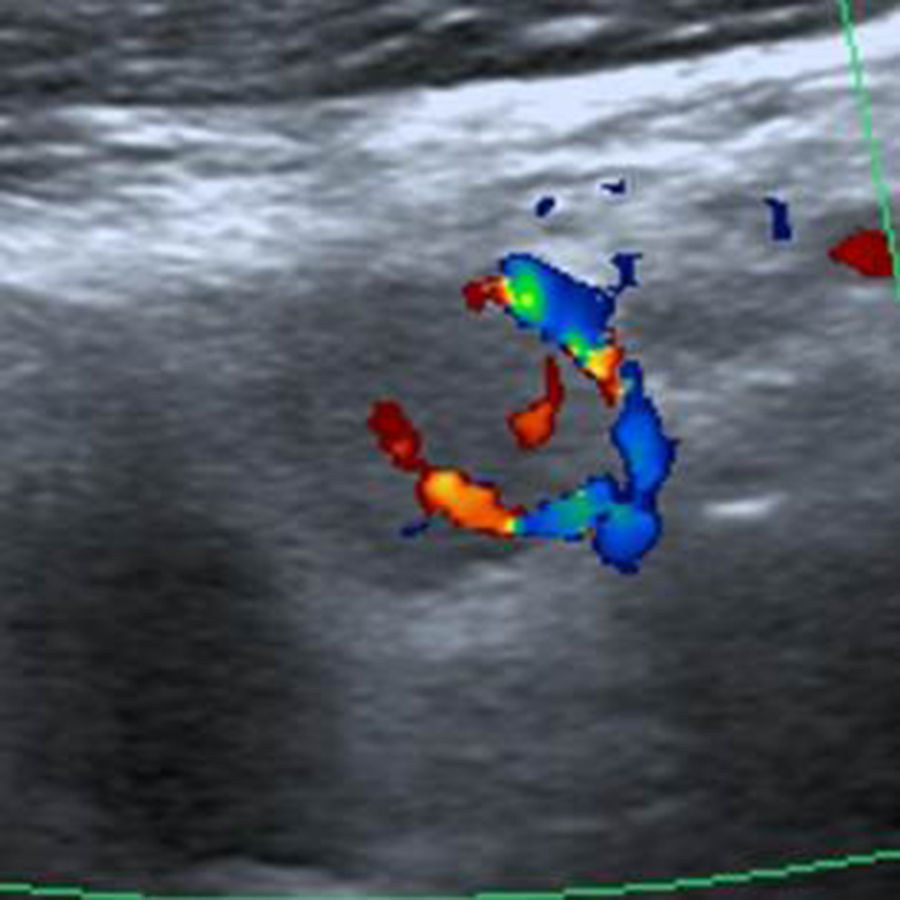
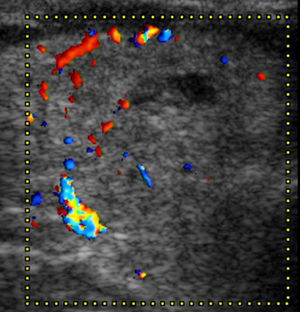
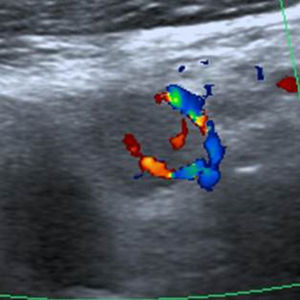
Por último, los NT con cinco o más puntos en la escala de valoración se clasificaron como TI-RADS 5 (figs. 16 y 17). En nuestro estudio, todos los NT que tuvieron estas características ecográficas resultaron ser malignos, pero Horvath et al.3 y Kwak et al.6 refieren para esta categoría una probabilidad de malignidad de entre un 85 y 99%.
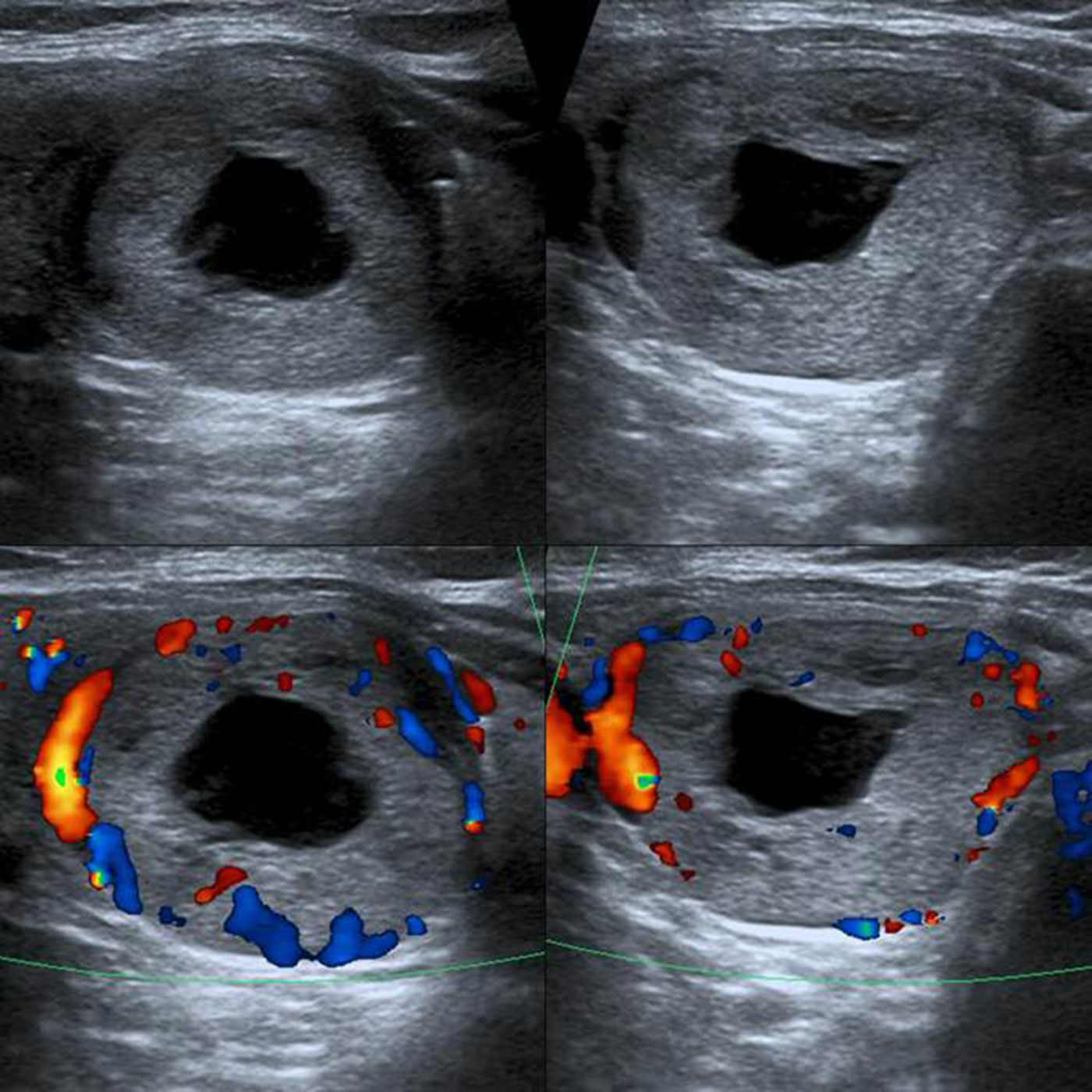
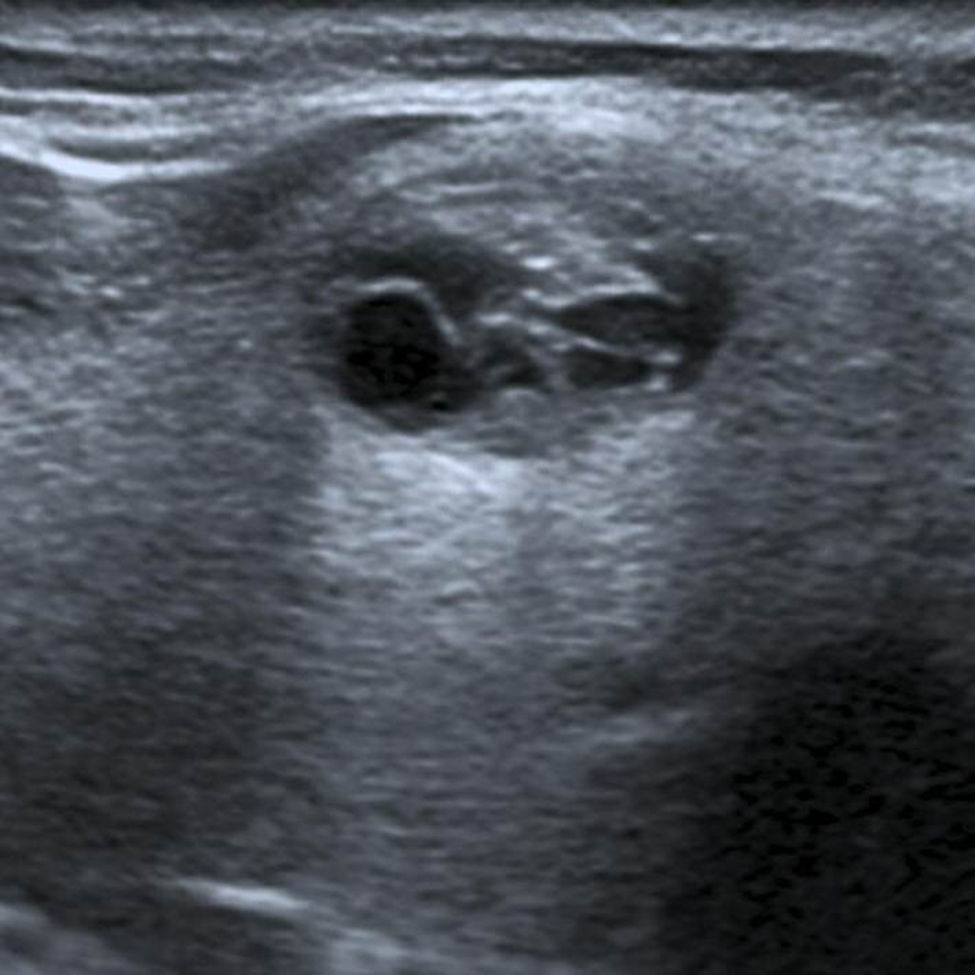
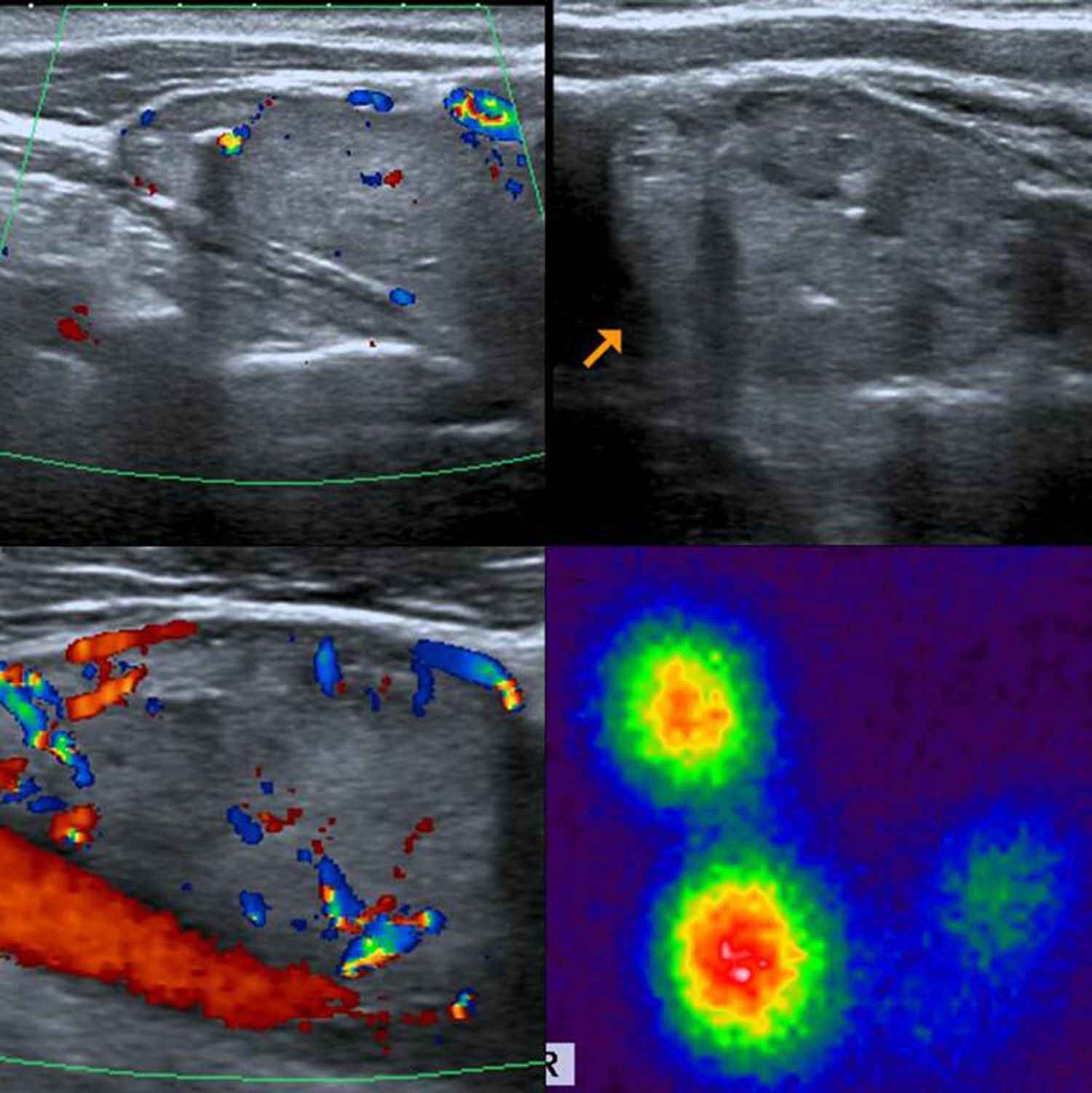
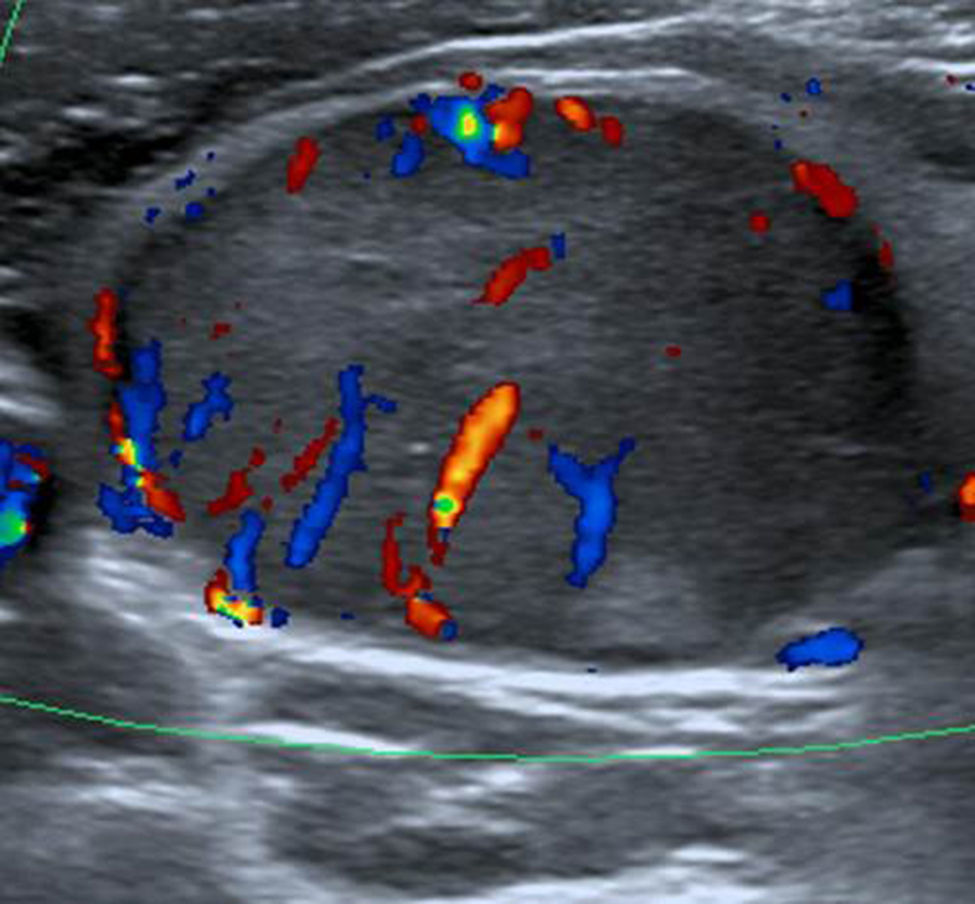
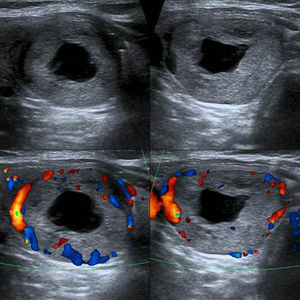
TI-RADS 5: nódulo hipoecogénico con microcalcificaciones y bordes mal definidos, con invasión del tejido perinodular (flecha). Configuración taller than wide. Además, se observa un ganglio linfático cervical sospechoso de malignidad (ver: Fig. 17). En total, seis puntos en la escala de valoración.
TI-RADS 5: ganglio linfático sospechoso, hipoecoico con configuración redonda y vascularización anómala. En total, seis puntos en la escala de valoración del nódulo de la fig. 16.
La clasificación TI-RADS basada en la escala de puntuación se refleja en la tabla 3. Su ventaja reside en la mayor practicidad y facilidad de aplicación. El primer paso en la catalogación ecográfica de los NT consiste en evaluar la posible existencia de criterios sospechosos de malignidad. Luego de su detección, hay que adicionar a la escala de valoración los puntos correspondientes. Así, si tiene cero puntos en la escala, el NT es con seguridad benigno (TI-RADS 2) en los patrones ecográficos descritos (quiste simple, nódulo sólido con quiste central, nódulo con calcificación periférica homogénea y nódulo espongiforme) o probablemente benigno (TI-RADS 3). A partir de un punto en la escala, los NT comienzan a tener, en función de la puntuación final, desde una catalogación incierta hasta una elevada probabilidad de malignidad. En los NT clasificados como TI-RADS 4a la forma de proceder depende del contexto clínico general. Cuando se trata de un hallazgo casual en un paciente con historia clínica negativa en cuanto al riesgo de padecer un carcinoma tiroideo (por ejemplo, ningún familiar con carcinoma de tiroides, ninguna radiación cervical por procesos malignos, etc.), es suficiente realizar un control ecográfico en aquellos NT con un tamaño inferior a 1cm; mientras que en aquellos nódulos superiores a 1cm se debe efectuar una gammagrafía tiroidea con 99mTc-pertecnetato sódico para evaluar su captación36,37. El posible manejo protocolizado de los casos TI-RADS 4a, con realización adicional de una PAAF, depende de la anamnesis, la evaluación clínica, así como también de los hallazgos gammagráficos y los controles ecográficos (para ello, debería haber más estudios prospectivos). Por el contrario, en los NT clasificados como TI-RADS 4b y 4c se debe llevar a cabo siempre, salvo alguna contraindicación o un riesgo elevado, una PAAF. De acuerdo con los resultados de este estudio, los TI-RADS 5 invariablemente deberán contar con una evaluación histológica luego de la cirugía.
Como limitación de este estudio, se puede mencionar la falta de una confirmación citológica o histológica en todos los casos. No obstante, todo aquel que se enfrente diariamente con el diagnóstico ecográfico de los NT sabe que es imposible efectuar una punción o cirugía en todos ellos, así como es irrealizable en estudios clínicos por cuestiones éticas. De hecho, gracias al avance tecnológico del ultrasonido y a la instauración de nuevas técnicas (como el Doppler color o la elastografía) y otros métodos diagnósticos (gammagrafía o PET/TC, p. ej.) se ha podido reducir el número de este tipo de intervenciones.
Si bien algunos carcinomas tiroideos tienen una evolución lenta, cuando los métodos diagnósticos adicionales muestran signos de benignidad en la práctica médica resulta suficiente, pues la probabilidad de que algunos de estos nódulos malignicen es escasa. Por este motivo, a pesar de no contar con una correlación citológica o histológica en los 3650 nódulos, se consideró que la benignidad definida por estos criterios era válida. Además, en 966 casos TI-RADS 2 y 3 sí se efectuó una punción o cirugía, y en todos los casos de malignidad TI-RADS 3, 4a, 4b, 4c y 5 se llevó a cabo la confirmación histológica.
La clasificación TI-RADS es meramente ecográfica. La evaluación final y la toma de una decisión terapéutica ante la presencia de un NT no puede reducirse al resultado de una ecografía de tiroides. Para ello, son importantes también, además de los análisis usuales de laboratorio para determinar la función tiroidea, la tiroglobulina, la calcitonina y los diversos anticuerpos tiroideos, así como la gammagrafía de tiroides con 99mTc-pertecnetato sódico.
ConclusiónLa clasificación TI-RADS de los NT basada en un sistema de puntuación acorde a los criterios ecográficos más relevantes de malignidad tiene una mejor y más fácil aplicación en la práctica diaria. Según los criterios de malignidad y la puntuación asignada en este estudio, la posibilidad de que un NT con un punto en la escala sea maligno es de aproximadamente un 10%, mientras que la probabilidad para aquellos con dos puntos es casi del 50% y para los valorados con tres o cuatro puntos del 85%. Todos los NT con 5 o más puntos son malignos.
La clasificación TI-RADS basada en el sistema de puntuación descrito debería permitir y dar lugar a que todos los médicos que evalúen el resultado de una ecografía de tiroides (sea el médico de atención primaria, un endocrinólogo, un radiólogo o un especialista en Medicina Nuclear) utilicen la misma nomenclatura y terminología con respecto a la catalogación de los NT.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.