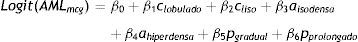Diferenciar el angiomiolipoma atípico del carcinoma de células renales del mismo tamaño mediante hallazgos tomográficos.
Materiales y métodosSe realizó un estudio retrospectivo con 68 pacientes (17 con angiomiolipomas atípicos y 51 con carcinoma de células renales) nefrectomizados por diagnóstico presuntivo preoperatorio, mediante tomografía computada trifásica (fases sin contraste, corticomedular y excretora temprana), de carcinoma de células renales menor de 45mm. Dos radiólogos que desconocían el diagnóstico definitivo evaluaron retrospectivamente las características generales del tumor, su atenuación en fase sin contraste y las características de su realce. Se realizó un análisis estadístico con software R, aplicándose el modelo logit para diferenciar el angiomiolipoma atípico del carcinoma de células renales a partir de los hallazgos tomográficos de masa renal, incluidos en el modelo final el contorno, la atenuación en fase sin contraste y el patrón de realce con el tiempo.
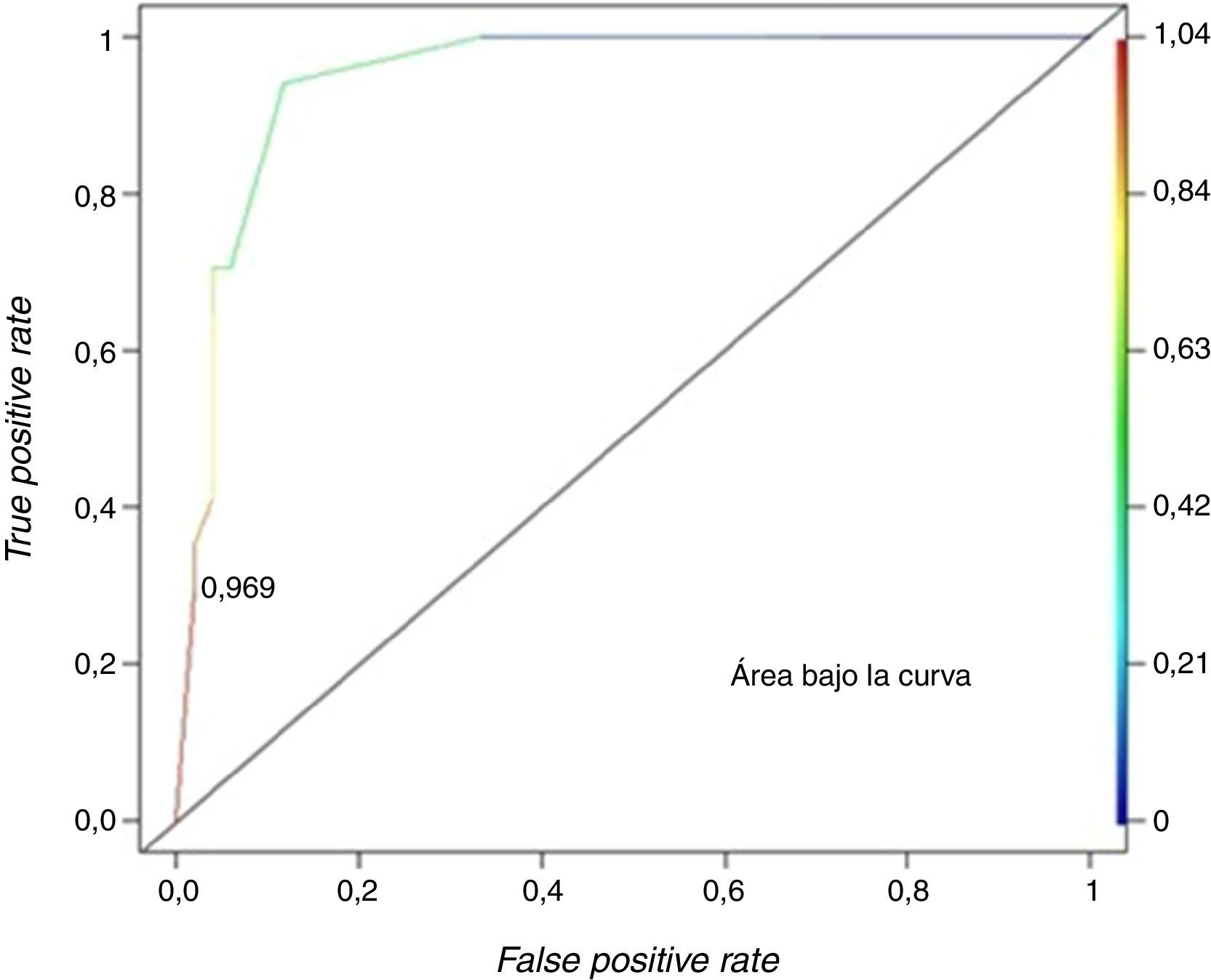
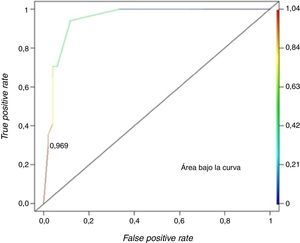
ResultadosLos hallazgos de angiomiolipoma atípico que resultaron significativos fueron atenuación tumoral en fase sin contraste hiperdensa y patrón de realce con tiempo prolongado con chance de ocurrencia de 10,49 (p=0,0381) y 36,71 (p=0,0009), respectivamente. En los pacientes, según el valor de cada hallazgo incluido en el modelo, se calculó probabilidad, sensibilidad (0,2941) y especificidad (0,9804). La curva característica operativa del receptor (ROC) determinó un punto de corte óptimo (0,9694) para discriminar el angiomiolipoma atípico, por lo que se confirmó su presencia.
ConclusiónLa tomografía computada helicoidal trifásica es útil para diferenciar el angiomiolipoma atípico del carcinoma de células renales, siendo la atenuación hiperdensa sin contraste del tumor y su patrón de realce prolongado los hallazgos tomográficos más valiosos.
To compare various computed tomographic features of atypical angiomyolipoma with those of size-matched renal cell carcinoma.
Materials and methodsSixty-eight patients (17 with atypical angiomyolipomas and 51 with carcinoma renal cells) who had undergone nephrectomy by presumptive diagnosis of carcinoma renal cell<45mm on diameter by preoperative triphasic computed tomography (CT) (with unenhanced, corticomedullary, and early excretory phase scanning) were evaluated in a retrospective study. Two reviewers who were unaware of the diagnosis retrospectively recorded tumor attenuation on unenhanced scans, enhancement characteristics and general characteristics of the tumor. Statistical analysis was performed with R software, applying logit model to differentiate atypical angiomyolipoma from renal cell carcinoma from CT findings of renal mass, included in the final model the tumor margin, its attenuation on unenhanced scans and the enhancement pattern over time.
ResultsFor atypical angiomyolipomas the most valuable CT findings were hyperdense attenuation tumour in unenhaced phase scan and prolonged enhancement pattern, with chance of occurrence of 10.49 (p=0.0381) and 36.71 (p=0.0009), respectively. In the patients, as each finding value in the model, probability, sensitivity (0.2941) and specificity (0.9804) was calculated ROC curve was constructed that determined optimal cutoff (0.9694) to discriminate atypical angiomyolipoma, confirming their presence.
ConclusionTriphasic helical CT may be useful in differentiating atypical angiomyolipoma from renal cell carcinoma, with hyperdense tumor attenuation on unenhanced scans and prolonged enhancement pattern being the most valuable CT findings.
Una masa renal sólida (MRS) es una lesión sin grasa macroscópica, que realza sin importar su patrón. Es importante detectar las malignas y diferenciarlas de las benignas, sobre todo cuando son pequeñas1–4. La tomografía computada (TC) constituye la técnica más sensible en la distinción de subtipos de carcinoma de células renales (CCR) en las MRS grandes y en el análisis de las pequeñas. Hasta la fecha, los patrones de realce no han sido rigurosamente evaluados para caracterizar la enfermedad maligna versus la benigna y los diferentes subtipos de CCR dentro de las MRS pequeñas1–3,5–8.
Si bien la mayoría de las MRS son CCR, el 20-30% resulta benigna. Las opciones terapéuticas de las MRS pequeñas incluyen vigilancia activa, nefrectomía parcial o cirugías ablativas7,9–11.
Para maximizar su detección y caracterización, la tomografía incluye imágenes obtenidas antes y después de la administración del contraste intravenoso (fases), comparando sus Unidades Hounsfield (UH). Si bien no hay consenso sobre un valor que sea una prueba inequívoca de realce, un cambio de 20 UH o más constituye una fuerte evidencia8–13.
El angiomiolipoma (AML) es la MRS benigna más común del riñón y ocurre en 0,3-3% de la población. Corresponde a un hamartoma (es decir, tejidos histológicamente normales en localización, pero de proporciones anormales), compuesto por cantidades variables de tejido vascular, muscular y lipídico. La frecuencia de hemorragia, necrosis, extensión perirrenal y pleomorfismo miomatoso puede provocar un erróneo diagnóstico anatomopatológico de malignidad14–19.
Existe el AML típico y atípico20. El primero (o clásico) representa la mayoría y se define en una etapa prequirúrgica como AML con hallazgos tomográficos típicos de grasa14,18–20. Por el contrario, los de mínimo componente graso (AMLmcg) o atípicos constituyen una inusual manifestación (3-4,5%) y se caracterizan por la ausencia de grasa dentro de una lesión que realza poscontraste endovenoso14,20,21.
Actualmente, el diagnóstico de AML renal se realiza en forma no invasiva y precisa mediante TC, ultrasonido (US) y resonancia magnética (RM)14,20,21. La TC presenta mayor sensibilidad en la detección de grasa dentro del AML por su capacidad para discriminar pequeñas diferencias de densidad, así como es útil para determinar complicaciones frecuentes, como la extensión perirrenal y la hemorragia16. La apariencia tomográfica de los AML depende en gran medida del tipo, reflejando hallazgos patológicos variables16. En algunos casos, la biopsia de la MRS puede estar indicada (si algunos hallazgos imagenológicos secundarios están presentes) para lograr el diagnóstico de certeza y evitar la cirugía12,22,23.
En cuanto al CCR, este representa casi el 3% de los tumores sólidos. La mayoría de las MRS con realce encontradas mediante imágenes corresponde a CCR, siendo menos comunes otras entidades benignas, como los oncocitomas y el AML atípico. Entre los subtipos (células claras [CCRc], papilar [CCRp] y cromófobo [CCRcr]), el CCRc es el más común en adultos (70%), y cada uno tiene sus implicancias en el tratamiento y pronóstico24–29.
Dados los avances tecnológicos, particularmente en la TC helicoidal multidetector (TCMD), en los últimos años se han detectado más frecuentemente MRS pequeñas (< 3cm de diámetro) y muy pequeñas (< 1,5cm)30. Actualmente se sabe que el 20% de todas las MRS pequeñas que refuerzan son benignas y que el tamaño del tumor por sí solo no es suficiente información para decidir el tratamiento31.
El objetivo de este trabajo es diferenciar los hallazgos tomográficos del AML atípico de los del CCR del mismo tamaño.
Materiales y métodosPoblaciónSe realizó un estudio retrospectivo entre mayo de 2010 y julio de 2013 con la aprobación del Comité Institucional. Mediante las historias clínicas informatizadas del servicio de Urología, se identificó a los pacientes de ambos sexos con diagnóstico preoperatorio presuntivo de CCR menor de 45mm, realizado a través de una TCMD multifásica en nuestro centro. Todos los casos habían tenido una nefrectomía total o parcial para la resección de la lesión con posterior evaluación de la misma por el centro de anatomía patológica.
Se valoraron los tumores de hasta 4,5cm de diámetro para comparar los dos tipos de lesión de tamaño similar. El consentimiento informado no fue necesario para este estudio retrospectivo.
Se excluyeron aquellos pacientes con: TCMD monofásica (solo fase sin contraste endovenoso), TC realizada en otro centro de imágenes, TC que no pudiera ser recuperada en archivos digitales, resultado histopatológico de otro centro, AML típico diagnosticado prospectivamente en TCMD en base al contenido graso intratumoral o con resultados histopatológicos de CCR no claras (papilar y cromófobo).
Evaluación anatomopatológicaSe revisaron los registros del centro de patología para determinar el diagnóstico y las características histológicas de las lesiones de los pacientes con nefrectomía parcial o total. En todos los casos, el material patológico consistió en preparaciones microscópicas.
Los portaobjetos con muestras de todas las lesiones renales fueron revisados a ciegas por un solo patólogo en un mínimo de 10 campos en diferentes regiones del tumor, dada su naturaleza heterogénea. En los casos con diagnóstico de AML se determinó el porcentaje de grasa para establecer si era un AML típico o atípico.
TomografíaLas TC multifásicas se realizaron con un tomógrafo helicoidal multicorte de 16 filas de detectores (Phillips) bajo el protocolo de estudio del centro, consistente en fases sin y con material de contraste yodado endovenoso (EV). Todos los pacientes recibieron 500-900ml de contraste oral (2% de suspensión de sulfato de bario, EZ-CAT), 30 minutos antes de la exploración tomográfica. Esta se realizó, en las distintas fases, abarcando el área comprendida entre ambas cúpulas diafragmáticas y la tuberosidad isquiática correspondiente. Los parámetros fueron: sección de colimación de 5mm, velocidad de la mesa de 15mm por rotación (18mm/s), 120 kVp, corriente del tubo de 250-340mA, y un tiempo de ciclo de un segundo. Las constantes se mantuvieron en todas las fases.
Las imágenes iniciales, denominadas fase sin contraste, se obtuvieron tras la ingesta del contraste oral y sin la administración del contraste endovenoso, con retención de la respiración.
Para las fases de realce renal, los pacientes recibieron 50-100ml de contraste yodado hidrosoluble, no iónico y de baja osmolaridad (lobitridol- Xenetix) por vía intravenosa, correspondiente a una dosis de 2ml por kg de peso y 300mg de yodo por mililitro, por lo que la cantidad de yodo por frasco de 50ml correspondió a 15g. Se administró a través de una bomba inyectora mediante técnica multifásica (tasas de inyección de 3ml/s [50ml] en un tiempo total de inyección de aproximadamente 17 s). Las inyecciones se realizaron en la vena antecubital y fueron monitoreadas visualmente y por palpación.
También se evaluaron la fase corticomedular (cuya diferenciación sucede a los 20-30 s poscontraste), la nefrográfica (cuyo máximo realce con nefrograma homogéneo es a los 60-80 s poscontraste) y la excretora temprana (que comienza a los 120 s luego de la inyección del contraste, cuando este se excreta en cálices, infundíbulos y en la pelvis renal, aunque existe un nefrograma homogéneo con menor atenuación que la de la fase nefrográfica)8–13.
Para este estudio, se consideró únicamente la fase nefrográfica para evaluar las características generales del tumor. El retraso de la exploración en la fase corticomedular fue de 30 s tras la inyección y de 120 s en la fase excretora temprana.
Revisión de imágenesTodas las imágenes se reconstruyeron en forma contigua, sin intervalos de superposición de 5mm. Las TC preoperatorias fueron analizadas por dos radiólogos del equipo con experiencia en TC renal, en una estación de trabajo Extended Brilliance TM Workspace. Si bien ellos estaban al tanto del diseño del estudio, desconocían el diagnóstico anatomopatológico final. En primer lugar, cada especialista evaluó visualmente las imágenes de las lesiones en fase sin contraste para determinar si cada tumor presentaba áreas de baja atenuación, asociadas a un valor de atenuación negativa por la presencia de grasa dentro de la lesión. El tejido se consideró grasa cuando poseía la misma densidad que el tejido graso subcutáneo o retroperitoneal.
Las lesiones en las que se descartó tejido graso a continuación fueron evaluadas objetivamente a partir de la medición del valor de atenuación media del tumor en las fases sin contraste, corticomedular y excretora temprana.
Se utilizó una estación de trabajo para calcular el diámetro del tumor y valorar la atenuación en una región de interés (ROI) mediante la herramienta homónima.
Evaluación de imágenesEn cada tumor se analizaron tres rasgos: sus características generales, su atenuación en fase sin contraste y su realce (tabla 1).
Evaluación tumoral por tomografía computada
| Características generales del tumor (fase nefrográfica) | Margen tumoral | Liso |
| Irregular | ||
| Ubicación del centro tumoral | Extracapsular (75% o más del centro del tumor situado más allá del contorno del riñón) | |
| Intracapsular (centro del tumor situado 50% o más por debajo del contorno renal) | ||
| Calcificación intratumoral | Presencia | |
| Ausencia | ||
| Cambios perirrenales (estriaciones perirrenales y engrosamiento de fascia de Gerota) | Presencia | |
| Ausencia | ||
| Atenuación tumoral (fase sin contraste) | Hipoatenuación | Menor que la del parénquima renal adyacente |
| Isoatenuación | Similar a la del parénquima renal adyacente | |
| Hiperatenuación | Mayor que la del parénquima renal adyacente | |
| Características del realce tumoral (aumento de atenuación en más de 20 UH) | Distribución del realce tumoral (valoración subjetiva) | Homogéneo (realce uniforme tumoral tanto en fase corticomedular y fase excretora temprana) |
| Heterogéneo (en caso contrario) | ||
| Patrón de realce tumoral en el tiempo | Patrón de wash out temprano Fase corticomedular: tumor con pico de realce Fase excretora temprana: lavado > 20 UH | |
| Patrón gradual Fase excretora temprana: valor de atenuación tumoral aumenta > 20 UH que el de fase corticomedular | ||
| Patrón prolongado (si diferencia entre valores de atenuación del tumor de la fase corticomedular y fase excretora temprana osciló entre −20 y 20 UH) | ||
| Grado de realce tumoral (en UH) | Grado de realce tumoral en fase corticomedular = fase sin contraste − fase corticomedular | |
| Grado de realce tumoral en fase excretora temprana = fase sin contraste − fase excretora temprana |
En cuanto a sus características generales, se determinó en fase nefrográfica: su margen (liso o irregular), la ubicación del centro (extracapsular, con al menos el 75% del centro del tumor situado por encima del contorno renal; o intracapsular, con el centro del tumor situado 50% o más por debajo del contorno renal), la calcificación intratumoral (presencia o ausencia) y los cambios perirrenales (presencia o ausencia; es decir, hilos de atenuación de los tejidos blandos en la zona perirrenal y engrosamiento de la fascia de Gerota).
La atenuación del tumor en fase sin contraste se estimó subjetivamente, y fue cotejada con la del parénquima renal circundante. Se clasificó como hipoatenuación (si era menor a la del parénquima renal adyacente), como isoatenuación (cuando era similar) y como hiperatenuación (si era mayor).
Finalmente, las características del realce tumoral, definido como un aumento en la atenuación de más de 20 UH, incluyeron:
- •
Distribución del realce tumoral: homogéneo (cuando la mayoría de las zonas mostraron realce uniforme en la fase corticomedular y en la excretora temprana) o heterogéneo (en caso contrario). Si la atenuación era heterogénea, se apreció subjetivamente utilizando para la clasificación la zona con mayor atenuación.
- •
Patrón de realce en el tiempo: comportamiento lesional del contraste yodado endovenso. Este se subclasificó como:
- -
de wash out temprano: cuando el tumor mostró un pico de realce en la fase corticomedular y luego tuvo un lavado de al menos 20 UH en la fase excretora temprana.
- -
gradual: cuando el valor de la atenuación del tumor en la fase excretora temprana fue de al menos 20 UH más de lo que era en la fase corticomedular.
- -
prolongado: cuando la diferencia entre los valores de atenuación del tumor de la fase corticomedular y la excretora temprana osciló entre las -20 y 20 UH.
- -
- •
Grado de realce tumoral en la fase corticomedular y la excretora temprana en UH. Se consideró la diferencia de los valores promedio de atenuación entre las imágenes sin y con contraste. Para su análisis, se utilizó un ROI redondo, de al menos 1cm2, con idéntica localización y tamaño en las tres fases de exploración. Para minimizar el volumen parcial promediado con el parénquima renal circundante, se colocó el ROI cerca del centro del tumor. Se seleccionaron las TC que mostraron las superficies más extensas de la lesión y del parénquima renal, y en esas se obtuvo la región de interés más grande posible.
Se consensuó la localización ideal del ROI, según la homogeneidad o heterogeneidad del tumor. En el primer caso, se selecciónó un área sólida de realce en la fase corticomedular, mientras que en las lesiones heterogéneas, al haber múltiples áreas de realce, se incluyó dentro del ROI la mayor cantidad posible de porciones sospechosas (áreas de realce superiores a 1cm de diámetro en el eje corto) y al menos tres regiones de interés fueron analizadas por cada fase para asegurar la presencia de realce inequívoco y luego calcular los valores promedio. Se intentó incluir la mayor cantidad de área de realce en el ROI y excluir el parénquima renal circundante y cualquier área intratumoral con degeneración quística o calcificación.
Métodos estadísticosEl análisis estadístico se efectuó con el software R-project32. Se llevó a cabo la regresión logística múltiple para diferenciar el AML atípico del CCR a partir de las TC. Mediante la exploración se determinaron los hallazgos tomográficos a ser incluidos en el modelo de regresión. Se evaluó la presencia de interacción y confusión, sin encontrar ninguna de las dos.
En el modelo final se incluyó el contorno de masa renal, la atenuación tumoral en fase sin contraste y el patrón de realce en el tiempo.
El logit del modelo de regresión logística múltiple final se determinó por la ecuación:
(siendo clobulado: contorno de masa renal lobulado; cliso: contorno de masa renal liso; aisodensa: atenuación tumoral en fase sin contraste isodensa; ahiperdensa: atenuación tumoral en fase sin contraste hiperdensa; pgradual: patrón de realce gradual; y pprolongado: patrón de realce prolongado).
Como base para la comparación se utilizaron los hallazgos tomográficos relacionados con el contorno irregular, la atenuación tumoral en fase sin contraste hipodensa y el patrón de realce wash out temprano.
Se consideró indicador de diferencia estadísticamente significativa un valor de p menor de 0,05.
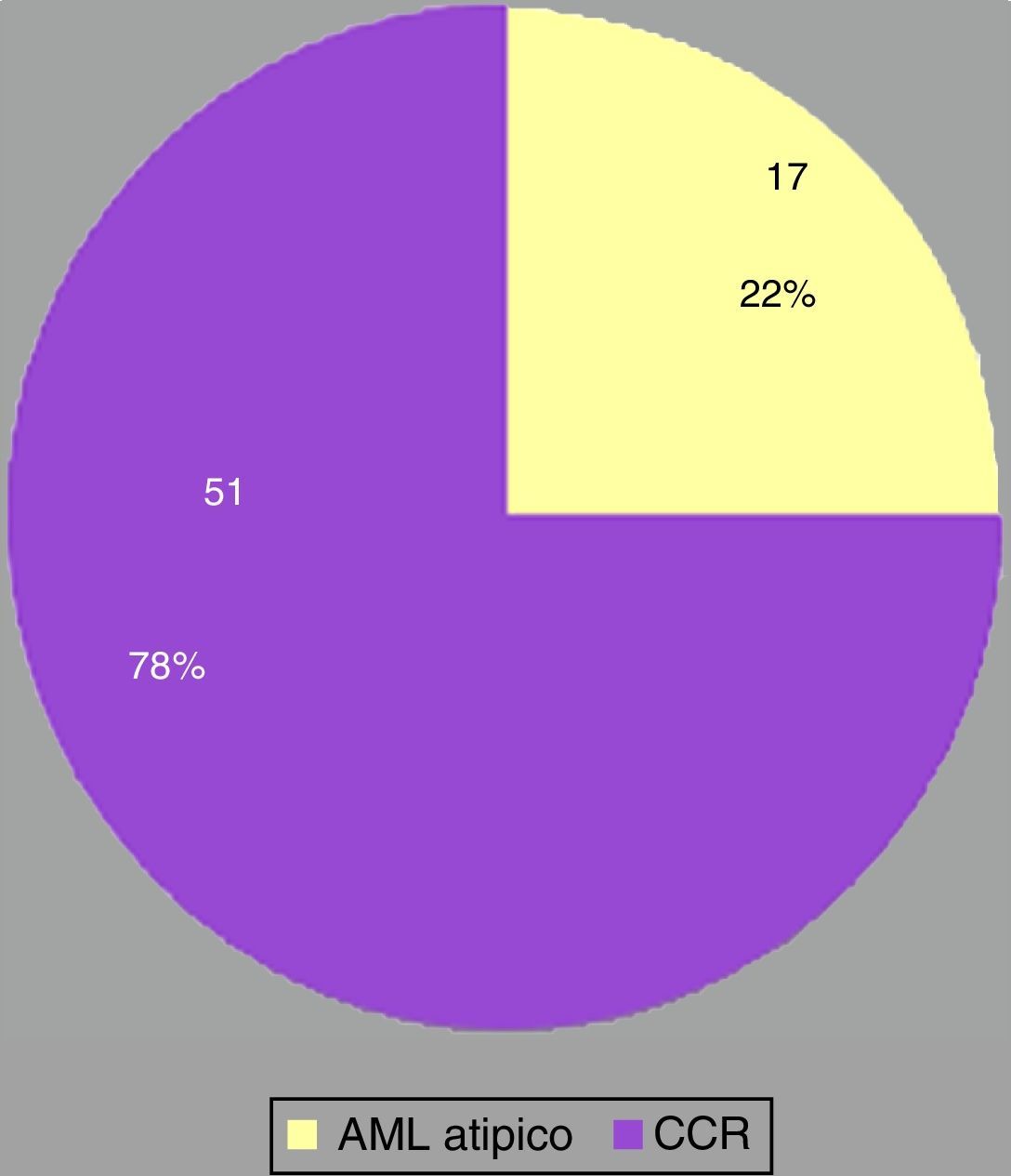
ResultadosSe hallaron 68 adultos con masas renales menores de 45mm de diámetro (promedio: 27mm; rango: 11-45mm), diagnosticadas mediante TCMD como CCR. Del total, 43 eran hombres y 25 mujeres, con un edad entre los 30 y 83 años (media: 57 años) (tabla 2).
Resultados de las características generales tumorales
| Sexo | Tamaño | Contorno | Calcificaciones | Localización | Cambios perirrenales | ||
|---|---|---|---|---|---|---|---|
| M (n = 25) | V (n = 43) | ||||||
| AML atípico (n = 17; 26%) | 65% | 27% | 20-30 mm (47%) | Liso (100%) | Presencia (100%) | Intracapsular (64%) | Ausencia (94%) |
| CCR (n = 51; 74%) | 35% | 73% | 30-45 mm (55%) | Irregular (65%) | Ausencia (88%) | Extracapsular (61%) | Presencia (94%) |
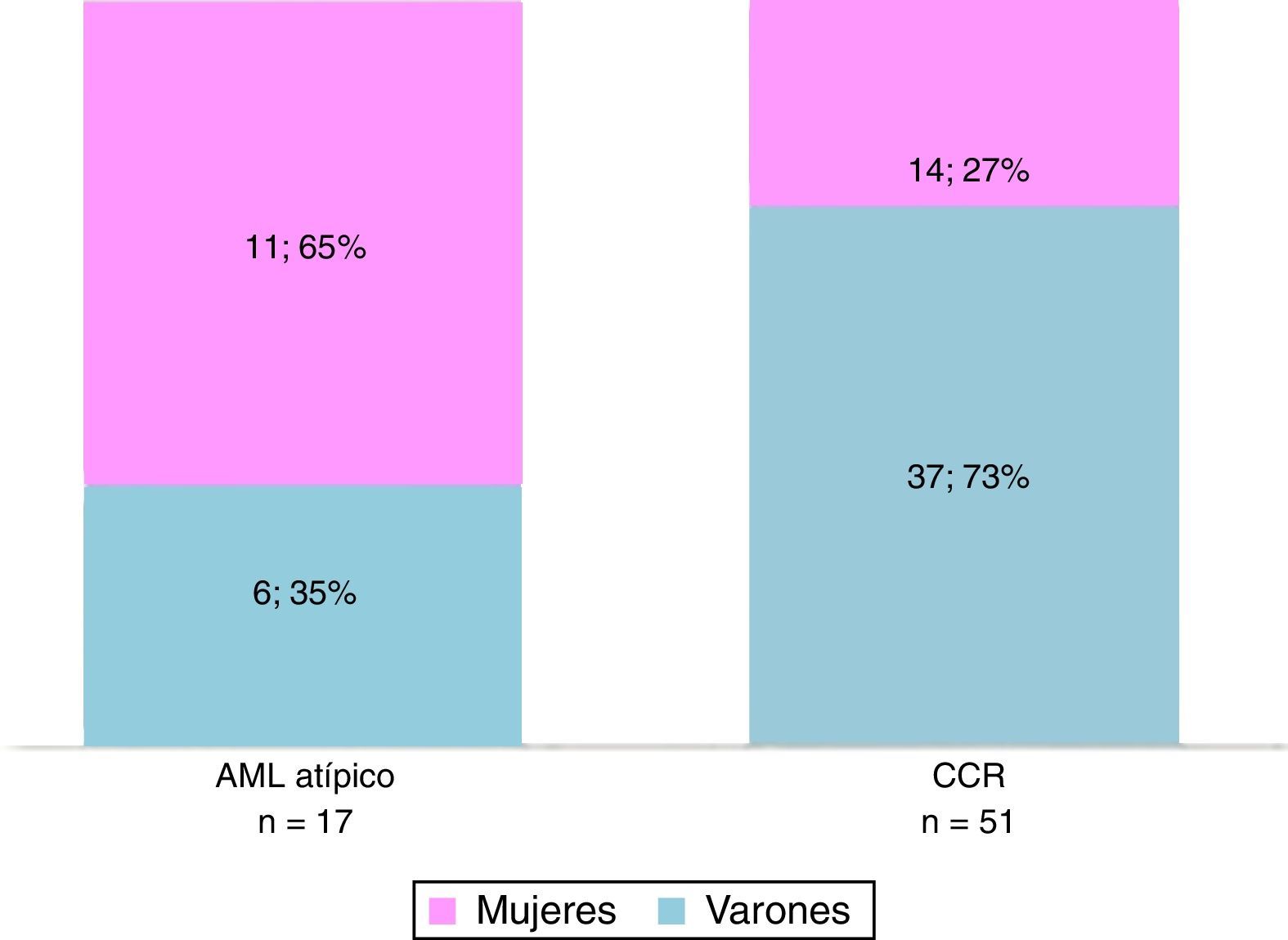
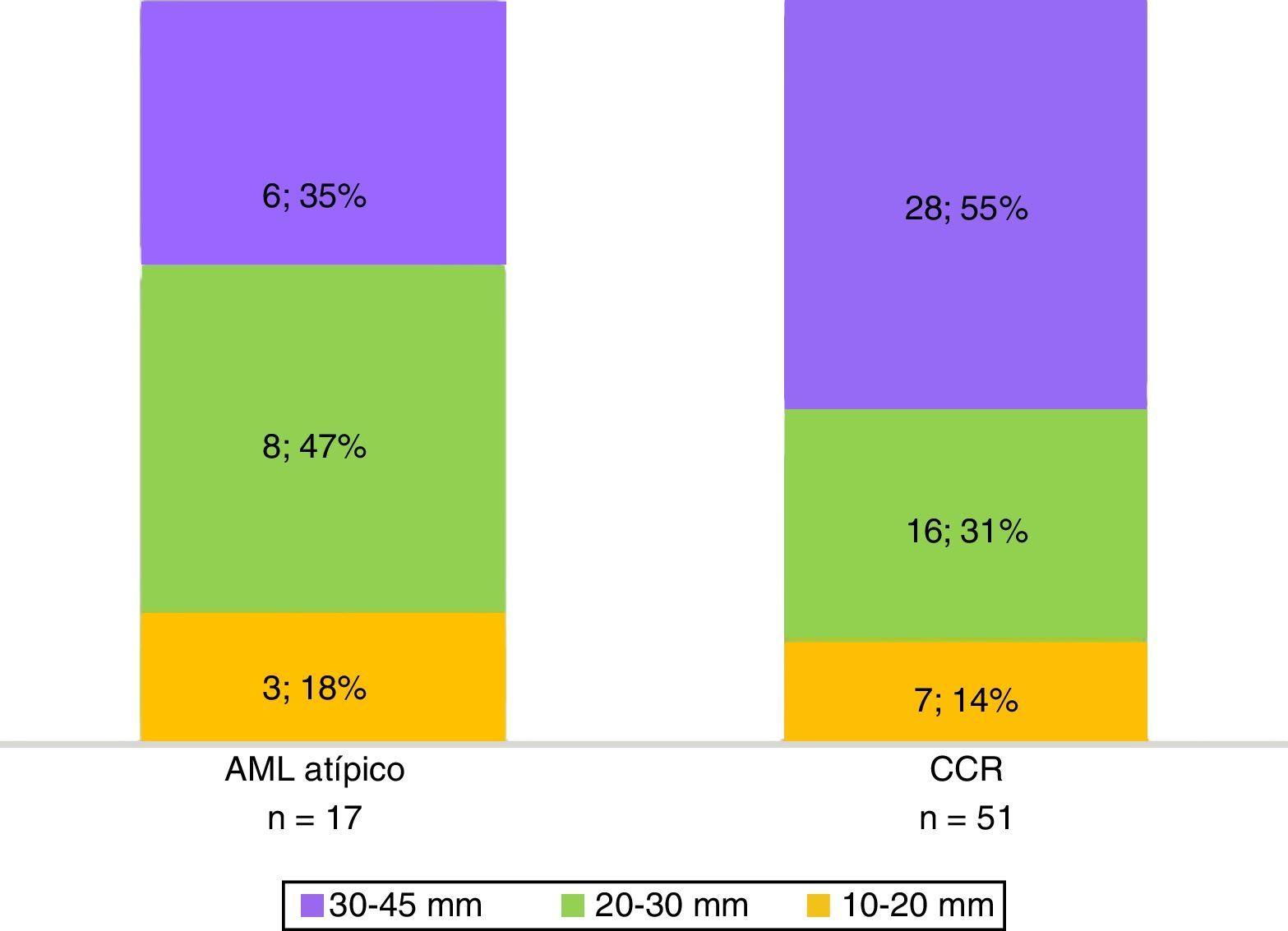
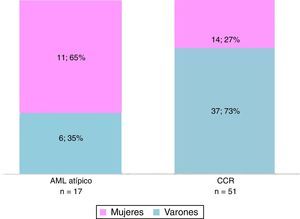
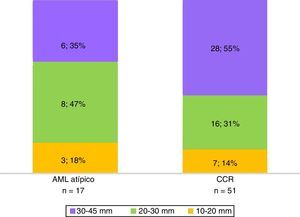
La histopatología diagnosticó 17 AML atípicos y 51 CCR. Hubo predominio de mujeres con AML atípicos (65% del total; n=11) y de hombres con CCR (73%; n=37) (fig. 1). En cuanto al tamaño, la mayoría de los CCR midió 30-45mm, mientras que los AML atípicos estuvieron entre los 20 y 30mm (fig. 2).
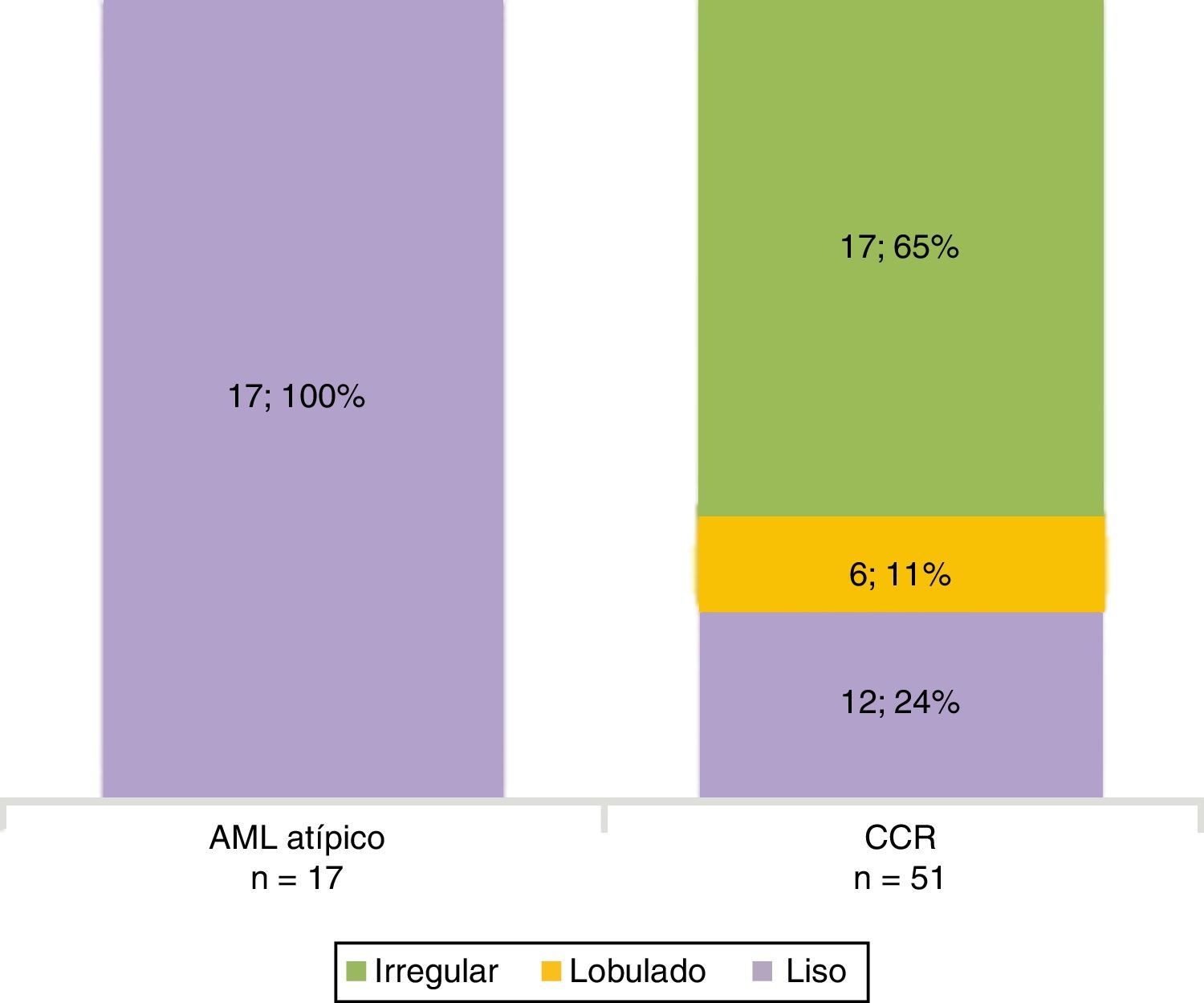
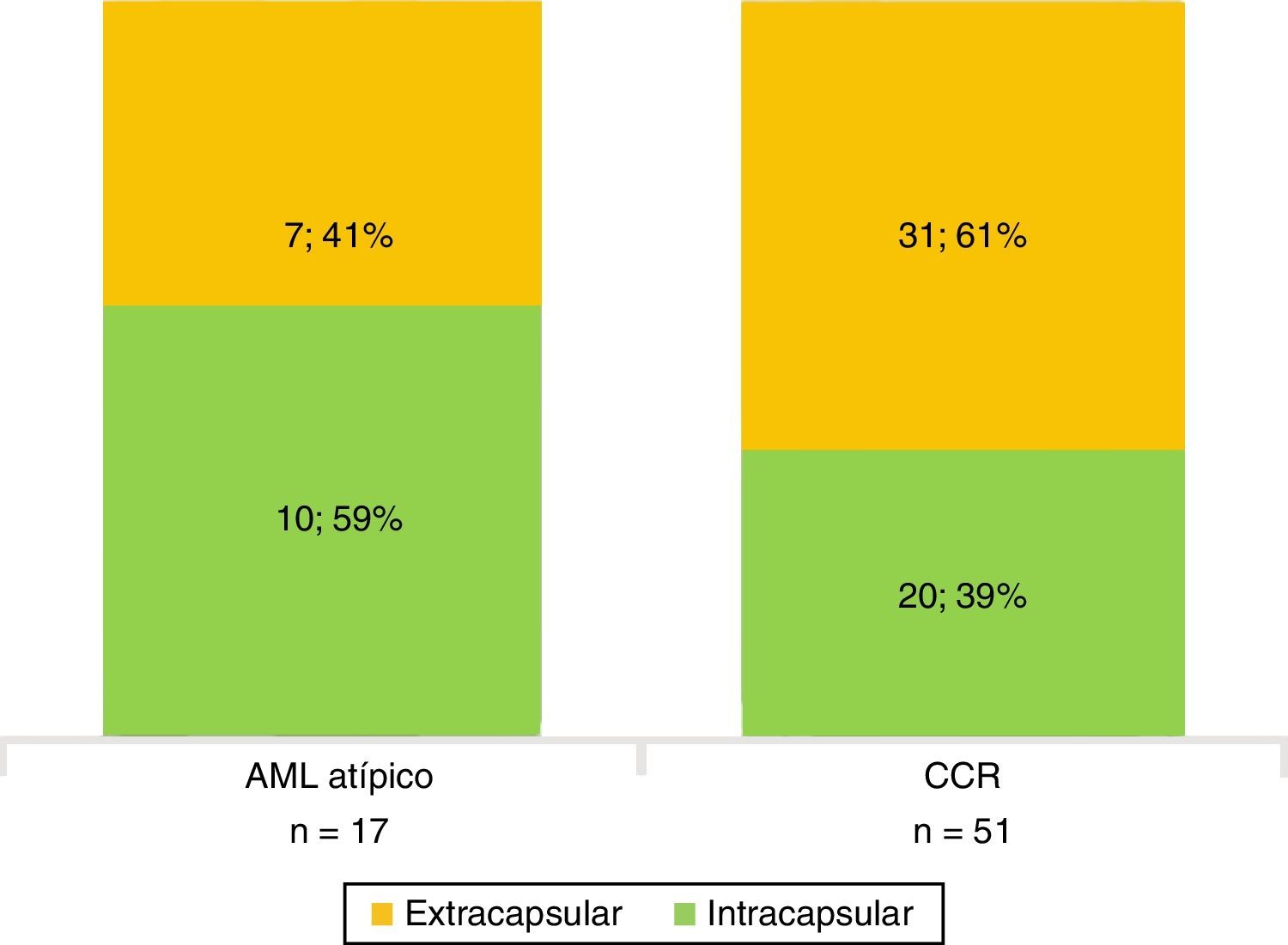
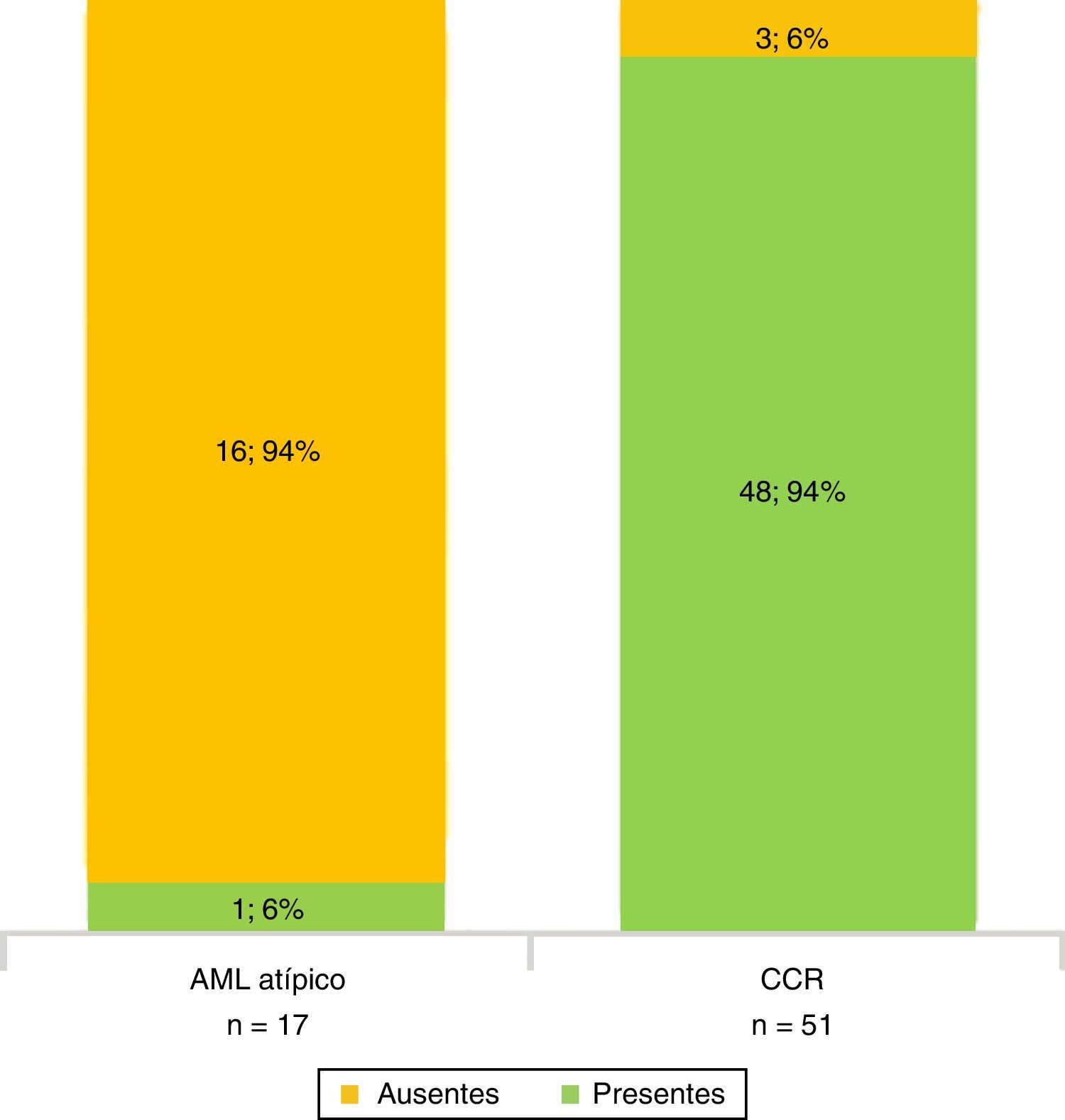
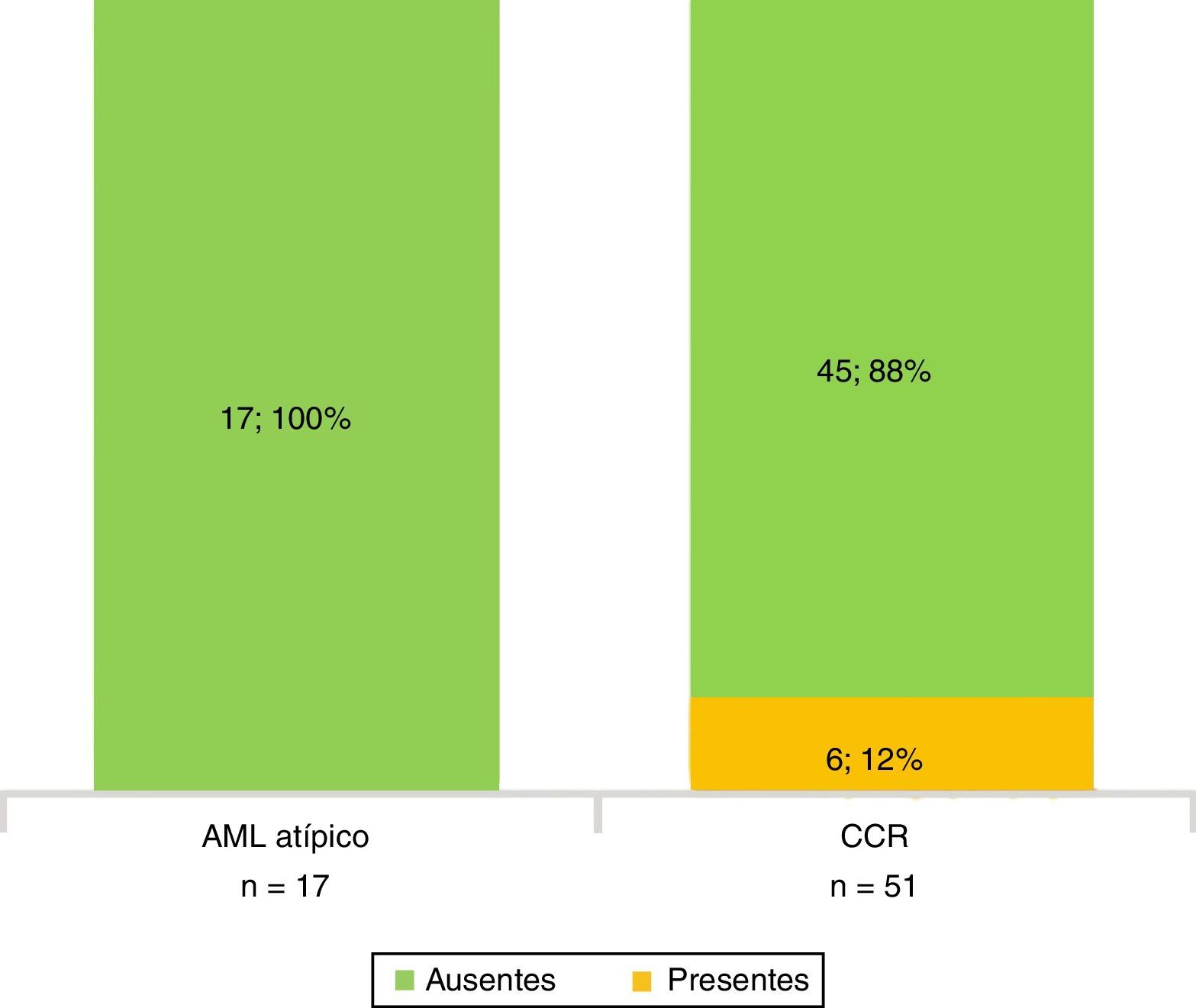
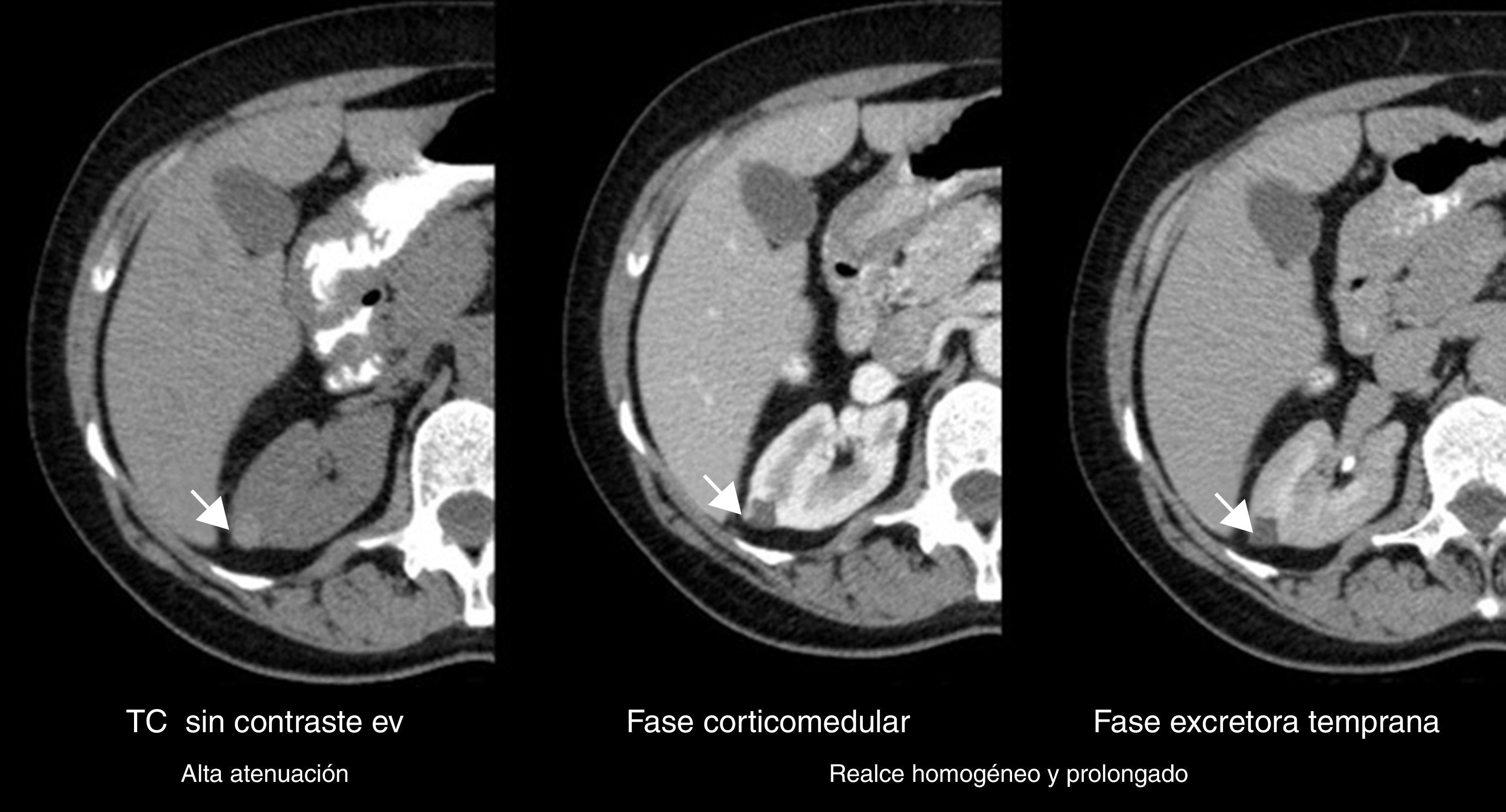
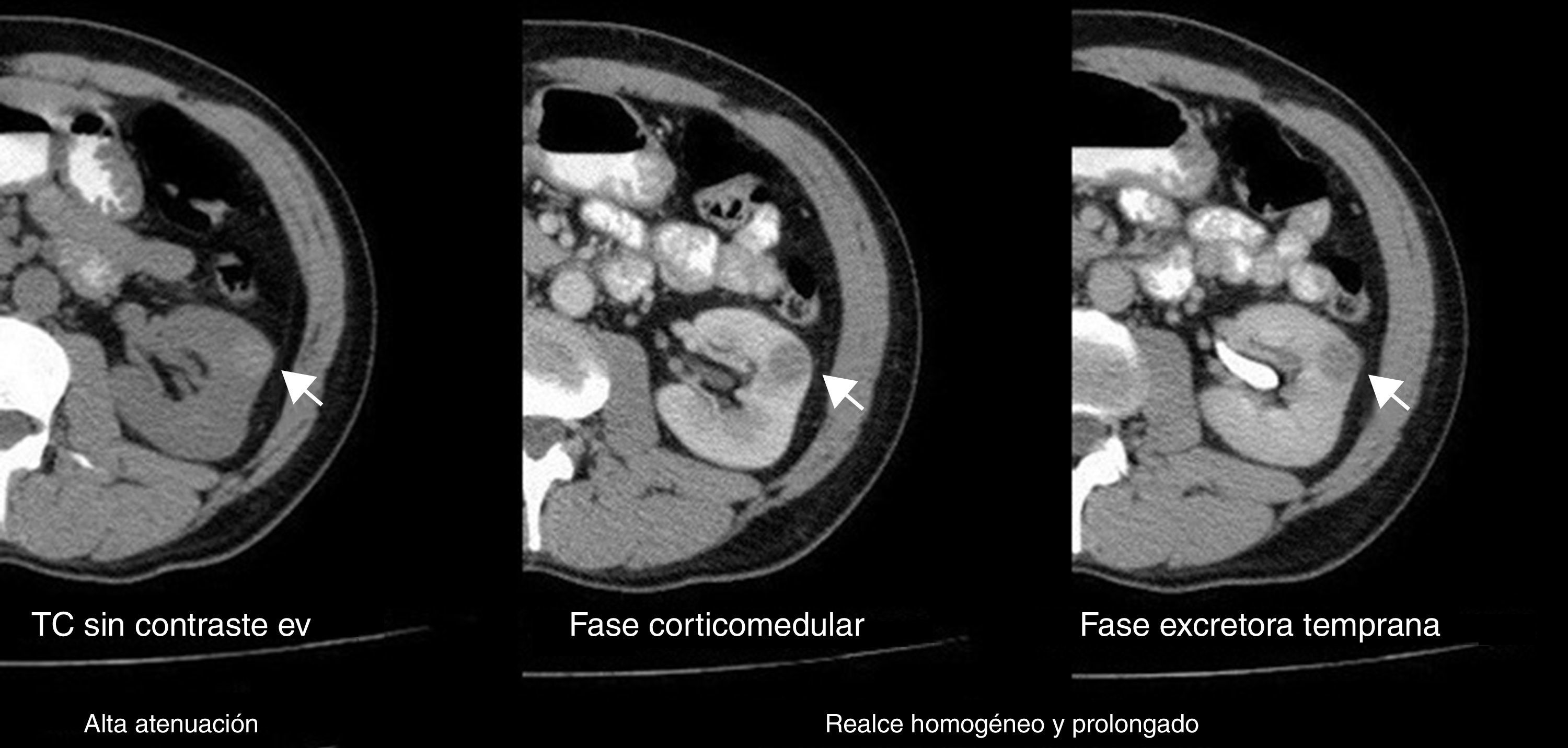
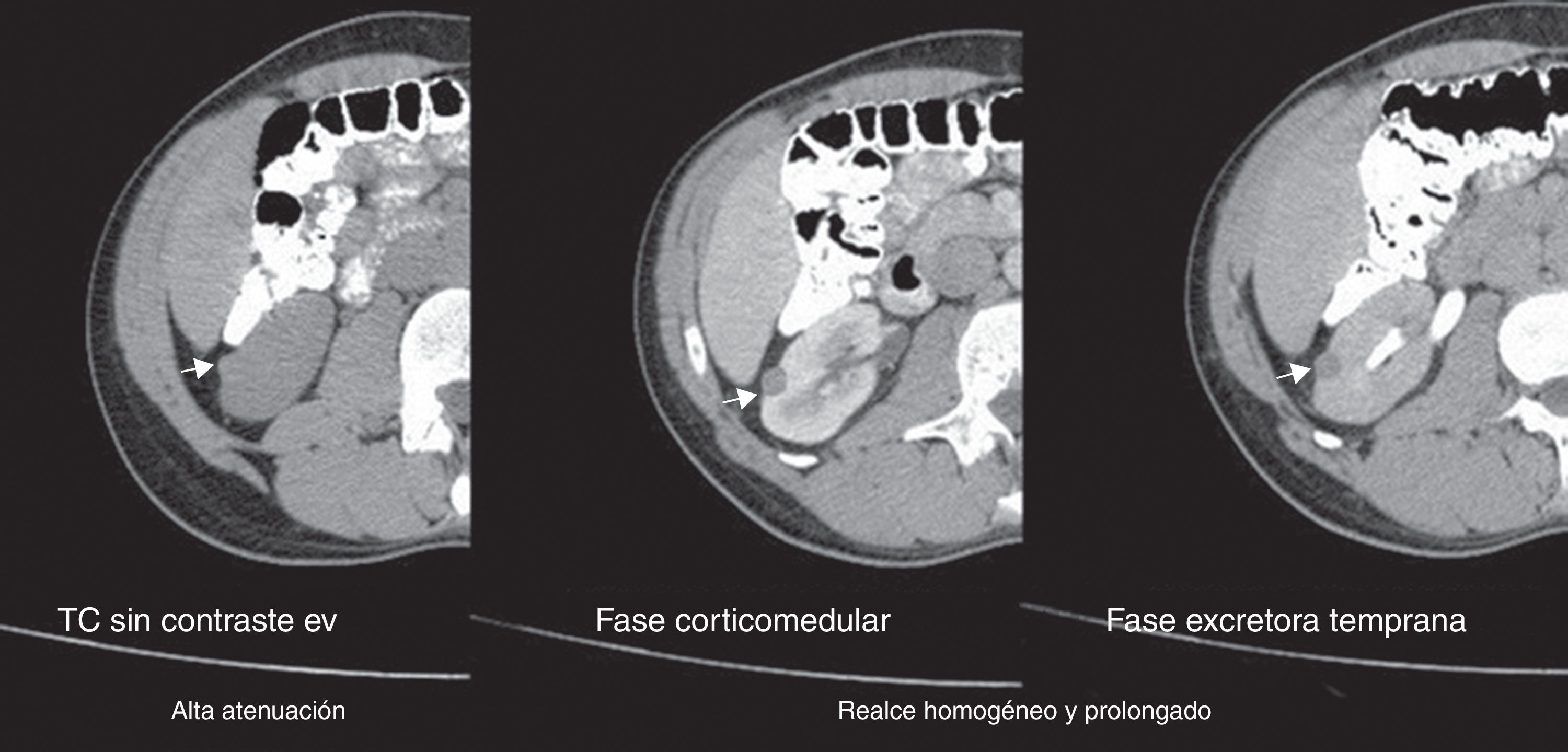
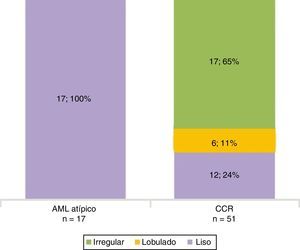
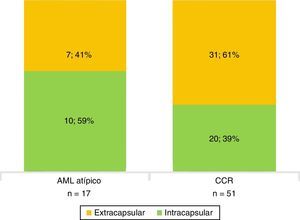
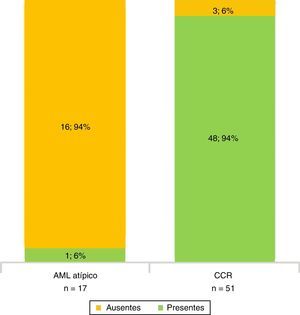
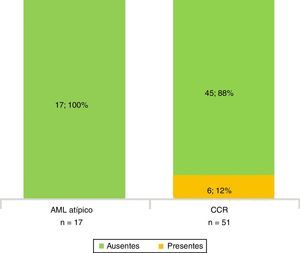
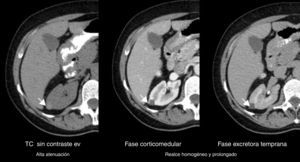
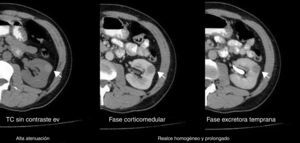
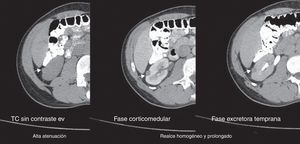
Todos los AML atípicos mostraron contornos lisos, calcificaciones intratumorales, localización intracapsular (65%) y ausencia de cambios perirrenales (94%); a la vez que la mayoría de los CCR reveló contornos irregulares (65%), localización extracapsular (61%), presencia de cambios perirrenales (94%) y ausencia de calcificaciones intratumorales (88%) (figs. 3-6).
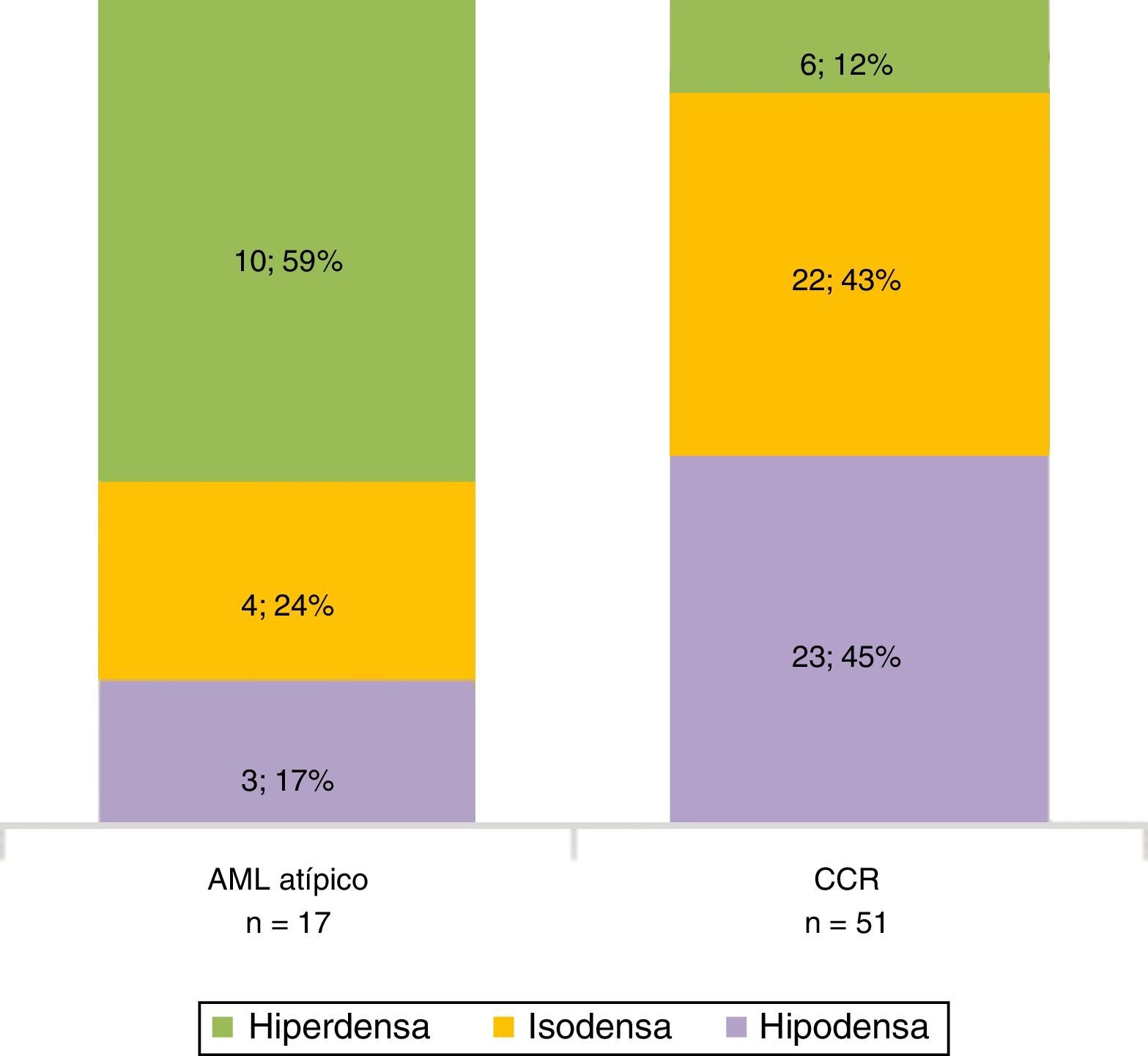
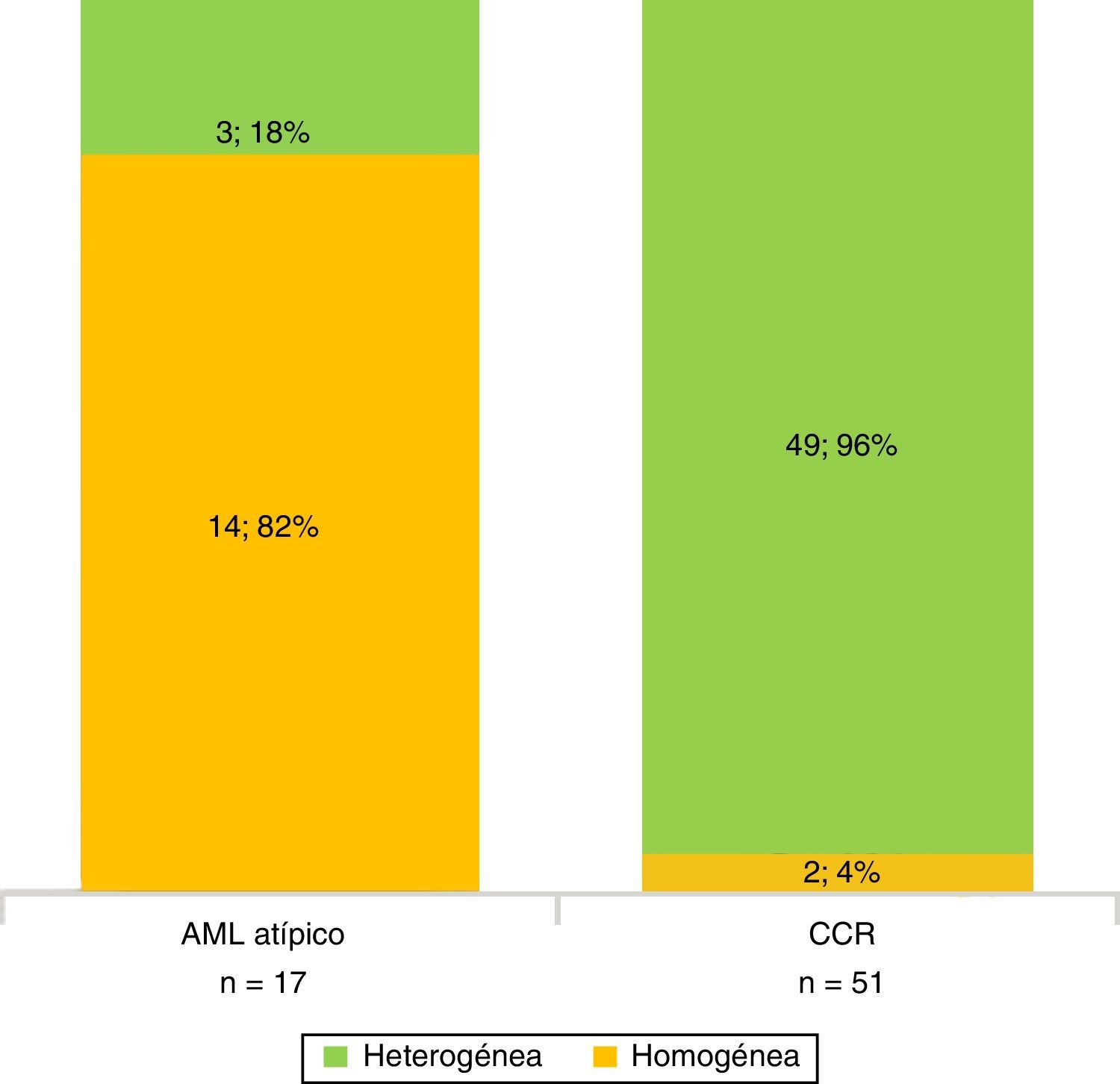
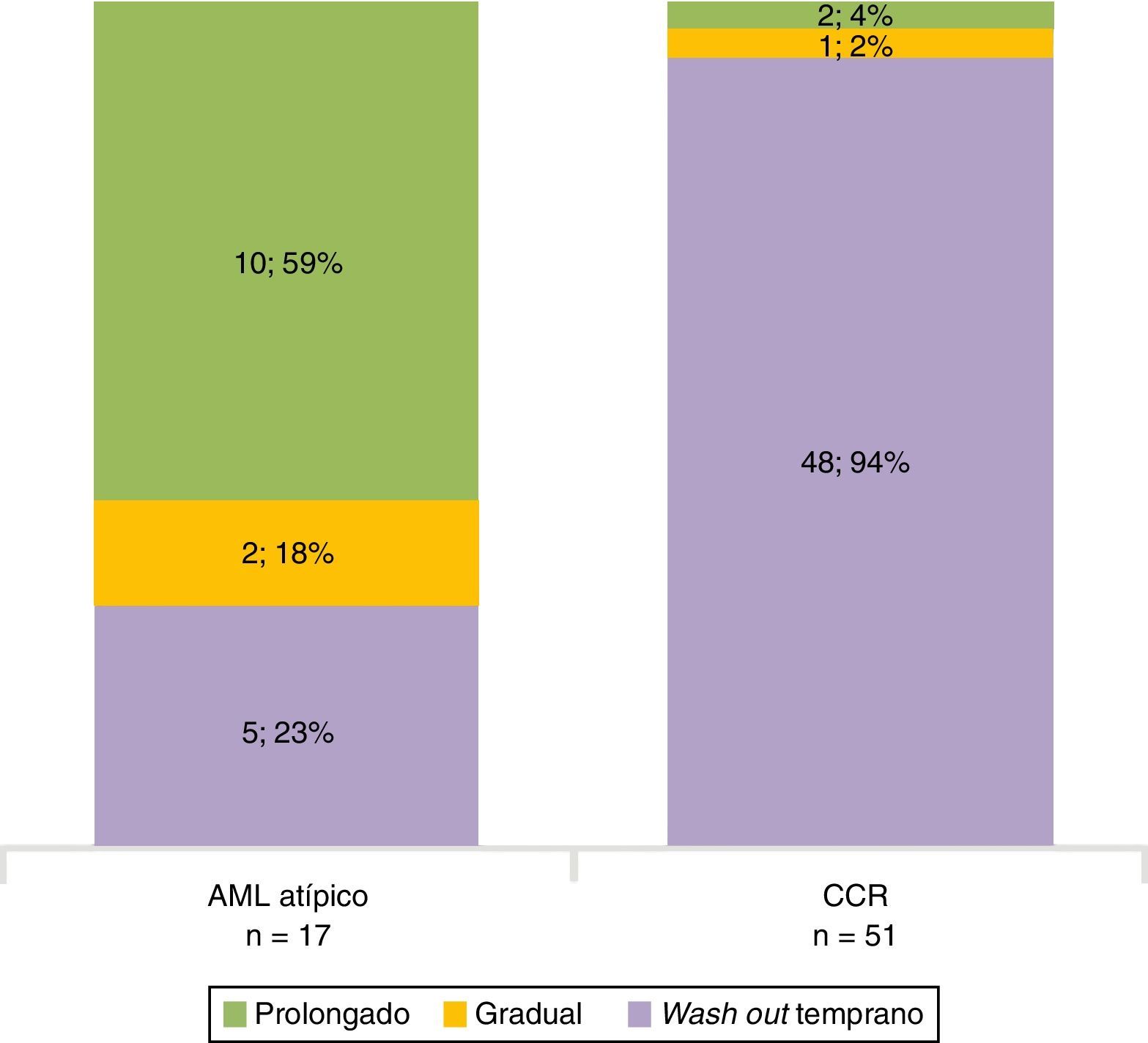
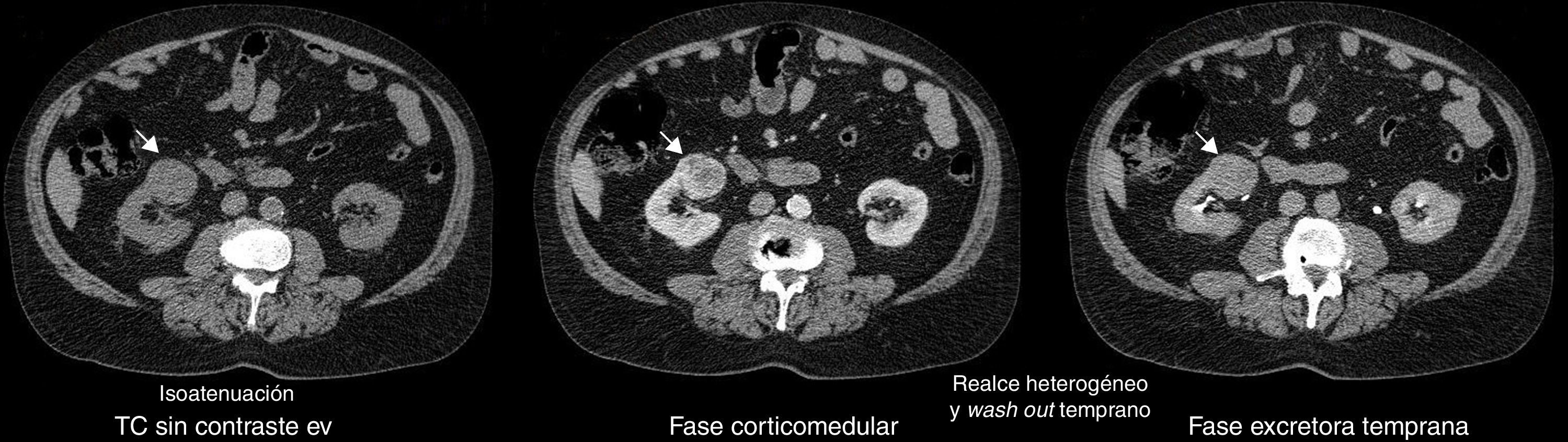
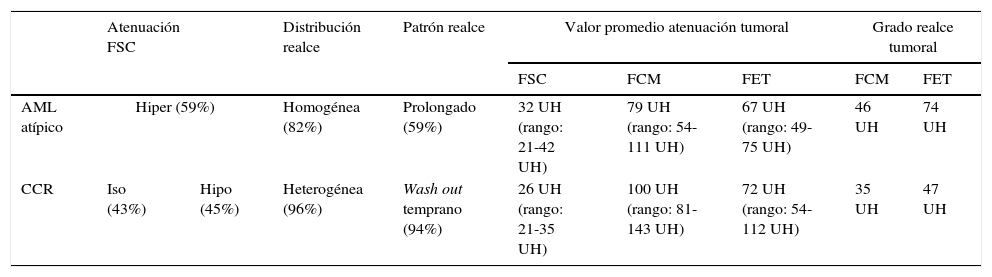
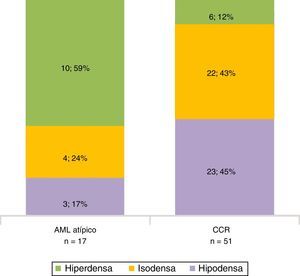
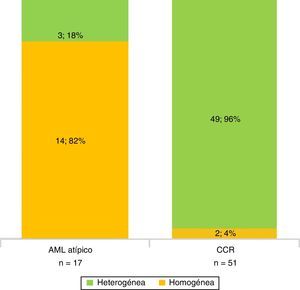
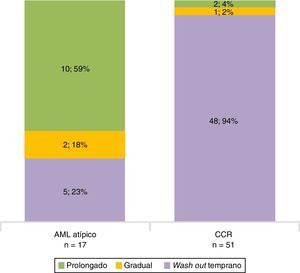
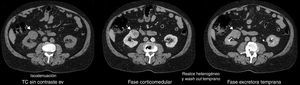
En la fase sin contraste, los AML atípicos fueron hiperdensos en el 59% de los casos y los CCR se mostraron iso o hipodensos en proporciones similares: 43% y 45%, respectivamente (fig. 7). Por su parte, en la fase poscontraste, los AML atípicos tuvieron un realce de distribución homogénea en el 82% y un patrón de realce prolongado en el tiempo del 59%; mientras que los CCR presentaron heterogeneidad en el 96% y un patrón de realce wash out temprano en el 94%.
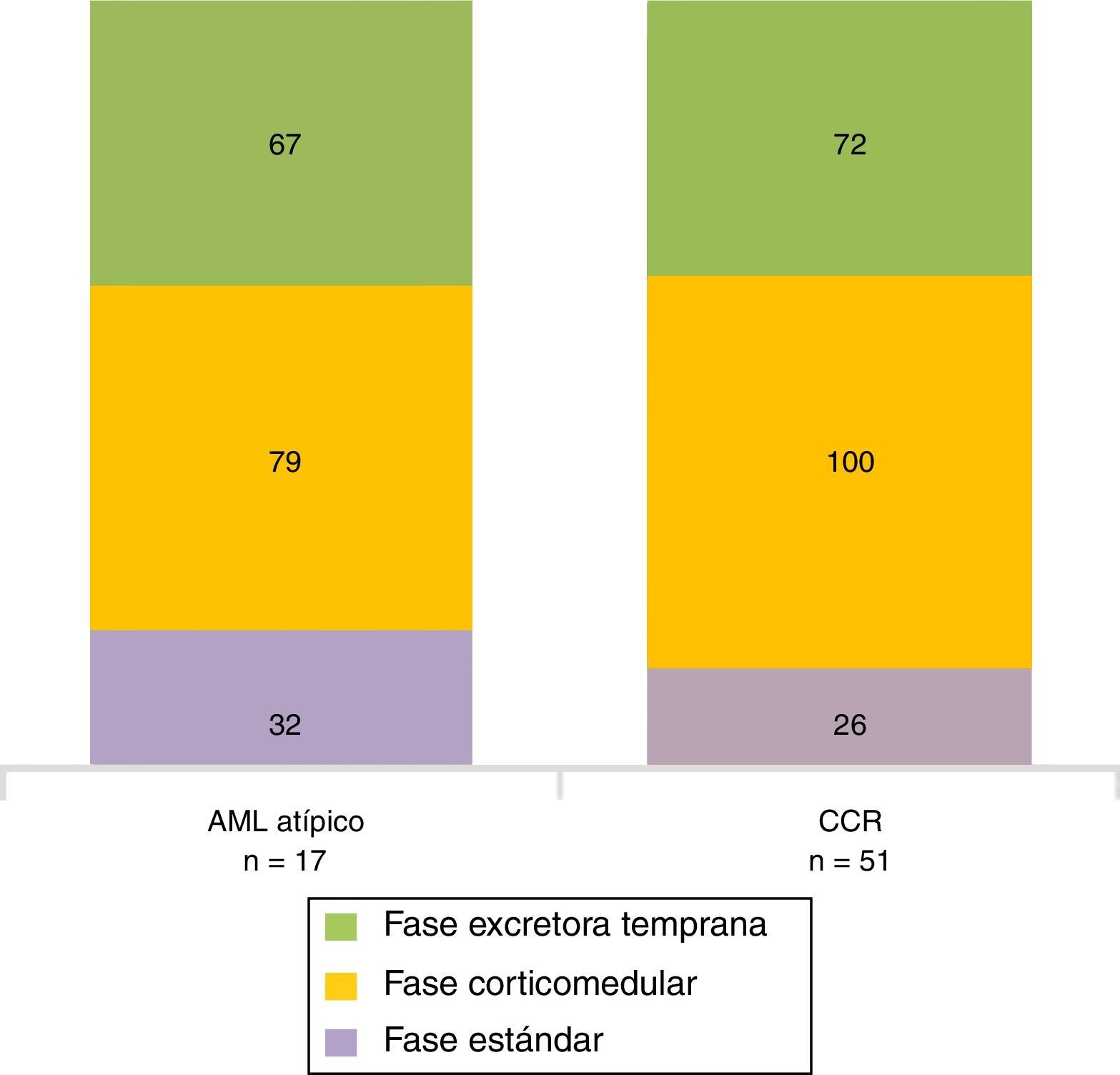
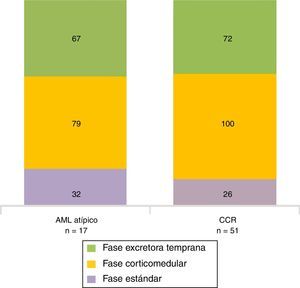
Para los AML atípicos, el valor promedio de atenuación tumoral en fase sin contraste fue de 32 UH (rango: 21-42 UH), en fase corticomedular de 79 UH (rango: 54-111 UH) y en fase excretora temprana de 67 UH (rango: 49-75 UH) (figs. 8 y 9). En lo que respecta a los CCR, estos tuvieron un valor promedio de atenuación tumoral en fase sin contraste de 26 UH (rango: 21-35 UH), en fase corticomedular de 100 UH (rango: 81-143 UH) y en fase excretora temprana de 72 UH (rango: 54-112 UH) (fig. 10).
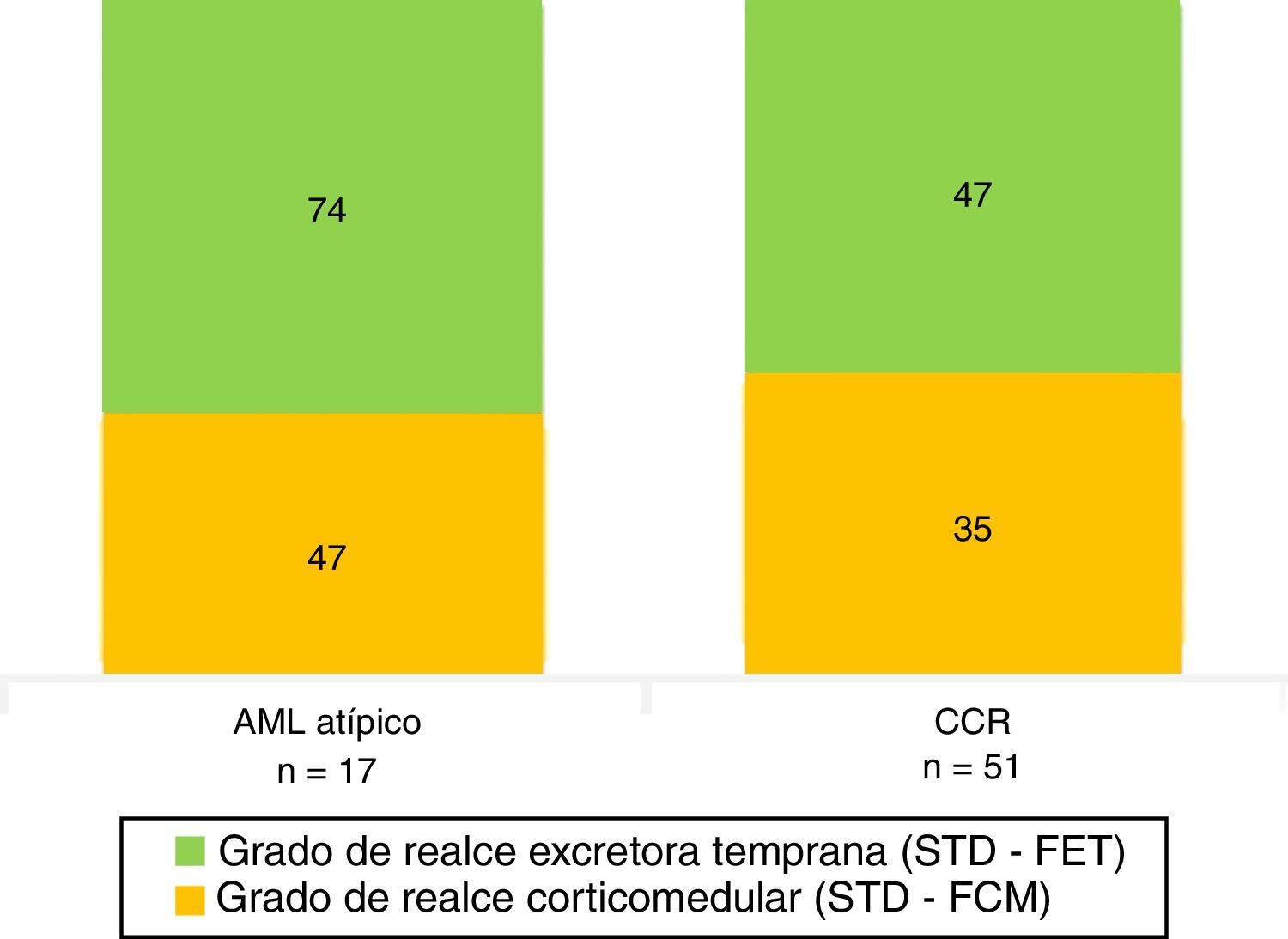
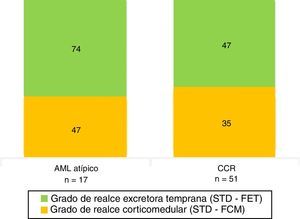
De acuerdo con la histología, el grado de realce tumoral evidenciado en fase corticomedular fue de 46 UH en los AML atípico y de 35 UH en los CCR. Además, hubo una notoria diferencia en el grado de realce en la fase excretora temprana entre los AML atípicos (74 UH) y los CCR (47 UH) (fig. 11; tabla 3).
Resultados de atenuación y el realce tumoral
| Atenuación FSC | Distribución realce | Patrón realce | Valor promedio atenuación tumoral | Grado realce tumoral | |||||
|---|---|---|---|---|---|---|---|---|---|
| FSC | FCM | FET | FCM | FET | |||||
| AML atípico | Hiper (59%) | Homogénea (82%) | Prolongado (59%) | 32 UH (rango: 21-42 UH) | 79 UH (rango: 54-111 UH) | 67 UH (rango: 49-75 UH) | 46 UH | 74 UH | |
| CCR | Iso (43%) | Hipo (45%) | Heterogénea (96%) | Wash out temprano (94%) | 26 UH (rango: 21-35 UH) | 100 UH (rango: 81-143 UH) | 72 UH (rango: 54-112 UH) | 35 UH | 47 UH |
FCM. fase corticomedular; FET: fase excretora temprana; FSC: fase sin contraste.
Las biopsias de las piezas quirúrgicas (nefrectomías parciales/totales) realizadas en el mismo centro revelaron AML atípico en 17 pacientes (26%) y CCR en 51 (74%). Estos 17 casos no diagnosticados preoperatoriamente habían tenido diagnóstico presuntivo de CCR sobre la base de hallazgos tomográficos, aunque posteriormente se consideraron AML atípicos por su histología. Los resultados imagenológicos por TCMD de los 17 AML atípicos fueron revisados.
De los 68 pacientes, 51 (74%) tenían CCR. En el examen histológico, 47 de estos mostraron células exclusivamente o predominantemente claras (fig. 12), mientras que los 4 restantes resultaron ser CCR papilares.
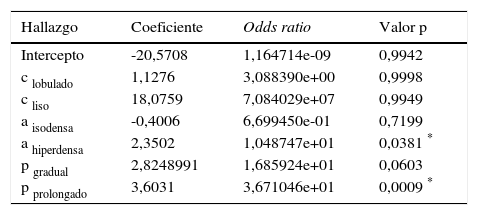
Los hallazgos tomográficos significativos fueron la atenuación tumoral hiperdensa en fase sin contraste y el patrón de realce prolongado en el tiempo. Es decir, la posibilidad (odds ratio) de que sea un AML atípico si hay atenuación tumoral hiperdensa en fase sin contraste fue de 10,49; pero si el patrón de realce era prolongado en el tiempo, la chance aumentaba a 36,71 (tabla 4).
Resultados del modelo de regresión logística múltiple
| Hallazgo | Coeficiente | Odds ratio | Valor p |
|---|---|---|---|
| Intercepto | -20,5708 | 1,164714e-09 | 0,9942 |
| c lobulado | 1,1276 | 3,088390e+00 | 0,9998 |
| c liso | 18,0759 | 7,084029e+07 | 0,9949 |
| a isodensa | -0,4006 | 6,699450e-01 | 0,7199 |
| a hiperdensa | 2,3502 | 1,048747e+01 | 0,0381 * |
| p gradual | 2,8248991 | 1,685924e+01 | 0,0603 |
| p prolongado | 3,6031 | 3,671046e+01 | 0,0009 * |
Luego se calculó la probabilidad de presentar un AML atípico por el valor de cada hallazgo tomográfico incluido en el modelo. Para cada una de estas posibilidades, se calculó la sensibilidad y especificidad, y se construyó la curva ROC con el objetivo de fijar el punto de corte óptimo para discriminar un AML atípico (fig. 13). Este fue de 0,9694, dado que maximiza la especificidad (0,9804) con una sensibilidad de 0,2941 y un valor de cociente de probabilidad positivo (razón de verosimilitud del test positivo) de 15.
Para una probabilidad preprueba de 0,25, es posible calcular la de posprueba a partir del cociente de probabilidad positivo. Si se desea establecer la posibilidad de que presente un AML atípico, el resultado es 0,83.
DiscusiónLos tumores del parénquima renal son un grupo de lesiones que pueden ser desde benignas a muy agresivas. En consecuencia, sus características morfológicas y el grado y patrón de realce varían significativamente según la arquitectura y el subtipo. Por ello, la caracterización de los tumores del parénquima renal mediante técnicas de imagen plantea sus dificultades33.
Si bien es importante diferenciar en la etapa prequirúrgica una MRS para planificar el tratamiento y asesorar al paciente, no existen criterios imagenológicos bien establecidos para clasificar sus subtipos histológicos. Por lo tanto, el diagnóstico definido en base a los resultados de la biopsia es un reto, en tanto puede ser difícil distinguir un CCRcr de un oncocitoma o un CCR con componente sarcomatoide de un AML con componente spindle6.
El AML atípico es la patología más importante de diferenciar del CCR mediante imágenes. En un estudio, el 6,9% de los pacientes sometidos a nefrectomía parcial por sospecha de CCR con un diámetro promedio de 2,3cm (rango: 1,2-4,3cm) tuvieron confirmación patológica de AML15. Esta entidad representa el 1% de todos los tumores renales que se exploran quirúrgicamente. Ocurren aislados o asociados a esclerosis tuberosa, y pueden hallarse incidentalmente en US o TC, o bien presentarse con dolor crónico, hemorragia retroperitoneal aguda, shock, masa palpable o hematuria16–18.
En la US son lesiones redondas u ovaladas, bien circunscritas y altamente ecogénicas (iso o hiperecoicas). Con respecto al seno renal, los AML típicos son hiperecogénicos, mientras que los atípicos presentan isoecogenicidad homogénea, por lo que debe considerarse como diagnóstico diferencial al CCR. Si bien es muy sugerente de AML, la hiperecogenicidad de una masa intrarrenal no es patognomónica, así que la TC debe confirmar la presencia de grasa y excluir un CCR potencialmente curable14,17,20.
En cuanto a la TC, el AML típico posee grasa suficiente para ser reconocido y, por lo general, el CCR puede descartarse. En fase sin contraste es una MRS hipodensa por la presencia de grasa macroscópica (similar a la grasa normal subcutánea o retroperitoneal) con valores de atenuación negativa (entre -10 y -120 UH), y dentro de ella se intercalan elementos con densidad de tejidos blandos en forma de estriaciones, que representan músculo liso, vasos sanguíneos o hemorragias. Algunos autores consideran que los valores absolutos de TC son relativamente fiables debido a que pueden estar afectados por factores, como parámetros de análisis (kilovoltios y miliamperios), orientación del ROI y valores de TC de los tejidos circundantes. En las fases poscontraste, estas lesiones muestran realce12,14–20,34.
Asimismo, los AML atípicos son de difícil diagnóstico por TC debido a la imposibilidad de demostrar grasa intratumoral (por ausencia de grasa macroscópica o presencia de mínimas cantidades). Esta puede pasar inadvertida si no se evalúan meticulosamente todas las masas renales sólidas, además de que resultan indistinguibles de otras neoplasias renales (incluyendo al CCR), lo que lleva a una cirugía innecesaria con diagnóstico anatomopatológico posterior de AML atípico. En estos casos, si se revisa retrospectivamente la TC preoperatoria correspondiente, se visualiza una masa renal sin grasa con realce. En la TC en fase sin contraste son siempre hiperdensas en relación con el parénquima renal, mientras que poscontraste muestran un realce homogéneo y prolongado, que evidencia grandes paquetes vasculares o contenidos fibromusculares relevantes; o por el contrario no revelan realce, en proporción al acúmulo de grasa y la minorización del patrón de vasos (todos hallazgos inespecíficos para un diagnóstico certero de AML atípico).
La grasa no es detectable en las imágenes axiales por quedar oculta por la hemorragia intratumoral, estar compuesta principalmente por tejido muscular, vascular o graso inmaduro, o por la dispersión de una pequeña cantidad de grasa dentro de otros componentes.
El papel más importante del radiólogo es diferenciar la entidad del CCR y otros tumores malignos mediante la TC prequirúrgica, de forma no invasiva y certera, siendo vital para determinar las estrategias terapeúticas, ya que en los AML asintomáticos la conducta es conservadora (observación), mientras que en el CCR, según su tamaño y ubicación, el manejo es quirúrgico (nefrectomía radical o parcial) o se procede a la embolización angiográfica8,12,14–16,18–22,35–37.
En la RM, el AML típico es hiperintenso en ponderación T1 sin contraste por su componente graso, con señal similar a la grasa perirrenal en secuencias ponderadas en T2; mientras que los atípicos son hipointensos en ponderación T2 con descenso focal o difuso notable en la intensidad de señal en las fases opuestas por componente graso. Esto no indica necesariamente un AML, ya que algunos CCRc también pueden mostrar estas características debido a la presencia de abundante grasa microscópica17,22,26,29,38. De todos modos, existen algunas particularidades imagenológicas que diferencian al CCR del AML tanto en fase sin y con contraste endovenoso.
En múltiples trabajos se comprobó la escasez o ausencia de grasa en ciertos AML definidos histológicamente, por lo que esos autores recomiendan que, ante la sospecha de una pequeña cantidad de grasa en una MRS, se use la TC adaptando la colimación y el avance de la mesa para obtener un espesor de corte eficaz (1,5-5mm). Al respecto, algunos proponen registrar en etapa precontraste el valor de atenuación (muestreo de UH mediante ROI) si es necesario, mientras que otros sugieren un estudio multifásico para la detección12,14,17–19,37,39.
Sant et al.36 determinaron que un coeficiente de atenuación negativa es característico del AML renal con elementos adiposos maduros, mientras que una positiva, a pesar de ser sugestiva de CCR, también puede encontrarse en los AML con escasez de grasa madura o alta proporción de grasa fetal inmadura. Para identificar esta última, la TC tiene una incapacidad relativa, por lo que puede ser una limitación para el diagnóstico preoperatorio de AML.
El coeficiente de atenuación positiva del AML atípico puede explicarse si se considera la fracción de materia grasa entre el 5-15% de la cantidad total del tumor y/o la proporción de adipocitos fetales o inmaduros con respecto a la grasa madura36,40. Al respecto, Winkler considera que una fracción de materia grasa superior al 50% permite un diagnóstico confiable de AML típico41.
En lo referente a la fase sin contraste, en nuestro estudio se encontró como hallazgo tomográfico significativo la atenuación tumoral hiperdensa para AML atípico (figs. 14-16).
El realce tumoral entre AML y CCR también ha sido comparado. Con respecto a la utilidad de las fases en la detección de MRS, esta varía según los distintos autores. Para algunos, la nefrográfica es superior por el realce máximo y homogéneo del parénquima, mientras que este es más difícil en la corticomedular y la excretora temprana8,12,42. Otros, como Smith et al., detectaron un 20-30% más de MRS mediante la fase excretora temprana que usando la corticomedular; pero una revisión encontró una sensibilidad comparable en la detección de MRS tanto en la fase corticomedular como en la excretora temprana8,42–44. Al respecto, Cohan et al.45 detectaron 1,5 veces más MRS, al interpretar juntas las imágenes en fase sin contraste y en fase nefrográfica que aquellas en fase sin contraste y fase corticomedular. En cuanto a Millet et al.31, ellos determinaron la inexistencia de criterios tomográficos, morfológicos o de realce útiles para diferenciar MRS pequeñas malignas y benignas.
En lo referente al valor de atenuación y el patrón de realce para diferenciar estos tumores también hay discrepancias. En nuestra experiencia el hallazgo tomográfico significativo fue el patrón de realce prolongado en el tiempo para el AML atípico. Además el CCRc, mostró un realce superior a 81 UH en la fase corticomedular y a 54 UH en la fase excretora temprana, en concordacia con Kim et al.46
En el trabajo de Hosokawa et al.39, los tumores renales hiperdensos en fase sin contraste, con moderado realce y sin mostrar componente graso, sugirieron un AML atípico; mientras que Pierorazio et al.7 determinaron que una MRS pequeña con realce alto y temprano tiene mayor probabilidad de ser CCRc que un oncocitoma, un CCRcr, un AML o un CCRp. En su estudio, al igual que en nuestra serie (fig. 17), el aumento de los valores de realce durante la fase corticomedular aumentó la probabilidad de CCRc. Por el contrario, y en discordancia con nuestros resultados (28%), Bird et al.47 demostraron que los CCRc mostraron un wash out del 50%.
Como en otras publicaciones, nosotros incorporamos características morfométricas y de realce para proporcionar pistas sobre la histología tumoral. Si bien Pierorazio et al.7 no lograron establecer su utilidad, posiblemente por el pequeño tamaño muestral o por reflejar diferencias en la biología de las MRS pequeñas (generalmente más homogéneas) y grandes incluidas en estudios previos, en el presente trabajo casi todos los AML atípicos mostraron contornos lisos, localización intracapsular, ausencia de cambios perirrenales y de calcificaciones intratumorales, mientras que los CCR revelaron en su mayoría contornos irregulares, localización extracapsular, presencia de cambios perirrenales y ausencia de calcificaciones intratumorales1,5,7,46,48.
Entre las fortalezas de nuestro estudio cabe mencionar la estricta aplicación de un protocolo de TC estandarizado (tiempo de adquisición y técnica), que evitó factores extrínsecos que modificaran los resultados. Además, al igual que Zhang et al.6, se minimizaron los efectos de volumen parcial de las zonas con cambios quísticos o necróticos, reflejando así la verdadera vascularización tumoral mediante la medición de las áreas de mayor realce en MRS heterogéneas, en lugar de la totalidad del tumor.
A su vez, la mayoría de los análisis incluyen solo tumores malignos o subgrupos de estos, mientras en el nuestro tuvimos en cuenta los malignos y benignos, como Jinzaki et al. (aunque su cohorte de pacientes fue relativamente pequeña [n=40])2,6.
En contrapartida, como limitación de nuestro trabajo se destaca la pequeña cantidad de casos, a pesar de que otras series han tenido la misma falencia por la rareza de los AML atípicos14,20. En segundo lugar, se puede señalar que, aunque no se proporcionaron los datos patológicos a nuestros radiólogos, este estudio idealmente se llevó a cabo de una manera prospectiva y verdaderamente cegada. También se debe resaltar el carácter retrospectivo del estudio y el porcentaje de lesiones malignas (88%) posiblemente un poco más alto que en la población general debido a que nuestra institución es un centro de referencia terciario para pacientes oncológicos. Sin embargo, incluso en la población general, la incidencia de lesiones renales malignas es mucho mayor que la de las lesiones benignas sólidas.
Por último, no podemos dejar de subrayar que en nuestra muestra hubo una cantidad relativamente pequeña de lesiones benignas, y otras histologías de masas renales pequeñas benignas que no se incluyeron.
ConclusiónLa TC helicoidal trifásica es la modalidad estándar para evaluar las MRS menores de 4cm. Sirve para diferenciar el AML atípico del CCR, siendo los hallazgos tomográficos más valiosos la atenuación tumoral hiperdensa sin el contraste endovenoso y el patrón de realce prolongado.
No obstante, estudios futuros deberán incluir poblaciones más grandes, mediciones prospectivas multiobservador y mejoras en el valor real de los patrones de realce en la predicción de diagnósticos histológicos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.