El objetivo del presente estudio fue evaluar la producción de blastosporas y conidios de diferentes aislados nativos de México del hongo entomopatógeno Isaria fumosorosea y de una cepa de colección mediante diferentes técnicas de propagación. En la producción de blastosporas se utilizaron 2 medios de cultivo líquidos (sumergidos), uno a base de casaminoácidos y el otro a base de peptona de colágeno como fuentes de nitrógeno, con glucosa como fuente de carbono en ambos. Para la producción de conidios, los hongos se cultivaron en agar papa dextrosa, a partir de esos cultivos se prepararon suspensiones de 1×106 conidios/ml para inocular matraces con caldo dextrosa Sabouraud, para iniciar así la fase líquida del cultivo bifásico, denominado también precultivo. Posteriormente con el precultivo y las suspensiones de conidios se inocularon bolsas con granos de arroz, que se incubaron durante 14 días para el cultivo bifásico y para la fermentación sólida, respectivamente. El aislado HIB-23 fue el que logró la más elevada concentración de blastosporas obtenida en el cultivo sumergido: 4,90×108 blastosporas/ml en el medio casaminoácidos; y en el medio con peptona de colágeno se obtuvieron 2,15×108 blastosporas/ml. La máxima producción de conidios en fermentación sólida la logró la cepa Pfr-612 (1,58×109 conidios/g), mientras que la máxima en cultivo bifásico correspondió al aislado HIB-30 (9,00×106 conidios/g). La fermentación sólida resultó ser el método más efectivo, con un promedio de 1,09×109 conidios/g, mientras que el cultivo bifásico fue el menos efectivo, con un promedio de 2,76×106 conidios/g. Para la producción de blastosporas en los medios sumergidos no se obtuvo diferencia significativa alguna.
The aim of this study was to evaluate the production of blastospores and conidia of different native isolates and a strain of Isaria fumosorosea using different propagation techniques. Two liquid culture media of casamino acids and peptone as nitrogen sources and glucose as carbon source for both media cultures were respectively used in the production of blastospores, while for the production of conidia, the fungi were grown in potato dextrose agar; from these cultures, solutions of conidia to a concentration of 1×106 per milliliter were prepared to inoculate flasks with Sabouraud dextrose broth for the liquid phase of the biphasic culture, also known as preculture. Subsequently, rice grain bags were inoculated with the preculture and the conidia solutions, which were incubated for 14 days for solid fermentation and biphasic culture, respectively. The HIB-23 isolate recorded a concentration of 4.90×108 blastospores/ml in the casamino acid medium, while a concentration of 2.15×108 blastospores/ml was obtained in the peptone collagen medium. For the Pfr-612 strain, the conidia production in solid-state fermentation was 1.58×109 conidia/g, and for HIB-30 in the biphasic culture of 9.00×106 conidia/g. Solid-state fermentation proved to be the most effective method with an average of 1.09×109 conidia/g, whereas the biphasic culture was the least effective method with 2.76×106 conidia/g; no significant difference was reported for the submerged production media.
En las últimas décadas, los hongos entomopatógenos se han convertido en una alternativa importante en la conformación de un espectro más amplio de insecticidas, dentro de los esquemas contemporáneos de manejo de insectos plagas21,26,33. Recientemente, el enfoque de la investigación sobre estos hongos se aceleró y ha generado 2 líneas principales: en primer término, el estudio de la biología molecular, la genómica y la proteómica de los entomopatógenos; en segundo lugar, el uso práctico de estos agentes en los planes de manejo de plagas de insectos.
Dentro de ese segundo enfoque, Isaria fumosorosea ocupa un lugar destacado como uno de los hongos entomopatógenos más conocidos a nivel mundial, con una amplia distribución geográfica (incluyendo zonas templadas y tropicales) y un extenso rango de hospederos, lo cual lo hace un agente de interés para el desarrollo de métodos de control biológico22,38.
I. fumosorosea produce principalmente dos tipos de propágulos: conidios y blastosporas17. Los conidios aéreos comprenden el principal ingrediente activo de los micoinsecticidas, por ser uno de los propágulos más viables empleados en programas de biocontrol7,19. Estos cuerpos especializados se caracterizan por poseer una gruesa pared exterior, constituida por 3 capas que protegen el interior de la espora. Esta gruesa pared se diferencia de la pared celular de las células vegetativas del hongo, que son mucho más delgadas y no están formadas por capas constitutivas, como las esporas. La ventaja para la espora de poseer una pared celular gruesa es que esa pared la aísla del medioambiente y le permite sobrevivir en condiciones adversas, manteniéndola en latencia hasta que las condiciones sean propicias para la germinación1. Por su parte, a las blastosporas se las considera una forma levaduriforme; estas son más sensibles a la desecación y tienden a morir más rápidamente que los conidios17. Sin embargo, diversos estudios han demostrado que las blastosporas son más efectivas que los conidios aéreos para el control de insectos como moscas blancas, áfidos y escarabajos, por mencionar solo algunos3,32,36.
La producción de estos propágulos depende de diversos factores, como los métodos y los medios de cultivo utilizados, así como del tipo de vegetal afectado y del insecto blanco. Respecto de las necesidades nutricionales de los hongos, estas comprenden principalmente fuentes de carbono y de nitrógeno, ya que los hongos requieren estos nutrientes durante la esporulación. La glucosa es la fuente de carbono más ampliamente utilizada por los hongos, la fructosa y la manosa se ubicarían a continuación; también pueden utilizar otros compuestos, entre ellos galactosa, sacarosa, lactosa, maltosa, trehalosa, además de polisacáridos como almidón, celulosa, pectina15, quitina16, sorbitol y manitol4. Por otra parte, después del carbono y del oxígeno, el nitrógeno es el elemento más abundante en las células de los hongos, y es uno de los nutrientes más caros en el medio de fermentación37.
La identificación de fuentes de nitrógeno de bajo costo es fundamental en el desarrollo de un medio adecuado de producción para un biopesticida. El nitrógeno se puede encontrar en fuentes orgánicas complejas, como semillas de algodón y harinas de soya, que son generalmente más económicas que los compuestos de nitrógeno altamente refinados, como los hidrolizados ácidos y enzimáticos de caseína o de soya, o las proteínas de la carne27.
I. fumosorosea ha sido desarrollada en cultivo líquido o sumergido2,5,17,27, en cultivo bifásico28 y en una amplia variedad de sustratos naturales5,10. Respecto de las técnicas de propagación, estas varían considerablemente. Una gran cantidad de ellas están basadas en fermentaciones sobre un sustrato sólido con granos de cereales; otras usan sustratos no nutritivos, como gránulos de arcilla. Otras tecnologías se desarrollan en tanques de fermentación para obtener productos a base de micelio, blastosporas o conidios sumergidos. En general, los tipos de cultivo más comúnmente utilizados en la producción de hongos se pueden clasificar en cultivos bifásicos y cultivos líquidos agitados o fermentaciones líquidas. En los sistemas bifásicos se desarrolla el inóculo en cultivo líquido agitado y luego se pasa al soporte sólido. En este tipo de cultivo es importante siempre optimizar la fase líquida, para que promueva un rápido crecimiento del aislado. Es el más utilizado en el mundo, ya que se obtienen estructuras infectivas de alta calidad y se acorta el tiempo cuando la fase líquida es en agitación19.
Se dispone de un amplio rango de sustratos sólidos para su uso en la producción de hongos entomopatógenos destinados al control biológico. La selección del sustrato depende de varios factores, incluyendo la disponibilidad, los costos y la adaptabilidad de cada aislado. Por su parte, los cultivos líquidos poseen un alto grado de automatización del proceso, son muy rápidos y tienden a formar abundantes blastosporas. Una de las ventajas de estos sistemas radica en el óptimo aprovechamiento de los nutrientes y en los bajos niveles de contaminación20.
En años recientes, en México y en general en el continente americano se ha hecho extensiva la presencia del psílido asiático de los cítricos, Diaphorina citri, un insecto vector de una de las enfermedades más devastadoras a escala mundial, el huanglongbing, causante de grandes pérdidas en la industria citrícola14. Debido a esto, los esfuerzos se han centrado primariamente en el control del vector con el uso de diferentes estrategias, una de ellas es el uso de hongos entomopatógenos, específicamente de I. fumosorosea, por la facilidad de producir sus estructuras infectivas en una amplia variedad de sustratos, como ya se describió anteriormente31.
Se sabe que existen diferentes requisitos para que un hongo sea considerado un agente de control biológico potencial de una o varias plagas; uno de esos requisitos es que pueda producir propágulos infectivos a altas tasas. Esto hace necesario evaluar el uso de diferentes estrategias de producción, así como de diversos medios de cultivo o sustratos para una propagación efectiva.
El objetivo del presente estudio fue evaluar la factibilidad de producir conidios y blastosporas de 4 aislados nativos del noreste de México y de una cepa de colección de I. fumosorosea que han mostrado hasta un 62% de mortalidad sobre adultos de D. citri en estudios previos12, mediante fermentación sólida y cultivo bifásico, utilizando grano de arroz como sustrato, y en cultivo sumergido, en 2 medios con diferente fuente de nitrógeno (casaminoácidos y peptona de colágeno).
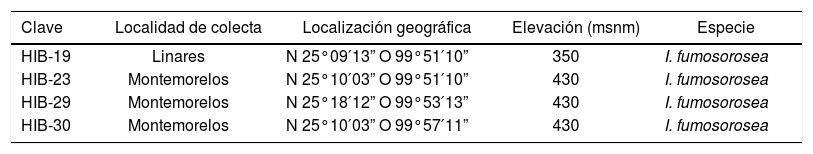
Materiales y métodosMicroorganismos. Los aislados de I. fumosorosea fueron obtenidos de suelos de la región citrícola de los municipios de Linares y Montemorelos, estado de Nuevo León, México, a 350 y 430msnm, respectivamente (tabla 1). El método para el aislamiento de los diferentes hongos entomopatógenos fue descrito anteriormente11. Los cultivos madre (cultivos stock) se depositaron en la colección del laboratorio L6 del Instituto de Biotecnología, Facultad de Ciencias Biológicas-Universidad Autónoma de Nuevo León (FCB-UANL). Para su conservación se usaron viales criogénicos con 1ml de glicerol al 10% v/v, almacenados a −80°C. Los aislados nativos utilizados corresponden a las claves HIB-19, HIB-23, HIB-29 y HIB-30 y la cepa de colección corresponde a la clave Pfr-612 de I. fumosorosea.
Hongos entomopatógenos aislados en suelos donde se cultivan cítricos en diferentes localidades del estado de Nuevo León, México
| Clave | Localidad de colecta | Localización geográfica | Elevación (msnm) | Especie |
|---|---|---|---|---|
| HIB-19 | Linares | N 25°09′13” O 99°51′10” | 350 | I. fumosorosea |
| HIB-23 | Montemorelos | N 25°10′03” O 99°51′10” | 430 | I. fumosorosea |
| HIB-29 | Montemorelos | N 25°18′12” O 99°53′13” | 430 | I. fumosorosea |
| HIB-30 | Montemorelos | N 25°10′03” O 99°57′11” | 430 | I. fumosorosea |
Producción de blastosporas en cultivo sumergido. Medio M. Jackson18: los componentes del medio basal por litro fueron los siguientes: KH2PO4, 2,0g; CaCl2 2H2O, 0,4g; MgSO4 7H2O, 0,3g; CoCl2 6H2O, 37mg; FeSO4 7H2O, 50mg; MnSO4 H2O, 16mg; y ZnSO4 7H2O, 14mg. Al medio basal se le agregó glucosa (80g/l) y casaminoácidos (25g/l). La solución de glucosa fue esterilizada por separado antes de agregarse al medio basal. Medio C. Rivas9: los componentes del medio por litro fueron los siguientes: KH2PO4, 4,0g; CaCl2 2H2O, 0,8g; MgSO4 7H2O, 0,6g; FeSO4 7H2O, 0,1g; glucosa, 80g; peptona de colágeno, 15g; y extracto de levadura, 5g.
Todos los hongos fueron cultivados por espacio de 14 a 21 días en agar papa dextrosa a 25±2°C. Después se prepararon suspensiones de 5×105 conidios/ml con agua destilada estéril para inocular el cultivo líquido (sumergido). Se usaron matraces con hendiduras internas (bafles) de 250ml con 100ml de medio, se incubaron a 28°C y 300 rpm en un incubador con agitación orbital14. Al final del crecimiento se determinaron la concentración de blastosporas y la biomasa, y después del secado el porcentaje de viabilidad.
Durante el crecimiento de los hongos en medio líquido se contaron blastosporas/ml (a las 24, 48 y 72h) y al final (72h) se determinó el peso seco. La concentración de blastosporas se determinó usando una cámara de Neubauer, después de realizar diluciones (10−6 a 10−8). Para medir la biomasa se determinó el peso seco, se tomó 1ml de cultivo y se filtró al vacío a través de membranas de microfibra de vidrio, con filtros de 110mm de diámetro, que se lavaron con 1ml de agua destilada. Los filtros se secaron 24h a 100°C y se pesaron. La concentración de blastosporas se expresó en blastosporas/ml y la biomasa con base en el peso seco, en g/l. Las blastosporas fueron recuperadas mediante secado por aire. Después de 72h de incubación se cosecharon los cultivos de todos los experimentos o las suspensiones de esporas, las blastosporas fueron filtradas 2 veces a través de una doble gasa para eliminar el exceso de micelio. El cultivo se formuló con tierra de diatomeas al 5% (p/v), la suspensión se filtró al vacío a través de un embudo Buchner usando papel de filtro Whatman n.° 1. Los filtrados obtenidos se secaron 24h a temperatura ambiente (25-28°C), se colocaron en bolsas de plástico y se almacenaron a 4°C.
La viabilidad de las formulaciones de blastosporas de I. fumosorosea se determinó tomando de cada bolsa 50mg de blastosporas secas, a las que se adicionaron 50ml de caldo papa dextrosa en un matraz Erlenmeyer con hendiduras internas (bafles) de 250ml de capacidad. Después de 6h de incubación a 28°C y 300 rpm en un incubador con agitación orbital, se contaron 100 blastosporas microscópicamente para evaluar el tubo germinativo. El criterio para considerar a una espora viable fue cuando se formó un tubo germinativo tan largo como la mitad del diámetro de la espora12. La viabilidad se expresó en porcentaje de germinación.
Producción de conidios en cultivo bifásico. Todos los aislados de I. fumosorosea fueron cultivados en agar papa dextrosa entre 14 y 21 días a 25±2°C. Después se prepararon suspensiones de 1×106 conidios/ml con agua destilada estéril para inocular 10ml en matraces Erlenmeyer con hendiduras internas (bafles) de 250ml, en los que había 90ml de caldo dextrosa Sabouraud. Estos matraces se incubaron durante 72h a 28°C y 300 rpm en un incubador con agitación orbital17.
Producción de conidios en fermentación sólida. Todos los aislados de I. fumosorosea se cultivaron en agar papa dextrosa entre 14 y 21 días a 25±2°C. Transcurrido el tiempo de incubación, con una asa bacteriológica se desprendieron los conidios aéreos para preparar las suspensiones de conidios con Tween 80 al 0,01% (v/v), a una concentración de 1×106 conidios/ml, estas se utilizaron para inocular el sustrato.
Preparación e inoculación del sustrato para la fermentación sólida y el cultivo bifásico. Se utilizaron bolsas transparentes de polietileno de alta densidad de 1kg de capacidad. En cada bolsa se colocaron 50g de arroz (Oryza sativa L.) y 60% de agua bidestilada (p/v); las bolsas se esterilizaron a 121°C, 103,40kPa, durante 15min. Las bolsas se inocularon con 5ml de cada una de las suspensiones del precultivo en el caso del cultivo bifásico, o con 5ml de cada una de las suspensiones de conidios para la fermentación sólida, tratando de esparcirlas de manera uniforme sobre el sustrato; al terminar, las bolsas fueron selladas herméticamente. Luego se incubaron 14 días a temperatura ambiente (25±2°C) y se expusieron a la luz blanca de las lámparas del laboratorio (12:12h luz:oscuridad). Las bolsas fueron agitadas cada 3 días para esparcir las esporas homogéneamente sobre el sustrato. Al final del tiempo de crecimiento se determinaron la concentración de conidios y su porcentaje de viabilidad32.
Medición de la productividad del sustrato en fermentación sólida y en cultivo bifásico. A los 14 días de incubación se determinó la concentración de conidios por gramo de arroz de cada bolsa. Se realizaron diluciones (10−6 a 10−8) en una solución de Tween 80 al 0,01% (v/v) y se contaron los conidios usando una cámara de Neubauer. Para determinar la viabilidad se adicionó 1g de arroz a 50ml de caldo papa dextrosa. Este cultivo se mantuvo en agitación rotatoria (300 rpm) a 25±2°C durante 6h, tras lo cual se tomaron muestras y se contaron 100 esporas (conidios germinados y no germinados), para cuantificar la proporción de estas que fueron viables, según el criterio de la longitud del tubo germinativo antes descrito. La viabilidad se expresó en porcentaje de germinación y este procedimiento se repitió periódicamente hasta completar 4 semanas13.
Los resultados se expresaron como valores promedio más/menos el error estándar. Para verificar la normalidad de los datos se realizó la prueba de Kolmogorov-Smirnov, luego de convertir los resultados a sus logaritmos (log10) para introducirlos en el programa estadístico y, en caso de cumplir con esta condición, se realizó un análisis de varianza (ANOVA) y una prueba de Tukey (p ≤ 0,05) para las medias. Los datos fueron analizados con el programa IBM SPSS® v.19 Inc., Nueva York, EE. UU. Los experimentos se realizaron por triplicado y se repitieron al menos en 2 ocasiones.
Resultados y discusiónProducción de blastosporas. La producción de blastosporas en medio líquido aumentó exponencialmente, como se esperaba, a partir de las 48h en el medio con casaminoácidos. Sin embargo, en el medio con peptona de colágeno no se registró crecimiento hasta las 72h de incubación. A las 24h no se detectó crecimiento, y no se obtuvo diferencia significativa en el número de blastosporas/ml entre los diferentes aislados cultivados en el medio con casaminoácidos a las 48h ni en ninguno de los dos medios a las 72h (p ≥ 0,05) (tabla 2).
Blastosporas de Isaria fumosorosea obtenidas en cultivo líquido a diferentes tiempos de incubación en medio casaminoácidos y peptona de colágeno
| Blastosporas/ml | |||
|---|---|---|---|
| Clave | Medio casaminoácidos | Medio peptona de colágeno | |
| 48h | 72h | 72h | |
| HIB-19 | 2,2×107 | 3,70×108 | 6,80×106 |
| HIB-23 | 3,50×107 | 4,90×108 | 2,15×107 |
| Pfr-612 | 2,7×107 | 2,35×108 | 1,55×107 |
| Media±EEa | 2,65±0,06×107 | 3,75±0,06×108 | 1,30±0,14×107 |
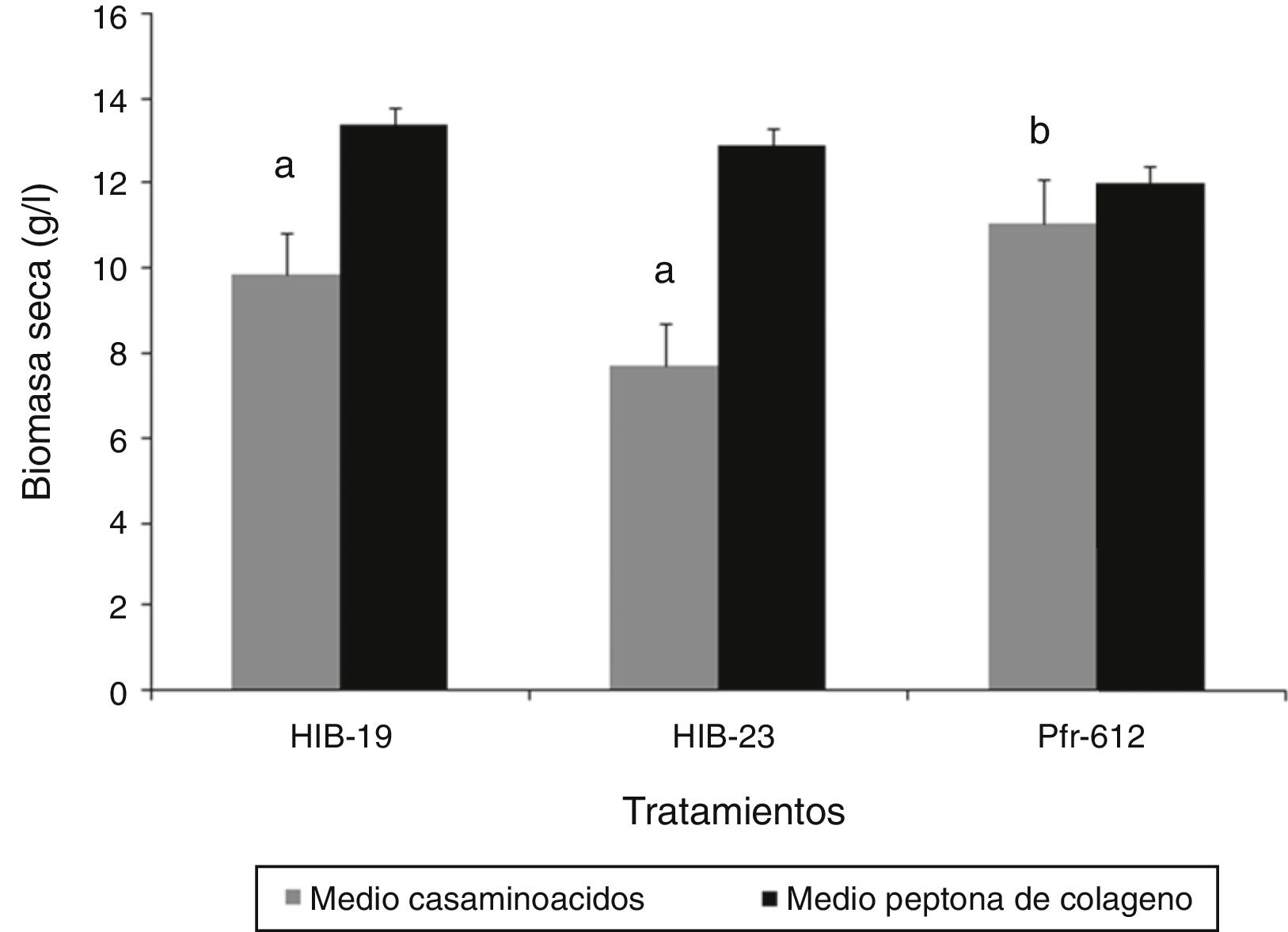
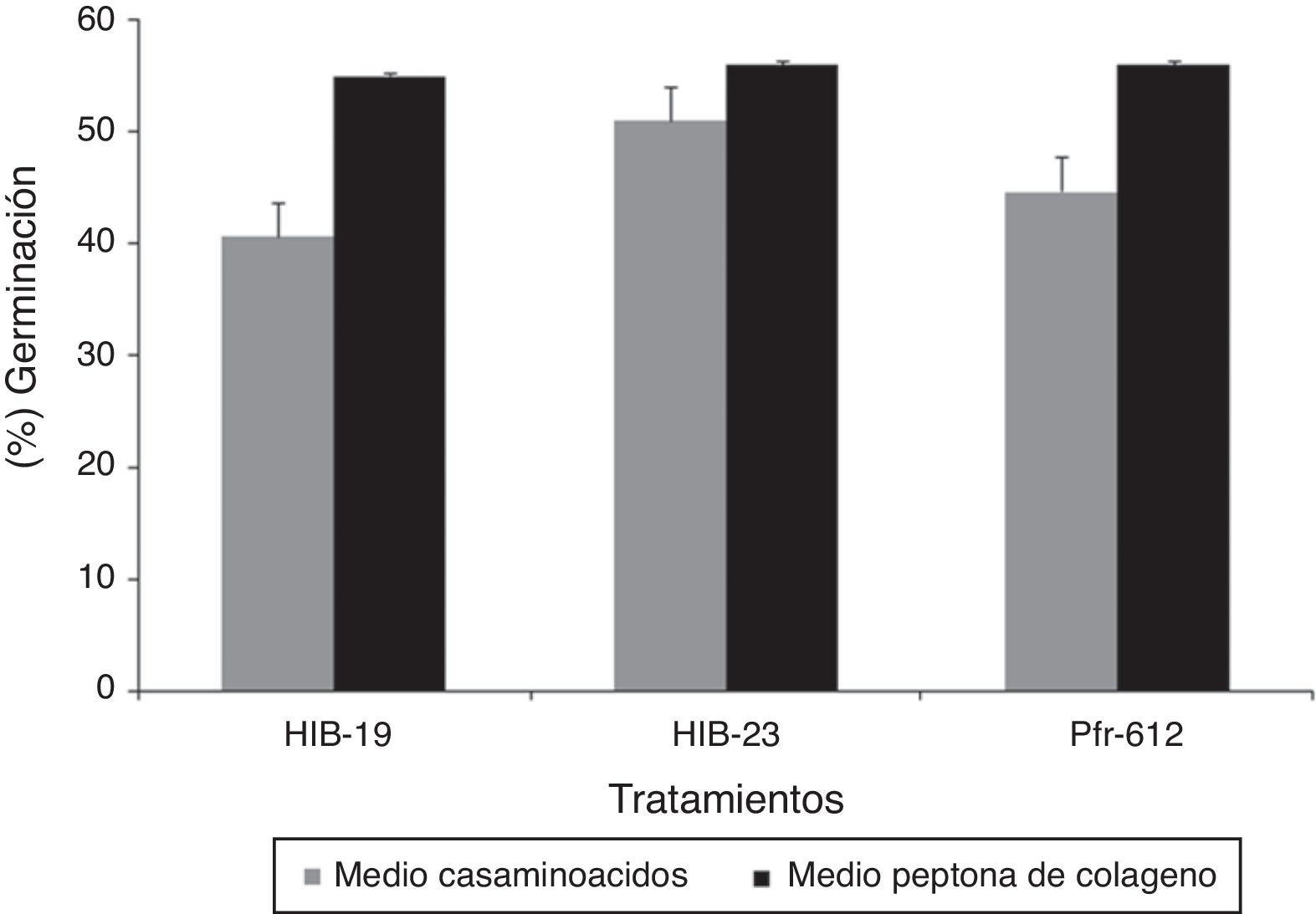
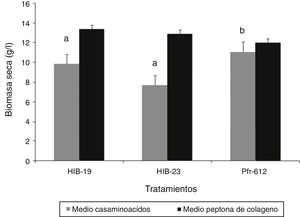
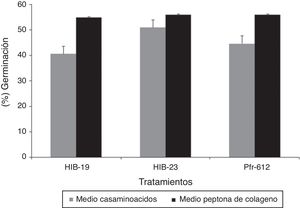
La producción de biomasa en el medio con casaminoácidos a las 72h mostró diferencias significativas (p ≤ 0,05) entre los hongos evaluados. La cepa Pfr-612 mostró la mayor producción (13,50g/l) y el aislado HIB-23 solamente 7,70g/l. Respecto del medio con peptona de colágeno, a las 72h no se encontró diferencia significativa entre los hongos (p ≥ 0,05) (fig. 1). La viabilidad de las blastosporas recuperadas en tierra de diatomeas como soporte no mostró diferencias significativas (p ≥ 0,05) entre los hongos crecidos en los distintos medios de cultivo. El porcentaje de germinación para el medio con casaminoácidos fue del 40-51%, mientras que para el de peptona de colágeno fue del 55-56% (fig. 2).
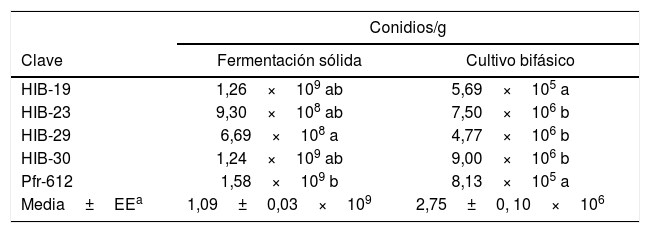
Producción de conidios en fermentación sólida. La producción de conidios en grano de arroz (O. sativa L.) fue 108 a 109conidios/g, y existió diferencia significativa (p ≤ 0,05) entre los hongos evaluados. El valor mínimo de 6,69×108 conidios/g se registró para el aislado HIB-29 y el máximo de 1,58×109 conidios/g para la cepa Pfr-612 (tabla 3). Los valores de germinación en promedio fueron superiores al 90% a las 4 semanas de almacenamiento.
Conidios de Isaria fumosorosea obtenidos mediante fermentación sólida y cultivo bifásico
| Conidios/g | ||
|---|---|---|
| Clave | Fermentación sólida | Cultivo bifásico |
| HIB-19 | 1,26×109 ab | 5,69×105 a |
| HIB-23 | 9,30×108 ab | 7,50×106 b |
| HIB-29 | 6,69×108 a | 4,77×106 b |
| HIB-30 | 1,24×109 ab | 9,00×106 b |
| Pfr-612 | 1,58×109 b | 8,13×105 a |
| Media±EEa | 1,09±0,03×109 | 2,75±0, 10×106 |
Los tratamientos con diferente letra son estadísticamente significativos (Tukey p ≤ 0,05).
Producción de conidios en cultivo bifásico. La producción de conidios en cultivo bifásico fue de 105 a 106conidios/g y hubo diferencia significativa (p ≤ 0,05) entre los hongos evaluados. El valor mínimo de 5,69×105 conidios/g se registró para el aislado HIB-19 y el máximo de 9,00×106 conidios/g para el aislado HIB-30 (tabla 3). Los valores de germinación en promedio fueron superiores al 90% a las 4o semanas de almacenamiento.
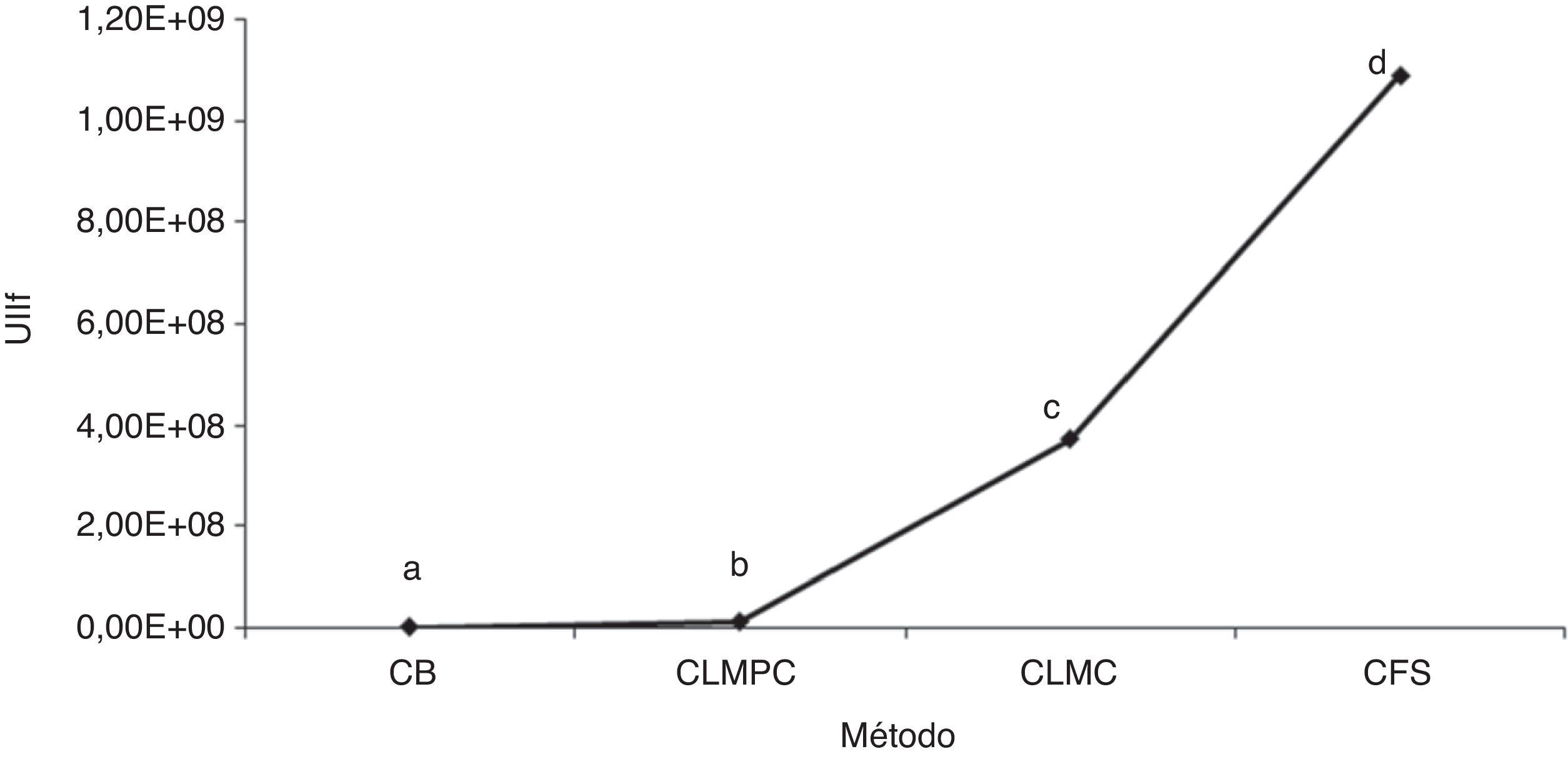
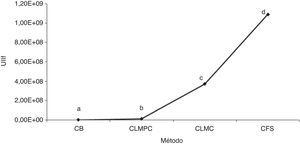
Comparativo final de la producción de unidades infectivas de I. fumosorosea según el método y el aislamiento. Se observó diferencia significativa entre los métodos empleados (p ≤ 0,05): mientras que la fermentación sólida resultó ser el procedimiento más efectivo para la producción de unidades infectivas de I. fumosorosea, con un promedio de 1,09×109 conidios/g, el cultivo bifásico resultó el menos efectivo, con un promedio de 2,75×106 conidios/g. De los medios de cultivo líquidos, el medio con casaminoácidos registró una producción de 3,74×108 blastosporas/ml y el medio con peptona de colágeno 1,31×107 blastosporas/ml. La producción promedio por aislado fue del orden de 107 blastosporas/ml, y no se registró diferencia significativa (p ≥ 0,05) entre los hongos evaluados (fig. 3).
Comparativo de la producción de unidades infectivas de Isaria fumosorosea mediante 3 métodos de propagación.
Los tratamientos con diferente letra son estadísticamente significativos (Tukey p ≤ 0,05).
CB: cultivo bifásico; CLMPC: cultivo líquido- medio peptona de colágeno; CLMC: cultivo líquido-medio casaminoácidos; CFS: cultivo en fermentación sólida; UIIf: unidades infectivas de Isaria fumosorosea.
En el presente estudio se utilizaron 3 diferentes técnicas para la propagación masiva de aislados nativos de I. fumosorosea. La propagación en medio líquido provee ciertas ventajas sobre otras metodologías, como la reducción de los tiempos de producción y la menor contaminación del medio. En el presente estudio se utilizaron 2 medios líquidos para la producción de blastosporas, con diferente fuente de nitrógeno, casaminoácidos y peptona de colágeno, y se obtuvieron valores de hasta 108 blastosporas/ml con la primera fuente y de 107 blastosporas/ml con la segunda. En estudios anteriores16 en un medio con casaminoácidos, con la misma proporción de carbono y nitrógeno que la utilizada en este trabajo, pero luego de 96h de incubación, se obtuvieron valores de hasta 8,90×108 blastosporas/ml, mientras que en el presente estudio se llegó a 4,90×108 blastosporas/ml a las 72h de incubación.
En estudios recientes27 realizados con aislados de I. fumosorosea procedentes de Brasil y EE. UU. se informan valores superiores a 1×109 blastosporas/ml utilizando hidrolizado ácido de caseína y harina de semillas de algodón (25g/l) como fuentes de nitrógeno, y glucosa (100g/l) como fuente de carbono. Respecto del medio con peptona de colágeno, la producción se mantuvo en el orden de 107 blastosporas/ml a las 72h de incubación, lo cual contrasta con estudios anteriores35, en los que se reporta a las 72h una producción de 8,90×108 blastosporas/ml para la cepa GHA de Beauveria bassiana en un medio que contenía 80g/l de glucosa y 12g/l de peptona de colágeno. Sin embargo, I. fumosorosea parece preferir otras fuentes de nitrógeno, diferentes de la peptona de colágeno y el extracto de levadura utilizados en este estudio. La variedad de resultados al comparar diferentes ensayos de producción de blastosporas parece corroborar lo citado en otros trabajos24, donde se señala que la calidad y la cantidad de propágulos obtenidos durante la producción en masa de hongos entomopatógenos son dependientes de varios factores, tales como los aislados en sí, los nutrientes, la densidad del inóculo y las condiciones ambientales.
En lo concerniente a la producción de biomasa, solo cuando se cultivaron en el medio con casaminoácidos se verificó una diferencia significativa en favor de la cepa Pfr-612, que produjo 13,50g/l, mientras que en el medio con peptona de colágeno no hubo diferencias significativas entre los hongos evaluados, lo cual guarda relación con los resultados de producción de blastosporas.
La tasa de germinación de las blastosporas se ubicó entre el 40 y el 56% utilizando, tierra de diatomeas como soporte. Esto está en consonancia con un estudio34 en el que reportan una viabilidad de hasta un 69,6% en un medio con casaminoácidos y de 21,9% en un medio con peptona de colágeno para blastosporas de I. fumosorosea con tierra de diatomeas al 5%. En ese estudio concluyen que el medio de producción y el soporte usados durante el secado pueden afectar a la tolerancia a la desecación y la estabilidad en el almacenamiento de las blastosporas. Una investigación reciente27 corrobora esta observación, al reportar una mayor supervivencia (82,4% de germinación) de las blastosporas formuladas en tierra de diatomeas al 7,5% que en un medio de hidrolizado ácido de caseína y glucosa.
Por otro lado, la producción de I. fumosorosea por la técnica de cultivo bifásico fue de solo 105 a 106 conidios por gramo, lo cual contrasta con los rendimientos obtenidos tanto en el cultivo líquido como en la fermentación sólida. Estos bajos rendimientos pueden atribuirse a varios factores, entre ellos el medio utilizado para la producción de micelio en la fase líquida, así como el sustrato utilizado para la fase sólida. En este estudio, en el que se utilizó caldo dextrosa Sabouraud para la fase líquida, es posible que la caseína del medio no haya sido metabolizada correctamente por los hongos evaluados, o que la cantidad de glucosa disuelta haya sido insuficiente. Por otra parte, aunque el grano de arroz es uno de los sustratos preferidos para la producción masiva de hongos entomopatógenos, este no siempre resulta ser la mejor opción. En algunos hongos, como Lecanicillium lecanii, la cantidad de conidios puede disminuir debido a la alta compactación que ejerce el hongo sobre el arroz, lo que impide la aireación interna y reduce la producción conidial6.
La estructura del sustrato puede ser tan importante como la cantidad de nutrientes disponibles, ya que un sustrato ideal debe proveer una alta proporción entre el área superficial y el volumen, donde las partículas individuales se mantienen separadas con el fin de proporcionar espacio para la aireación y la formación de conidios25. En este estudio con I. fumosorosea, el grano de arroz utilizado presentó tendencia a permanecer compactado una vez que se inoculó la fase líquida. En otro estudio28 mencionan que existen también otros aspectos importantes que se deben tener en cuenta durante la inoculación de la fase sólida, como la duración de la incubación de la fase líquida. En este sentido, tras una incubación líquida prolongada se produce una considerable cantidad de micelio, que después de las 96h puede derivar en la formación de grandes cantidades de pellets miceliales. Estos pellets disminuyen el número de puntos de colonización en la fase sólida y retrasan el desarrollo fúngico sobre el medio, ya que no permiten la cobertura total de las partículas del sustrato19. Aunque en el presente estudio no se observó la formación de pellets miceliales de gran tamaño, no se descarta su presencia, ya que la fermentación líquida se llevó a cabo durante 72h, período muy cercano al tiempo límite para evitar su formación.
Es probable que el caldo dextrosa Sabouraud utilizado para la propagación durante la fase líquida del cultivo bifásico haya favorecido solo la formación de abundante micelio y no de las blastosporas que se esperaba que se formaran. Otra de las razones por las que el cultivo bifásico fue poco efectivo tal vez sea la composición química del sustrato utilizado para la propagación, es decir el grano de arroz. Como se ha indicado ya, uno de los aspectos importantes para la producción de hongos entomopatógenos es la composición química del sustrato de crecimiento para establecer su contenido de carbono y su relación carbono-nitrógeno (C:N). Dado que, en general, se emplean productos o residuos de origen vegetal, sus nutrientes pueden ser variables a lo largo del año y esta variación puede afectar en gran medida a los parámetros de producción. Si bien no hay sustratos estándar en el mercado, un análisis previo de nutrientes podría ayudar a controlar estas variables y es recomendable realizarlo para asegurar la calidad de los sustratos28. Por otro parte, se sabe que medios enriquecidos, tanto en nitrógeno como en carbono, favorecen la producción de biomasa; sin embargo, se debe considerar que un mayor crecimiento micelial no necesariamente conlleva una alta producción de conidios29. Estudios anteriores30 señalan que la esporulación y el crecimiento del micelio pueden verse favorecidos por la presencia de monosacáridos, como glucosa o fructosa. Sin embargo, no todas las fuentes de nitrógeno parecen favorecer estos procesos: aminoácidos como la asparagina y otros compuestos amoniacales pueden acumularse durante el crecimiento somático y alcalinizar el medio e inhibir los procesos de conidiación y crecimiento.
Otro estudio8 menciona que para inducir el proceso de esporulación en hongos es necesario que la fuente de carbono se encuentre en abundancia y el contenido de nitrógeno sea el factor limitante del crecimiento. Por otro lado, en el caso de la formación de blastosporas, en estudios anteriores18 se demostró que eran necesarias altas concentraciones de glucosa, de hasta 20g por litro, para obtener el rendimiento máximo en la formación de blastosporas, y que la tolerancia a la desecación dependía del contenido de casaminoácidos, es decir, de la fuente de nitrógeno, la cual a concentraciones de hasta 40g por litro permite obtener una tolerancia a la desecación óptima. En ese mismo estudio se demostró que la producción de blastosporas de diferentes cepas de I. fumosorosea en medio con casaminoácidos ocurre rápidamente antes de que se agoten los casaminoácidos o la glucosa. Estos resultados se apoyan en estudios realizados con varios aislamientos de I. fumosorosea y otros hongos entomopatógenos, que muestran que, a diferencia del proceso de conidiación, la formación de blastosporas no siempre depende del agotamiento de nutrientes.
Finalmente, cabe señalar que en el presente trabajo, la fermentación sólida resultó ser la técnica con mejores resultados, ya que los rangos de producción fueron de hasta 109 conidios por gramo, lo cual coincide con los resultados de trabajos previos9 en los que se obtuvieron rendimientos de hasta 6,94×109 conidios/g utilizando grano de arroz como sustrato durante 12 días de incubación. En otro estudio1, reportaron para Trichoderma sp. en cascarilla de algodón enriquecida con solución de melaza al 1%-urea 1% (5:1) y en cascarilla de algodón al 60% y semillas de Artocarpus incisa al 40%, utilizando procesos de fermentación sólida artesanal y semiindustrial, concentraciones de 2,53×109 y 2,31×109 conidios/g, respectivamente.
Estos resultados en diferentes géneros de entomopatógenos muestran la factibilidad de producir conidios mediante la técnica de fermentación sólida. Sin embargo, el tiempo requerido para la esporulación en sustratos sólidos es generalmente de semanas y el proceso es laborioso, lo que puede resultar en un alto riesgo de contaminación, con el consiguiente aumento de los costos de producción. La tecnología por fermentación líquida puede superar estos inconvenientes logrando que sea más económico escalar el proceso de producción para producir propágulos fúngicos bajo condiciones nutricionales y ambientales controladas. Debido al corto tiempo de fermentación, la facilidad de recuperación del producto, la automatización del proceso y la disponibilidad de componentes de medios económicos, la fermentación líquida se considera el método más rentable para producir agentes fúngicos de biocontrol18, aunque cabe mencionar que los hongos entomopatógenos poseen una amplia variabilidad genética, por lo que dependiendo de la cepa o el aislado, pueden responder de diferente manera cuando se cultivan en medios líquidos. Esta variante debe considerarse para evaluar y optimizar los parámetros de producción del cultivo líquido23, además de que la elección de una técnica o un método de producción va a depender de diversos factores, como, por ejemplo, el género y la especie en particular del entomopatógeno, el tipo de propágulo que se quiere obtener y el insecto plaga al cual va dirigido el producto, solo por mencionar algunos de los aspectos más importantes por considerar.
ConclusionesLos resultados obtenidos en el presente estudio muestran la factibilidad de producir propágulos de I. fumosorosea bajo diferentes técnicas de propagación. La fermentación en cultivo líquido mostró marcadas diferencias entre los medios utilizados en la producción de blastosporas por mililitro; sin embargo, fueron similares en los porcentajes de viabilidad obtenidos, así como en la biomasa recuperada, la cual estuvo acorde con la concentración de blastosporas. La producción de conidios en fermentación sólida fue el método con el que se obtuvieron los mejores resultados, ya que la producción de unidades infectivas de I. fumosorosea con ese método superó a la de la fermentación líquida y a la del cultivo bifásico; que fue el método que mostró los menores rendimientos por gramo de sustrato. Estos resultados muestran el potencial de I. fumosorosea para producir propágulos bajo diferentes condiciones, lo que contribuye a pensar en su posible uso en programas de manejo y control de plagas de importancia agrícola de la región, como Diaphorina citri, pero es necesario continuar con la evaluación de la estabilidad en el almacenamiento de cada uno de estos propágulos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.