El objetivo de este estudio fue evaluar la eficacia de un Programa de Control de Sangre de Pacientes (PBM) en pacientes sometidos a cirugía cardiovascular (CCV) en la Clínica San Camilo, Buenos Aires, Argentina.
Materiales y métodosSe analizó retrospectivamente el consumo de glóbulos rojos (GRD), plasma fresco congelado (PFC) y concentrado de plaquetas (CP) en 76 pacientes sometidos por primera vez a CCV con bypass cardiopulmonar (BCP) en un centro único de atención terciaria. Fueron designados como grupo convencional 37 pacientes previos a la implementación del PBM y como grupo PBM 39 pacientes operados bajo el programa.
ResultadosSe encontró un descenso transfusional del 93 y el 91% para PFC y CP, respectivamente. No hubo diferencia significativa en las transfusiones de GRD. El número de pacientes con transfusiones combinadas de PFC y CP disminuyó significativamente.
ConclusiónLa implementación de criterios de PBM en paciente sometidos a CCV logró reducir significativamente el consumo de PFC y de CP, permitiendo incrementar los stocks de componentes sanguíneos, generalmente escasos, para otros pacientes. La implementación de PBM implicó una posible reducción de costos y contingencias legales. Serán necesarios mayores esfuerzos para reducir el consumo de GRD.
The aim of this study is to evaluate the efficacy of a Patient Blood Management Program (PBM) in patients undergoing cardiovascular surgery at the San Camilo Clinic, Buenos Aires, Argentina.”
Materials and methodsThe red blood cell (RBC), fresh frozen plasma (FFP) and platelets (PLT) consumption was retrospectively analyzed in 76 first-time CVS patients with a cardiopulmonary bypass (CPB) at a single tertiary care center. They were allotted to either Conventional Group (37 patients pre-PBM) or PBM Group (39 patient post implementation).
ResultsThere were 93% and 91% transfusion reduction in FFP and PLT, respectively. No significant difference in RBC transfusions was detected. The number of patients with combined FFP and PLT transfusions was decreased significantly.
ConclusionImplementation of PBM criteria in CVS patients significantly reduced FFP and PLT consumption, while increasing blood components stock, usually scarce, in other patients. The PBM implementation meant a potential cost reduction and legal contingencies. Greater efforts will be necessary to reduce RBC consumption.
La cirugía cardiovascular (CCV) requiere un importante soporte transfusional, lo cual aumenta el riesgo de presentar eventos adversos asociados1. El uso liberal del recurso transfusional estaba universalmente difundido hasta la toma de conciencia de las complicaciones. La transfusión de sangre es un factor de riesgo independiente vinculable a mala evolución del paciente2. Ha sido demostrada su asociación con: aumento de la mortalidad, prolongación de la estancia hospitalaria, infecciones, sepsis y disfunción multiorgánica3,4.
Los hemocomponentes como el plasma fresco congelado (PFC) o la transfusión de plaquetas están asociados al desarrollo de injuria pulmonar aguda y mayor riesgo de infecciones en pacientes críticos5,6.
El riesgo de infección (hepatitis virales, HIV), descripto en la literatura universal como de baja prevalencia, contrasta con nuestra realidad de país en vías de desarrollo7.
En Argentina, de acuerdo con un relevamiento nacional con técnicas de detección de ácidos nucleicos (pruebas NAT), realizado entre 2004 y 2016, sobre aproximadamente 1.500.000 donaciones, se hallaron 14 ventanas serológicas para HBV (9,91 casos por millón [cpm]), 8 HIV (5,15 cpm) y 4 HCV (2,58 cpm)8. Esto contrasta con los hallazgos en Estados Unidos para HBV (0,82 a 1,18 cpm), HIV (0,68 cpm) y HCV (0,87 cpm)7.
La búsqueda de mejora continua, tratando de disminuir el «período de ventana» no solo incluye la investigación por biología molecular (aún no establecido como obligatoria por la normativa vigente), sino además de disponer de sangre de donantes voluntarios habituales en un 100%, según recomendaciones de la Organización Mundial de la Salud/Organización Panamericana de la Salud, de lo cual estamos aún lejos (del 30 al 35% actualmente).
A esto se suman los riesgos aún no claramente determinados de infecciones emergentes (virus zika, chikungunya, dengue, etc.) y las complicaciones no infecciosas históricamente descriptas (reacciones hemolíticas, alérgicas, lesión pulmonar aguda, sobrecarga cardíaca) y de reciente conocimiento (aumento de la morbimortalidad por complicaciones infecciosas generales, disfunción cardíaca y respiratoria, progresión tumoral, etc.)1,9,10.
La tromboelastometría rotacional (ROTEM®) es un método que permite medir rápidamente las propiedades viscoelásticas de la sangre. Esta metodología incluye 4 canales de lectura simultánea, trabaja en sangre entera citratada, está conectado en forma integrada a una computadora que permite el análisis automático de los test y estos se realizan con el uso de activadores y/o inhibidores. Representa un importante adelanto ya que reduce los tiempos para poder tomar decisiones terapéuticas a no más de 10min. Brevemente, las pruebas a realizar son: EXTEM analiza vía extrínseca, INTEM vía intrínseca, FIBTEM fibrinógeno, HEPTEM presencia de heparina y APTEM confirmación de fibrinólisis. Se ha reportado que su uso reduce la pérdida de sangre y disminuye la necesidad de transfusión de productos sanguíneos durante la cirugía cardíaca más eficazmente que el método empírico11-13.
El Programa de gestión de sangre del paciente (en inglés Patient Blood Management [PBM]) tiene como objetivo minimizar la exposición a sangre alogénica, optimizando el cuidado de los pacientes que puedan requerir de transfusiones mediante un abordaje multidisciplinario, basado en evidencias científicas. Son elementos fundamentales del PBM las guías sobre el uso apropiado de la sangre y la educación continua de los profesionales de la salud que requieren de la medicina transfusional como complemento de sus indicaciones terapéuticas14,15.
El soporte transfusional óptimo se caracteriza por dar el producto de la sangre terapéuticamente requerido, en los volúmenes apropiados, en forma oportuna, al paciente correcto. Un PBM eficazmente implementado debería: a) reducir las transfusiones de sangre innecesarias y conjuntamente los efectos adversos asociados ya mencionados; b) abastecer de hemocomponentes en cantidad y calidad acorde con la necesidad de los pacientes; c) mejorar la evolución de aquellos que necesitan transfusiones (incluyendo los que tienen trastornos hematológicos o anemias no quirúrgicas), y d) disminuir los costos en salud9,16,17.
El presente trabajo tiene como objetivo evaluar la repercusión de la implementación del PBM en el consumo de concentrado de plaquetas (CP), PFC, crioprecipitados, concentrados de factores (los cuales son modificados por el uso de ROTEM®) y de glóbulos rojos desplasmatizados (GRD) en una institución de complejidad terciaria, en pacientes sometidos a CCV.
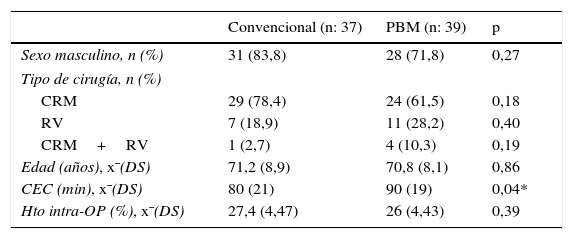
Material y métodosEn este estudio se evaluaron retrospectivamente los registros de 76 pacientes operados por primera vez de CCV, con bypass cardiopulmonar, entre enero del 2013 y marzo del 2016. El mismo comprende 2 etapas que identificamos como: 1) grupo convencional, tratados entre enero del 2013 y julio del 2014, período previo a la implementación del PBM, compuesto por 37 pacientes a los que se les efectuó, en 29 casos, de cirugía de revascularización miocárdica (CRM), en 7 reemplazo valvular (RV) y un procedimiento combinado (CRM+RV); y 2) grupo PBM, tratados entre agosto del 2014 y marzo del 2016, 39 pacientes a los que se intervino por CRM: 24, RV: 11 y 4: CRM+RV (tabla 1).
Datos basales de la población en estudio
| Convencional (n: 37) | PBM (n: 39) | p | |
|---|---|---|---|
| Sexo masculino, n (%) | 31 (83,8) | 28 (71,8) | 0,27 |
| Tipo de cirugía, n (%) | |||
| CRM | 29 (78,4) | 24 (61,5) | 0,18 |
| RV | 7 (18,9) | 11 (28,2) | 0,40 |
| CRM+RV | 1 (2,7) | 4 (10,3) | 0,19 |
| Edad (años), x¯(DS) | 71,2 (8,9) | 70,8 (8,1) | 0,86 |
| CEC (min), x¯(DS) | 80 (21) | 90 (19) | 0,04* |
| Hto intra-OP (%), x¯(DS) | 27,4 (4,47) | 26 (4,43) | 0,39 |
Todos los procedimientos fueron efectuados por el mismo equipo quirúrgico, en forma programada; se cumplió con los estudios prequirúrgicos de rutina, incluyendo un interrogatorio exhaustivo para detectar alteraciones de la hemostasia. En ambos grupos el control de la hemostasia en el preoperatorio y posoperatorio se realizó con un coagulograma convencional (CC), el cual incluye tiempo de protrombina, APTT, concentración de fibrinógeno por método de Clauss y recuento de plaquetas y tiempo de trombina. En ambos grupos, los pacientes ingresaron con parámetros de hemostasia adecuados. El seguimiento de la hemostasia se realizó a la salida de bomba y luego en la unidad de cuidados intensivos hasta normalización de los parámetros y/o cese del sangrado. En ambos grupos hubo un cuidadoso manejo de temperatura intraoperatoria acorde con los procedimientos realizados.
En el grupo convencional se utilizó ácido tranexámico como antifibrinolítico (Arotran®), luego de la protamina si el paciente sangraba con valores de fibrinógeno de Clauss menores de 200mg/dl, y en el grupo PBM se lo utilizó en todos los pacientes durante la circulación extracorpórea (CEC) de acuerdo con las Guías de la Sociedad Europea de Anestesiología 2013, administrándose nuevamente en el postoperatorio cuando los resultados de ROTEM® indicaban fibrinólisis.
En ninguno de los 2 grupos fue necesario el uso de factor viia.
En ambos grupos se utilizó concentrado de fibrinógeno (Haemocomplettan-Behring®) en lugar de crioprecipitados por las ventajas que presenta (velocidad para el inicio de la terapéutica, volumen infundido, seguridad en la concentración de factor administrado). Contamos también con concentrados de factores K dependientes como alternativa al PFC, pero no fueron necesarios en ninguno de los 2 grupos.
En el grupo convencional las transfusiones intraoperatorias fueron indicadas por anestesia y en el postoperatorio las correcciones de la hemostasia por Hematología y se utilizaron métodos convencionales de comunicación (teléfonos internos, celulares y protocolos en papel).
El grupo PBM utilizó un protocolo de PBM institucional, basado en guías sobre el uso apropiado de la sangre y la educación continua de los profesionales, y se diferenció del grupo control por:
a) Controles con (ROTEM®), antes y después de la neutralización con protamina, a la llegada a la unidad de cuidados intensivos y hasta alcanzar parámetros con adecuada reserva hemostática y/o cese del sangrado.
b) Utilización de mantas térmicas en forma normatizada en el postoperatorio.
c) Controles seriados de temperatura, pH, y Calcemia en las primeras 12 h de recuperación.
d) Protocolo de comunicación grupal de resultados y toma de decisiones en tiempo real. Desde el punto de vista operativo, se establecía el día previo al procedimiento quienes integrarían el equipo multidisciplinario (anestesista, cirujanos, perfusionista, laboratorio, medicina transfusional, Unidad de Cuidados Intensivos y Hematología) y los responsables de las distintas fases del mismo, por ejemplo, toma de muestras, procesamiento, entrega de resultados, interpretación de los mismos, toma de decisiones, ejecutores de conductas, etc., con ellos se conformaba un grupo de whatsapp (www.whatsapp.com) con clara identificación del paciente, resguardando identidad. De esta manera, se compartían la información y la toma de decisiones desde el ingreso del paciente al quirófano.
La responsabilidad de interpretar resultados y definir conductas para el control del sangrado quedaba a cargo del especialista en hemostasia cuando se consideraba que el sangrado no era de causa quirúrgica. También se mantuvo una estrecha vigilancia sobre el pH, la calcemia y la temperatura, (condiciones básicas para una adecuada hemostasia). Los controles por CC y ROTEM® fueron realizados en forma seriada hasta la estabilización de los parámetros hemostáticos en valores de seguridad.
e) Se consensuó no realizar transfusiones profilácticas y solo transfundir por objetivos guiados por ROTEM®.
Se registraron los requerimientos transfusionales de GRD, PFC y CP en ambos grupos.
Se comparó el consumo de componentes sanguíneos entre ambas poblaciones, calculando la media sobre los pacientes transfundidos.
Método estadísticoTanto el análisis de los datos poblacionales como el de los resultados se hizo mediante un test de t para muestras independientes para las variables continuas y un test de la chi al cuadrado o test exacto de Fisher (según correspondiera) para las variables discretas. El análisis del sangrado mostró una distribución asimétrica, no cumpliendo criterios de normalidad por lo que se utilizó el test de Mann-Whitney para su análisis. En todos los casos se consideró significativa un p valor<0,05. El análisis estadístico se efectuó con el software SPSS versión 18 (SPSS Inc., Chicago, IL, EE. UU.).
El estudio fue aprobado por el Comité de Docencia e Investigación de la Institución.
ResultadosLa población analizada se caracterizó por estar representada por 59 hombres (77,6%), con una media de edad (x¯) de 70,5. Grupo convencional 37 pacientes (H: %, x¯: 71 años), grupo PBM 39 pacientes (H: 71,8%, x¯: 70 años).
Las características de sexo y edad de la población, en ambos grupos, se corresponde con la epidemiología de la patología cardiovascular (adulto mayor, predominantemente masculino). La única diferencia estadísticamente significativa en los datos basales es el tiempo de CEC, mayor en el grupo PBM, vinculado con el mayor número de cirugías combinadas en este grupo (4 vs. 1 en grupo convencional). El promedio de CEC de CRM+RV fue de 106 min.
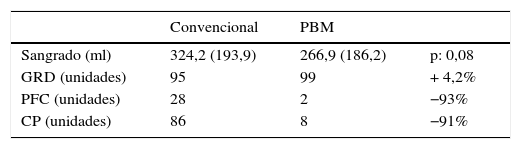
Los datos acerca del sangrado intraoperatorio y la utilización de GRD y hemoderivados pueden verse en la tabla 2. Si bien existe una tendencia a menor sangrado en el grupo PBM (–18%) no alcanza una significación estadística por los valores extremos (principalmente en el grupo convencional), lo que genera una gran dispersión (intervalo de confianza del 95%, muy amplio). Además, tiene una distribución no normal, por lo que el análisis se hace por otro método estadístico (Mann-Whitney).
El análisis de los datos registrados no mostró diferencias significativas en el consumo transfusional de unidades de GRD, lo que para nosotros representa un nuevo objetivo a cumplir. Por el contrario, se observó un significativo descenso tanto de las unidades de PFC como de CP.
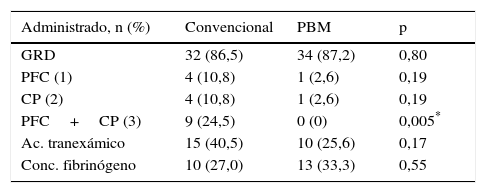
En lo que respecta al número de pacientes transfundidos (tabla 3), el número de pacientes que recibieron PFC y CP, por separado, no alcanza la significación porque es un número muy bajo en ambos grupos. Se redujo significativamente el número de pacientes que requirieron el uso combinado de PFC-CP en grupo PBM.
Hemoderivados y fármacos administrados en recuperación
| Administrado, n (%) | Convencional | PBM | p |
|---|---|---|---|
| GRD | 32 (86,5) | 34 (87,2) | 0,80 |
| PFC (1) | 4 (10,8) | 1 (2,6) | 0,19 |
| CP (2) | 4 (10,8) | 1 (2,6) | 0,19 |
| PFC+CP (3) | 9 (24,5) | 0 (0) | 0,005* |
| Ac. tranexámico | 15 (40,5) | 10 (25,6) | 0,17 |
| Conc. fibrinógeno | 10 (27,0) | 13 (33,3) | 0,55 |
CP: Concentrado de Plaquetas; GRD:glóbulos rojos desplasmatizados; n: número de pacientes; PFC: Plasma Fresco Congelado; %: porcentaje sobre el total.
En ambos grupos se utilizaron alternativas a las transfusiones de hemocomponentes para el manejo del sangrado postoperatorio, como el ácido tranexámico y el concentrado de fibrinógeno, sin diferencias significativas.
DiscusiónLa toma de decisiones transfusionales basadas en la observación clínica y cuantificación del sangrado en relación con el tiempo, complementado por el estudio del CC son empíricas y muchas veces tardías18.
Un metaanálisis de 19 estudios prospectivos aleatorizados que confronta esquemas transfusionales libres vs. restrictivos mostró que la adherencia a estos últimos disminuía la mortalidad hospitalaria y las infecciones postoperatorias19.
La disminución del consumo de sangre alogénica es de trascendental importancia en la disminución de riesgo de morbimortalidad en los pacientes. Es además una manera de incrementar la disponibilidad de hemocomponentes para situaciones donde su indicación es ineludible20-22.
El PBM se ha considerado uno de los 10 adelantos claves de los últimos 50 años9. Implica un trabajo interdisciplinario con el fin de optimizar el cuidado de los pacientes que pueden requerir la transfusión.
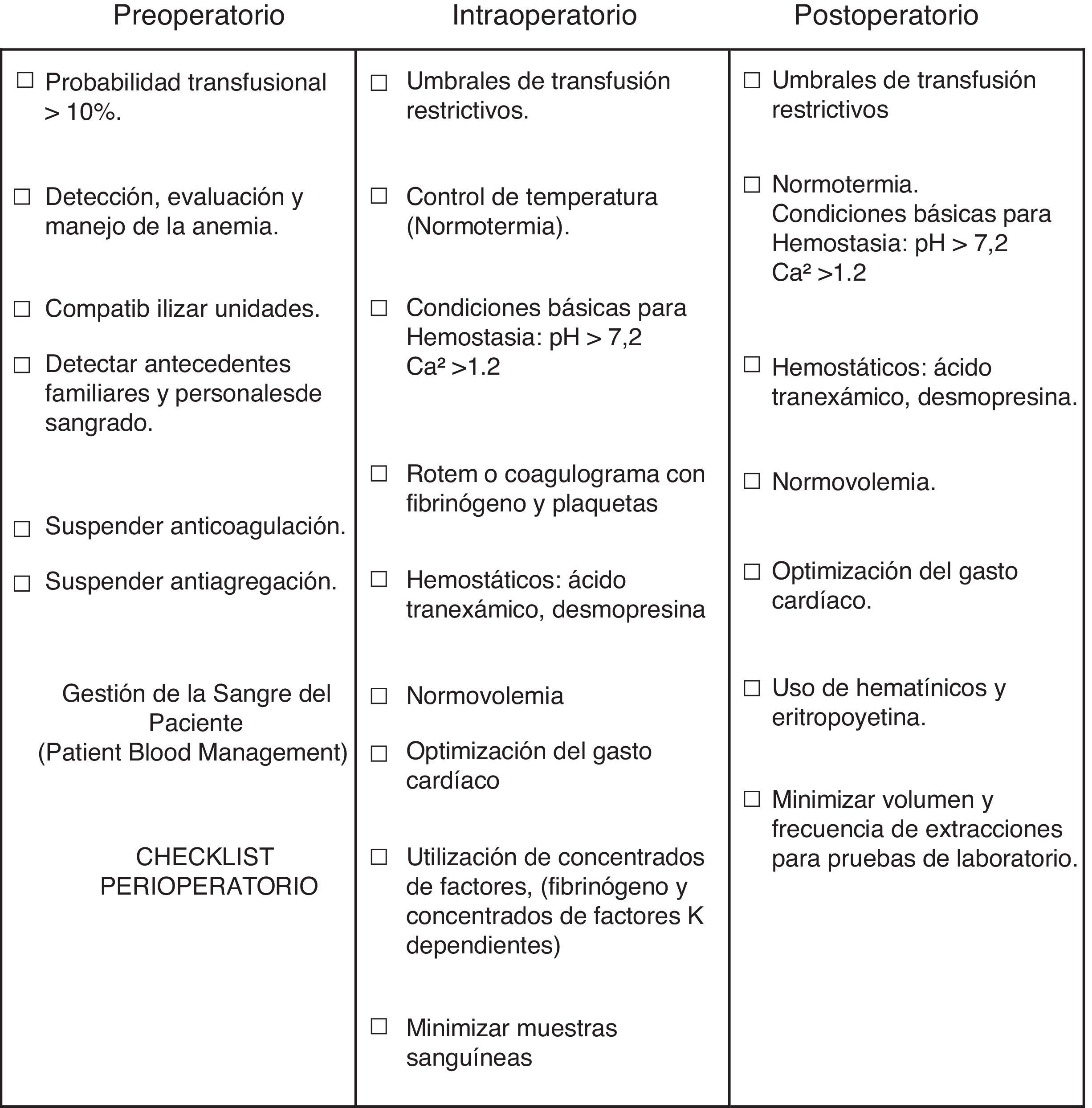
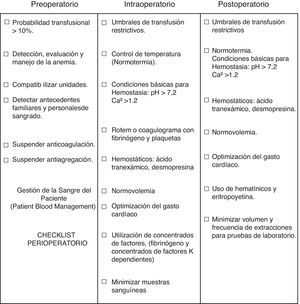
Demanda un cambio cultural médico e institucional mejorando la calidad de la indicación, optimizando la masa eritrocitaria y minimizando el sangrado (aplicando múltiples estrategias de fácil implementación y bajo costo, entre ellas: apropiado manejo de la temperatura, de la calcemia y del estado ácido base, condiciones esenciales requeridas para una adecuada hemostasia) (fig. 1). Incorporando el uso de fármacos para el control del sangrado posoperatorio, como los antifibrinolíticos (p. ej., ácido tranexámico) y, por último, la posibilidad de corregir alteraciones de la hemostasia con concentrados de factores de la coagulación: Concentrado de fibrinógeno, como alternativa a los crioprecipitados y concentrados de factores K dependientes como alternativa al PFC (ambos caracterizados por el escaso volumen, facilidad y rapidez para su infusión)17.
Los resultados del presente estudio sobre pacientes de cirugía cardíaca son coincidentes con la bibliografía citada en la que se ha logrado disminuir el número de pacientes transfundidos y unidades administradas particularmente de plasma y plaquetas10,17.
La sistemática de abordaje del paciente quirúrgico potencialmente sangrante con un protocolo de PBM permitió discriminar rápidamente entre el sangrado de causa quirúrgica del ocasionado por coagulopatía y, a su vez, definir si esta última era causada por defecto de plaquetas (funcional o cuantitativo), factores de la coagulación, fibrinógeno, deficiente neutralización de la heparina o exacerbación de la fibrinólisis.
La tromboelastometría ROTEM® tiene la ventaja de ofrecer en forma inmediata la diferenciación diagnóstica entre presencia de heparina, exceso de protamina, disminución de factores y/o plaquetas, siendo el único método disponible en la actualidad para diagnosticar un incremento en la fibrinólisis en tiempo terapéuticamente útil.
Nosotros consideramos que los pilares de los cambios implementados fueron no solo la incorporación del ROTEM®, sino además, haber establecido consensos previos interdisciplinarios y utilizar sistema de comunicación grupal en tiempo real como el whatsapp o similares.
ConclusiónLa implementación de criterios de PBM logró reducir el consumo de PFC y CP, aumentando el stock de componentes sanguíneos (siempre escasos), para otros pacientes. Este estudio no fue diseñado para considerar una disminución de morbimortalidad, lo cual constituye una de las limitaciones.
Mayores esfuerzos serán necesarios para reducir el consumo de GRD. Son potenciales derivaciones institucionales la disminución de costos, contingencias legales y mejoras en su posición frente a procesos de acreditación23-25.
Estamos convencidos de que es necesario generar conciencia en la comunidad médica de las implicancias del acto transfusional. Debemos ser responsables y fundamentar la indicación del mismo en la clínica del paciente.
Teniendo presente el precepto hipocrático que debe guiar nuestro accionar médico «primum non nocere», haciéndonos recordar que transfundimos pacientes, no resultados de laboratorio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.