Introducción
La necesidad de formular y aplicar políticas y regulaciones farmacéuticas está en la agenda de los gobiernos. Para todos es evidente que el mercado por sí solo no produce el bienestar al que aspiran la mayoría de ciudadanos. Por eso, la intervención del Estado es relevante para establecer las reglas que permitan ordenar el sector farmacéutico y asegurar el acceso de la población a los medicamentos necesarios. La Organización Mundial de la Salud (OMS), a partir de la Reunión de Expertos de Nairobi1 estableció como una de sus prioridades apoyar a los Estados miembros en el diseño de políticas farmacéuticas y publicó en 1991 sus Pautas para el desarrollo de políticas farmacéuticas. En 1988 la ciudad de México fue sede de la I Conferencia Latinoamericana sobre Políticas Farmacéuticas y Medicamentos Esenciales, convocando a los diferentes actores ligados al quehacer farmacéutico: reguladores, académicos, consumidores y empresarios.
En 1995 una importante iniciativa en la región Asia-Pacífico plasmada en la Conferencia Internacional sobre Políticas Farmacéuticas Nacionales (Australia, octubre de 1995) enfatizó que "el objetivo de una política nacional de medicamentos es asegurar el acceso equitativo y el uso racional de medicamentos seguros y efectivos"2. En 1996 la Asamblea Mundial de la Salud instó a sus Estados miembros a "que reafirmen su compromiso de elaborar y aplicar políticas farmacéuticas nacionales para asegurar el acceso equitativo a los medicamentos esenciales" y a "que refuercen los mecanismos de reglamentación farmacéutica para la vigilancia y control de la eficacia de los medicamentos comercializados".
En la actualidad el debate internacional sobre la política farmacéutica se centra en la Resolución EB109.R17 de la 55 Asamblea Mundial de la Salud (mayo de 2002).
Asegurando el acceso a medicamentos esenciales
Un tercio de la población mundial no tiene acceso regular a los medicamentos esenciales, que son aquellos que satisfacen las necesidades de cuidado de salud de la mayoría de la población; por lo tanto deben estar disponibles en todo momento, en cantidades adecuadas, en las formas y dosificaciones apropiadas y a un precio asequible para los individuos y comunidades.
Bajo estas circunstancias es evidente que el mercado no puede resolver estos problemas y es la voluntad soberana de los Estados la que tiene que asumir el compromiso de establecer las reglas de juego apropiadas.
En España la política farmacéutica se transforma de forma radical a partir de la aprobación de la Ley del Medicamento en 1990, tanto en la definición de sus objetivos como en los instrumentos utilizados para alcanzarlos. El objetivo de la política se transforma de un modelo basado en el control de los aspectos económicos del consumo de medicamentos y juego de intereses entre la administración del Estado y la industria farmacéutica, a un modelo en el que las cuestiones de carácter sanitario adquieren especial relevancia.
Este proceso de cambio es rápido en el que el Estado debe asumir un nuevo papel, marcado por tres circunstancias con dimensiones diferentes: la descentralización, la europeización y la globalización. La descentralización llevada de la mano de las Comunidades Autónomas (CC.AA.) representa un nuevo escenario en el que nuevos actores se incorporan a la política farmacéutica, reduciendo en consecuencia el poder de decisión de otros. La europeización produce una delegación de funciones por parte del Estado hacia instituciones supranacionales, lo que merma la autonomía del mismo. La globalización ha hecho que el sector farmacéutico se acelere tras la segunda revolución farmacológica y la incorporación de la biotecnología al desarrollo de nuevos medicamentos. A principios del siglo xxi el gobierno del sector farmacéutico es un gobierno multinivel, caracterizado por una creciente delegación de funciones hacia la Unión Europea y las CC.AA3.
Contexto europeo
Desde una perspectiva histórica en Europa se ha evolucionado con continuidad y progreso; el Tratado del Carbón y del Acero de la Comunidad Europea firmado en París en 1951 fue el punto de partida, pasando posteriormente por el Tratado de Roma, el Acta Única, el Tratado de la Unión en 1993, y en el momento actual en puertas de una Constitución Europea que daría como resultado la unión política y social de Europa tal como anticipó Walter Hallstein, primer presidente de la Comisión Europea. Estos son sucesos de una magnitud importante no sospechados hace 50 años.
Los objetivos que han establecido los responsables de la regulación de medicamentos en el seno de la Comisión Europea son los de asegurar un alto nivel de protección de la salud publica en materia de medicamentos para los ciudadanos europeos, trabajar sobre un mercado único de medicamentos, así como favorecer un entorno estable y predecible en el que se pueda desarrollar innovación dentro del sector farmacéutico. Se está trabajando en esta línea de actuación para elaborar una propuesta de cambios que van a afectar de manera importante al desarrollo farmacéutico en el seno de la Unión Europea.
Las propuestas de cambio afectan fundamentalmente al reglamento 2309/93 que regula la Agencia Europea de Evaluación de Medicamentos y las directivas 2001/82/CE y 2001 /83/CE, relativas al código comunitario sobre medicamentos veterinarios y medicamentos de uso humano.
Destacar en relación al nuevo Reglamento que pretende mejorar los procedimientos de autorización de comercialización de los medicamentos en la Comunidad, y modificar determinados aspectos administrativos de la Agencia Europea para la Evaluación de Medicamentos. Se considera necesario seguir autorizando mediante procedimiento comunitario centralizado los medicamentos de alta tecnología, y en particular, los derivados de biotecnología, también se incorpora a este procedimiento todo medicamento de uso humano que contenga una sustancia activa totalmente nueva, es decir, que aún no haya sido autorizada en la Comunidad y cuya indicación terapéutica sea el tratamiento del síndrome de inmunodeficiencia adquirida, el cáncer, los trastornos neurodegenerativos o la diabetes. El período de protección de los datos correspondientes a las pruebas preclínicas y los ensayos clínicos debería ser igual al establecido en la Directiva 2001/83/CE, excepto para los medicamentos para los que es obligatorio aplicar el procedimiento centralizado de autorización. En este último caso el período de protección de los datos debería ser mas prolongado. Se simplifica el nombre de la Agencia y los Comités pasando a denominarse Agencia Europea de Medicamentos y Comités de medicamentos de uso humano y veterinario.
La legislación comunitaria constituye una etapa importante hacia el objetivo de la circulación libre y segura de medicamentos en el espacio europeo, para ello es necesario adoptar medidas nuevas con el fin de aproximar las disposiciones legales, reglamentarias y administrativas nacionales que presentan diferencias sobre principios esenciales, a expensas de favorecer el funcionamiento del mercado interior, sin perjuicio de la salud pública. La regulación en materia de producción y de distribución de medicamentos debe tener un objetivo principal: la salvaguarda de la salud y el bienestar de ciudadanos y animales, así como de la salud pública. Las dos directivas que van a sufrir modificaciones en paralelo al Reglamento son las Directivas 2001/82/CE por la que se establece un código comunitario sobre medicamentos veterinarios y 2001/83/ CE, por la que se establece un código comunitario sobre medicamentos para uso humano. La aparición de nuevas terapias y el número creciente de productos denominados "fronterizos" entre el sector del medicamento y los demás sectores, hace que se replantee la definición de medicamento para evitar confusiones. Se apuesta por normas que respondan en particular a las necesidades de salud y bienestar de los animales productores de alimentos sobre bases que garanticen un nivel elevado de protección de los consumidores en un contexto que presente un interés económico suficiente para la industria del medicamento veterinario. Se refuerza el procedimiento de reconocimiento mutuo, creando un grupo de coordinación de dicho procedimiento para mejorar la cooperación entre Estados miembros de la Unión. Los criterios de calidad, seguridad y eficacia deben permitir la evaluación de la relación beneficio-riesgo de todo medicamento, tanto en el momento de la comercialización como cuando la autoridad competente lo juzgue oportuno. Se propone una renovación de la autorización comercialización a los 5 años, tras la cual el período de validez debería ser ilimitado. No obstante, deberían establecerse excepciones a esta norma cuando estén justificadas por motivos de salud pública.
Contexto nacional
La Agencia Española del Medicamento y Productos Sanitarios (AEMPS) es un organismo autónomo de los previstos en el artículo 43.1.a) de la Ley 6/1997, de 14 de abril, de Organización y Funcionamiento de la Administración General del Estado, adscrito al Ministerio de Sanidad y Consumo, con personalidad jurídica diferenciada y plena capacidad de obrar, actuando bajo las directrices del Ministerio de Agricultura, Pesca y Alimentación en lo relacionado al medicamento veterinario. La AEMPS fue creada a través de la Ley 66/1997 de acompañamiento de los Presupuestos Generales del Estado. Un año después la Ley 50/1998 incorpora a la Agencia competencias relativas a medicamentos de uso veterinario. En agosto del año 2003, y consecuencia de la promulgación previa de la Ley de Cohesión y Calidad del Sistema Nacional de Salud, cambia de denominación pasando a llamarse Agencia Española de Medicamentos y Productos Sanitarios.
La misión que tiene encomendada la Agencia es la de contribuir a la protección y promoción de la salud pública en materia de medicamentos de uso humano y veterinario, facilitar un acceso rápido de nuevos medicamentos a los pacientes, así como la de promover la investigación y el desarrollo de los medicamentos en todas sus etapas.
La Ley 16/2003 de 28 de mayo de Cohesión y Calidad del Sistema Nacional de Salud establece las competencias del Estado en materia de farmacia, la AEMPS asume como organismo técnico especializado las actividades de evaluación, registro, autorización, inspección, vigilancia y control de medicamentos de uso humano y veterinario y productos sanitarios, cosméticos y de higiene personal, y la realización de los análisis económicos necesarios para la evaluación de estos productos, sin perjuicio de las competencias ejecutivas de las CC.AA. El posterior desarrollo de la Ley a través del Real Decreto 1087/2003 de 29 de agosto, por el que se establece la estructura orgánica del Ministerio de Sanidad y Consumo, determina la estructura actual de la AEMPS.
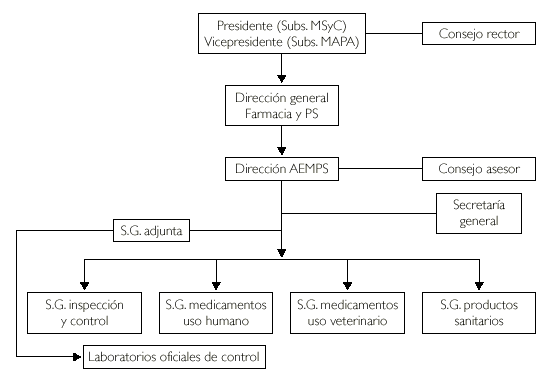
La Dirección General de Farmacia y Productos Sanitarios es el órgano al que corresponde la dirección, desarrollo y ejecución de la política farmacéutica del Departamento, así como el ejercicio de las funciones que competen al Estado en materia de financiación pública y fijación del precio de los medicamentos y productos sanitarios, y las condiciones especiales de prescripción y dispensación de medicamentos en el Sistema Nacional de Salud, en particular el establecimiento de visados previos a la dispensación. Le corresponde, asimismo, ejercer la potestad sancionadora cuando realice funciones inspectoras. Se adscribe a la Dirección General de Farmacia y Productos Sanitarios la Agencia Española de Medicamentos y Productos Sanitarios (fig. 1).
Figura 1.Real Decreto 1087/2003. Estructura orgánica de la AEMPS.
La AEMPS comparte con los órganos competentes de las CC.AA. las responsabilidades de control que afectan de una manera plena el sector farmacéutico: investigación preclínica y clínica con medicamentos, fabricación industrial, distribución mayorista, promoción y publicidad de medicamentos y la farmacovigilancia, así como las referentes a productos sanitarios cosméticos y de higiene personal.
Desarrollo e innovación
Los aspectos tecnológicos y de desarrollo de bases de datos han sido casi paralelos en ambos contextos, el europeo y el nacional, si bien es cierto que en nuestro país hemos desarrollado dos vías de actuaciones paralelas, una marcada por la propia estructura del registro nacional de medicamentos y la otra derivada de las instituciones europeas que contemplan la posibilidad del reconocimiento mutuo y el procedimiento europeo centralizado de registro de medicamentos. En este escenario de trabajo en el año 1991 se inició el Proyecto Care, dentro del Programa IDA, lanzado por la Comisión Europea con el objeto de mejorar las comunicaciones entre las Administraciones de los Estados miembros4. España junto con el Reino Unido lideró el proyecto Care en farmacovigilancia, que tuvo su continuidad con el Proyecto Euroscape, en el que además participarían Francia y Alemania. Mientras estos dos proyectos sirvieron de plataforma para el desarrollo actual de la farmacovigilancia en Europa, primero con el Eudrawatch y en la actualidad con Eudravigilance. Mencionar en este punto que las dos vías tienen punto final en un sistema de información denominado FEDRA, instrumento tecnológico base del Sistema español de farmacovigilancia.
Otra plataforma de actuación de la AEMPS en coordinación con la Unión Europea lo constituye las redes de vigilancia de medicamentos a través de los laboratorios oficiales de control(OMCL network). Estas redes se coordinan también con las Administraciones Sanitarias de las CC.AA. En conjunto se establece una vigilancia del mercado de medicamentos en el seno de la Unión, con independencia del procedimiento administrativo por el cual el medicamento alcanza el mercado (centralizado, reconocimiento mutuo o nacional).
Finalmente hacer mención al nuevo programa que España lidera en el seno de la Agencia Europea para la Evaluación de Medicamentos y que se denomina EUDRACT, orientado al registro y seguimiento de los ensayos clínicos que se desarrollan en la Unión Europea.