A oncofertilidade é um campo de interesse interdisciplinar de desenvolvimento recente que busca mesclar os conhecimentos em oncologia e medicina reprodutiva, com a contribuição das técnicas de reprodução assistida, para o desenvolvimento de estratégias de preservação da função gonadal e oferecer a possibilidade da procriação biológica aos sobreviventes de câncer. As estratégias de preservação da fertilidade feminina em pacientes oncológicas atualmente aceitas para a prática rotineira são a criopreservação de embriões e a criopreservação de oócitos maduros. Ocorre que, para execução de ambos, a indução de ovulação é obrigatória e, com ela, vêm os riscos teóricos de estimulação do crescimento de tumores estrogênio‐dependentes e a postergação do início do tratamento antineoplásico. Os protocolos de estimulação ovariana de início aleatório contemplam a intenção de se minimizar o atraso no início da quimioterapia ou radioterapia e o bloqueio ao crescimento tumoral e oferecem resultados satisfatórios, semelhantes aos obtidos em protocolos de início habitual. Apresentamos neste artigo as diretrizes clínicas da Sociedade Brasileira de Reprodução Humana para indução de ovulação em pacientes com tumor estrogênio‐dependente.
Oncofertility is an interdisciplinary interest field of recent development, which aims to merge the knowledge in oncology and reproductive medicine, with the help of assisted reproductive technologies, to develop strategies for gonadal function preservation and to offer the possibility of biological procreation to cancer survivors. Preservation strategies of female fertility in oncological patients currently accepted for routine practice are the cryopreservation of embryos and cryopreservation of mature oocytes. It happens that ovulation induction is mandatory for executing both strategies, and with it the theoretical risk of stimulation of estrogen‐dependent tumors growth and the postponement of anti‐neoplastic treatment. Random‐start ovarian stimulation protocols include the intention of minimizing the delay in onset of chemo‐radiotherapy and to block tumor growth, providing satisfactory results, similar to those obtained in the usual beginning protocols. This article presents the clinical guidelines of the Brazilian Society of Human Reproduction for ovulation induction in patients with estrogen‐dependent tumors.
Para 2015, o Instituto Nacional do Câncer (Inca) estimou a incidência de 190 mil casos de câncer na mulher brasileira, entre os quais 57.120 seriam tumores da mama, traduzidos em risco estimado de 56 casos por 100 mil mulheres. Os números mundiais para o câncer de mama são semelhantes e indicam ser ele o tipo de malignidade mais prevalente entre as mulheres em todo o mundo, com quase 25% de todos os tumores.1
A sobrevida ao câncer de mama em cinco anos pode chegar a 85% no Brasil e nos países desenvolvidos, principalmente entre mulheres jovens.1 O relatório do programa americano Surveillance, Epidemiology and End Results (SEER), do National Cancer Institute, documentou sobrevida em cinco anos de 84,5% entre mulheres que receberam diagnóstico de câncer antes dos 45 anos.2
Nesse cenário, em que crianças, adolescentes e mulheres adultas jovens com câncer submetem‐se anualmente a tratamentos antineoplásicos bem‐sucedidos, pode‐se esperar que a cada grupo de 570 mulheres entre 20 e 34 anos que uma seja sobrevivente de câncer na infância ou na adolescência.3
Paralelamente ao cenário em que a mortalidade por câncer decresce mais significativamente do que sua incidência, observamos que muitas mulheres optam por adiar a maternidade em prol de suas carreiras profissionais ou pela inexistência de uma unidade familiar. Nos Estados Unidos, nascimentos entre mulheres na faixa de 20 a 29 anos caem em ritmo de até 2% ao ano; em contrapartida há a ascensão de até 3% a partir dos 30 anos. Em 2013, houve quase 50 nascimentos/1.000 mulheres entre 35 e 39 anos, o que significou maior taxa de nascimentos na faixa etária nos últimos 52 anos.4 Da mesma forma, já se observa no Brasil aumento nas taxas de nascidos vivos entre mulheres de 30 a 39 anos, em detrimento das taxas entre as mais jovens.5
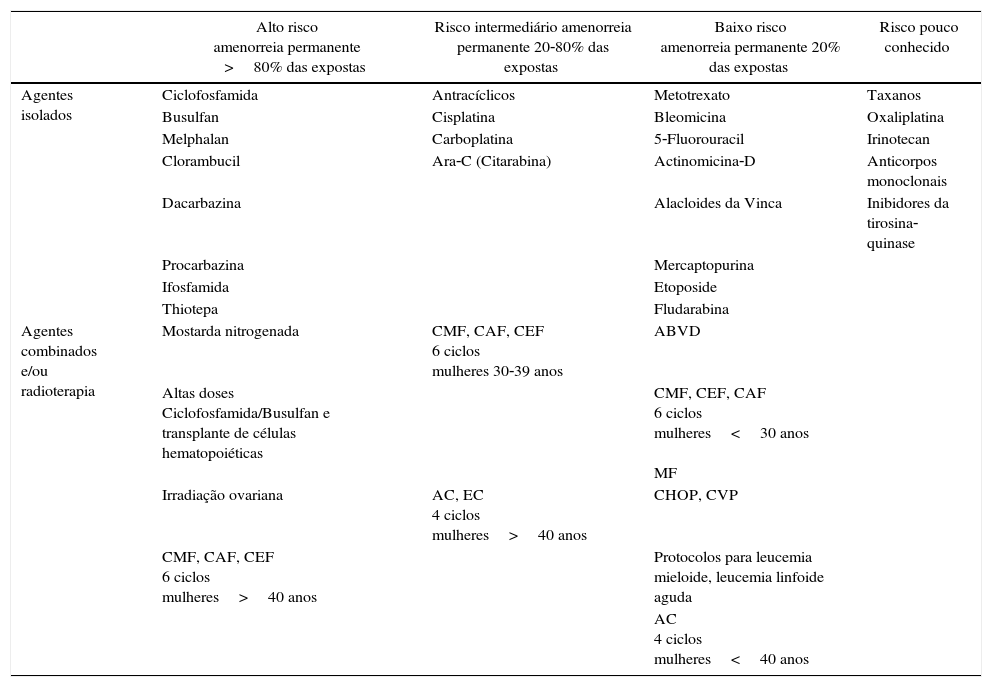
Os tratamentos antineoplásicos podem agredir os ovários e levar à restrição funcional ou mesmo à falência precoce (tabela 1). Na quimioterapia para tratamento do câncer de mama, o risco de amenorreia pode variar de 6 a 70%, a depender da faixa etária e do esquema de drogas usado.6,7 Considerando‐se que a incidência de muitos cânceres aumenta diretamente com a idade, podemos inferir que teremos cada vez mais diagnósticos de câncer em mulheres que ainda não constituíram prole e cada vez mais sobreviventes do câncer interessadas em ser mães.8
Risco de gonadotoxicidade ovariana estimado para diferentes combinações de agentes quimioterápicos antineoplásicos. Adaptado com autorização de Carvalho et al. (2014).9
| Alto risco amenorreia permanente >80% das expostas | Risco intermediário amenorreia permanente 20‐80% das expostas | Baixo risco amenorreia permanente 20% das expostas | Risco pouco conhecido | |
|---|---|---|---|---|
| Agentes isolados | Ciclofosfamida | Antracíclicos | Metotrexato | Taxanos |
| Busulfan | Cisplatina | Bleomicina | Oxaliplatina | |
| Melphalan | Carboplatina | 5‐Fluorouracil | Irinotecan | |
| Clorambucil | Ara‐C (Citarabina) | Actinomicina‐D | Anticorpos monoclonais | |
| Dacarbazina | Alacloides da Vinca | Inibidores da tirosina‐quinase | ||
| Procarbazina | Mercaptopurina | |||
| Ifosfamida | Etoposide | |||
| Thiotepa | Fludarabina | |||
| Agentes combinados e/ou radioterapia | Mostarda nitrogenada | CMF, CAF, CEF 6 ciclos mulheres 30‐39 anos | ABVD | |
| Altas doses Ciclofosfamida/Busulfan e transplante de células hematopoiéticas | CMF, CEF, CAF 6 ciclos mulheres<30 anos MF | |||
| Irradiação ovariana | AC, EC 4 ciclos mulheres>40 anos | CHOP, CVP | ||
| CMF, CAF, CEF 6 ciclos mulheres>40 anos | Protocolos para leucemia mieloide, leucemia linfoide aguda | |||
| AC 4 ciclos mulheres<40 anos |
AC, doxorrubicina+ciclofosfamida; CAF, ciclofosfamida+doxorubicina+fluorouracil; CEF, ciclofosfamida+epirrubicina+fluorouracil; CMF, ciclofosfamida+metotrexato+fluorouracil; MF, metotrexato+fluorouracil; EC, epirrubicina+ciclofosfamida; CHOP, ciclofosfamida+doxorrubicina+vincristina+prednisolone; CVP, ciclofosfamida+vincristina+prednisone; ABVD, adriamicina+bleomicina+vinblastina+dacarbazina.
Não restam dúvidas de que, ao falarmos em preservação da fertilidade depois de um câncer, os maiores ganhos sejam psicoemocionais, já que o sentimento de descontinuidade por não poder deixar um legado biológico é motivo de grande angústia e realça a impotência sentida perante uma doença em geral grave.9 Assim, com a intenção de garantir a esses pacientes que, quando livres da doença e em condições de procriar, possam ter chances de tentar a maternidade e/ou paternidade biológica por meio da fertilização in vitro, chamou‐se de oncofertilidade o resultado da intersecção entre a medicina reprodutiva e a oncologia.10 Esse campo de atuação multidisciplinar estuda as estratégias de preservação da saúde reprodutiva de sobreviventes ao câncer e tem como horizonte uma sobrevida com qualidade.
Estratégias reprodutivasAs estratégias de preservação da fertilidade feminina em pacientes oncológicas atualmente aceitas são a criopreservação de embriões e a criopreservação de oócitos maduros. O congelamento de embriões é o método de preservação fertilidade mais usado em todo o mundo, com sobrevivência embrionária ao descongelamento de até 80%,11 taxas de gravidez de 29 a 43% e nascidos vivos entre 22 e 32%, a depender da idade e de características individuais de melhor ou pior prognóstico reprodutivo.12,13
O congelamento de oócitos maduros assumiu recentemente grande importância,9 foi reconhecido no último consenso da Sociedade Americana de Oncologia Clínica,14 ao eliminar dilemas éticos que envolvem o congelamento de embriões, uma vez que não se pode excluir o risco de um desfecho letal na população oncológica.
De acordo com estudo de Cobo et al. (2013),15 em ciclos terapêuticos com oócitos criopreservados e aquecidos as taxas de implantação e de gravidez variam de 10 a 60% e de 30 a 60%, respectivamente, com resultados reprodutivos muito próximos aos obtidos com embriões oriundos da junção de gametas a fresco.15
Ocorre que, para execução de ambos os tratamentos com melhores resultados, a indução de ovulação é obrigatória e, com ela, incitam‐se certos riscos. Fato de grande preocupação para os oncologistas, os quais precisamos sensibilizar,16 é que a indução de ovulação necessária para obtenção de oócitos ou embriões pode estimular os tumores estrogênio‐dependentes, que representam 60 a 81% dos cânceres de mama.17 Outro elemento limitante é a necessidade de adiamento do tratamento antineoplásico para a estimulação ovariana.
Indução da ovulação: esquemasA definição do esquema de estimulação ovariana geralmente é feita de acordo com as preferências do médico assistente ou os protocolos do serviço, sofre influência direta do tempo disponível até o início do tratamento antineoplásico.18 Não há evidências suficientes que comparem resultados de protocolos com o uso de agonistas e antagonistas do GnRH em mulheres com câncer. Cabe registrar que, independentemente do protocolo escolhido, a estimulação ovariana em pacientes oncológicas comumente resulta em resposta folicular aquém da obtida em mulheres saudáveis da mesma faixa etária,19 o que foi particularmente demonstrado para o câncer de mama.20
O protocolo clássico de estimulação ovariana, com análogo agonista do GnRH, requer quatro a cinco semanas para ser concluído, uma vez que a inibição hipofisária deve ser iniciada na fase lútea média do ciclo que antecede ao terapêutico. Dessa forma, para a paciente oncológica, cujo tempo é escasso, ganha importância o desenvolvimento de protocolos opcionais, de início independente da fase do ciclo menstrual.
Os protocolos de estimulação ovariana de início aleatório (random‐start protocols), com o uso de análogos antagonistas do GnRH, têm sido desenvolvidos e usados com resultados satisfatórios e semelhantes aos obtidos em protocolos de início habitual,21–23 marcam um grande avanço da medicina reprodutiva e contemplam a intenção de se minimizarem os efeitos eventualmente causados pelo atraso no início do tratamento antineoplásico.
Da mesma forma, como não há preocupação com a qualidade do endométrio, tem‐se usado a indução da maturidade folicular final (trigger) com o análogo agonista do GnRH, na intenção de minimizar os riscos de síndrome de hiperestimulação ovariana.18,20,24–26
Embora não se tenha certeza sobre o real benefício, qualquer protocolo que impeça a interferência da elevação estrogênica sobre o comportamento do tumor será considerado ideal.27 Para isso, duas são as estratégias possíveis: bloqueio da conversão de androgênios a estrogênios pela aromatase ou bloqueio dos receptores estrogênicos em tecidos‐alvo.
Vários estudos têm documentado o uso do letrozol,28 inibidor da enzima aromatase, e do tamoxifeno,29,30 modulador seletivo do receptor estrogênico, associados às gonadotrofinas comumente usadas para estimulação ovariana, com resultados satisfatórios e sem pioria do prognóstico ou aumento aparente da recorrência do câncer em curto prazo. As drogas coadjuvantes podem ser usadas simultaneamente na presença de receptores estrogênicos positivos à imuno‐histoquímica do tumor.25,31
Quando a mulher encontra‐se na fase folicular inicialInicia‐se a estimulação ovariana preferencialmente até o quinto dia do ciclo menstrual ou, opcionalmente, depois do quinto dia, desde que não exista dominância folicular à ultrassonografia (folículo com diâmetro médio>10mm). As doses recomendadas de FSH ou HMG variam entre 150 UI/dia a 300 UI/dia e dependerão do protocolo estabelecido pelo serviço. Cavagna et al. (2013)25 sugerem que a dose de gonadotrofina seja definida pela contagem de folículos antrais (CFA), a saber: CFA>15 folículos=FSH ou HMG 150 UI/dia; CFA entre 10 e 15 folículos=FSH 225 UI/dia; e CFA<10 folículos=FSH ou HMG 300 UI/dia. Os mesmos autores recomendam adição de letrozol, na dose diária de 5mg, iniciado juntamente com a gonadotrofina, independentemente da presença de receptores estrogênicos. O primeiro controle ultrassonográfico deve ser feito no sexto dia de estimulação ovariana.25
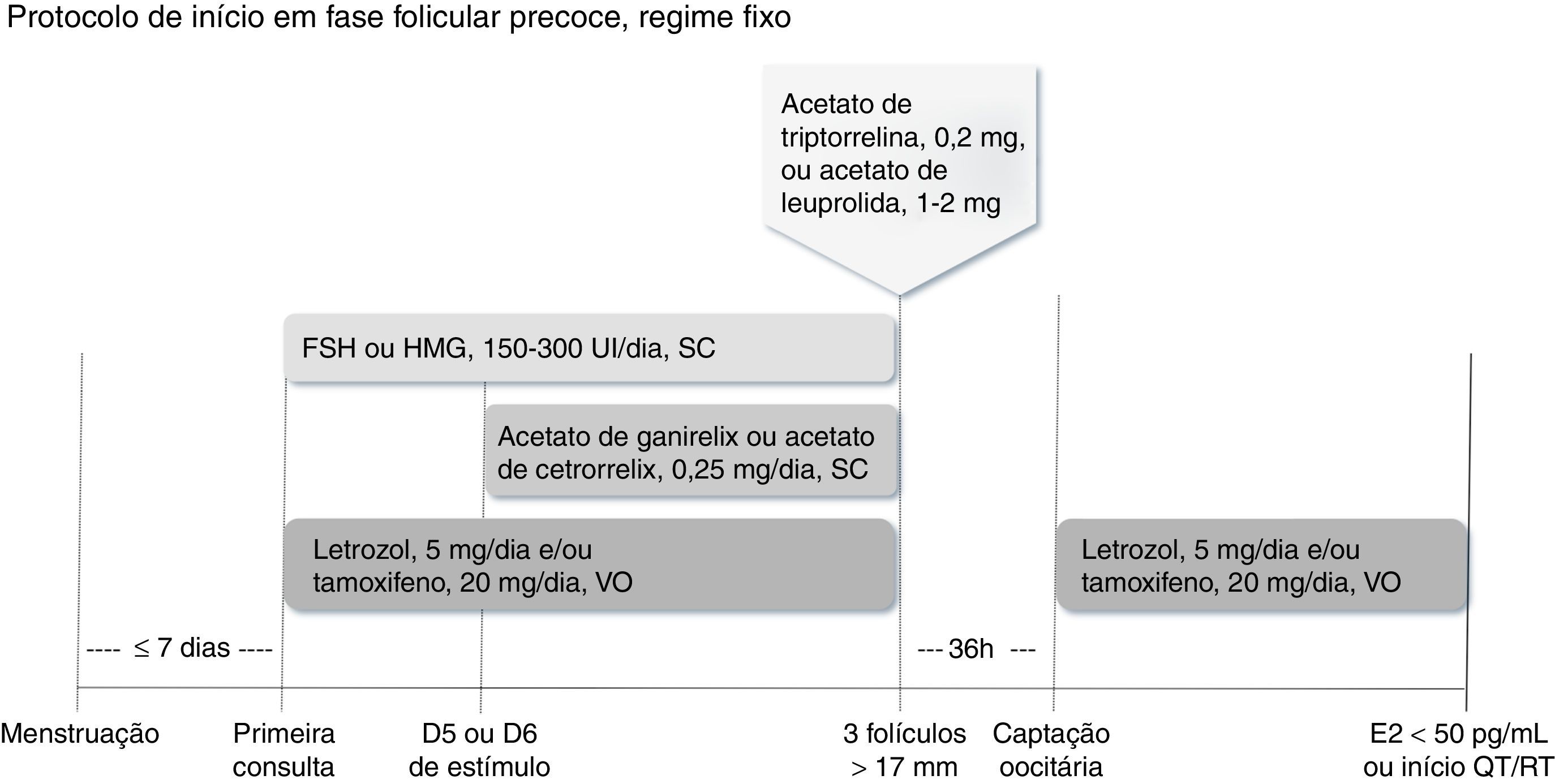
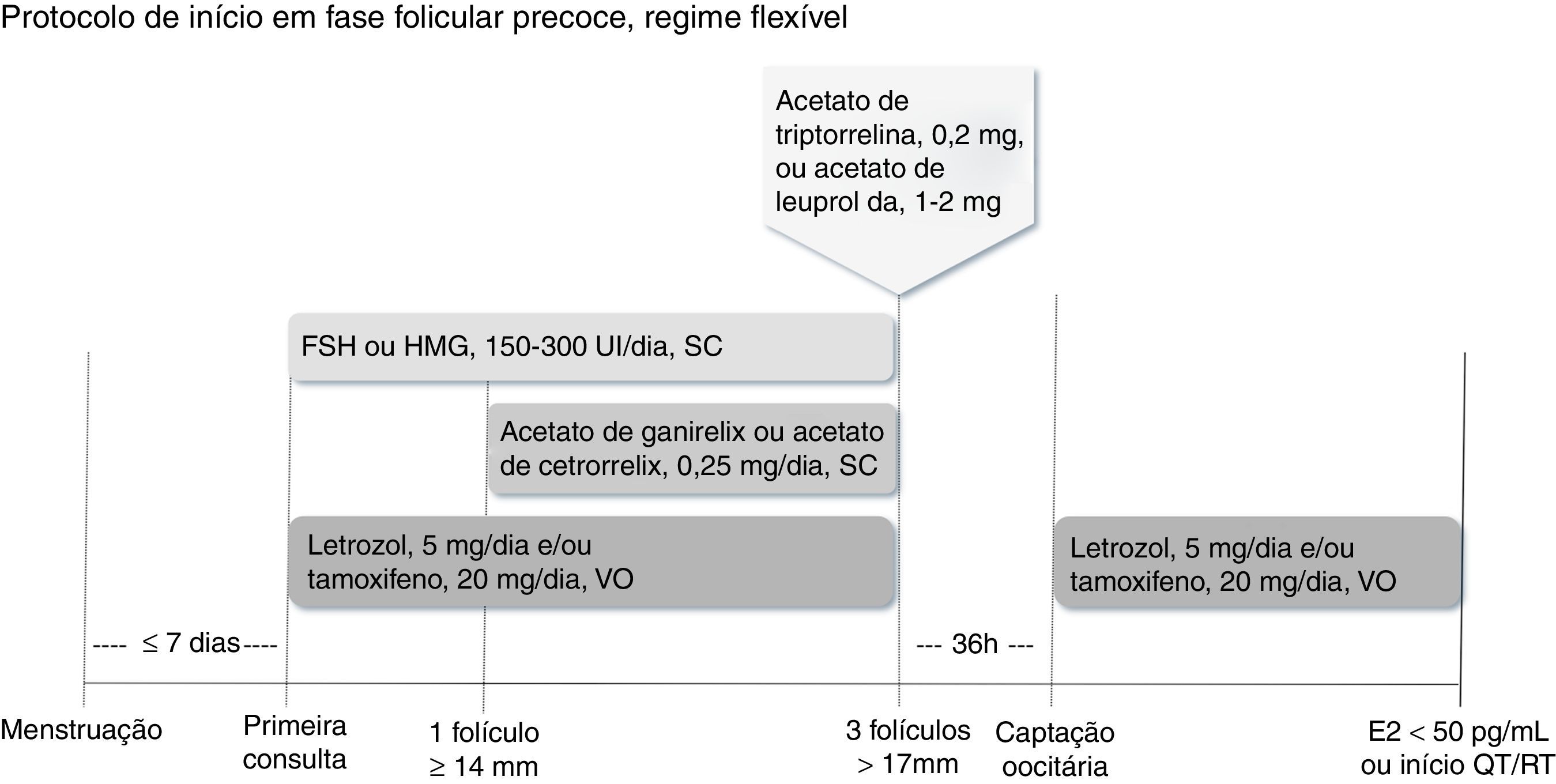
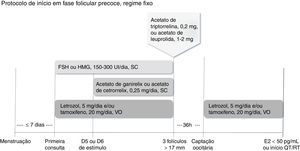
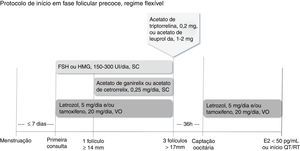
Há duas maneiras de se fazer o bloqueio hipofisário. No regime fixo, inicia‐se o análogo antagonista do GnRH (acetato de cetrorrelix ou acetato de ganirelix, 0,25mg/dia, via subcutânea) no quinto ou sexto dia de estimulação, independentemente da avaliação do crescimento folicular (fig. 1). No regime flexível, o análogo antagonista do GnRH deve ser introduzido quando o primeiro folículo dominante atingir diâmetro médio ≥ 14mm (fig. 2).32
Inicia‐se a estimulação ovariana preferencialmente até o quinto dia do ciclo menstrual com FSH ou HMG, associado ao letrozol e/ou ao tamoxifeno. Inicia‐se o antagonista do GnRH (acetato de cetrorrelix ou acetato de ganirrelix) no quinto ou sexto dia de estimulação, independentemente da avaliação folicular. Quando pelo menos três folículos estiverem com diâmetro>17mm, suspendem‐se medicamentos e procede‐se ao trigger com agonista do GnRH (acetato de triptorrelina ou acetato de leuprolida). A captação oocitária deve ser feita 36 horas depois, reinicia‐se proteção com letrozol e/ou tamoxifeno até níveis séricos de estradiol<50 pg/mL ou início da quimioterapia ou radioterapia.
Inicia‐se a estimulação ovariana preferencialmente até o quinto dia do ciclo menstrual com FSH ou HMG, associado ao letrozol e/ou ao tamoxifeno. Inicia‐se o antagonista do GnRH (acetato de cetrorrelix ou acetato de ganirelix) quando o folículo dominante atingir diâmetro ≥ 14mm. Quando pelo menos três folículos atingem diâmetro>17mm, suspendem‐se medicamentos e procede‐se ao trigger com agonista do GnRH (acetato de triptorrelina ou acetato de leuprolida). A captação oocitária deve ser feita 36 horas depois, reinicia‐se proteção com letrozol e/ou tamoxifeno até níveis séricos de estradiol<50 pg/mL ou início da quimioterapia ou radioterapia.
Quando pelo menos três folículos monitorados atingem diâmetro médio>17mm, suspendem‐se todos os medicamentos e procede‐se ao trigger pela administração de um agonista do GnRH (acetato de triptorrelina, 0,2mg, ou acetato de leuprolida, 1 a 2mg, dose única, subcutânea).24,32,33 A aspiração folicular para captação oocitária deverá acontecer cerca de 36 horas após a administração do agonista.25,32
Embora não exista ainda um posicionamento claro na literatura, letrozol ou tamoxifeno devem ser reiniciados logo depois da aspiração folicular e sugere‐se que sejam continuados até que os níveis séricos de estradiol sejam<50 pg/mL28 ou que se dê início ao tratamento antineoplásico.29
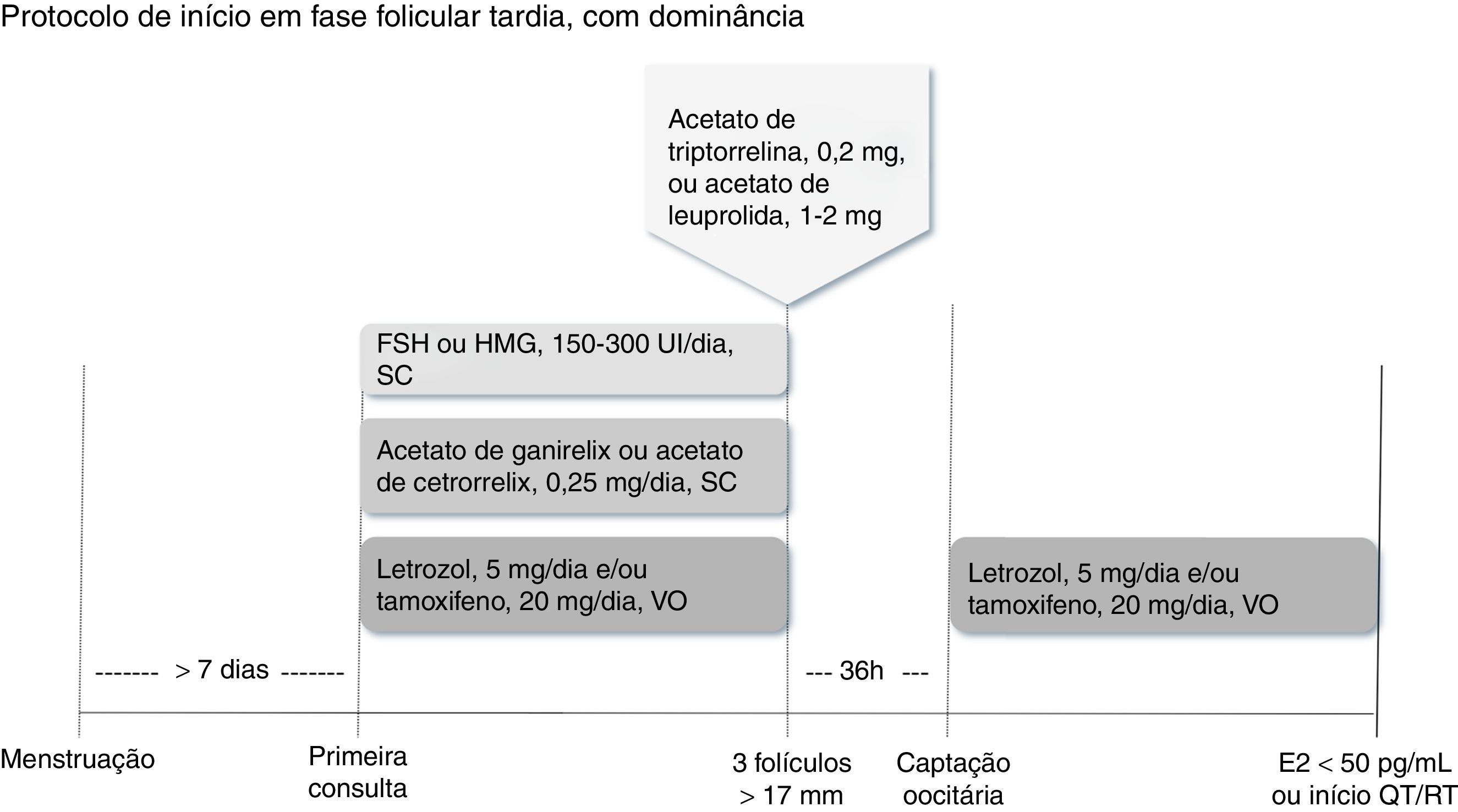
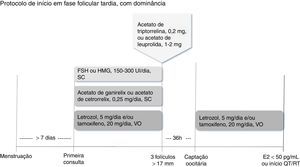
Quando a mulher encontra‐se na fase folicular tardiaDefine‐se como fase folicular tardia qualquer momento após o sétimo dia do ciclo menstrual com folículo dominante de diâmetro>10‐13mm e níveis plasmáticos de progesterona<2 ng/mL.21,25,34 Como o tempo para início da quimioterapia normalmente é escasso, o folículo dominante pode ser desconsiderado. Nesses casos, iniciam‐se simultaneamente a estimulação ovariana com FSH ou HMG em doses entre 150 UI/dia e 300 UI/dia, o antagonista do GnRH e o letrozol ou o tamoxifeno. Quando pelo menos três folículos dominantes atingem diâmetro médio>17mm, suspendem‐se todos os medicamentos em uso e procede‐se ao trigger com análogo agonista, programa‐se a captação oocitária para que aconteça 36 horas depois.25,26,31,32 A proteção com letrozol e/ou tamoxifeno deve ser reiniciada logo depois da aspiração folicular e mantida até que os níveis séricos de estradiol sejam<50 pg/mL28 ou que se inicie o tratamento antineoplásico (fig. 3).29
Inicia‐se simultaneamente a estimulação ovariana com FSH ou HMG, o antagonista do GnRH (acetato de ganirelix ou cetrorrelix) e o letrozol, e/ou o tamoxifeno. Quando pelo menos três folículos estiverem com diâmetro>17mm, suspendem‐se medicamentos e procede‐se ao trigger com análogo agonista (acetato de triptorrelina ou acetato de leuprolida). A captação oocitária deve ser feita 36 horas depois, reinicia‐se a proteção com letrozol e/ou tamoxifeno até níveis séricos de estradiol<50 pg/mL ou início da quimioterapia ou radioterapia.
Quando o tempo é favorável, pode‐se estimular o crescimento do folículo existente com FSH ou HMG em doses de 75 UI/dia juntamente com o antagonista do GnRH e uma droga coadjuvante (letrozol e/ou tamoxifeno), até que ele atinja diâmetro médio>17mm, quando se deve proceder ao trigger com agonista do GnRH. Passadas 36 horas, procede‐se à a aspiração desse folículo para captação e criopreservação oocitária. Em seguida, mantém‐se apenas o antagonista por dois a três dias para luteólise. Depois de dois a três dias do bloqueio hipofisário exclusivo, sem que se suspenda o antagonista, inicia‐se estimulação ovariana e seguem‐se as diretrizes acima mencionadas.25,26,31,32
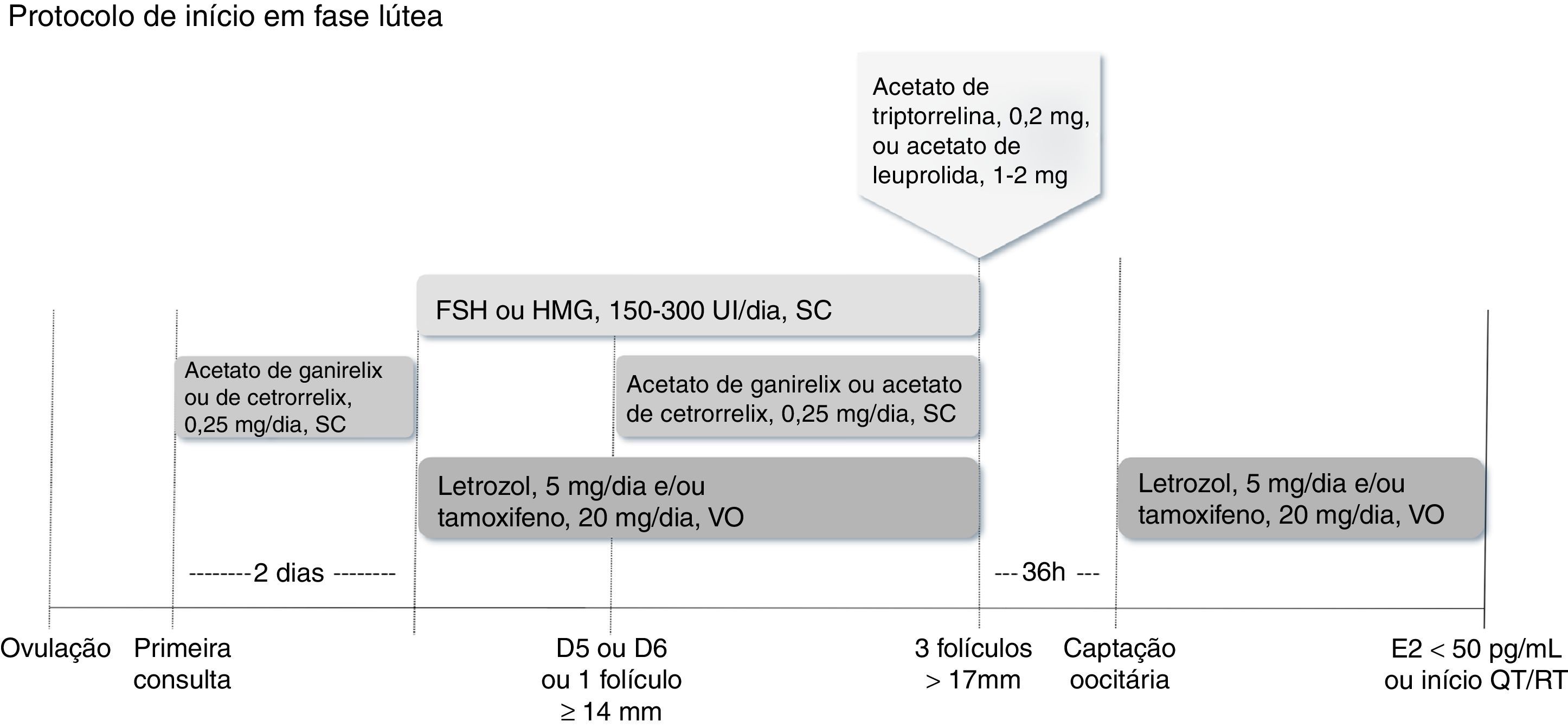
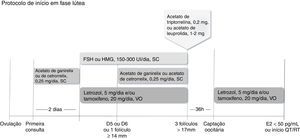
Quando a mulher encontra‐se na fase lúteaQuando a estimulação ovariana inicia‐se na fase lútea, administra‐se o antagonista do GnRH por dois dias, período depois do qual se procede à estimulação com FSH ou HMG em doses entre 150 UI/dia e 300 UI/dia, associado ao letrozol e/ou tamoxifeno. O antagonista deve ser reintroduzido quando o primeiro folículo dominante atingir diâmetro médio>13mm ou em regime fixo e são mantidos os medicamentos em uso concomitante até o dia do trigger, nos moldes anteriormente (fig. 4).23,25
Administra‐se antagonista do GnRH por dois dias, período depois do qual se procede à estimulação com FSH ou HMG em doses entre 150 UI/dia e 300 UI/dia, associado a letrozol e/ou tamoxifeno. O antagonista pode ser reintroduzido em regime fixo ou flexível. Quando pelo menos três folículos estiverem com diâmetro>17mm, suspendem‐se medicamentos e procede‐se ao trigger com análogo agonista (acetato de triptorrelina ou acetato de leuprolida). A captação oocitária deve ser feita 36 horas depois, reinicia‐se proteção com letrozol e/ou tamoxifeno até níveis séricos de estradiol<50 pg/mL ou início da quimioterapia ou radioterapia.
Há na literatura relato de início concomitante de todas as drogas no primeiro dia de tratamento.23,35 Assim, pode‐se opcionalmente iniciar imediatamente a estimulação com FSH ou HMG em doses entre 150 UI/dia e 300 UI/dia, juntamente com o antagonista do GnRH e letrozol e/ou tamoxifeno, que devem ser usados concomitantemente até o dia do trigger, nos moldes anteriores.
Por fim, como opção mais conservadora, Humaidan et al. (2005)36 descreveram protocolo com luteólise induzida, pelo qual se administra o antagonista do GnRH em dose única na fase lútea (acetato de cetrorrelix 3mg, indisponível no Brasil), que leva a paciente à menstruação em dois a quatro dias. A vantagem reside na antecipação do fluxo menstrual para início breve do estímulo gonadotrófico nos moldes acima mencionados para a fase folicular inicial.36
Preservação da fertilidade em mulheres que já tenham recebido tratamento antineoplásicoA estimulação ovariana depois de a mulher ter sido submetida a tratamento antineoplásico resulta em números reduzidos de oócitos, além de existir efeito deletério sobre a qualidade de gametas e embriões gerados a partir deles. Dessa forma, não há respaldo para preservação de gametas de mulheres que já tenham recebido tratamento antineoplásico e a prática não é recomendada.37
Indução da ovulação em pacientes com tumor estrogênio‐independenteOs protocolos descritos aplicam‐se igualmente à indução da ovulação em mulheres portadoras de tumor estrogênio‐independente, torna‐se facultativo o uso das drogas protetoras (letrozol e tamoxifeno), a depender das condutas protocoladas em cada serviço.
Preservação da fertilidade em pacientes não oncológicasA preservação da fertilidade também surge como opção para mulheres em situação não oncológica, como na motivação social, quando desejam adiar a procriação, quando portadoras de doenças não neoplásicas cujos tratamentos possam agredir irreversivelmente os ovários, como em doenças autoimunes e hematológicas,38 nas portadoras de doenças progressivas, como a endometriose,39 ou em doenças que impliquem na necessidade de extirpação das gônadas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Estudo conduzido pela Sociedade Brasileira de Reprodução Humana (SBRH), São Paulo, SP, Brasil.