El hueso es un tejido metabólicamente activo que sufre un continuo proceso de remodelado, lo que confiere al esqueleto su capacidad regenerativa y de adaptación funcional. En los individuos jóvenes el remodelado mantiene la masa esquelética prácticamente invariable, mientras que el envejecimiento, la menopausia y distintas enfermedades alteran el balance del remodelado hacia un predominio de la resorción sobre la formación, lo que ocasiona una pérdida ósea y, como consecuencia, osteoporosis.
El proceso de remodelado tiene lugar en las unidades básicas de remodelado (BMU), formadas por los tres tipos celulares presentes en el hueso. La unidad de remodelado se compone de un frente de osteoclastos seguido de un grupo de osteoblastos, un aporte vascular y nervioso, y tejido conectivo. Su vida media es de entre seis y nueve meses y se calcula que en un determinado momento están activas entre 1,5 y 2 millones de estas unidades. El desarrollo simultáneo de este proceso en múltiples unidades de remodelado apoya su regulación por factores del microambiente óseo. También se ha demostrado la influencia de factores hormonales, fuerzas mecánicas locales y cambios ocurridos en el hueso como consecuencia del envejecimiento o daños por fatiga.
FUNCIONES DEL REMODELADO
Se considera que la principal función del proceso de remodelado es el mantenimien to de las características mecánicas del hueso a través de la sustitución de las zonas dañadas por hueso nuevo. También es respon sable de la organización espacial del hueso a la carga mecánica experimentada en cada momento y contribuye a la homeostasis mineral y especialmente al balance fosfocálcico.
REGULACION
Aunque en los últimos años se ha producido un gran avance en el conocimiento de los factores que intervienen en la regulación del proceso de remodelado, aún quedan por aclarar muchos aspectos. Esta regulación es compleja ya que integra diversos estímulos como son factores mecánicos, hormonales, citoquinas y factores de crecimiento. Además, muchos de estos factores ejercen efecto sobre osteoblastos y osteoclastos, o bien actúan estimulando a su vez una cascada de señales.
FACTORES MECANICOS
La influencia de los factores mecánicos sobre el remodelado es responsable de la pérdida de masa ósea inducida por la falta de actividad física. El ejercicio físico moderado e intenso tiene un efecto positivo sobre la masa ósea, que se reduce con la edad por el deterioro de las células mecanosensoras del hueso.
El mecanismo por el cual el hueso detecta y traduce los estímulos físicos, y cómo estas señales se traducen en señales biológicas y de expresión génica, no se conoce en su totalidad, aunque recientemente se ha destacado el importante papel que tienen los osteocitos en este proceso. Las fuerzas mecánicas inducidas sobre el hueso son detectadas por los osteocitos conectados entre sí y con las lining cells por un sistema canalicular, y los microdaños por fatiga inducen la apoptosis de osteocitos en las zonas adyacentes, seguida de la resorción de los sitios afectados1. En estudios con animales se ha comprobado cómo la carga mecánica estimula la transformación de las células del endostio en osteo blastos además de estimular factores de transcripción de forma proporcional a la carga2.
FACTORES HUMORALES
PARATOHORMONA
Los efectos de la paratohormona (PTH) sobre el tejido óseo son complejos y no están totalmente aclarados. Niveles elevados de forma continuada producen un aumento de la actividad osteoclástica, mientras que su administración intermitente tiene efectos anabólicos a través de un aumento del número de osteoblastos y de la tasa de formación3. La PTH estimula la secreción de RANKL, IGF-1 e interleuquinas (IL) 6 y 11 por los osteoblastos, lo que activa la diferenciación y función osteoclástica. Otros efectos de la PTH son la transformación de osteocitos en osteoblastos activos y el aumento de la vida media de estos por disminución de la apoptosis4.
CALCITRIOL
Aunque su efecto sobre el remodelado es difícil de estudiar por sus múltiples acciones, estimula la resorción ósea a través de su acción sobre osteoclastos y sus precursores. Entre sus acciones se incluye el aumento de la absorción intestinal de calcio y la inhibición de la secreción de PTH actuando sobre las paratiroides, e interviene también en la mineralización ósea5.
CALCITONINA
In vitro inhibe la acción de los osteoclastos tras inducir un descenso en el número de receptores, aunque se desconoce la trascendencia biológica de esta acción6. Algunos autores proponen además acciones sobre los osteoblastos, aunque otros cuestionan su papel en la fisiología del hueso. El aumento observado de los niveles de calcitonina durante el crecimiento, el embarazo y la lactancia apoyan su papel en el mantenimiento de la masa ósea.
HORMONAS SEXUALES
Las hormonas sexuales desempeñan un importante papel tanto en el desarrollo como en el mantenimiento de la masa ósea. Tradicionalmente se ha considerado que el papel de estrógenos y testosterona era específico del sexo, aunque en la actualidad se sabe que ambos tipos de hormonas desempeñan acciones en el tejido óseo ya que las células expresan receptores para estrógenos y testosterona independientemente del sexo. Las hormonas sexuales ejercen un efecto positivo sobre la masa ósea ya que inhiben la resorción ósea y estimulan la formación. El efecto antirresortivo de los estrógenos es más potente, y aunque ambos estimulan la formación ósea, la testosterona influye fundamentalmente sobre osteoblastos maduros y osteocitos, mientras que los estrógenos regulan la actividad osteoblástica en distintas fases de su desarrollo.
Estrógenos
El papel fundamental de los estrógenos en el metabolismo óseo queda de manifiesto en la pérdida de masa ósea que ocurre en los primeros años de postmenopausia tras el cese de la actividad estrogénica, lo que ocasiona un aumento del remodelado debido a la elevación de distintas citoquinas prorresortivas como IL-1, M-CSF y el factor de necrosis tumoral a7 (TNF-a). Sus efectos sobre las células óseas están mediados por dos clases de receptores estro génicos expresados en citoplasma y núcleo: el alfa, presente en osteoblastos y osteo clastos, y el beta, expresado solo por osteoblastos. Los estrógenos ejercen además sus efectos positivos a través de un efecto paracrino.
El papel de los estrógenos in vitro es la inhibición del desarrollo de los osteoclastos, favoreciendo su apoptosis por estímulo de la producción del factor de crecimiento tumoral b (TGF b) por los osteoblastos, además de inhibir la producción de IL-6, el principal estímulo para la resorción. Previenen también la apoptosis osteoblástica8. La deficiencia estrogénica incrementa además la apoptosis de los osteocitos8, lo que, según se ha propuesto, altera la función mecanosensora del sistema canalicular de reparación de microdaños contribuyendo a la fragilidad ósea (fig. 1)9.
Fig. 1. Efectos estrogénicos sobre el remodelado. Adaptada de Riggs BL et al9.
Aunque los andrógenos desempeñan funciones similares in vitro, en general los estudios que han investigado los efec tos de los andrógenos sobre las células óseas no arrojan resultados tan concluyentes como los realizados con estrógenos, tanto para los efectos sobre producción de citoquinas como sobre proliferación y diferenciación osteoblástica.
El papel de los estrógenos sobre la adquisición de la masa ósea y el desarrollo del esqueleto masculino se conocen a partir de la experiencia de pacientes con defectos genéticos del gen de la aromatasa, en los que a pesar de niveles elevados de andrógenos existía una baja masa ósea y que respondía a la administración de estrógenos10. Las acciones estrogénicas sobre la masa ósea del varón se realizan fundamentalmente a través del receptor alfa como se ha demostrado en estudios con ratones knockout. Estudios transversales y posteriormente prospectivos han demostrado el efecto de mantenimiento de la masa ósea adquirida, y así, un estudio longitudinal de Koshla et al mostró una estrecha correlación entre los niveles de estradiol biodisponible en suero y la masa ósea en varones, tanto en jóvenes como en ancianos11. Posteriormente en un estudio de intervención en el que se bloqueó la producción de estrógenos y andrógenos en varones ancianos, solo los estrógenos fueron capaces de inhibir la resorción, mientras que la administración de testosterona fue mucho menos eficaz. El papel dominante de los estrógenos en el metabolismo óseo del esqueleto adulto del varón ha sido comprobado en varios estudios posteriores. El efecto antirresortivo más potente de los estrógenos y su importante papel en la masa ósea de los varones puede explicarse por los diferentes efectos ejercidos sobre la producción de OPG. Tanto in vivo como in vitro los estrógenos estimulan la producción de OPG y suprimen la de RANKL, mientras que la testosterona inhibe ambas moléculas12. Es posible que exista un efecto diferencial sobre otras moléculas reguladoras de la osteoclastogénesis.
Andrógenos
Los principales efectos de los andrógenos tanto en varones como en mujeres son incrementar el tamaño óseo y estimular la formación, con un discreto efecto de inhibición de la resorción ósea. La mayoría de los estudios realizados in vitro demuestran un efecto estimulador de la proliferación y diferenciación osteoblástica, a la vez que inhibe su apoptosis13. La vía efectora de estos efectos se ha propuesto que es un estímulo de TGF b e IGF-1 junto a una inhibición de IL-613. La existencia de un efecto directo de los andrógenos sobre los osteoclastos es controvertida, y se ha propuesto que gran parte de los efectos de inhibición osteoclástica están mediados de forma indirecta por la acción sobre osteoblastos, aunque es importante destacar que la mayoría de estos efectos no han sido comprobados in vivo.
En varones, los andrógenos son responsables de una mayor masa muscular, lo que determina mayor tamaño óseo y carga mecánica, aunque se desconoce la trascendencia de este efecto sobre el remodelado. Experiencias en animales resaltan el principal efecto esquelético de los andrógenos, la regulación del tamaño óseo por potenciación de la aposición de hueso sobre la superficie perióstica externa14.
En mujeres, el efecto positivo de los andrógenos sobre la densidad mineral ósea (DMO) queda demostrado en la menor masa ósea que presentan las mujeres con síndrome de resistencia a los andrógenos, asociación que ha sido comprobada en estudios observacionales posteriores. En mujeres premenopáusicas, los niveles de testosterona total y biodisponible muestran asociación con la DMO en el cuello femoral15, y parecen ser un buen marcador de predicción de pérdida ósea en dicha localización tras ajustar por edad, peso y niveles de estradiol. Los datos en cuanto a la asociación entre andrógenos suprarrenales y DMO no son concluyentes, aunque puede que contribuyan a mantener la masa ósea.
La administración de diversos andrógenos tiene efectos positivos sobre la DMO en mujeres postmenopáusicas, aunque los efectos virilizantes y sobre parámetros metabólicos han impedido hasta el momento su aplicación clínica. En cualquier caso, a pesar de sus efectos positivos sobre la masa ósea, los andrógenos en la mujer no desempeñan un papel central en el metabolismo óseo como ocurre con los estrógenos en los varones.
FACTORES LOCALES
Numerosos factores locales, paracrinos y autocrinos, influyen en el proceso de remodelado. Su origen son las células óseas, células sanguíneas como los monocitos y macrófagos, y células de la médula ósea. En su regulación intervienen factores sistémicos y hormonales y elementos de la matriz ósea liberados durante el proceso de resorción, como los fragmentos de colágeno.
IGF-1 Y PROTEÍNAS TRANSPORTADORAS
Aunque la secreción máxima de IGF-1 se produce durante la pubertad, en la edad adulta tiene un importante papel en el mantenimiento de la masa ósea. Se origina en distintos tejidos, incluido el hueso, y a pesar de su reconocida importancia sobre la masa ósea su mecanismo de acción no está totalmente aclarado. Estimula la replicación de precursores osteoblásticos, su activación y la síntesis de la matriz y el colágeno, y ha demostrado inhibir su apoptosis in vitro16. La IGF-1 se almacena en la matriz y es posible que también intervenga en el acoplamiento. Su asociación con la masa ósea de mujeres postmenopáusicas y el riesgo de fracturas osteoporóticas ha quedado de manifiesto en diversos estudios17.
Las células óseas producen también los seis tipos de proteínas transportadoras de IGF, IGF-BP1-6. Su papel exacto no está claro y entre sus funciones descritas están la de prolongar la vida media de la IGF o el transporte a las células diana. La IGF-BP4 tiene un papel inhibidor de la replicación y diferenciación de los osteoblastos, mientras que la IGF-BP 5 sería estimuladora18.
INTERLEUQUINAS
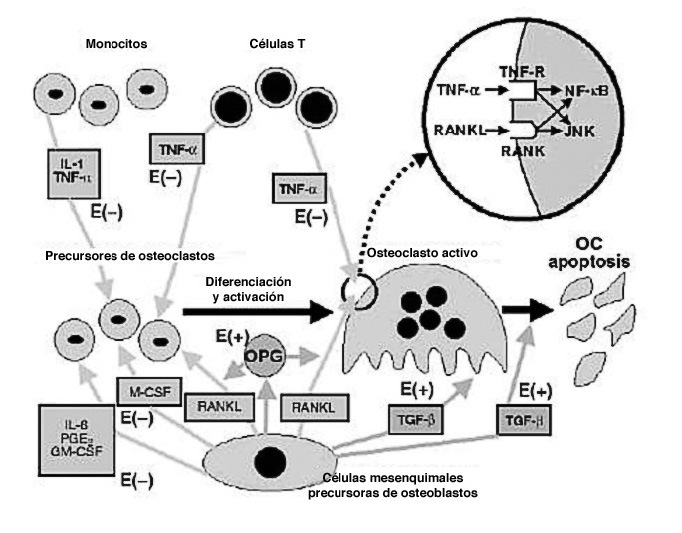
El receptor activador del factor nuclear kappa B, RANKL, es el factor crítico en las fases más tardías de la diferenciación osteoclástica. Una vez diferenciados numerosos factores influyen sobre la actividad y supervivencia osteoclásticas: IL-1 es un factor activador de los osteoclastos maduros19; IL-3 estimula la diferenciación de precursores a osteoclastos maduros; las IL-4, 13 y 10 inhiben la maduración osteo clástica20; IL-6 estimula precursores hema topoyéticos, lo que de forma indirecta esti mula la formación osteoclástica. IL-11 estimula la producción de RANKL por los osteoblastos, y las IL-12 y 18 inhiben la formación de osteoclastos21.
TGF b E INF g
TGF b es una de las principales moléculas que intervienen en el proceso de remodelado, ya que inhibe la apoptosis osteoblástica e induce la apoptosis de los os teoclastos, fenómeno que da paso a la fase de formación. Estimula además la síntesis de OPG, por lo que se considera una señal crucial entre las células que mantienen el remodelado óseo y desempeña un importante papel en la reparación de fracturas22. El INF g ejerce una potente inhibición de la formación de osteoclastos, a la vez que estimula la síntesis de diversas citoquinas, entre ellas IL-1823.
BONE MORPHOGENETIC PROTEINS (BMP)
Son péptidos de la familia del TGF b cuya acción sobre receptores específicos estimula la diferenciación osteoblástica e induce la formación ósea durante el desarrollo esquelético. En el tejido adulto su función es mantener un aporte continuo de osteoblastos, y también se ha demostrado que pueden estimular la resorción ósea24. Como característica única, induce la diferenciación de células del tejido conectivo a células osteoprogenitoras.
ÓXIDO NÍTRICO
La fuente principal de óxido nítrico en el hueso son los osteoblastos y las células endoteliales. Ha cobrado importancia en los últimos años como regulador del remodelado, ya que es un mediador del efecto anabólico de los estrógenos25 y de la respuesta mecánica del hueso26, y ejerce también efectos de inhibición osteoclástica.
LEPTINA
La leptina es una hormona liberada desde el tejido adiposo con efecto regulador del apetito y de la función reproductora por acción en el sistema nervioso central. Recientemente se ha destacado su efecto sobre el esqueleto, y se han demostrado receptores para leptina en células mesenquimales preosteoblásticas y osteoblastos maduros. Su efecto es anabólico ya que promueve la diferenciación osteoblástica, aumenta la síntesis de proteínas de la matriz y reduce su apoptosis27. Disminuye también la función osteoclástica por aumento de OPG y descenso de RANKL28. Existe una correlación negativa entre leptina y marcadores de remodelado en mujeres con osteoporosis postmenopáusica y una correlación positiva con la masa ósea, aunque la causalidad de esta asociación se ve interferida por la relación entre masa grasa, masa ósea y leptina29.
SISTEMA OPG/RANKL
Son clásicos ya los estudios en ratones que ayudaron a comprender la función del sistema OPG-RANKL. Los ratones knockout para OPG desarrollaban una osteoporosis grave, mientras que la sobreexpresión de OPG en ratones transgénicos producía osteo petrosis. La ausencia de RANKL en ratones producía osteopetrosis, alteración de la dentición por ausencia de osteoclastos maduros, ausencia de ganglios linfáticos y deficiencia de linfocitos B y T, mientras que la administración de RANKL en su forma soluble se acompañaba de un aumento de la actividad osteoclástica, osteoporosis e hipercalcemia.
RANKL es el factor crítico para la diferenciación osteoclástica, y en presencia del factor estimulante de colonias de macrófagos (M-CSF) se une a RANK y promueve la diferenciación, activación y supervivencia de los osteoclastos, así como su adherencia a la superficie ósea30. En este proceso de diferenciación también intervienen otras moléculas de la familia de los TNF como TNFa, posiblemente favoreciendo la acción de RANKL o estimulando similares vías intracelulares. Las células osteoblásticas también pueden producir M-CSF, que facilita la replicación de los precursores osteoclásticos y que puede inducir la expresión de RANK en dichos precursores.
La OPG se une al ligando del receptor activador del factor nuclear kappa B (RANKL) neutralizando su acción, y de esta manera inhibe la osteoclastogénesis. La cascada de señalización que ocurre tras la unión de RANKL y RANK no se conoce en su totalidad, aunque se sabe que están implicados factores asociados al receptor de TNF y especialmente el 6. Los preosteoblastos y osteoblastos maduros expresan RANKL, que se une a RANK expresado en la superficie de los precursores de osteoclastos, y favorece la diferenciación de precursores hacia la formación de osteoclastos maduros. La OPG se une a RANKL, al que neutraliza, y como resul tado inhibe la osteoclastogénesis y la acti vidad osteoclástica, a la vez que induce la apoptosis de los osteoclastos. La producción de OPG respecto a la de RANKL aumenta con la diferenciación de los osteoblastos, permitiendo que el osteoclasto maduro rellene el espacio de remodelado. La regulación del proceso de remodelado integra la unión de múltiples factores de diverso origen, lo cual dota de una gran complejidad a este proceso. Aunque en los últimos años se ha producido un gran avance en el conocimiento de estos mecanismos reguladores, aún quedan por aclarar múltiples aspectos. El conocimiento cada vez mayor de las vías metabólicas y genéticas que regulan el funcionamiento del tejido óseo dota aún de una mayor complejidad al conocimiento exacto del proceso de remodelado. Por otra parte, el mayor conocimiento existente sobre las vías y moléculas que intervienen en su regulación, abre la posibilidad de futuras terapéuticas en el campo de las enfermedades metabólicas óseas.