El balance esquelético depende del equilibrio entre la actividad destructora de hueso de los osteoclastos y la formación posterior de hueso nuevo por parte de los osteoblastos. Es evidente, por tanto, la importancia de los mecanismos moduladores de la actividad de estas células en la patogenia de la osteoporosis y otras enfermedades óseas. Una serie de estudios publicados en los últimos 5 años han puesto de manifiesto el papel de la vía Wnt (wingless) en la modulación de la actividad osteoblástica y se empiezan a atisbar posibilidades de manipularla farmacológicamente en beneficio de los pacientes osteoporóticos. Por ello, pretendemos revisar brevemente la vía Wnt y especialmente los aspectos más interesantes en relación con las enfermedades óseas. Algunas de las moléculas implicadas en esta vía tienen nombres caprichosos, difícilmente relacionables con su estructura o función, por lo que mantendremos su denominación y abreviatura originales, sin intentar traducirlas al español.
LA VÍA WNT
La vía Wnt es una vía de señalización celular muy conservada a lo largo de la escala filogenética. No es exclusiva del hueso, sino que interviene también de manera importante en otros procesos, incluyendo la embriogénesis, la organogénesis y la tumorigénesis1,2.
La activación de esta vía induce diversas señales intracelulares que en conjunto se dividen en dos grandes grupos: la vía canónica o clásica y la vía no canónica, de las cuales la primera es la mejor conocida.
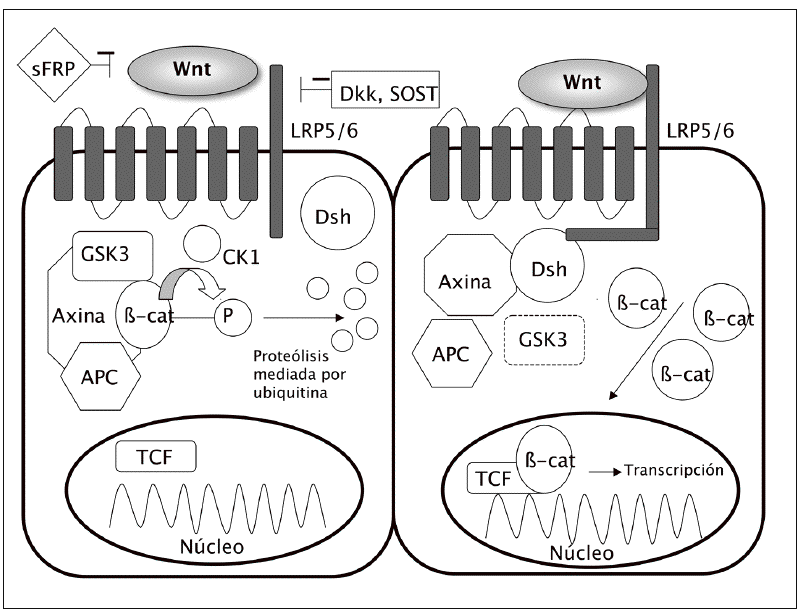
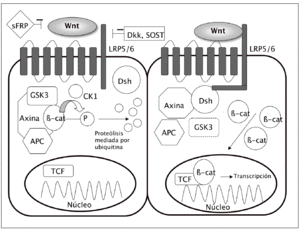
El acontecimiento clave en la cascada ca nónica es la acumulación de la b-catenina en el citoplasma y su ulterior translocación al núcleo celular, donde modula la transcripción de diferentes genes (fig. 1).
Fig. 1. Vía canónica: en ausencia de unión de los ligandos Wnt a su receptor (izquierda), lab-catenina se degrada y los genes no se transcriben. Sin embargo, cuando se activa la vía (derecha) disminuye la degradación de lab-catenina, con lo que se acumula en el citoplasma, desde donde puede entrar en el núcleo y activar los factores de transcripción. APC: proteína de la poliposis adenomatosa del colon; b-cat:b-catenina; cK: caseína-cinasa; Dsh: dishevelled; GSK3: glucógeno sintasa cinasa 3b; sFRP: proteína soluble similar a frizzled; SOST: esclerostina.
En condiciones basales, cuando no se encuentra estimulada la vía Wnt, existe en la célula un complejo formado por varias proteínas, incluyendo la axina, la proteína de la poliposis adenomatosa del colon (APC) y la glucógeno sintasa cinasa 3b (GSK3). Esta última fosforila la b-catenina, lo que la hace susceptible de unirse a la ubiquitina y ser posteriormente degradada en los proteasomas. De esta manera, los nive les intracelulares de b-catenina se mantienen relativamente bajos.
Sin embargo, cuando se activa la vía Wnt, por la unión de los ligandos Wnt a su receptor, se descompone el complejo axina-APC-GSK3, lo que disminuye la actividad fosforilativa de la GSK3. A su vez, ello disminuye la fosforilación de la b-catenina y en consecuencia su degradación en los proteasomas. La b-catenina hipofosforilada se acumula en el citoplasma y se transloca al núcleo, donde regula la expresión genética a través de la activación de diversos factores de transcripción, como el Tcf-Lef1 (T cell factor/lymphocyte enhancer factor 1)3.
Los ligandos Wnt actúan a través de la fijación a receptores situados en la membrana celular. Estos tienen dos componentes principales: por un lado, una proteína frizzled (familia de receptores transmembrana serpentinados con 7 dominios); por otro, un co-receptor relacionado con el de las LDL (lipoprotein receptor related peptide o LRP). Hay dos formas principales de LRP, la 5 y la 6. Es la unión de los ligandos Wnt a este complejo frizzled-LRP5/6 lo que desencadena la inhibición del complejo axina-APC-GSK3, con el consiguiente aumento de los niveles de b-catenina.
Los componentes de la vía Wnt canónica pueden por tanto agruparse de la mane ra siguiente.
1. Ligandos Wnt: son glucoproteínas hidrofóbicas que contienen cadenas de ácido palmítico unido a ciertas citosinas. Estas moléculas son capaces de fijarse al receptor e iniciar la activación de la vía. Hasta la fecha se han descubierto 19, que se denominan con números y letras (por ejemplo Wnt-5a, Wnt-10b, etc.).
2. Receptores de membrana: constituidos por las proteínas frizzled (de las que hay diversos tipos) y los co-receptores LRP5 y LRP6. Otra molécula que puede actuar como co-receptor es la llamada kremen.
3. Efectores intracelulares: forman parte de cascadas complejas en las que participan diferentes proteínas. Algunas de ellas ya han sido mencionadas (axina, APC, GSK3, b-catenina, etc.). Otras moléculas implicadas incluyen las proteínas dishevelled.
4. Antagonistas: se han descrito diversos tipos de moléculas con acción inhibidora sobre la vía Wnt. En algunos casos se trata de moléculas que actúan como señuelos que se fijan a los ligandos Wnt y compiten así por su fijación al receptor. Es el caso de algunas proteínas solubles tipo frizzled que son segregadas al medio extracelular. Otra molécula inhibidora es la esclerostina, codificada por el gen SOST, que se expresa en los osteocitos. La esclerostina parece fijarse a LRP5/6, impidiendo la formación del complejo LRP5/6-frizzled-Wnt. Otras moléculas capaces de antagonizar las señales Wnt por unirse a los co-receptores LRP5/6 y kremen son las de la familia dickkopf. Hay al menos cuatro miembros de esta familia, de los cuales el tipo 1 (Dkk-1) es especialmente importante en el hueso4.
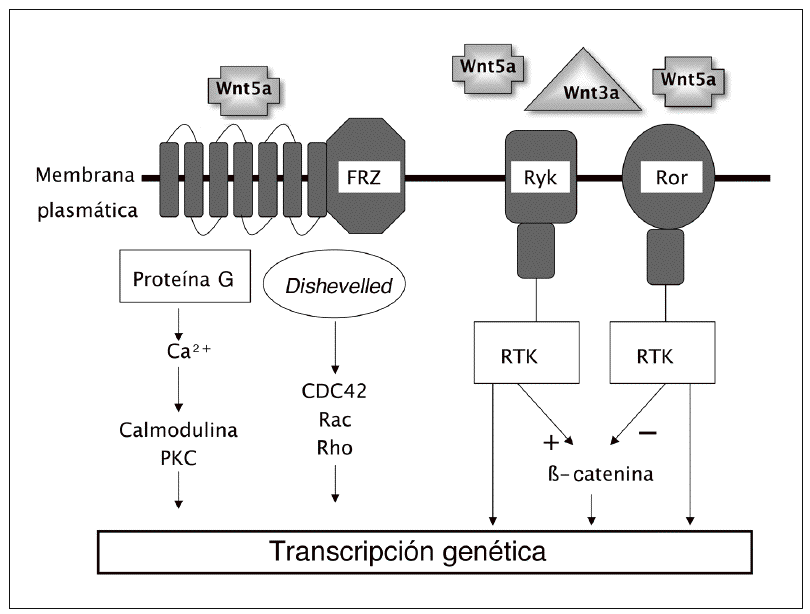
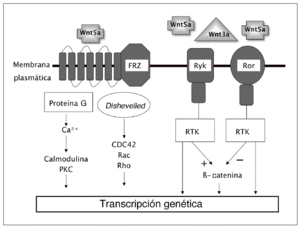
La canónica es la mejor conocida de las vías de transmisión de señales Wnt. Pero hay evidencia de que estas señales pueden activar también otros mecanismos que utilizan mediadores diferentes a los de la vía canónica. Estas vías no canónicas parecen estar implicadas en diversas fases del desarrollo embrionario, al menos en animales inferiores. Su papel real en los mamíferos es discutido. Los mecanismos de señalización incluyen cambios en los niveles intracelulares de calcio y parecen implicar diferentes enzimas fosforilantes como la protein-cinasa C y la protein-cinasa dependiente de la calmodulina. Algunos ligandos, como el Wnt-5a, pueden activar preferentemente esta vía. Por otro lado, otros ligandos Wnt parecen ser capaces de actuar a través de receptores de membrana diferentes de la proteína frizzled, incluyendo los Ror1, Ror2 y Ryk, que pertenecen a la familia de tirosin-cinasas ligadas a receptores3,5 (fig. 2).
Fig. 2. Vías no canónicas con sus diversos mecanismos de acción. FRZ: frizzled. PKC: proteína-cinasa C. RTK: tirosin-cinasas ligadas a receptores.
WNT Y ESQUELETO
WNT Y MASA OSEA
En estudios in vitro se ha demostrado que la activación de la vía Wnt favorece la diferenciación de los precursores osteoblásticos a través de la inducción de Runx2/Cbaf y otros factores de transcripción6,7. Por el contrario, los elementos inhibidores de esta vía, como la proteína soluble frizzled, tienen un efecto negativo sobre la supervivencia de los osteoblastos8. Por otro lado, los estudios con animales transgénicos han demostrado importan tes cambios esqueléticos cuando se altera la expresión de algunos genes de esta vía, como Wnt-10b, b-catenina, la proteína soluble frizzled o las propias LRP5 y LRP6.
Las primeras evidencias directas de la importancia de la vía Wnt en la homeostasis esquelética en humanos surgieron a partir del descubrimiento de que dos raros fenotipos óseos estaban causados por mutaciones de la LRP5. Uno de ellos es un tipo muy infrecuente de osteoporosis, el llamado síndrome de pseudoglioma-osteoporosis (cuyas siglas en inglés son OPPG), enfermedad autosómica recesiva que cursa con ceguera por crecimiento vascular anormal, fracturas y deformidades de las extremidades9. En contraposición con el síndrome OPPG, se ha descrito el fenotipo de alta densidad ósea (HBM, high bone mass), con herencia autosómica dominante, valores de Z $ 5, elevación de los marcadores de formación ósea y resorción normal10-12. Tanto el OPPG como el HBM se deben a mutaciones en el gen LRP5, si bien en el primer caso se trata de mutaciones inhibidoras y, en el segundo, de mutaciones activadoras. La enfermedad de Van Buchem y la esclerosteosis son otros trastornos relacionados con la vía Wnt que cursan con aumento de la masa ósea. Se deben a mutaciones en el gen de la esclerostina, un inhibidor de Wnt.
Esos casos de mutaciones demuestran fehacientemente la implicación de la vía Wnt en la homeostasis esquelética, pero, dada su rareza, tienen poca relevancia directa en la patogenia de la osteoporosis. No obstante, varios investigadores han analizado si algunos polimorfismos frecuentes de ciertos genes de la vía Wnt se asocian a diferencias en la densidad mineral ósea y podrían, por tanto, desempeñar algún papel en la predisposición genética a la osteoporosis. Así, aunque los resultados no son totalmente concluyentes, se ha sugerido que, efectivamente, ciertos polimorfismos de los genes Wnt10b, LRP5, LRP6 y SOST pueden influir en la masa ósea13-16.
ARTROSIS
La artrosis es la enfermedad más frecuente de las articulaciones. Aunque su característica principal es la degradación del cartílago articular, algunos estudios sugieren que el hueso subyacente puede estar implicado en la patogenia. La vía Wnt puede desempeñar también algún papel en este proceso. De hecho, esta vía modula la diferenciación de los precursores pluripotenciales, de manera que en general tiende a favorecer la formación de osteoblastos e inhibir la de condrocitos y adipocitos. Algunos investigadores han señalado que en las articulaciones artrósicas se altera la expresión de algunos genes de esta vía y, en concreto, aumenta el Wnt-7b17.
Es posible que algunas variantes genéticas de la vía Wnt condicionen el riesgo de desarrollar artrosis. Por ejemplo, Loughlin et al encontraron que un polimorfismo del gen FRZB, que codifica una proteína soluble frizzled inhibidora de Wnt se asocia con la artrosis de cadera18. Por su par te, Smith et al señalaron que un haplotipo definido por 5 polimorfismos bialélicos del gen de LRP5 estaba relacionado con el riesgo de sufrir artrosis de rodilla, con una odds ratio de 1,619.
TUMORES OSEOS
La vía Wnt se ha implicado en diversos fenómenos relacionados con la carcinogénesis. Por otro lado, se ha sugerido que puede estar implicada en las lesiones óseas del mieloma múltiple. A diferencia de otros procesos neoplásicos, en este trastorno es característica la existencia de lesiones osteolíticas sin aumento reactivo de la formación ósea. Se ha señalado que ello puede ser debido a la producción de Dkk-1 por las células plasmáticas. Puesto que el Dkk-1 bloquea los ligandos Wnt, el aumento de Dkk-1 inhibiría esta vía y por tanto la actividad osteoblástica20.
Curiosamente, la vía Wnt también se ha implicado en el desarrollo de las metástasis osteoblásticas del cáncer de próstata, de manera compleja. Hall et al han planteado un modelo en el cual la producción de Dkk-1 y otros factores como PTHrP favorecería la destrucción local de tejido óseo y el anidamiento y desarrollo de las células metastásicas. Posteriormente, la expresión de ligandos Wnt por esas mismas células ejercería un efecto paracrino favorecedor de la actividad osteoblástica21.
INTERACCIONES DE WNT CON OTROS FACTORES MODULADORES DEL REMODELADO OSEO
Se ha sugerido que la vía Wnt puede estar implicada en los cambios en el modelado y el remodelado del hueso en respuesta a los estímulos mecánicos. Así, se ha visto que en los individuos con el fenotipo HBM los cambios más significativos en la masa ósea se dan en los lugares de sobrecarga mecánica. Según una hipótesis planteada por Johnson, la mutación HBM alteraría la «sensibilidad» del hueso, de forma que en los niños con HBM se induciría la formación de hueso con estímulos mecánicos inferiores a los normales12,22.
También parecen existir interacciones entre la vía Wnt y otras vías reguladoras de la diferenciación de los osteoblastos, como las proteínas morfogenéticas óseas, y en particular la BMP-2.
Las dosis altas de glucocorticoides suprimen la formación de hueso e incrementan las fracturas. Los mecanismos son complejos, pero parecen incluir una apoptosis incrementada de las células de estirpe osteoblástica23. Los mecanismos exactos a través de los cuales sucede esto están aún por dilucidar, pero se ha sugerido una conexión entre los glucocorticoides y la vía Wnt canónica. Dos trabajos de Ohnaka et al24,25 muestran que la dexametasona eleva la expresión de Dkk-1 y suprime la señalización Wnt en cultivos de osteoblastos humanos normales. Esos resultados in vitro han sido confirmados en otros estudios que muestran que la administración de metilprednisolona a ratas aumenta la expresión de Dkk-1 en el hueso, de una forma dependiente del tiempo y de la dosis.
Incluso la propia PTH ejerce parte de sus efectos a través de esta vía de señalización. Se ha descrito que aumenta la expresión de varios miembros de la familia frizzled (como FZD-1, FZD-2, y sFRP-4), y aumenta los niveles de b-cadherina y Wnt-3. Aunque la mayor parte de los estudios acerca de la influencia de la vía Wnt en el hueso se han centrado en su influencia sobre los osteoblastos, existen datos experimentales que indican que esta vía puede modular también la actividad osteoclástica. En general, la activación de la vía Wnt inhibe la formación de osteoclastos, puesto que tiende a disminuir la producción de RANKL y a aumentar la de osteo protegerina por parte de los osteoblastos. De hecho, en algunos modelos murinos de artritis se ha comprobado que el bloqueo de Dkk-1, un inhibidor de la vía Wnt, previene el desarrollo de lesiones óseas26,27.
CONCLUSIÓN
La vía Wnt es una vía de señalización celular implicada en múltiples procesos orgánicos. A nivel del esqueleto su papel mejor conocido es la regulación de la actividad osteoblástica (proliferación, funcionamiento y apoptosis), pero también parece tener efectos moduladores de los osteoclastos.
El interés en la vía de señalización Wnt continúa expandiéndose rápidamente. Tras ser descubiertas hace 20 años, las proteínas Wnt se mencionan en más de 5.000 artículos incluidos en Medline, la mitad de los cuales se han publicado en los últimos 3 años. Cada vez disponemos de más evidencias de que las modificaciones de la señalización Wnt son un factor contribuyente en muchos trastornos esqueléticos. Por otro lado, la vía Wnt parece estar implicada en la patogenia de otras en fermedades, tan diversas como el cáncer o la esquizofrenia28. Además, las proteínas Wnt parece que expanden, o al menos mantienen, ciertas poblaciones de células madre indiferenciadas29. Por tanto, la vía Wnt incluye dianas potenciales para agentes terapéuticos frente a diversas enfermedades. Cabe mencionar en esta línea los estudios que muestran que el bloqueo de la esclerostina aumenta la masa ósea en animales de experimentación.
No obstante, quedan muchos interrogantes. Algunas de las cuestiones pendientes son: cómo se inicia la señalización tras la unión de Wnt a su receptor, qué mecanismos están implicados en la regulación de la actividad del complejo fosforilador de la b-catenina y, sobre todo, cómo se consi gue la especificidad en la actividad nuclear de la b-catenina y la regulación de genes diana. En cuanto al campo específico de la osteoporosis, es especialmente relevante conocer cuál es el papel real de esta vía en la osteoporosis primaria.
Para profundizar en el conocimiento de la vía Wnt, el lector interesado puede consultar la página del profesor Roel Nusse, quien ha efectuado contribuciones notables al estudio de esta vía de señalización (www.stanford.edu/~rnusse/wntwindow.html).