INTRODUCCIÓN
La infección por el virus C de la hepatitis (VHC) es extraordinariamente frecuente, pues afecta al menos al 0,5% de la población mundial1. Afortunadamente, la mayoría de los individuos con anticuerpos frente al VHC no desarrolla enfermedad2.
Aun así, la hepatopatía crónica por virus C, incluyendo cirrosis y eventualmente hepatocarcinoma, constituye un problema sanitario de primera magnitud3, terminando frecuentemente en trasplante hepático. Además, aun cuando existe tratamiento para esta entidad -a base de interferón pegilado y ribavirina-, el resultado es subóptimo, especialmente en el caso de la infección por genotipo 1, el más frecuente en nuestro medio4. Por añadidura, muchos pacientes acuden ya con cirrosis establecida, lo que dificulta el control de la enfermedad, y un porcentaje apreciable tiene coinfección por el virus de la inmunodeficiencia humana (VIH).
Independientemente de su etiología, la cirrosis hepática es una entidad en la que se asiste a un progresivo depósito de colágena en el hígado5, que paulatinamente va a distorsionar la arquitectura hepática, aislando a los hepatocitos unos de otros y alterando la función de la víscera. Dado el papel central del hígado en el metabolismo, no es de extrañar que la cirrosis hepática se asocie a gran cantidad de alteraciones multisistémicas. Una de ellas es la denominada osteopatía del cirrótico, que para muchos estriba en solo osteoporosis6.
Varios mecanismos pueden intervenir en la osteopatía del cirrótico. En nuestro medio, la causa principal de la cirrosis es el alcoholismo crónico7, y tal vez por eso la osteopatía de la cirrosis alcohólica ha sido la más estudiada. El alcohol altera el metabolismo calcio-fósforo y causa también osteoporosis de por sí8,9, alteración en la que además influye la malnutrición propia del alcohólico10. Hay que señalar también que la malnutrición es frecuente en el cirrótico11, y se sabe que en la malnutrición proteica experimental aparece osteoporosis12. Además, como últimamente se ha señalado, también puede desempeñar un papel la alteración del perfil de citoquinas potencialmente involucradas en el metabolismo óseo13-16. Resumiendo, en la osteopatía del cirrótico alcohólico influyen el deterioro funcional hepático, el eventual efecto del alcohol y la malnutrición acompañante, desconociéndose el valor relativo de cada uno de estos factores.
Si bien parece claro que existe una osteopatía ligada a la hepatopatía alcohólica, especialmente en fase de cirrosis hepática, son pocos los estudios que analizan si en la hepatopatía crónica por virus C aparece también afectación ósea, y el papel de la infección crónica, de la malnutrición, o de la insuficiencia hepática en su génesis. Son escasos los estudios que han analizado el metabolismo calcio-fosfórico en la infección por VHC, y para mayor oscuridad, los resultados son dispares. Así, por ejemplo, Schiefke et al17 encuentran reducción de la densidad mineral ósea (DMO) en hepatópatas crónicos no cirróticos infectados por virus B (13 casos) o C (30 casos) de la hepatitis, refiriendo además que la parathormona (PTH) y la fosfatasa alcalina específica del hueso guardaban relación con la fibrosis. En cambio, Yenice et al18, en 105 pacientes con hepatitis B o C, no encuentran osteoporosis; por el contrario, González-Calvin et al19 encuentran que hay osteoporosis en 40 pacientes con hepatitis vírica, debida a un incremento de la reabsorción ósea, resultado que concuerda con otro trabajo previo del mismo grupo20 en 32 pacientes, entre los que había un 53% de osteoporóticos, con marcadores bioquímicos sugestivos de una alta tasa de recambio óseo. Duarte et al21 también encuentran que en la hepatitis viral la actividad de la PTH está incrementada. En estos estudios la importancia del estado nutricional no ha sido evaluada. Por todo lo expuesto, es de sumo interés estudiar el metabolismo calcio-fosfórico y la presencia de osteopenia u osteoporosis en hepatópatas afectos de hepatitis C, y su relación con el estado nutricional y con las alteraciones de hormonas involucradas en el metabolismo calcio-fosfórico (factor de crecimiento insulínico [IGF]-1, PTH, 1,25 dihidroxivitamina D), cuyos valores pueden verse afectados por el deterioro de la función hepática.
MATERIAL Y MÉTODOS
PACIENTES
Se incluyen 28 pacientes con infección por el VHC ingresados en el Servicio de Medicina Interna para ser sometidos a biopsia hepática previa a la instauración de tratamiento antiviral. La edad media de estos pacientes era de 40,32 ± 9,56 años (rango 23-63 años); 5 eran mujeres y 23 eran varones; 6 estaban coinfectados por el VIH.
MÉTODO
Todos los pacientes fueron sometidos a una exploración física completa que incluía una serie de parámetros antropométricos que definimos a continuación.
Antropometría
Se determinaron parámetros nutricionales simples (área muscular del brazo y área grasa del brazo) utilizando cinta métrica y un lipocalibre tipo Holtain (Whitehouse Skinfold Caliper) y el índice de masa corporal (IMC) expresado como peso/talla2.
Densitometría
A todos los pacientes se les practicó estudio densitométrico y de composición corporal mediante un densitómetro tipo Hologic QDR-2000 (software v. 5.54) (Waltham, Mass, USA); se determinaron los siguientes parámetros:
1. DMO en ambos brazos, ambas piernas, costillas, pelvis, columna lumbar y columna dorsal.
2. DMO en ambos trocánteres, zona intertrocantérea, triángulo de Ward, determinando también el T-score en cada uno de esos niveles. Los mismos parámetros se determinaron en columna lumbar.
3. Masa magra, total y a nivel de ambos brazos, ambas piernas y tronco.
4. Masa grasa total y a nivel de ambos brazos, ambas piernas y tronco.
Parámetros bioquímicos
Además de la analítica rutinaria (que incluye función hepática y carga viral del VHC), a todos los pacientes se les determinaron los siguientes parámetros en muestras de suero extraídas tras 12 horas de ayuno, a las 8 am del día en el que fueron sometidos a biopsia hepática: PTH intacta mediante método radioisotópico (sensibilidad de 1 pg/ml, valores esperados 10-65 pg/ml [Nichols, San Juan de Capistrano, CA, USA]); 1,25 dihidroxivitamina D mediante análisis radioinmune para su determinación cuantitativa en suero (sensibilidad de 0,6 ng/ml, valores esperados 9,2-63,3 ng/ ml [Biosource Europe S.A., Bélgica]); IGF-1 por prueba inmunométrica quimioluminiscente marcada enzimáticamente de fase sólida, analizada mediante analizador Immulite (sensibilidad de 20 ng/ml [DPC, Los Ángeles, CA, USA]); osteocalcina por método inmunométrico en el analizador Immulite (sensibilidad de 0,3 ng/ml, valores esperados < 2,0-21 ng/ml [DPC, Los Ángeles, CA, USA]); cuantificación del telopéptido C-terminal del colágeno tipo I(cross lap) determinado mediante ELISA, prueba inmunoenzimática (sensibilidad de 0,010 ng/ml, valores esperados medios en varones 0,332 ng/ml [Nordic Bioscience Diagnostics A/S, Dinamarca]).
Tanto la densitometría ósea como los parámetros bioquímicos fueron determinados también en un grupo control constituido por 21 individuos de 38,67 ± 9,76 años (rango 24-64).
Valoración histológica
Se valoró el índice de Knodell teniendo en cuenta la intensidad de la necrosis portal, la degeneración intralobular, la fibrosis y el infiltrado inflamatorio.
MÉTODO ESTADÍSTICO
Se realizó mediante el programa SPSS (Chicago, Illinois, USA). Primeramente se procedió a determinar si las variables se distribuían de forma normal (prueba de Kolmogorov-Smirnov). Posteriormente, una vez comprobada la distribución normal de los parámetros, procedimos a comparar los distintos grupos mediante la t de Student, análisis de varianza y, posteriormente, la prueba de Student-Newman-Keuls y la correlación simple mediante la r de Pearson.
RESULTADOS
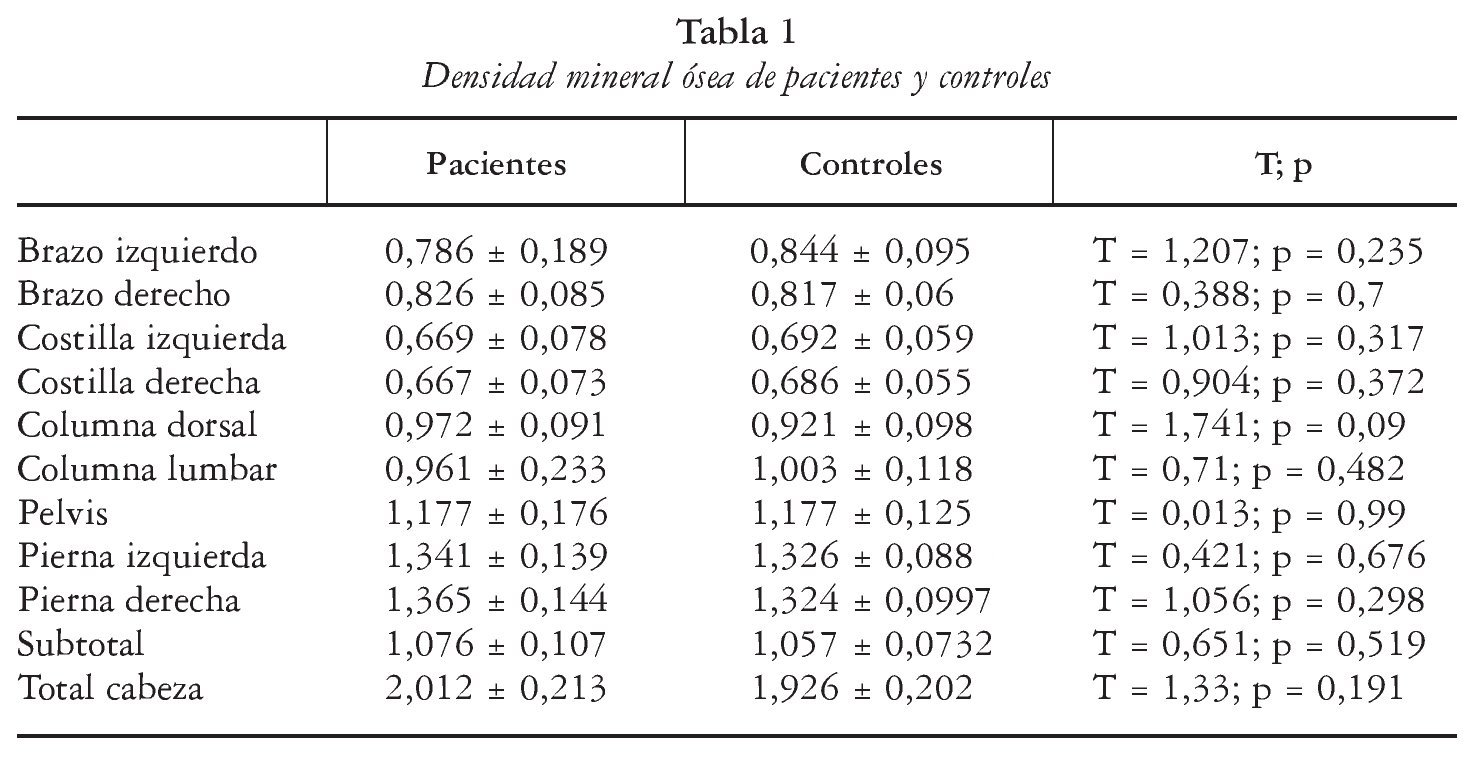
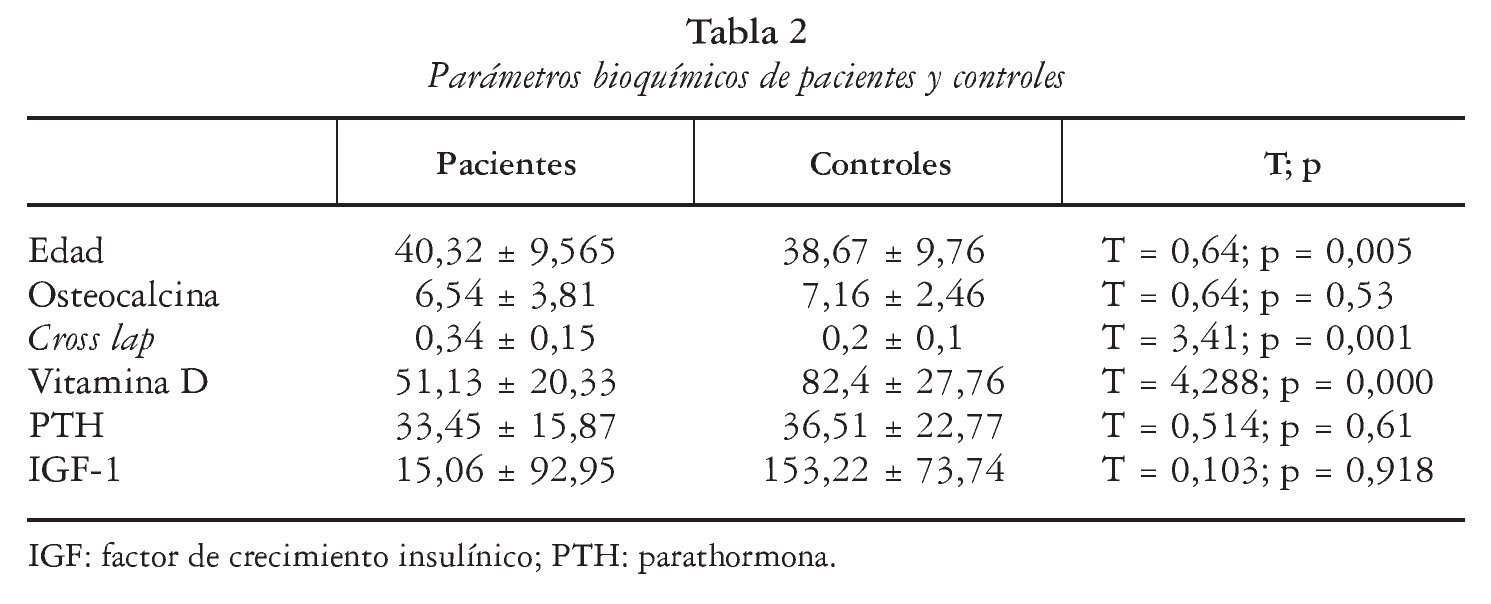
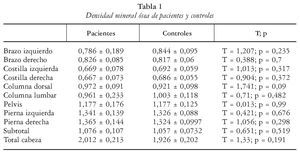
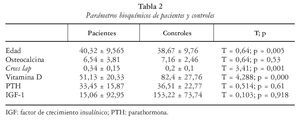
Nuestros pacientes tendían a presentar unos niveles de DMO menores que los controles (tabla 1), aunque sin alcanzar significación estadística. Con respecto a los parámetros bioquímicos, los pacientes presentaban cifras de telopéptido C-terminal más elevados que los controles (T = 3,4, p < 0,001) y más bajas de vitamina D, mientras que no había diferencias en relación con la osteocalcina, IGF-1 y PTH (tabla 2).
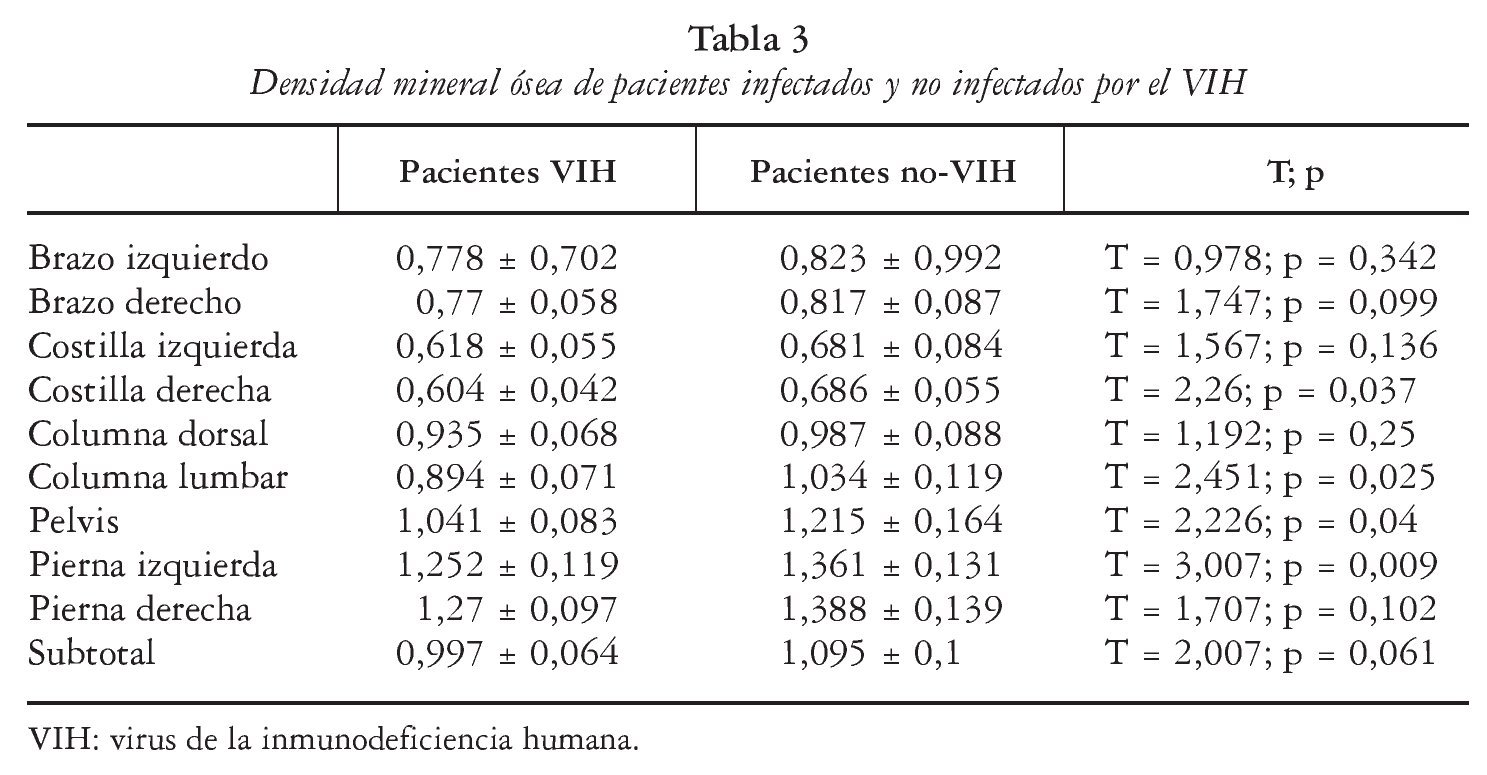
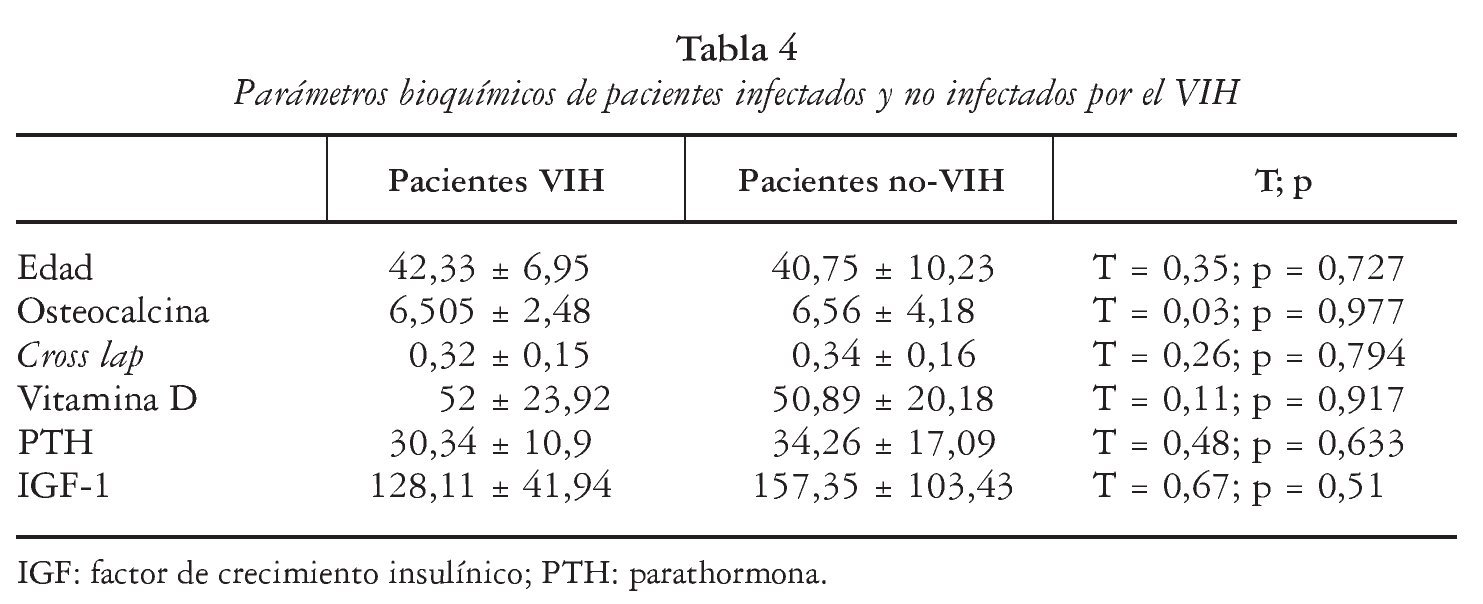
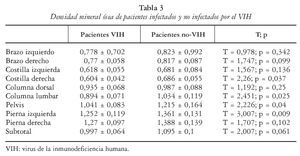
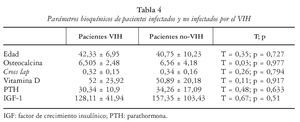
Encontramos diferencias significativas entre infectados y no infectados por el VIH en lo que respecta a la costilla derecha (T = 2,26, p = 0,037), la columna lumbar (T = 2,45, p = 0,025) y la pelvis (T = 2,23, p = 0,04); en cambio, no hubo diferencias entre ambos grupos en lo que respecta a los parámetros bioquímicos (tablas 3 y 4).
Al analizar las diferencias considerando los tres grupos conjuntamente (controles, hepatitis C coinfectados por el VIH y no coinfectados) volvimos a encontrar diferencias significativas en lo que respecta a la DMO en la costilla derecha (F= 3,77, p = 0,033); se rozó la significación estadística en lo que respecta a la DMO de la pelvis (F = 2,95, p = 0,065), la columna lumbar (F = 2,77; p = 0,07) y el subtotal (F = 2,63, p = 0,08); de la misma forma, hubo diferencias en lo que se refiere al telopéptido C-terminal (F = 5,74, p = 0,006) y la vitamina D (F = 8,98, p = 0,001). Al analizar, mediante un análisis post-hoc(prueba de Student-Newman-Keuls), entre qué grupos se establecían las diferencias, vimos que el grupo con menor masa ósea, significativamente diferente de los otros dos, es siempre el formado por pacientes coinfectados con VHC y VIH, apareciendo diferencias significativas no solo a nivel de la costilla derecha, sino también en la pelvis y la columna lumbar.
Con respecto a los parámetros nutricionales, encontramos una relación significativa entre DMO en el brazo derecho y el perímetro braquial (p = 0,019), ocurriendo lo mismo entre la masa magra determinada mediante DEXA en distintos niveles y la DMO (masa magra total con DMO a nivel de brazo izquierdo r = 0,69, a nivel de brazo derecho r = 0,71, columna torácica r = 0,79 y lumbar r = 0,53). En cambio no encontramos ninguna relación entre masa grasa y parámetros óseos, ni tampoco entre IMC y DMO.
Con respecto a la actividad histológica encontramos una relación significativa inversa entre masa ósea e índice de Knodell (mayor deterioro óseo a mayor intensidad de la lesión histológica). Así, hubo relación entre la DMO de costilla derecha con el índice de Knodell (p = 0,041) y entre la DMO en columna lumbar y el índice de Knodell (p = 0,033). Igualmente encontramos una relación inversa entre carga viral y masa ósea con valores de r oscilantes entre -0,52 y -0,48 (p < 0,05).
En lo referente a parámetros bioquímicos, encontramos una relación directa entre DMO e IGF-1 en costilla derecha (r = 0,50; p = 0,031), costilla izquierda (r = 0,47, p = 0,044) y T-score a nivel del triángulo de Ward (r = 0,65, p = 0,002).
DISCUSIÓN
Hemos encontrado en nuestros pacientes un descenso de la masa ósea, especialmente acusado en aquellos afectos de infección por VIH. En efecto, un 26,31% tiene un T-score a nivel de columna lumbar menor de -1, valores presentes también en un 20% de los pacientes cuando se determina a nivel de cuello femoral. Como indican los resultados relativos a los niveles de péptido C-terminal de la colágena tipo I, aumentados en nuestros pacientes, podemos afirmar que, en nuestra serie, la osteopenia obedece a un aumento de la destrucción ósea, no compensada por un aumento de síntesis, ya que tanto el IGF-1 como la osteocalcina no presentaban diferencias con el grupo control; además, la vitamina D, hormona importante en la mineralización ósea, estaba descendida en nuestros pacientes, lo que refuerza la hipótesis de que el aumento de la destrucción ósea no puede ser compensado. Por otra parte, y como era de esperar, observamos una relación entre masa ósea y parámetros tanto densitométricos como antropométricos indicadores del estado nutricional, lo que concuerda plenamente con lo descrito en la literatura10,12. Es de destacar, no obstante, que la relación se establece más con la masa magra que con la masa grasa, lo que sugiere que más que el peso -es decir, el efecto antigravitatorio-, influyen en el mantenimiento de una adecuada masa ósea la masa y la actividad muscular, al menos en los pacientes estudiados.
No obstante, también hemos observado que el deterioro de la masa ósea guarda relación con la actividad histológica. Sin duda, la alteración funcional hepática puede desempeñar un papel relevante en la génesis de la osteopatía de esos pacientes, ya que en el hígado tiene lugar la síntesis de factores directamente involucrados en el metabolismo calcio-fosfórico, destacando entre ellos el IGF-1 y la 25 hidroxivitamina D. Además, la alteración funcional hepática conlleva la alteración de los niveles de estradiol, cortisol y, eventualmente, citoquinas relacionadas con el metabolismo óseo13-16,22. En este sentido, en la cirrosis alcohólica se describe una osteopatía metabólica, que casi siempre es osteoporosis8,9, de origen multifactorial, pero que en algunos casos también se asocia a osteomalacia23, sobre todo en las hepatopatías crónicas con componente colestásico, en las que influyen la malabsorción de vitaminas liposolubles (como la vitamina D) y la consiguiente malabsorción de calcio e hiperparatiroidismo secundario. Las relaciones encontradas con el IGF-1 y la masa ósea en nuestro estudio confirman la comentada importancia del mantenimiento del equilibrio hormonal en la homeostasis fosfo-cálcica y que, tal vez, la alteración de ese equilibrio en el paciente con VHC justifique en parte las alteraciones observadas.
En nuestra corta casuística es de destacar que los pacientes afectos de infección por el VIH parecen estar más afectados que los no infectados. Estos resultados deben tomarse como preliminares, pues solo 6 pacientes reúnen estas características. No obstante, hay razones teóricas que podrían argumentarse para explicar estos hallazgos, ya que la infección por el VIH se asocia a osteopenia24, aunque los mecanismos no son conocidos25.
Concluimos, por lo tanto, que en los pacientes afectos por hepatopatía crónica por VHC existe una disminución de la masa ósea, especialmente manifiesta en los pacientes coinfectados por el VIH. Este descenso de la masa ósea guarda relación con la disminución de la masa magra, pero no con la masa grasa. También es más intenso a medida que aumenta la carga viral y en pacientes con lesiones histológicas más graves. En nuestros pacientes el descenso de la masa ósea guarda una relación directa con el descenso del IGF-1.
Correspondencia: R. Pelazas González.
Servicio de Medicina Interna.
Hospital Universitario de Canarias.
Urb. Ofra, s/n.
38320 La Laguna. Tenerife. Islas Canarias. España.
Correo electrónico: rpelazas@hotmail.com